Una mujer de 61 años se presentó con una historia de 2 años de pápul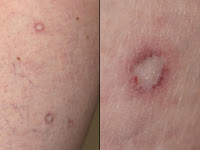 as eritematosas a rosadas, con un centro un centro cicatrizal blanco aporcelanado y un anillo telangiectásico, asintomáticas. (Figura 1) Un número progresivo de lesiones desarrolló en su abdomen, dorso y muslos. La histología de la piel mostró atrofia epidérmica, una interfase vacuolar y un área de bordes definidos de degeneración colágena y esclerosis dérmica papilar. Los resultados de las investigaciones figuran en la tabla.
as eritematosas a rosadas, con un centro un centro cicatrizal blanco aporcelanado y un anillo telangiectásico, asintomáticas. (Figura 1) Un número progresivo de lesiones desarrolló en su abdomen, dorso y muslos. La histología de la piel mostró atrofia epidérmica, una interfase vacuolar y un área de bordes definidos de degeneración colágena y esclerosis dérmica papilar. Los resultados de las investigaciones figuran en la tabla.
 Cual es el diagnótico?
Cual es el diagnótico?
A) Liquen escleroso.
B) Morfea guttata
C)Lupus eritematoso sistémico
D) Papulosis atrófica malignaE) Atrophie blanche blanca Respuesta correcta: D
Discusión
Basados en los hallazgos clínicos y patológicos, la respuesta correcta es la (D), papulosis atrófica maligna (también conocida como enfermedad de Degos).
Esta condición es rara pero potencialmente fatal, consistente en una arteriopatía oclusiva de vasos pequeños y medianos. Algunos pacientes pueden tener una variante benigna de la enfermedad que está limitada a la piel (variedad benigna de la papulosis atrófica cutánea maligna). Sin embargo, hallazgos id énticos de piel pueden anteceder a la variante letal de compromiso multiorgánico (papulosis atrófica sistémica maligna). La ausencia de compromiso de órganos internos después de 3 años sugiere que nuestro paciente tiene una variante cutánea benigna. Solo el tiempo dirá si desarrolla o no enfermedad sistémica.
énticos de piel pueden anteceder a la variante letal de compromiso multiorgánico (papulosis atrófica sistémica maligna). La ausencia de compromiso de órganos internos después de 3 años sugiere que nuestro paciente tiene una variante cutánea benigna. Solo el tiempo dirá si desarrolla o no enfermedad sistémica.
Más de 200 casos de papulosis atrófica maligna, incluyendo tanto la forma cutánea benigna como la forma sistémica han sido publicadas. (1) Sin embargo, la enfermedad es probablemente subdiagnosticada. Típicamente, la papulosis atrófica maligna ocurre en adultos jóvenes de raza blanca, a menudo en la tercera década de la vida. Ha sido descripto en pacientes de todas las edades y grupos étnicos. En 1997, Katz describió una forma familiar de papulosis atrófica maligna con una relación hombre/mujer de 3 a 1. (2) La forma benigna es más comúnmente reportada en mujeres, con una relación mujer/hombre de 3 a 1. (3)
Los hallazgos patognomónicos tanto en la forma cutánea benigna como en la forma sistémica de papulosis atrófica maligna son las pápulas d esde eritematosas a rosadas de 2 a 15 mm de diámetro que desarrollan una cicatriz atrófica blanca aporcelanada en el centro de la lesión. Las pápulas están a menudo rodeadas por un anillo de telangiectasias, pueden tener forma de domo o apariencia de trébol. El promedio del número de pápulas es alrededor de 30. Sin embargo, más de 600 lesiones se han descripto en un paciente. (1) La superficie corporal proximal, genitales y dorso, son los más a menudo comprometidos. La cara, palmas y plantas son habitualmente respetadas. Aunque las lesiones son habitualmente asintomáticas, algunos pacientes pueden experimentar sensaciones de quemadura.
esde eritematosas a rosadas de 2 a 15 mm de diámetro que desarrollan una cicatriz atrófica blanca aporcelanada en el centro de la lesión. Las pápulas están a menudo rodeadas por un anillo de telangiectasias, pueden tener forma de domo o apariencia de trébol. El promedio del número de pápulas es alrededor de 30. Sin embargo, más de 600 lesiones se han descripto en un paciente. (1) La superficie corporal proximal, genitales y dorso, son los más a menudo comprometidos. La cara, palmas y plantas son habitualmente respetadas. Aunque las lesiones son habitualmente asintomáticas, algunos pacientes pueden experimentar sensaciones de quemadura.
La evaluación histopatológica de la biopsia de piel es requerida para diagnosticar papulosis atrófica maligna y distinguir estas lesiones de otras entidades con similar presentación como la atrophie blanche, el lupus eritematoso sistémico, la dermatomiositis, esclerodermia, liquen escleroso en gota, la mucinosis dérmica, y el síndrome antifosfolipídico. Los característicos hallazgos histológicos son áreas bien demarcadas de degeneración colágena y una reacción de interfase con aspecto escamoso de la unión dermo-epidérmica, una zona de esclerosis dérmica papilar, incontinencia melánica y atrofia epidérmica (Figura 2). (1) Las lesiones tempranas tienen infiltrados inflamatorios perivasculares, perianexiales, y perineurales con deposición de mucina. (1) La inflamación y proliferación de las células endoteliales y la trombosis pueden ser vistas debajo de la zona de necrobiosis. (1) Histológicamente, las lesiones de la variante cutánea benigna y la variable sistémica son indistinguibles.
Las lesiones de piel son a menudo la primer manifestación y heraldos de el inicio de la papulosis atrófica maligna sistémica. La forma sistémica es a menudo fatal, y típicamente desarrolla dentro de semanas a años después del inicio de las lesiones de piel. El compromiso de órganos internos raramente precede al inicio de la enfermedad cutánea. Los sistemas gastrointestinal, neurológico, oftalmológico, cardiopulmonar y hepato renal pueden estar afectados. Sin embargo, la perforación intestinal permanece la primer causa de muerte. (2) Los accidentes cerebro vasculares isquémicos o hemorrágicos, polirradiculoneuropatías discapacitantes y los síntomas neurológicos inespecíficos están entre las complicaciones de la papulosis atrófica maligna. (4) Las complicaciones oculares de la variante sistémica incluyen cataratas subcapsulares posteriores, diplopía, alteraciones en los campos visuales, ptosis, parálisis óculo motoras, atrofia y neuritis óptica, edema de papila y placas esclerales. (5) La pericarditis constrictiva, pleuritis, derrames pleurales, y muerte por infarto agudo de miocardio han sido reportadas. (1) Finalmente, han sido descriptas vasculitis en el síndrome hepatorenal. (1) En pacientes con papulosis atrófica maligna variante sistémica, la muerte ocurre dentro de los 2 o 3 años del comienzo de compromiso de órganos internos.(2) No hay tests de laboratorio específicos disponibles para distinguir las formas benignas de las sistémicas. Debido a que la forma sitémica es frecuentemente fatal, los pacientes asintomáticos con enfermedad de piel a menudo tienen ansiedad y depresión. Se han intentado múltiples tratamientos pero con poca efectividad. Una pequeña serie de casos sugiere que los agentes antiplaquetas (ácido acetil salicílico, y dipiridamol) e inmunoglobulina intravenosa pueden prevenir la progresión de la enfermedad. (1,6) En nuestra paciente, se administró bajas dosis de aspirina (81 mg/día) que previnieron la aparición de nuevas lesiones . No encontramos evidencias de compromiso sistémico después de un seguimiento de 3 años
Fuente: *Division of Dermatology, Department of Medicine, University of Calgary; Department of Pathology and Laboratory Medicine, University of Calgary, and Calgary Laboratory Services, Calgary, Alta.
Publicado en el CMAJ (Canadian Medical Association Journal)
November 18, 2008; 179 (11). doi:10.1503/cmaj.080373.
Bibliografía
1) 1) Scheinfeld N. Malignant atrophic papulosis. Clin Exp Dermatol 2007;32:483-7.[CrossRef][Medline]
2) 2) Katz SK, Mudd LJ, Roenigk HH Jr. Malignant atrophic papulosis (Degos' disease) involving three generations of a family. J Am Acad Dermatol 1997;37:480-4.[CrossRef][Medline]
3)3) Wilson J, Walling HW, Stone MS. Benign cutaneous Degos disease in a 16-year-old girl. Pediatr Dermatol 2007;24:18-24.[Medline]
4) 4) Subbiah P, Wijdicks E, Muenter M, et al. Skin lesion with a fatal neurologic outcome (Degos'disease). Neurology 1996;46:636-40.[Free Full Text]
5) 5) Egan R, Lessell S. Posterior subcapsular cataracts in Degos disease. Am J Ophthalmol 2000;129:806-7.[CrossRef][Medline]
6) 6) Zhu KJ, Zhou Q, Lin AH, et al. The use of intravenous immunoglobulin in cutaneous and recurrent perforating intestinal Degos disease (malignant atrophic papulosis). Br J Dermatol 2007;157:206-7.[CrossRef
 lo relaciona con una ducha de agua muy caliente, produciéndose la recuperación de la visión “cuando el cuerpo se enfría” según palabras de la propia paciente.
lo relaciona con una ducha de agua muy caliente, produciéndose la recuperación de la visión “cuando el cuerpo se enfría” según palabras de la propia paciente.




 Figura 3
Figura 3











