clickear en las imágenes para ampliarlas
Un hombre de 52 años consultó al médico por disnea y tos. En los últimos 15 años él había tenido episodios recurrentes de tos que eran aliviados solo por cursos intermitentes de corticoides. En el último año él había sido tratado en tres ocasiones con 20 mg de Prednisona/día por 2 semanas. En las últimas 3 semanas su tos había aumentado en frecuencia y había agregado severa disnea. Esta vez, 2 semanas de Prednisona no habían brindado alivio a sus síntomas. Refería en estos últimos días escalofríos pero no fiebre. Su tos era productiva y el esputo amarillo.
Como antecedentes tenía una operación de Timoma para lo que había sido sometido a resección completa del mismo, no recibiendo quimioterapia ni radioterapia posterior y el examen histopatológico había mostrado un tumor de células en huso.
Su tos no mejoró después de la cirugía. No había antecedentes de uso de tabaco, alcohol o drogas ilícitas. Él vivía con su esposa, no tenía mascotas en su casa y trabajaba en una empresa de seguros. No había realizado viajes ni tenía riesgos para infección por HIV. Tenía sinusitis crónica y había perdido 9 Kg de peso en los últimos 3 meses. No tomaba medicamentos.
Las evaluaciones previas por su tos incluían una espirometría que mostró moderada limitación al flujo aéreo, con una CVF de 3,34 Lts (75% del esperado)y un VEF1 de 2,06 Lts (63%) del valor esperado. No había reversibilidad con broncodilatadores. La Rx de torax era normal.
En el examen físico el paciente estaba cianótico, temperatura 37,2ºC, TA 122/86 mm Hg, y uns frecuencia cardiaca de 118 latidos por minuto. Saturación 77% mientras respiraba aire ambiente. Excepto por su taquipnea, el examen respiratorio era normal. Había un precordio hiperdinámico, sin soplos, galope ni ingurgitación yugular. El resto del examen físico era normal.
El paciente fue internado. Los glóbulos blancos eran de 19600 con 97% de granulocitos. Hemoglobina 14,4 g. Ph 7,46 PCo2 33 mm Hg y Po2 60 mm Hg mientras e l paciente respiraba Oxígeno al 50%. La Rx de tórax (Figura) mostraba infiltrados bilaterales.
l paciente respiraba Oxígeno al 50%. La Rx de tórax (Figura) mostraba infiltrados bilaterales.
Comienza tratamiento con Moxifloxacina como para una neumonía adquirida en la comunidad. El Gram del esputo mostró diplococos Grampositivos y en el hemocultivo desarrolló Streptococcus pneumoniae sensible a Penicilina. El paciente es rotado a Penicilina G pero continuó estando hipoxémico. Después de 4 dias de ATB su saturación de Oxígeno fue 93% con un aporte de 6 Lts de Oxígeno por cánula nasal, y permaneció febril con 38,3ºC de temperatura. La Rx no mostró mejoría después de 5 días de terapia.
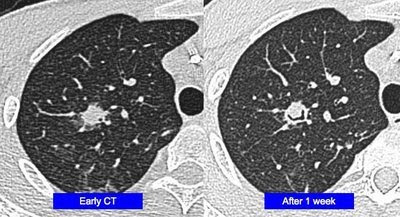
La TAC de tórax con protocolo para tromboembolismo pulmonar, mostró infiltrados en vidrio esmerilado con múltiples pequeños nódulos y broncograma aéreo (Figura). No había evidencia de embolia pulmonar. La broncoscopía mostró una vía aérea normal. El conteo diferencial del lavado broncoalveolar mostró 72% de macrófagos alveolares, 15% de neutrófilos, 12% de linfocitos y 1% de eosinófilos. No se vieron bacilos ácido alcohol resistentes en el BAL. La tinción con Metenamina de Plata mostró abundantes quistes y trofozoitos de P jiroveci (antes llamado Pneumocistis carinii) . El paciente comienza con Trimetoprima-Sulfametoxazol IV y 40 mg de Prednisona 2 veces por día.

El resultado del HIV por Elisa fue negativo. El conteo diferencial de células mostró linfopenia absoluta con 625 linfocitos/mm3 (normal 1000 a 3100), CD4 231/mm3 (normal 600 a 1900) una relación CD4/CD8 de 6,1 y ausencia de células B. El nivel de IgG fue 365 mg/dl (normal 650 a 1600), la IgM fue de 25 mg/dl (normal 50 a 300), y la IgA fue de 101 mg/dl (normal 40 a 350). El paciente fue tratado con Inmunoglobulina IV, y fue rotado a TMS oral antes del alta. Él completó un curso de 21 días de ATB y la dosis de Prednisona fue reduciéndosele con buena respuesta. El control de nivel de Inmunoglobulinas 10 semanas después era el mismo que los anteriores por lo que continuó con tratamiento de reposición de Inmunoglobulinas cada 3 semanas. En una visita de control al año el paciente se sentía bien, no había tenido mas tos ni infecciones respiratorias y había recuperado su peso habitual.
Cual es el diagnóstico del paciente?
Este paciente no tiene SIDA, sin embargo tiene Hipogamaglobulinemia, Linfopenia con CD4 bajos y ausencia de Linfocitos B . Todos estos elementos en presencia de un paciente con antecedentes de Timoma configuran el Síndrome de Good. La infección por Pjiroveci y Ppneumoniae con hemocultivos positivos son explicadas por linfopenia con bajos CD4 y carencia de células B respectivamente. La historia de tos crónica es explicada probablemente por infecciones virales o bacterianas recurrentes. La obstrucción crónica al flujo aéreo (EPOC) probablemente se deban a bronquiectasias que deberán ser estudiadas con TAC de alta resolución.
Conclusiones:
Cuando la condición de un paciente no mejore a pesar de la terapia apropiada, los clínicos deben reconsiderar su accionar y volver sobre sus pasos, reevaluar el diagnóstico y las posibles causas de fallo del tratamiento.
En el caso presentado la neumonía neumocóccica fue inicialmente diagnosticada de los hemocultivos y del Gram del esputo. La elección del tratamiento fue la correcta pero las expectativas de mejoría al cabo de 3 días de tratamiento de una neumonía neumocóccica con el ATB adecuado se desvanecieron con la mala evolución del paciente.
La dilación o el retraso entre el diagnóstico inicial y la decisión de llevar a cabo testeos diagnósticos adicionales es una tendencia conocida como sesgo de búsqueda de satisfacción (“search-satisfying bias”), un sesgo de parar la investigación una vez que el diagnóstico está hecho. Este sesgo, puede conducir a errores médicos, por hacer que los profesionales intervinientes pasen por alto otra condición que contribuye a la enfermedad del paciente. Ante la falta de mejoría con el tratamiento, los médicos que atendieron a este paciente, perdieron rápidamente la satisfacción que el diagnóstico confirmado de neumonía neumocóccica les proporcionaba, llevando a cabo una broncoscopía que descubrió una segunda infección por pneumocistis hasta ahora no reconocida.
Sin embargo un segundo diagnóstico no significa que la búsqueda haya terminado. La neumonía por Pneumocistis es indicativa de inmunodeficiencia, aumentando las probabilidades de infección por HIV y cáncer. Como alternativa en este caso el Síndrome de Good parece explicar mejor que cualquier otro diagnóstico el caso presente a la luz de la negatividad de la investigación de HIV.
La hipogamaglobulinemia ocurre en 6 a 11% de los pacientes con Timoma. Hallazgos adicionales en el Síndrome de Good son ausencia de células B deficiencia de CD4 y una relación de CD4/CD8 de menos de 1, y deterioro de función de células T. La patogenia de este síndrome no está del todo aclarada. Las manifestaciones son las de cualquier otra hipogamaglobulinemia tal como la Inmunodeficiencia común variable excepto en que en el síndrome de Good las infecciones oportunistas son mas frecuentes como resultado de un mas severo defecto en la inmunidad mediada por células. Los pacientes a menudo se presentan coninfecciones recurrentes en la cuarta o quinta décadas de la vida. Las infecciones sinopulmonares ocurren mas frecuentemente y son mas comúnmente debidas a organismos capsulados.
A menudo desarrollan bronquiectasias como consecuencia de infecciones respiratorias recurrentes y alteraciones de la inmunidad humoral. La diarrea crónica es frecuentey es el resultado de patógenos intestinales o malabsorción. Nuestro paciente no tenía diarrea y presumiblemente la pérdida de peso era debida a infecciones sinopulmonares crónicas ya que el tratamiento de la infección resultó en una recuperación del peso.
Los Timomas son tumores de crecimiento lento, y, en ausencia de Síndrome de Good el pronóstico de un paciente que se somete a timectomía es similar al de la población general. En pacientes con Síndrome de Good el pronóstico a largo plazo depende de complicaciones infecciosas. Aunque la incidencia de hipogamaglobulinemia con timomaes baja, la inmunodeficiencia ciando está presente puede ser severa. En consecuencia la cuantificación de las inmunoglobulinas debe ser realizada en todos los pacientes con Timoma y repetida periódicamente. El tratamiento es con Inmunoglobulinas endovenosas y eventual profilaxis para P jiroveci
Es importante como conclusión para el clínico no cerrar rápidamente el diagnóstico y la mente, sino mas bien estar abierto a otras posibilidades diagnósticas cuando la evolución del paciente no es la esperada o ante hallazgos clínicos o de laboratorio inesperados.
Una respuesta inadecuada a la terapia no debe ser considerada como un fracaso sino como una oportunidad para el internista de administrar su arte.
Fuente:
Departamento de Medicina División Pulmón, Cuidado crítico, Alergia y Medicina DEL sueño de la Universidad de Ohio
Departamentote Medicina del Centro de Investigación Médica Judía (Denver)
Departamento de Medicina de la Universidad de Colorado (Denver)