Las microangiopatías trombóticas (MAT) son una serie de cuadros que tienen como denominador común la presencia de
anemia hemolítica microangiopática (agresión traumática mecánica de los eritrocitos),
agregación plaquetaria y trombocitopenia. La agregación plaquetaria forma tapones fibrinoplaquetarios que cursan con isquemia de diferentes parénquimas, por ejemplo a nivel renal en el Síndrome Hemolítico Urémico (SHU), y a nivel cerebral en la Púrpura Trombocitopénica Trombótica (PTT).Los trombos encontrados histológicamente son blandos y su constitución es predominantemente plaquetaria, con poca fibrina y células rojas a diferencia de los que observados en la Coagulación Intravascular Diseminada(CID)
El SHU y la PTT son las entidades paradigmáticas que cursan con MAT, aunque hay otras muchas situaciones en que ésta aparece:
Causas de Microangiopatías Trombóticas:
1) Púrpura Trombocitopénica Trombótica (PTT)
2) Síndrome Urémico Hemolítico (SHU)
3) Coagulación Intravascular Diseminada (CID)
4) Vasculitis
5) Preeclampsia
6) Hipertensión Maligna
7) Esclerosis Sistémica Progresiva (ESP)
La PTT fue descripta por Moschcowitz in 1924 y el SUH por Gasser y col en 1955.La causa de estas entidades permaneció oscura hasta la década del 80 en que se descubrieron los
inusualmente grandes multímeros de Von Willebrand circulantes liberados por las células endoteliales. En pacientes sanos, los multímeros de Von Willebrand liberados por las células endoteliales son procesados por una proteasa llamada
"ADAMTS 13", (acrónimo de a disintegrin and metalloprotease with thrombospondin-1–like domains). Esta proteasa (de síntesis predominantemente hepática), cliva a los grandes multímeros de Von Willebrand inactivándolos o disminuyendo su actividad agregante plaquetaria. En 1994 se descubrió que el factor de Von Willebrand (fVW) era clivado entre un residuo tirosina y metionina en posición 1605 y 1606 por una metaloproteasa en condiciones de altos niveles de “shear stress” (fuerza de rozamiento). En 1998 se descubrió que había causas congénitas hereditarias de deficiencia de esta metaloproteasa que explicaba los casos familiares de PTT (Síndrome de Upshaw-Shulman) y una forma adquirida de esta deficiencia, producida por anticuerpos IgG dirigidos a esta metaloproteasa que explicaba los casos no familiares de PTT.
Genómicamente ADAMTS 13 comparte muchas propiedades con 19 miembros de la familia ADAMTS caracterizados todos por un dominio proteasa (la porción que lleva a cabo la hidrólisis), un dominio disintegrina y uno de trombospondina.
En niños la entidad mejor definida es el
SHU postinfeccioso, que afecta pacientes menores a 5 años y tiene tendencia a afectar menos órganos que la PTT, típicamente afecta
colon y riñón, aunque puede tener manifestaciones neurológicas, pulmonares o de otros sistemas. Es útil diferenciar SHU postinfeccioso relacionados a patógenos que producen toxina Shiga (por ej E coli O157:H7) y aquellas relacionadas a Shigella dysenteriae.
Por otra parte PTT, es generalmente una enfermedad de adultos. Distinguir PTT de SUH es importante debido a que hay terapias disponibles para ciertos tipos de PTT mientras que el tratamiento del SHU tiende a ser mas que nada de sostén
Clasificación: el siguiente es un esquema tentativo
1) PTT hereditaria o recurrente. Idiopática o por deficiencia de ADAMTS 13 (Síndrome de Upshaw-Shulman)
2) PTT postinfecciosa. Mediada por IgG anti ADAMTS 13 adquirida.
3) PTT sin deficiencia de ADAMTS 13
4) SHU postinfeccioso por toxina Shiga
5) SHU postinfeccioso no relacionado con toxina Shiga
6) SHU esporádico
7) SHU Familiar
8) MAT de etiología incierta
9) MAT asociada a neoplasia o quimioterapia
10) MAT post Transplante de Médula Ósea
11) MAT sintomática de otras enfermedades
Anatomía PatológicaEn casos letales la trombosis intravascular es mas generalizada en la PTT que en el SHU. Los trombos tienden a comprometer los órganos más vascularizados, en orden descendente de severidad: corazón, páncreas, riñón, adrenal y cerebro.
Los trombos en la PTT se alojan en las pequeñas arteriolas, capilares y vénulas de los distintos órganos, y están compuestos principalmente por plaquetas, multímeros de vonWillebrand. Por el contrario, los microtrombos encontrados en los casos fatales de SHU, son de fibrina y o glóbulos rojos y están confinados a las arteriolas y capilares del riñón.
Patofisiología
Los pacientes con PTT tienen grandes multímeros de vonWillebrand circulantes. Su presencia , asociada a microtrombos sugiere la importancia patogénica que tienen en el síndrome. La ADAMTS-13, una enzima de síntesis hepática, dependiente del Zinc para su función, es una metaloproteasa encargada de clivar a estos grandes multímeros y disminuir así su capacidad agregante plaquetaria. Estos grandes multímeros de vonWillebrand son secretados por los cuerpos endoteliales de Weber-Palade y persisten en la circulación hasta que son clivados por la ADAMTS-13.
La
PTT familiar es causada por la deficiencia constitucional de ADAMTS-13 lo suficientemente severa(<5%>PTT adquirida se produce por la formación adquirida (por ejemplo desencadenada por un cuadro infeccioso) de anticuerpos contra la ADAMTS-13. Cuando en condiciones de normalidad, los grandes multímeros de vonWillebrand son apropiadamente clivados, se producen los pequeños multímeros de von Willebrand. Estos últimos bajo condiciones estrictamente reguladas pueden unirse a receptores glicoproteicos de la superficie de la plaqueta, como los Ia/IIa y IIb/IIIa. La presencia de polimorfismos en los genes de codificación de estos receptores puede jugar un rol en la PTT así como también en la patogenia de Stroke en individuos jóvenes. La unión de estos pequeños multímeros a los receptores plaquetarios hace que la plaqueta cambie su conformación desde su forma globular resistente a la adhesión a una configuración elongada que promueve la adhesión. Para que los pequeños multímeros se unan a los receptores plaquetarios deben darse algunas condiciones estrictamente reguladas relacionadas a factores de coagulación así como de “sheer forces”
Sin el apropiado clivado, los grandes multímeros de vonWillebrand son protrombóticos, y tienen tendencia a alterar la conformación de la plaqueta y adherirlas sin que medien esas condiciones apropiadas, produciéndose así obstrucción en arteriolas y capilares. Porqué estas obstrucciones se producen en determinados parénquimas y no en otros de acuerdo al cuadro clínico es un fenómeno aún no comprendido. ADAMTS-13 no es el único inductor del clivaje de los grandes multímeros. Las Calprinas, elastasas leucocitarias, catepsina G, estreptoquinasa, urokinasa, y el activador tisular del plasminógeno (tPa) también lo hacen. Sin embargo estas sustancias altamente activas por razones no comprendidas son secuestradas o inhibidas bajo condiciones normales no jugando en condiciones fisiológicas un papel en el clivado de los grandes multímeros, y es la deficiencia severa de ADAMTS-13 congénita o adquirida la causante de la PTT. Como contrapartida, la activación excesiva de ADAMTS-13 puede resultar en un cuadro hemorragíparo que recuerda a la Enfermedad de vonWillebrand tipo 2ª El desencadenante de la aparición de Anticuerpos dirigidos contra la ADAMTS-13 en la PTT adquirida parece ser un fenómeno de mimetismo molecular u otras explicaciones de sensibilización autoinmune.. Medicamentos tales como la Ticlopidina provoca aumento de los títulos de Ac contra la ADAMTS-13. El embarazo es otro desencadenante conocido de estos Anticuerpos, y otra condición es el Sida.
La PTT que ocurre durante el embarazo puede ser confundida con Preeclampsia.
Los trastornos que pueden producir MAT por otros mecanismos diferentes de la deficiencia de ADAMTS-13, como por ejemplo los tumores pueden hacerlo a través de embolias de células tumorales.
Los trastornos que producen MAT por deficiencia adquirida de ADAMTS-13 son:
1) Neoplasias, particularmente Linfomas o quimioterapia antineoplásica.
2) Transplante de Médula Ósea
3) Condiciones asociadas al embarazo, usualmente periparto o posparto (excluyendo preeclampsia o eclampsia). Algunos excluyen al Síndrome HELLP de las MAT
4) Factores Agudos relacionados a drogas como Quinina, mas comúnmente que Ticlopidina o Clopidogrel, usualmente mediados por mecanismos idiosincrásicos
5) Factores insidiosos relacionados a drogas como Mitomicina C, Alfa Interferon, Ciclosporina, Tacrolimus, y otros agentes quimioterapéuticos, usualmente relacionados con la dosis, y por lo tanto por algún mecanismo tóxico.
6) Asociados a trastornos autoinmunes como LES, Síndrome Antifosfolipídco, Poliarteritis Nodosa, Esclerodermia, Artritis Reumatoidea, y Síndrome de Sjogren
La MAT debida a déficit adquirido de ADAMTS-13, es raro en la niñez, y generalmente puede aparecer después los 30 años.
En 1985 Karmali descubrió una asociación entre SHU e infecciones con E coli que producía toxina Shiga Clínica.
Las MAT tienen todas ellas
trombocitopenia (con aumento de los megacariocitos en médula ósea), eritrocitos fragmentados llamados esquistocitos o helmet cells (celulas en casco), y niveles altos de LDH como expresión de hemólisis aunque también de sufrimiento isquémico y necrosis tisular (esta última parece ser la causa principal) . La severidad de estos hallazgos está en relación directa con la extensión del compromiso microvascular por la agregación plaquetaria.
Los esquistocitos(glóbulos rojos rotos), se producen por injuria mecánica al pasar estos por áreas de gran turbulencia por obstrucción plaquetaria parcial, asociada a redes de fibrina que “cercenan” a las células rojas a su paso. Este es el sustrato del síndrome de anemia hemolítica microangiopática, a diferencia de la anemia hemolítica macroangiopática asociado a compromiso de grandes vasos como estenosis aórticas profundamente calcificadas o grandes fístulas arteriovenosas que también rompen a los eritrocitos a su paso(anemia hemolítica macroangiopática).
En pacientes con PTT los tapones plaquetarios mediados por los grandes multímeros de Von Willebrand resultan frecuentemente en conteos plaquetarios de
<>, es decir que la plaquetopenia obedece a que estos elementos formes de la sangre están agregados formando trombos en la microcirculación, algo parecido a lo que pasa en la trombocitopenia mediada por heparina. La isquemia cerebral o del tracto gastrointestinal son comunes y la disfunción renal puede ocurrir. La PTT tiene una péntada clásica: 1) trombocitopenia, 2) anemia hemolítica microangiopática, 3) anormalidades neurológicas , 4) compromiso renal, 5) fiebre . En la práctica actual, sin embargo, la tríada de trombocitopenia, esquistocitos y LDH elevada son suficientes para sospechar el diagnóstico. La diferenciación entre PTT y SHU no es siempre fácil de hacer y ambas entidades tienen un grado de superposición variable. Clásicamente la PTT tiene menos afectación renal y mas afectación neurológica y viceversa el SHU, sin embargo las manifestaciones renales de pacientes que han recibido el diagnóstico de PTT o las manifestaciones extrarenales de pacientes con SHU hacen que los límites entre las dos entidades no sea abrupto. Hay una forma excepcionalmente rara de PTT familiar(Síndrome de Upshaw-Shulman), que aparece en la infancia o niñez y después hace recurrencias periódicas cada tres semanas llamada PTT recidivante . Sin embargo la PTT adquirida idiopática es la mas frecuente y aparece en la edad adulta o niños mayores, y se caracteriza por un único episodio aunque recidiva en 11 a 36% de los pacientes a intervalos regulares . La PTT puede también presentarse a las pocas semanas del tratamiento con Ticlopidina, un inhibidor del receptor de ADP plaquetario, y en una incidencia considerablemente menor en pacientes que reciben Clopidogrel, un agente estructuralmente similar a Ticlopidina. También se puede ver PTT en el tercer trimestre del embarazo o en el puerperio. El SHU usualmente ocurre como un único episodio a menudo precedido por gastroenteritis causado por la citotoxina de una bacteria Gram(-) mas comúnmente E coli O157:H7 . Una forma recurrente de SUH puede ser causado por la producción defectiva de factor H una proteína soluble controladora de la activación del complemento Un tipo de MAT que puede tener manifestaciones exclusivamente renales o sistémicas ocurre en pacientes quienes reciben Mitomicina , Ciclosporina Tacrolimus, Quinina, Transplante de Médula Ósea, irradiación corporal total o combinación de agentes quimioterapéuticos
La mujer tiene mayor riesgo de PTT durante el embarazo, y durante el uso de contraceptivos orales. El HIV es otro factor de riesgo para PTT. Los pacientes con PTT comienzan su enfermedad en forma aguda o subaguda con síntomas neurológicos, anemia y trombocitopenia. Las manifestaciones neurológicas incluyen alteración del estado mental, convulsiones, hemiplejía, parestesias, disturbios visuales y afasia. La fatiga puede acompañar a la anemia. Es raro que haya sangrado debido a la trombocitopenia, aunque las petequias son frecuentes. La fiebre se ve en 50% de los pacientes . Puede haber orina oscura por hemoglobinuria En cuanto al examen físico, tanto los pacientes con PTT como SHU no tienen hallazgos característicos. Puede haber palidez, ictericia y petequias. Los signos neurológicos pueden ser evanescentes y confundir con ataques isquémicos transitorios.
Los hallazgos clínicos sugestivos de SHU post infeccioso son:
1) edad <5>Los hallazgos clínicos sugestivos de SUH atípico son:
1) Edad <>Los hallazgos clínicos sugestivos de SHU típico del adulto son:
1) El SHU típico del adulto es poco frecuente.
2) En países desarrollados, esta forma usualmente desarrolla en asociación a disentería debido a E coli, mientras que en países subdesarrollados este puede estar asociado a infección con S disenteriae.
3) La insuficiencia renal aguda es menos constante en adultos que en niños.
Los hallazgos clínicos sugestivos de SUH atípico del adulto son:
1) Es poco frecuente en adultos
2) Es mas difícil de diagnosticar en adultos que en niños
Los hallazgos clínicos sugestivos de MAT “no PTT” no “SHU” a veces producen hallazgos sugestivos de PTT, SHU o ambos, pero sin serlos son:
1) Sepsis debido a Rickettsia rickettsii, o Meningococos, Cytomegalovirus, o especies de Aspergillus.
2) Neoplasia diseminada particularmente Linfomas
3) Endocarditis.
4) Hipertensión Maligna
5) Deficiencia de factor H
6) Drogas o venenos (por ejemplo:Ticlopidina, Ciclosporina, Yoduros por vía oral, anticonceptivos orales, y algunos venenos)
Aunque los signos y síntomas iniciales de la PTT aguda pueden ser sutiles e inespecíficos al inicio de la enfermedad, evolucionan a un cuadro serio en el transcurso de 7 a 10 días. Alteraciones fluctuantes, especialmente en la esfera neurológica son particularmente característicos de la PTT temprana. La dysfunction neurological se ve en alrededor de 2/3 de los pacientes. Los síntomas ocasionalmente persisten en forma subaguda. En raros casos adoptan la forma crónica.
El deficit heredado de ADAMTS-13 que se manifiesta en la niñez temprana (Síndrome de Schulman-Upshaw)casi siempre produce un curso de deterioro agudo y enfermedad severa.
Los adultos con PTT asociada a medicación, toxinas, o enfermedad de base los síntomas iniciales de PTT pueden ser dificultosos de distinguir de los debidos a las circunstancias provocadoras.
La mayoría de los pacientes tienen
malestar , irritabilidad o confusión. Muchos reportan
debilidad o fatiga.. La mayoría tienen
trastornos visuales persistentes o trastornos del lenguaje. Puede haber
convulsiones y cefalea. La
diarrea y los vómitos pueden verse comúnmente. En niños menores de 5 años, la disentería debe sugerir la alternativa diagnóstica de SHU, mientras que en un adulto o en un niño mayor, la disentería sugiere PTT. Puede haber cambios en el color de la orina y de la materia fecal sugestivos de hemorragia.
Hemorragias nasales o gingivales se pueden ver. El
dolor abdominal es muy común a veces secundario a
pancreatitis. Puede haber
artralgias. Los coágulos formados en la circulación pueden interrumpir el flujo de sangre a órganos como el cerebro, y entonces puede aparecer
cefalea, confusión, dificultades en el habla, parálisis transitoria, parestesias o aún convulsiones. Estas últimas pueden ser por isquemia o por Hipertensión Arterial.
Examen físico: usualmente se encuentra
púrpura en >90% de los pacientes, generalmente asociada a
fiebre, la seriedad de estos hallazgos hace pasar desapercibidos los síntomas prodrómicos de la enfermedad, y son los motivos de consulta. La
palidez de la piel debida a anemia es común aunque a veces se debe a vasoconstricción por dolor. La fiebre es de aparición temprana en el curso de la enfermedad.
La Hipertensión Arterial es un hallazgo muy frecuente. También es común la
esplenomegalia. Las
hemorragias(retinianas, coroideas, nasales, gingivales, gastrointestinales, y genitourinarias) son muy frecuentes. En la auscultación cardiaca se puede apreciar alteraciones del ritmo. El dolor abdominal a menudo presente puede ser debido a pancreatitis. Las artralgias inespecíficas son frecuentes. Lo mas importante y prevalente del cuadro son los signos neurológicos, pudiendo existir una amplia variedad de manifestaciones neurológicas. Ellas tienden a ser multifocales y fluctuantes o a veces permanentes y se ven en los 2/3 de los pacientes. Así puede haber
letargia, confusión, estupor o coma.
Trastornos del lenguaje, afasia o disfasia. Puede haber convulsiones.Alteraciones de pares craneales. Hemiparesias o debilidad generalizada transitorias o permanentes. Cambios de la sensibilidad como hemianestesias. Ataxia u otros signos cerebelosos pueden ser transitorios o permanentes
Mortalidad:
En el momento de su descripción original, la mortalidad era de casi 100%. A comienzo de los 70 la mortalidad caía a 30% como resultado de mejora en los cuidados, y en los 90
con plasmaféresis, la mortalidad de la PTT es de 7 a 10%Morbilidad
En algunas ocasiones el riesgo de morbilidad está relacionado a la complicación de las terapias tales como la plasmaféresis. El riesgo de recurrencia en pacientes con PTT que responden bien a las terapias como plasmaféresis intensiva es de aproximadamente 11 a 28% y usualmente se ven en el primer año.
Causas:
La PTT puede ser secundaria o sintomática de varias afecciones. A las PTT no relacionadas con alteraciones de la ADAMTS-13 algunos prefieren llamarlas MAT PTT like.
Las siguientes, son causa de PTT o MAT PTT like:1) Vasculitis inflamatorias: (LES, Síndrome Antifosfolipídico, Artritis Reumatoide, Poliarteritis Nodosa, Síndrome De Sjogren. El LES es la causa mas importante dentro de este grupo, pudiendo aparecer después de varios años después del diagnóstico, pero a veces puede preceder al mismo.
2) Enfermedades infecciosas: particularmente la Endocarditis, infección por HIV, infección por patógenos entéricos (enterohemorrágicos), que elaboran la Toxina Shiga (ej: E coli O157:H7 o S dysenteriae)
3) HIV: ha emergido como una importante causa de MAT PTT like en adultos.
4) Neoplasias: particularmente Linfomas, aunque puede haber distintos tipos de neoplasias relacionadas a cuadros de MAT PTT like. En tales casos los tratamientos empleados en los diversos cuadros clínicos (terapia anticancer, irradiación corporal total, transplante de médula ósea o de ítem cell con inmunosupresión) pueden contribuir a la génesis del cuadro.
5) Condiciones ginecológicas: el Puerperio es la condición natural que mas puede predisponer a la mujer a desarrollo de MAT PTT like. En el embarazo el mayor riesgo está en el 2º trimestre aunque puede darse en cualquier momento del mismo y en el posparto inmediato. En estos casos la Hipertensión Arterial inducida por PTT puede ser confundida con Eclampsia. El Síndrome HELLP ha estado relacionado en algún momento con PTT aunque hoy día se los considera dos entidades no relacionadas.
6) La deficiencia del Factor H: puede contribuir al síndrome
7) Medicamentos: pueden producir PTT aunque el riesgo es demasiado pequeño. Los implicados en esta entidad son: Sulfas, Ciclosporina A, Quinina, Yoduros, drogas antiplaquetas (Ticlopidina Clopidogrel), o anovulatorios
8) Venenos: pueden también ser causa
Laboratorio:
La PTT es un diagnóstico clínico sin tests específicos de laboratorio. En el pasado la péntada signo sintomatológica de trombocitopenia, anemia hemolítica microangiopática, anormalidades neurológicas fallo renal y fiebre, eran requeridos. Los criterios de la clínica práctica actual:
trombocitopenia, esquistocitosis, y significativas elevaciones de LDH sugieren el diagnóstico de PTT. La medición de la actividad proteásica como único test para distinguir entre PTT y SHU no se realiza de rutina. La ausencia de tests in vitro, capaces de detectar anormalidades en el clivaje de los grandes multímeros de vonWillebrand por la ADAMTS-13 es una limitación.
Los tests de laboratorio que contribuyen al diagnóstico incluyen: Hemograma completo donde la anemia y la trombocitopenia son notados. La trombocitopenia puede preceder a la aparición de glóbulos rojos fragmentados y a la elevación de LDH por varios días.
En el extendido de sangre periférica, los
glóbulos rojos fragmentados (esquistocitos), son consistentes con hemólisis.
Los esquistocitos en el frotis de sangre periférica son los marcadores morfológicos de la enfermedad, aunque no hay guías que tengan en cuenta el número de esquistocitos necesarios para diferenciar la PTT de otras microangiopatías trombóticas.
Los niveles de LDH están altos, pero niveles extremadamente altos son principalmente consecuencia de isquemia o células titulares necróticas mas que de hemólisis. La bilirrubina indirecta está elevada. El conteo de reticulocitos está elevado. El tiempo de Protrombina y el aPTT son normales. El panel de estudio de CID (Fibrinógeno, Dímero D etc), son usualmente normales. La creatinina sérica está levemente elevada en 46% de los casos. En la orina suele verse proteinuria y hematuria macroscópica.
Imágenes:
La TAC de cráneo sirve para ver infartos y hemorragias intracerebrales.
Tratamiento:
El reconocimiento y tratamiento temprano es esencial para la sobreviva del paciente.
La plasmaféresis es el tratamiento Standard para todos los pacientes con PTT. Como consecuencia de este procedimiento se remueven todos los anticuerpos. La dilación del procedimiento está correlacionado con fallo en el tratamiento.
Si la plasmaféresis no está disponible en forma inmediata hay que comenzar por transfundir plasma ya que este aporta la proteasa en déficit hasta que el intercambio de plasma esté disponible. Se usa un catéter de dos vía en posición femoral por el que se remueve el plasma a través de un separador de células rojas y se reemplaza el plasma del paciente con plasma fresco congelado. Se comienza con un volumen de plasma y se pasa 40 ml/kg de peso de Plasma fresco congelado. El intercambio de plasma puede ser necesario 2 veces por día para la resolución de la trombocitopenia y las complicaciones neurológicas si la respuesta inicial con un intercambio es pobre.
Si no hay disponibilidad de plasmaféresis mientras tanto se le pueden transfundir al paciente 30ml/kg de plasma fresco congelado.
Los corticosteroides y agentes antiplaquetas son utilizados a menudo antes de la plasmaféresis. Si bien los esteroides no han mostrado agregar beneficios a la plasmaféresis sola, algunos pacientes responden a altas dosis de Prednisona (200 mg/día) sin recambio de plasma. Los agentes antiplaquetas son usados pero presentan el riesgo de la hemorragia y su beneficio no está probado. La Aspirina y el Dipiridamol son recomendados por algunas autoridades pero su uso es controversial. La Ticlopidina y Prostaciclinas tienen resultados diversos según las publicaciones.
La esplenectomía es llevada a cabo ocasionalmente para tratar pacientes que no responden a la plasmaféresis o que hacen formas recidivantes crónicas. Algunos de estos pacientes responden a la esplenectomía, y el éxito en estos casos puede ser debido a que en el bazo puede haber secuestro de glóbulos rojos y plaquetas.
La formas refractarias de PTT o las recidivantes son tratadas con drogas de segunda línea como Vincristina 1 mg/mt2 con un máximo de 2 mg/mt2 semanalmente. Su mecanismo de acción es desconocido.
Las medidas de sostén para los órganos afectados pueden ser requeridos. La hemodiálisis para pacientes con fallo renal. IECA, Nitroprusiato y Esmolol pueden ser requeridos para el manejo de la HTA severa. Los anticonvulsivantes del tipo de la Fenitoína, pueden ser requeridos para control de las convulsiones.
Si hay severa anemia hemolítica puede ser necesario transfundir glóbulos libres de plaquetas.
La Desmopresina está contraindicada debido a que libera grandes multímeros de von Willebrand a la sangre.
El tratamiento del SHU por toxina Shiga es solo de sostén, y los ATB deben ser evitados a menos que el paciente esté séptico.
Agentes orales anti toxina Shiga del tipo SYNSORB, que está compuesto por partículas de siliconas junto a globotriaosylceramida no han demostrado utilidad.
Los pacientes que evolucionan a Insuficiencia renal terminal deben ser transplantados. La tasa de recurrencia es de 10%.
Otras terapias incluyen plasma y uso de inmunoglobulinas intravenosas, agentes fibrinolíticos, agentes antiplaquetas, corticoides y antioxidantes .
El tratamiento del SHU independiente de la toxina Shiga comprende:
Manipulación de plasma (intercambio vs infusión). La tasa de mortalidad bajó de 50% a 25% con la introducción de la manipulación de plasma pero su eficacia en la etapa aguda es controversial. El intercambio parece ser mas efectivo que la transfusión ya que remueve sustancias potencialmente tóxicas de la circulación. Además el intercambio está indicado en vez de la transfusión en casos de Insuficiencia renal e Insuficiencia cardiaca. El tratamiento con plasma debe comenzar dentro de las 24 hs de comenzado el cuadro y debe continuar una o dos veces por día por al menos dos días después de la remisión completa. El intercambio de plasma está contraindicado en el SHU inducido por S pneumoniae , porque puede exacerbar la enfermedad debido a que en plasma del adulto contiene anticuerpos contra el antígeno de Thomsen-Freidenreich.
El transplante renal no es una opción en el SHU independiente de toxina Shiga debido a que recurren el 50%
Medidas de sostén:
Mantenimiento del balance hidroelectrolítico, control adecuado de la Tensión Arterial y bloqueo adecuado de renina angiotensina es importante para pacientes que evolucionan a insuficiencia renal. Se aconseja profilaxis de convulsiones con Difenilhidantoina en pacientes con síntomas neurológicos. Ya que 20 a 40% tienen convulsiones. Control de la uremia y optimizar la nutrición.
Pronóstico de la PTT : el viejo adagio de que la recurrencia en la PTT no puede ser predecida en base a ningún análisis de laboratorio permanece cierto excepto que las recurrencias tienden a ocurrir en pacientes que tienen PTT debido a deficiencia heredada de ADAMTS-13. La severa deficiencia de ADAMTS-13 manifestada en la infancia como Síndrome de Schulman-Upshaw tiene especial predilección por la recurrencia.
Dos grandes estudios de más de 130 episodios de PTT en adultos que recibieron cambio de plasma mostró una mortalidad de 8 a 25 % durante la fase aguda del la enfermedad. El riesgo de recidiva fue de 21% y el riesgo de Insuficiencia renal crónica que requirió diálisis fue de 16%.
Bibliografía
Adams RD, Cammermeyer J, Fitzgerald PJ. Neuropathological aspects of thrombotic acroagiothrombosis; clinico-anatomical study of generalized platelet thrombosis. J Neurol Neurosurg Psychiatry. 1948;11:27-43.
Amorosi EL, Karpatkin S. Antiplatelet treatment of thrombotic thrombocytopenic purpura. Ann Intern Med. Jan 1977;86(1):102-6.
[Medline].
Baker KR, Moake JL. Thrombotic thrombocytopenic purpura and the hemolytic-uremic syndrome. Curr Opin Pediatr. Feb 2000;12(1):23-8.
[Medline].
Bell WR, Braine HG, Ness PM, Kickler TS. Improved survival in thrombotic thrombocytopenic purpura-hemolytic uremic syndrome. Clinical experience in 108 patients. N Engl J Med. Aug 8 1991;325(6):398-403.
[Medline].
Berkowitz LR, Dalldorf FG, Blatt PM. Thrombotic thrombocytopenic purpura: a pathology review. JAMA. Apr 20 1979;241(16):1709-10.
[Medline].
Birgens H, Ernst P, Hansen MS. Thrombotic thrombocytopenic purpura: treatment with a combination of antiplatelet drugs. Acta Med Scand. 1979;205(5):437-9.
[Medline].
Blaker F, Altrogge H, Hellwege HH, et al. Treatment of severe haemolytic-uraemic syndrome by dialysis [in German]. Dtsch Med Wochenschr. Aug 4 1978;103(31):1229-32.
[Medline].
Bohle A, Helmchen U, Grund KE, et al. Malignant nephrosclerosis in patients with hemolytic uremic syndrome (primary malignant nephrosclerosis). Curr Top Pathol. 1977;65:81-113.
[Medline].
Bukowski RM, Hewlett JS, Harris JW, et al. Exchange transfusions in the treatment of thrombotic thrombocytopenic purpura. Semin Hematol. Jul 1976;13(3):219-32.
[Medline].
Bukowski RM. Thrombotic thrombocytopenic purpura: a review. Prog Hemost Thromb. 1982;6:287-337.
[Medline].
Bell WR, Braine HG, Ness PM, Kickler TS. Improved survival in thrombotic thrombocytopenic purpura-hemolytic uremic syndrome. Clinical experience in 108 patients. N Engl J Med. Aug 8 1991;325(6):398-403.
[Medline].
Fakhouri F, Vernant JP, Veyradier A, et al. Efficiency of curative and prophylactic treatment with rituximab in ADAMTS13-deficient thrombotic thrombocytopenic purpura: a study of 11 cases. Blood. Sep 15 2005;106(6):1932-7.
[Medline].
Furlan M, Robles R, Galbusera M, et al. von Willebrand factor-cleaving protease in thrombotic thrombocytopenic purpura and the hemolytic-uremic syndrome. N Engl J Med. Nov 26 1998;339(22):1578-84.
[Medline].
Blackall DP, Marques MB. Hemolytic uremic syndrome revisited: Shiga toxin, factor H, and fibrin generation. Am J Clin Pathol. 2004;121:Suppl:S81-8.
[Medline].
Caprioli J, Bettinaglio P, Zipfel PF, et al. The molecular basis of familial hemolytic-uremic syndrome: Mutation analysis of factor H gene reveals a hot spot in short consensus repeat 20. Journal of the American Society of Nephrology. 2001;12:297-307.
[Medline].
Cattran DC. Adult hemolytic-uremic syndrome: successful treatment with plasmapheresis. Am J Kidney Dis. Jan 1984;3(4):275-9.
[Medline].
Fremeaux-Bacchi V, Kemp EJ, Goodship JA, et al. The development of atypical HUS is influenced by susceptibility factors in factor H and membrane cofactor protein- evidence from two independent cohorts. J Med Genet. 2005;Mar 22:
[Medline].
Furlan M, Robles R, Galbusera M, et al. von Willebrand factor-cleaving protease in thrombotic thrombocytopenic purpura and the hemolytic-uremic syndrome. New England Journal of Medicine. 1998;339:1578-84.
[Medline].
George JN. ADAMTS13, thrombotic thrombocytopenic purpura, and hemolytic uremic syndrome. Curr Hematol Rep. 2005;4:167-9.
[Medline].
Gordon LI, Kwaan HC, Rossi EC. Deleterious effects of platelet transfusions and recovery thrombocytosis in patients with thrombotic microangiopathy. Semin Hematol. Jul 1987;24(3):194-201.
[Medline].
Hakim RM, Schulman G, Churchill WH Jr, Lazarus JM. Successful management of thrombocytopenia, microangiopathic anemia, and acute renal failure by plasmapheresis. Am J Kidney Dis. Mar 1985;5(3):170-6.
[Medline].







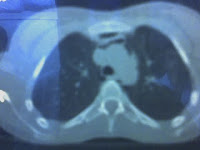


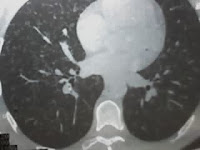
 Este es un quiste branquial , un tipo de quiste epidermoide tapizado por epitelio escamoso (a veces respiratorio o columnar) y con abundante tejido linfoide que asienta en los arcos branquiales, remanentes embriológicos encontrados en la región anterolateral del cuello. Los quistes que asientan en el primer arco branquial se encuentran debajo de la hemimandíbula cerca del pabellón auricular y la parótida. Aquellos que asientan en el segundo arco branquial (como en este caso) aparecen en la parte anteromedial del músculo esternocleidomastoideo. El 2do arco branquial es el responsable del 90% de los casos, y aquellos que asientan en el tercer y cuarto arco branquial se encuentran en la región inferior del cuello.
Este es un quiste branquial , un tipo de quiste epidermoide tapizado por epitelio escamoso (a veces respiratorio o columnar) y con abundante tejido linfoide que asienta en los arcos branquiales, remanentes embriológicos encontrados en la región anterolateral del cuello. Los quistes que asientan en el primer arco branquial se encuentran debajo de la hemimandíbula cerca del pabellón auricular y la parótida. Aquellos que asientan en el segundo arco branquial (como en este caso) aparecen en la parte anteromedial del músculo esternocleidomastoideo. El 2do arco branquial es el responsable del 90% de los casos, y aquellos que asientan en el tercer y cuarto arco branquial se encuentran en la región inferior del cuello.