Un hombre de 43 años, fue visto en una clínica neuro-oncológica debido a fatiga, lesión en hipófisis y cerebelo detectados en una radiografía.
Él había estado bien hasta hacía 9 años, cuando comenzó a tener sed, insomnio, fatiga y artralgias. En una evaluación en otro centro, se le hizo diagnóstico de diabetes insípida, y se le prescribió desmopresina. Los síntomas se resolvieron; sin embargo, durante los años siguientes, él, y su esposa fueron incapaces de concebir un segundo hijo. Aproximadamente 3 años antes, él comenzó con insomnio, fatiga, y los dolores articulares recidivaron, asociados ahora con intolerancia al frio. La evaluación no demostró evidencias de apnea del sueño. Los resultados de los tests de laboratorio se muestran en la Tabla 1.

Tabla 1. Análisis hematológicos y resultado de tests químicos.
Clickear sobre la Tabla para ampliarla.
La RMN de cerebro reveló una masa supraselar con realce nodular que comprometía el tallo pituitario superior y el hipotálamo y un nódulo que realzaba con el contraste en el hemisferio cerebeloso izquierdo. La TAC de tórax, abdomen y pelvis mostró focos escleróticos en la cabeza humeral derecha, varias vértebras torácicas, y las crestas ilíacas, con llenado correcto del sistema colector renal. Los resultados de la TAC fueron por otra parte normales.
Se le administró sulfato ferroso, levotiroxina, y testosterona transdérmica con lo que sus síntomas desaparecieron.
Dos años antes de la evaluación actual, el paciente fue visto en un hospital local debido a episodios de síncope; el examen físico fue normal, y no había hipotensión ortostática. La TAC de cabeza y cuello, llevada a cabo sin contraste, reveló engrosamiento mucoso en el seno frontal derecho y los senos etmoidales, y áreas escleróticas dentro del cráneo. La RMN mostró una lesión supraselar de aproximadamente 4 mm por 6 mm, por 9 mm que afectaba el tallo pituitario y el hipotálamo; una lesión en la sustancia blanca cerebelosa profunda, se 1,2 cm de diámetro; y leve engrosamiento mucoso del seno maxilar derecho y del seno etmoidal anterior.
En una visita de seguimiento por un neurólogo, se le realizaron un electroencefalograma y un examen oftalmológico que no mostraron anormalidades.
Una TAC de tórax y abdomen superior, llevada a cabo después de la administración de sustancia de contraste, mostró leve prominencia de ambos riñones, sin linfadenopatías. Una pequeña cantidad de líquido se observó alrededor de la aorta en el retroperitoneo y tórax, y se observaron focos escleróticos en múltiples vértebras.
Una ecografía de ambos riñones mostró que el riñón derecho media 12,1 cm y el izquierdo 10,9 cm de largo, con hidronefrosis bilateral grado 2; no había masas renales, quistes, ni litiasis. La TAC de pelvis reveló edema leve rodeando ambos riñones y un posible cálculo de menos de 3 mm de diámetro en el uréter distal. La punción lumbar y el examen del estudio del líquido cefalorraquídeo fueron normales; no había bandas oligoclonales y el nivel de acetilcolinesterasa estaba normal. Los resultados de los tests de laboratorio se muestran en la Tabla 1.
Se administró prednisona 80 mg/día por sospecha de sarcoidosis.
Un mes más tarde del comienzo de la terapia con prednisona, otra RMN de cerebro fue obtenida después de la administración de gadolinio, que reveló que las lesiones cerebelosas y neurohipofisarias habían disminuido de tamaño con respecto al estudio de RMN previo. Una pielografía retrógrada y una cistoscopia mostró agrandamiento difuso de los cálices y no se observaron litiasis ni evidencias de obstrucción. El paciente se sentía mejor, y la fatiga y los dolores articulares se habían resuelto. La prednisona fue gradualmente disminuida, pero los síntomas reaparecieron cuando se redujo la dosis a menos de 40 mg por día.
Dos RMN de cráneo obtenidas 18 meses y 12 meses antes de la evaluación actual no mostró cambios. Aumento de peso, acné, e hipertensión arterial (130/104 mmHg) aparecieron en la evolución. La prednisona se descendió a 10 mg/día.
Un año antes de la actual evaluación, el paciente fue visto por un neuro-oncólogo en este hospital. Él refería fatiga, ansiedad, dificultades en el sueño, debilidad proximal en miembros inferiores, alteraciones del equilibrio e intolerancia al frio. No tenía cefalea, rash cutáneo, úlceras genitales, derrame articular, uretritis, diarrea, o síntomas visuales; la función eréctil era normal. Él vivía con su esposa e hijo y trabajaba en una oficina. No fumaba, y raramente consumía alcohol. Su padre tenía diabetes y enfermedad de Alzheimer, su madre se había sometido a una tiroidectomía por enfermedad tiroidea, un tío había muerto de un tumor cerebral, y su hija tenía un síndrome de Tourette; sus 3 hermanos estaban sanos. Su medicación incluía prednisona (10 mg), desmopresina, atenolol, levotiroxina, y testosterona tópica.
En el examen, su tensión arterial era de 132/80 mmHg, y el pulso de 80 por minuto; su frecuencia respiratoria de 16 por minuto. Su status mental era normal. Sus campos visuales eran normales, y la agudeza visual era de 20/30 bilateralmente, no había rasgos acromegálicos ni cushingoides. La cabeza estaba inclinada hacia la derecha, y la pupila izquierda estaba mínimamente agrandada (1 mm) cuando se la comparaba con la derecha, con una sutil ptosis del párpado izquierdo. Su cara era simétrica, con movimientos oculars normales, y campos visuales normales, y papilas normales.
La fuerza en brazos y piernas era normal. Rápidos movimientos alternantes del brazo y pierna derechos, y el paciente no podía mantenerse parado sobre su pie derecho. Los reflejos eran simétricos y 2+, con respuestas plantares flexoras. El resto del exmen era normal. El test para anticuerpos contra SSA(Ro), SSB (La), Smith (Sm), y RNP eran negativos; otros resultados se muestran en la Tabla 1.
El examen oftalmológico mostró cámaras anterior y posterior limpias, campos visuales normales, y un resultado normal en el examen con la lámpara de hendidura.
Tres semanas más tarde, se discontinuó la prednisona; sin embargo, la fatiga y la intolerancia al frio empeoraron, y recurrieron los dolores articulares. Se comenzó tratamiento con hidrocortisona a una dosis de 10 mg 2 veces por día.
Ocho meses antes de la actual evaluación, una RMN obtenida después de la administración de gadolinio, mostró un proceso expansivo que realzaba, y que comprometía el receso infundibular del tercer ventrículo y el tallo pituitario; una lesión redondeada con leve realce, redondeada, de 1,7 cm de diámetro, en la zona medial del cerebelo izquierdo; y un foco esclerótico sin realce en hueso frontal y parietal izquierdos.
Se llevó a cabo una punción lumbar; el análisis del líquido cefalorraquídeo no mostró aumento de leucocitos, tenía un nivel normal de proteínas, glucosa y acetilcolinesterasa. El análisis citológico no mostró células tumorales malignas; la citometría de flujo no mostró evidencias de población de células-B monoclonal o inusual población de células T. Otros tests de laboratorio se muestran en la Tabla 1.
Cinco meses antes de la actual evaluación, una RMN de cerebro no mostró cambios.
Se realizó una biopsia transesfenoidal de la glándula pituitaria en este hospital.
El examen histopatológico reveló una glándula pituitaria anterior normal, sin evidencias de granulomas ni inflamación; la inmunotinción para hormonas pituitarias mostró una población mixta de células. El paciente no estuvo de acuerdo en realizar una craneotomía, que se le propuso para realizar una biopsia más amplia.
La fatiga, somnolencia y la dificultad en la coordinación y el equilibrio empeoraron. Tres meses antes de la actual evaluación, una RMN no mostró cambios.
Un mes más tarde, una densitometría ósea mostró osteoporosis de la columna lumbar y una osteopenia leve de cuellos femorales. Los resultados de los tests de laboratorio se muestran en la Tabla 1. La dosis de hidrocortisona se aumentó a 40 mg/día y se inició alendronato (70 g/semana) y carbonato de calcio (600 mg/día).
La fatiga disminuyó, y la dosis de hidrocortisona se bajó a 30 mg/día.
El paciente regresó por consultorio externo de neuro-oncología clínica, donde fue visto por un segundo neurooncólogo.
El paciente refirió insomnio, fatiga, tos ocasional, humor depresivo, dolor en músculos y articulaciones, palabra arrastrada, y dificultad en el equilibrio y la coordinación, sin vértigo ni caídas.
Su esposa dijo que en los dos años previos su palabra se había vuelto más lenta y más difícil de comprender. Su medicación incluía carbonato de calcio, desmopresina, sulfato ferroso, alendronato, hidrocortisona, y levotiroxina. En el examen el peso era de 88,6 kg, la presión arterial de 148/82 mmHg, el pulso de 92 por minuto, la frecuencia respiratoria de 18 por minuto, y la temperatura de 36,3C. Su palabra era disártrica y había leve dismetría en el test dedo/nariz-dedo del lado izquierdo. La marcha en tandem era levemente insegura. El resto del examen era normal. Los resultados de los tests de coagulación fueron normales, así como el nivel de electrolitos, glucosa, calcio, bilirrubina, proteínas totales, albúmina y globulinas; los tests de función renal y hepática eran normales; otros tests se muestran en la Tabla 1.
Otra RMN de cerebro reveló un crecimiento leve de la lesió cerebelosa izquierda (diámetro máximo de 1,8 cm) y el resto estaba sin cambios. Los tests de anticuerpos séricos para virus de HIV. Borrelia burgdorferi y toxoplasma (IgG e IgM) fueron negativos.
Una TAC de tórax, abdomen y pelvis con contraste endovenoso reveló densidad de partes blandas en una zona que se extendía desde el origen de la arteria subclavia izquierda a través de la aorta descendente y la aorta abdominal (grosor aproximado de 5 a 10 mm; densidad 75 unidades Hounsfield) y rodeando los riñones (grosor aproximado 5 mm), con leve hidronefrosis bilateral y leve engrosamiento de las suprarrenales. Focos escleróticos fueron vistos en la cabeza humeral, varios cuerpos vertebrales, y los ilíacos. No había masas, nódulos pulmonares ni linfadenopatías.
Un procedimiento diagnóstico fue llevado a cabo.
Diagnóstico diferencial
Este hombre comenzó entre los 30 y 40 años con un cuadro de diabetes insípida. El resultado de los tests endocrinológicos de ese momento no están disponibles, pero él respondió a la administración de vasopresina. La diabetes insípida es causada por trastornos que afectan ya sea la región infundibular del hipotálamo como el cuello pituitario. Varios años más tarde, aparecieron dolores articulares, intolerancia al frío, y trastornos del sueño, y los estudios endocrinos documentaron hipotiroidismo, y un bajo nivel de testosterona sérica, lo cual apunta al compromiso de la hipófisis en si misma o a alteración de la estimulación de la pars anterior de la hipófisis por las hormonas hipotalámicas. El nivel de hormona prolactina no estaba elevado, indicando que el sistema portal hipotálamo-hipofisario estaba funcionando. Las imágenes cerebrales demostraron lesions en la region del tallo pituitario y el cerebelo.
Un año antes del procedimiento diagnóstico, la paciente vio a un oncólogo en este hospital quien encontró evidencias de leve disfunción del tercer par craneal y del cerebelo. Podemos ver los estudios de imágenes del cerebro?
Dr. R. Gilberto Gonzalez: Las RMN de cerebro fueron obtenidas durante un período de 4 años, tanto en otro hospital como en este. Todas mostraron anormalidades en la señal centradas en el receso infundibular en el piso del tercer ventrículo (Figura 1 A)
Figura 1. RMN de cerebro.
Una imagen sagital en T1 con técnica de supresión supresión grasa y obtenida después de la administración de material de contraste, 5 meses antes de la
 actual evaluación, muestra una masa que realza en el receso infundibular del piso del tercer ventrículo y en el extremo del infundíbulo (Panel A, flecha). Hay una masa que realza con contraste en el hemisferio cerebeloso izquierdo en T1 obtenida después de la administración de contraste (Panel B, flecha). Ambas anormalidades permanecieron estables en un período de 2 años precediendo a una exploración más reciente, en la que se vió que la lesión del hemisferio cerebeloso izquierdo, hubo un leve aumento del tamaño de la lesión cuando se la compara con un hallazgo 3 meses previo(Panel C flecha).
actual evaluación, muestra una masa que realza en el receso infundibular del piso del tercer ventrículo y en el extremo del infundíbulo (Panel A, flecha). Hay una masa que realza con contraste en el hemisferio cerebeloso izquierdo en T1 obtenida después de la administración de contraste (Panel B, flecha). Ambas anormalidades permanecieron estables en un período de 2 años precediendo a una exploración más reciente, en la que se vió que la lesión del hemisferio cerebeloso izquierdo, hubo un leve aumento del tamaño de la lesión cuando se la compara con un hallazgo 3 meses previo(Panel C flecha).Una serie de RMN de cerebro, fueron obtenidas a lo largo de un período de 4 años, tanto en establecimientos fuera como en el servicio de radiología de este hospital. Todos estos estudios mostraron anormalidades centradas en el receso infundibular, en el piso del tercer ventrículo y en la punta del infundíbulo (Figura 1A). La glándula pituitaria parece normal. Una segunda anormalidad fue una masa que realza con contraste en el hemisferio cerebeloso izquierdo (Figura 1B); en T2, la masa era hipointensa y tenía un anillo de hiperintensidad, sugiriendo edema. Ambas lesiones realzan después de la administración de contraste. Ambas lesiones se mantuvieron estables en un período de 4 años hasta que en el último examen, en el que se vió que la lesión en el hemisferio cerebeloso izquierdo se agrandó levemente comparado con un estudio realizado 3 meses antes.
Hipopituitarismo
Alguna de las muchas causas de hipopituitarismo (Tabla 2) pueden ser descartadas con razonable certeza en este caso. La presencia de una masa en el área infundibular, así como los hallazgos de lesiones adicionales en el pedúnculo cerebeloso, descarta la mayoría de los tumores, excepto algunos tipos de germinomas (1) y un linfoma primario de sistema nervioso central. La ausencia de cefalea y un curso prolongado hacen a estos diagnósticos improbables. La granulomatosis de Wegener puede ser descartada por la ausencia de erosión ósea en el área de la silla turca, ya que la enfermedad habitualmente invade la fosa pituitaria desde los senos paranasales. (2)
El curso es muy largo para ser una paquimeningitis tuberculosa. El resultado normal de los tests en líquido cefalorraquídeo descartan la mayoría de los procesos infecciosos, excepto la enfermedad de Whipple. La deficiencia de hierro de causa oscura fue una manifestación clínica temprana en este paciente, y puede ser la primera pista que oriente hacia la presencia de malabsorción como resultado de una enfermedad de Whipple, pero este paciente no tenía otros signos de malabsorción. Además, las alteraciones cognitivas y conductuales (hallazgos cardinales de casi todos los casos de enfermedad de Whipple que afectan el sistema nervioso central (3) ), no están presentes. No hay evidencias de amiloidosis o hemocromatosis extracraneal.
La hipofisitis linfocitaria o autoinmune es una enfermedad que ocurre en mujeres en el período periparto.
Sarcoidosis:
El tratamiento primario de la sarcoidosis de sistema nervioso central son los glucocorticoides. (6) Este paciente recibió tratamiento con 80 mg de prednisona por un período de al menos 4 meses, y en algún momento se agregó azatioprina. La fiebre y los sudores nocturnos desaparecieron, pero las lesiones cerebrales no se resolvieron. Los hallazgos radiológicos de la sarcoidosis de sistema nervioso central, usualmente mejoran o desaparecen con la terapia glucocorticoidea, aunque la endocrinopatía raramente mejora. (5) Aunque no hay una evidencia clara de enfermedad intraselar, fue llevada a cabo una biopsia transesfenoidal, que mostró solo tejido pituitario anterior normal. La biopsia del área infundibular a través de la craneostomía fue rechazada por el paciente.
Algunos meses más tarde, aparecieron alteraciones de la palabra con una palabra arrastrada y trastornos del equilibrio en la marcha. Otra RMN mostró que las lesiones del cerebelo habían aumentado de tamaño. Aún así, la sarcoidosis de sistema nervioso central siguió siendo la presunción diagnóstico más firme, y aunque el paciente no tuvo en ningún momento de su enfermedad síntomas respiratorios, se solicitó una TAC de tórax de alta resolución buscando evidencias de enfermedad extracraneal.
Imágenes

Figura 2 TAC de Tórax y Abdomen.
Una TAC con contraste de tórax a nivel de la carina (Panel A) muestra una anomalía de partes blandas que rodea la aorta ascendente, con un grosor de 5 a 10 mm (flecha blanca). Una lesión esclerótica está localizada en la cara dorsal de un cuerpo vertebral (flecha negra). Una TAC con contraste a nivel de los riñones muetra una densidad de partes blandas que rodea la circunferencia de la aorta, las arterias renales, y los riñones (Panel B, flecha blanca); una lesión esclerótica está localizada en la cara ventral de un cuerpo vertebral (flecha negra)
En este momento, el diagnóstico diferencial de las manifesatciones radiográficas incluia fibrosis retroperitoneal y posiblemente una forma de periaortitis.
El linfoma fue también considerado, pero la ausencia de masas y adenopatías hicieron que este diagnóstico fuera considerado improbable. No había hallazgos sugestivos de sarcoidosis. Un hallazgo radiográfico adicional fue la presencia de varios focos escleróticos en cráneo, cabeza humeral, cuerpos vertebrales, y pelvis. Esos focos no fueron evaluados y no se obtuvieron radiografías de huesos largos.
Fibrosis Retroperitoneal:
Aortitis
Otras formas de aortitis asociadas con enfermedades del tejido conectivo, tales como el síndrome de Behcet, o la policondritis recidivante, son improbables debido a la ausencia de otras manifestaciones clínicas. Las causas infecciosas incluyen la sífilis, que sería improbable que afecta la aorta en toda su extensión, y la periaortitis granulomatosa por hongos. Finalmente, una forma de periaortitis puede ocurrir en la enfermedad aterosclerótica severa, que es considerada una reacción autoinmune a componentes del proceso aterosclerótico. La periaortitis generalmente es parcheada o parcelar, pero puede envolver toda la aorta. Sin embargo, ninguna forma de periaortitis puede explicar el sorprendente revestimiento de toda la aorta, y ni la fibrosis retroperitoneal ni la peiaortitis explicarían el infiltrado perinéfrico.
Histiocitosis
Los hallazgos radiográficos más remarcables, la envoltura e revestimiento externo circunferncial de la aorta es patognomónico de la enfermedad de Erdheim-Chester, una histiocitosis sistémica no Langerhans. (9,10)
Una biopsia de partes blandas del tejido que rodea a los riñones es el procedimiento indicado para confirmar el diagnóstico.
Diagnóstico presuntivo
Enfermedad de Erdheim–Chester .
Discusión Patológica:
Una biopsia con aguja del riñón, y del tejido perinéfrico contenía fragmentos de riñón normal. La grasa perirrenal contenía un infiltrado de células de apariencia histiocitaria, mezcladas con linfocitos (Figura 3A). Alguno de los histiocitos eran xantomatosos con citoplasma espumoso; otros tenían citoplasma eosinofílico más compacto. (Figuras 3 B y 3C). Células gigantes, en particular células tipo Touton con un núcleo central, estaban ausentes. No había hallazgos citológicos sugestivos de cáncer, y no había evidencias de células en huso.
Figura 3. Hallazgos anatomopatológicos del infiltrado perirrenal.
Una biopsia con aguja del riñón y tejidos perirrenales muestran un infiltrado celular reemplazando la grasa perirrenal (Panel A, hematoxi
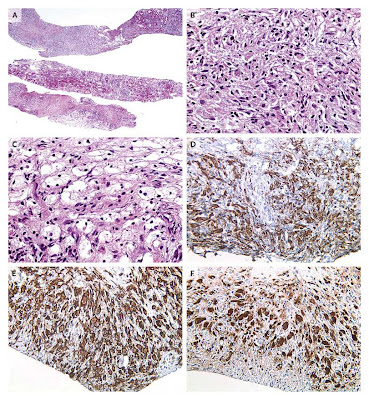 lina-eosina). Mayor magnificación revela que las células son predominantemente histiocitos con núcleos blandos y abundante citoplasma, con pocos linfocitos y células plasmáticas dispersos entre ellos. (Panel B, hematoxilina-eosina). En otras áreas, histiocitos con citoplasmas espumosos están presentes. En la tinción con inmunoperoxidasa, las células son positivas para CD14(no mostrado), CD68 (Panel D), y CD163 (Panel E), que es característico de la mayoría de los macrófagos, y para factor 13ª (Panel F) y fascina (no mostrado), que es más típico de células dendríticas intersticiales. Las células son negativas para S100, langerina, y CD1a (no mostrada), que es característica de las células de Langerhans,
lina-eosina). Mayor magnificación revela que las células son predominantemente histiocitos con núcleos blandos y abundante citoplasma, con pocos linfocitos y células plasmáticas dispersos entre ellos. (Panel B, hematoxilina-eosina). En otras áreas, histiocitos con citoplasmas espumosos están presentes. En la tinción con inmunoperoxidasa, las células son positivas para CD14(no mostrado), CD68 (Panel D), y CD163 (Panel E), que es característico de la mayoría de los macrófagos, y para factor 13ª (Panel F) y fascina (no mostrado), que es más típico de células dendríticas intersticiales. Las células son negativas para S100, langerina, y CD1a (no mostrada), que es característica de las células de Langerhans,El diagnóstico diferencial anatomo-patológico de un infiltrado histiocítico de partes blandas retroperitoneal, incluye enfermedades granulomatosas, enfermedad de Whipple, malacoplaquia, y pielonefritis xantogranulomatosa, así como inflamación inespecífica, neoplasias histiocíticas, e histiocitosis.
La presencia de histiocitos en una muestra de biopsia de retroperitoneo, combinado con los hallazgos clínicos, sugiere fuertemente el diagnóstico de enfermedad de Erdheim-Chester(11). El diagnóstico fue confirmado por los distintos fenotipos del infiltrado histiocitario (12). Esas células expresan tres moléculas comunes a los macrófagos: CD14 (un receptor monocítico-macrofágico que se fija a lipopolisacáridos), CD68 (principalmente unlisosoma macrosiálico) (Figura 3D), y CD13 (un receptor scavenger de hemoglobina-haptoglobina) (Figura 3E). Además, las células expresaban factor 13ª (una transglutaminasa tisular) (Figura 3F) y fascina (una proteína actina de envoltura), ambas de las cuales son típicas de células dendríticas interdigitantes. Estos histiocitos carecen de S100, CD1a, y langerina, todos ellos marcadores de células de Langerhans. Este inusual inmunofenotipo es compartido por todos los miembros de la familia de histiocitos xantogranulomas. (Tabla 3 y Figura 4) Yo creo que la combinación de los hallazgos clínicos. Los hallazgos morfológicos característicos, y el inmunofenotipo, son diagnósticos de enfermedad de Erdheim-Chester en este paciente.

Un sistema mieloide común da lugar a tres líneas de histiocitos y células dendríticas. Los monocitos de la sangre dan origen a los histiocitos tisulares (células intersticiales y macrófagos) que procesan los antígenos y los presentan a las células T. Los precursores de las células de la sangre dan origen a un grupo de células presentadoras de antígenos que incluyen las células intraepiteliales de Langerhans, células en velo, células dendríticas interdigitantes, que se encuentran en los ganglios linfáticos y otros tejidos.
Otros precursores de la sangre dan origen a las células dendríticas plasmocitoides productoras de interferon, también encontradas en ganglios linfáticos y otros tejidos; in vitro, esos precursores pueden ser inducidos con interleukina-3 y CD40 ligando (CD40L) para diferenciarlo de las células dendríticas.
Los histiocitos xantogranulomatosos son distintos de las células de la histiocitosis de las células de Langerhans, aunque tienen muchas similitudes. (13) En ambos trastornos, ha habido debate sobre si son procesos neoplásicos o procesos conducidos por citoquinas, y ambos tienen un amplio rango de agresividad clínica, desde la lesión cutánea aislada, hasta una enfermedad diseminada fatal, que no pueden ser predichos por los hallazgos anatomo-patológicos. La clonalidad ha sido confirmada en algunos casos de enfermedad de Erdheim-Chester. (14,15,16) Han sido descriptos casos raros, en que los pacientes con esta enfermedad, también tienen enfermedad de histiocitosis de células de Langerhans clásica en otrso sitios (9) o tienen células de Langerhans dentro de una lesión típica de enfermedad de Erdheim-Chester. (17)
La enfermedad de Erdheim-Chester no responde típicamente a la terapia con glucocorticoides. Se ha descripto el mejoramiento o estabilización de la enfermedad conirradiación y altas dosis de quimioterapia con rescate con stem-cell. Muchas combinaciones de agentes se han probado sin mucho éxito, pero la cladribina puede ser algo más efectiva que otras drogas. Recientemente, dos series de casos mostraron regresión de enfermedad radiológica y mejoramiento de de las manifestaciones clínicas con interferon alfa-2ª. (18,19) Desde la aparición de estos agentes, el tratamiento parece ser más efectivo que otros tratamientos, aún en pacientes en los que otras terapias han fallado, y ha sido propuesto como primera línea de tratamiento en la enfermedad de Erdheim-Chester.(19) Nosotros comenzamos el tratamiento de este paciente con interferon alfa pegylado, a una dosis de 150 ug/semana.
El paciente tenía severa fatiga y depresión, y nosotros redujimos la dosis de interferon a 50 ug/semana. Seis meses después del comienzo del tratamiento con interferon, los signos y síntomas neurológicos, así como las imágenes permanecían sin cambios.
Parece que este caso nos da una lección a radiólogos, patólogos, e internistas. Dr Mills, ya que la mayoría de nosotros somos internistas, qué aprendizaje podemos sacar de este caso, y como debemos mejorar nuestra destreza para diagnosticar antes este tipo de procesos?
Yo conocía esta enfermedad debido a que mi orientación es vasculitis, y especialemente aortitis. La apariencia radiográfica de la enfermedad de Erdheim-Chester que afecta la aorta a menudo plantea diagnósticos diferenciales con aortitis. Yo he visto varios pacientes con enfermedad de Erdheim-Chester, los cuales me fueron derivados con diagnóstico de aortitis, como lo fue este paciente. Si uno no acude a la literatura, es muy difícil arribar al diagnóstico. Yo pienso que la repetición de las imágenes de tórax y abdomen deberían haberse hecho antes, dado que la presencia de neurosarcoidosis progresiva sin evidencias de compromiso extracraneal es muy inusual. Cuando yo espero algo y no lo encuentro en el primer momento, es una buena idea hacer una segunda búsqueda.
Este paciente vió internistas, neurólogos, oftalmólogos, en su ciudad, y en este hospital vió a dos neurólogos, un neuroendocrinólogo, y un onco-hematólogo (debido a la sospecha de linfoma). Él también vió a otro reumatólogo después de que estuviera el informe de la biopsia y antes de ver al Dr. Mills. Un patólogo experimentado no consideró el diagnóstico cuando vió la biopsia. El Dr. Mills sospechó el diagnóstico con las imágenes y estudios de varios años atrás.
Unas radiografías obtenidas recientemente, que muestran agrandamiento simétrico y esclerosis heterogénea del fémur distal con engrosamiento perióstico, todos ellos consistentes con enfermedad de Erdheim-Chester.
Esta experiencia nos dice que el diagnóstico de histiocitosis puede ser remarcablemente dificultoso, aún con toda nuestra experiencia y tecnología.Diagnóstico Anatómico:
Enfermedad de Erdheim-Chester.
Case 25-2008 — A 43-Year-Old Man with Fatigue and Lesions in the Pituitary and Cerebellum
John A. Mills, M.D., R. Gilberto Gonzalez, M.D., Ph.D., and Ronald Jaffe, M.D.
CASE RECORDS OF THE MASSACHUSETTS GENERAL HOSPITAL
Volume 359:736-747 August 14, 2008 Number 7
Síntesis y conclusiones del Ateneo
Los elementos claves de la historia son: diabetes insípida, en relación a masa supraselar que afectaba el hipotálamo y el tallo hipofisario, así como también, masa en hemisferio cerebeloso izquierdo, que comienza 9 años antes, seguida de un panhipopituitarismo con afectación predominante en la esfera sexual, tiroides, y suprarrenal (evidenciado sólo después de la prueba de estimulación con ACTH), asociado esto a la presencia de lesiones óseas condensantes difusas, y de un tejido con densidad radiológica de partes blandas descripto en alguna parte de la Historia Clínica como “fibrosis”, que abarca todo el trayecto de la aorta torácica, desde el origen de la subclavia izquierda, aorta abdominal, retroperitoneo, englobando ambos riñones, y produciendo una hidronefrosis bilateral obstructiva, y probablemente infiltrando en el mismo proceso a ambas suprarrenales.
De entrada se presenta la dificultad de interpretar los componentes que llamaremos “intracraneales” (hipotálamo-hipofisarios, y cerebelosos) de los que llamaremos “extracraneales” (mediastino, retroperitoneo, huesos) como expresión de un mismo proceso, o considerarlas como dos enfermedades independientes.
Lógicamente, nuestro criterio unicista nos obliga a pensar en una causa que explique todas las manifestaciones (Ley de Occam), lo cual no es sencillo en este caso.
El primer síntoma que presentó el paciente fue diabetes insípida, a lo que se agregó posteriormente un hipopituitarismo parcial como dijimos.
La diabetes insípida (DI) es un trastorno producido por una deficiencia absoluta o relativa de vasopresina (ADH), o por resistencia a su efecto (DI nefrogénica).
La DI central es causada por trastornos que afectan ya sea la región infundibular (lesión más caudal) del hipotálamo, el tallo pituitario, o la hipófisis posterior, ya que la ADH es sintetizada en los núcleos supraóptico y paraventricular hipotalámicos, y es depositada en la neurohipófisis a través de axones que viajan por el tallo pituitario terminando en la neurohipófisis.
Las causas de DI de origen central, si bien son múltiples, no son una lista muy grande.
*La causa más frecuente de DI no traumática es la idiopática, que se asocia a un proceso autoinmune caracterizado por infiltración linfocitaria del hipotálamo, del tallo pituitario y de la hipófisis posterior. Pueden verse asociados a este proceso de inmunidad celular, anticuerpos dirigidos contra la ADH que son predictores del desarrollo de DI.
*El traumatismo craneal severo puede presentar DI en alrededor de 15% de los individuos.
*Los tumores intracraneales que causan DI incluyen el craniofaringioma, los tumores pineales, y los tumores de células germinales extragonadales supraselares o pineales.
*Otras causas neoplásicas causantes de DI incluyen las metástasis de cáncer de mama y pulmón, así como infiltración por linfomas y leucemias.
*Las enfermedades infecciosas que pueden dar DI incluyen todas aquellas que puedan dar una paquimeningitis basal como la tuberculosis, histoplasmosis y la sífilis entre otras. En esta categoría de infecciosas se puede incluir a la enfermedad de Whipple.
*Algunas vasculitis como la granulomatosis de Wegener.
*En misceláneas se pueden incluir a las malformaciones arteriovenosas o aneurismas que provocan síntomas compresivos en infundíbulo hipotalámico o tallo pituitario, y la anorexia nerviosa.
En este caso, la DI está dada por la masa supraselar hipotalámica, que afectaba también el tallo pituitario y el hemisferio cerebeloso izquierdo, con lo que queda establecido el diagnóstico anatómico de lesión.
En cuanto al diagnóstico etiológico, es lo que se intentó hacer con la primera biopsia transesfenoidal, que no mostró elementos categóricos (seguramente porque la masa no era intraselar), por lo que se propuso una craneotomía con nueva biopsia, a lo que el paciente “sabiamente” se niega. Decimos “sabiamente” porque, de considerar la enfermedad intra y extra craneal como un mismo proceso, es mucho más accesible una biopsia de tejidos perirrenales, que es lo que finalmente se hizo.
Después de analizar todos los diagnósticos diferenciales, sobre lo que no nos detendremos porque ya fue desarrollado extensamente en el ateneo, sólo se mantienen dos diagnósticos que pueden explicar este cuadro clínico, la sarcoidosis y las histiocitosis X. La primera descartada rápidamente por la ausencia de adenomegalias en las tomografías sobre todo de mediastino.
Aún con la biopsia retroperitoneal no se arribó a un diagnóstico de certeza, hasta que fue consultado un experto, a quien la presencia de histiocitos xantomatosos asociados a linfocitos, en una biopsia de retroperitoneo, en un contexto clínico e imagenológico como el que este paciente presentaba, evocaron rápidamente el diagnóstico de esta rara forma de histiocitosis.
Nadie diagnostica lo que no conoce. A este paciente, como bien dice la historia lo vieron varios internistas, oftalmólogos, neurólogos, endocrinólogos, reumatólogos, neuro-oncólogos, onco-hematólogos, que desconocían la enfermedad. Y cuando lo que se ve, no tiene una representación mental en forma de un cuadro clínico conocido, uno puede limitarse a describir lo que encuentra, que es lo que hicieron los médicos que vieron a este paciente, incluyendo el anatomo-patólogo que analizó la biopsia. Es así como se describen las nuevas enfermedades. Solo que esta, ya estaba descripta.
Las células de Langerhans son un tipo de histiocitos de la epidermis, llamadas también células dendríticas, que tiene la particularidad, a diferencia de la mayoría de los histiocitos tisulares, de poder migrar hacia órganos linfáticos secundarios como por ejemplo los ganglios linfáticos. La célula dendrítica es una célula capaz de captar antígenos bacterianos en las infecciones de piel, procesarlos en su interior, y comportarse como célula presentadora de antígeno. A medida que procesa el antígeno para presentarlo se diferencia y se transforma en una célula capaz de interactuar con las células T naive.
O sea que los histiocitos son parte del sistema inmune, que cumplen fundamentalmente 2 funciones, la fagocitosis, cumplida por los macrófagos, y la presentación de antígenos, función ejercida por las células dentríticas o de Langerhans. Tanto los macrófagos, como las células dendríticas derivan de las mismas células precursoras en la médula ósea, sometiéndose a diferenciación, bajo la influencia de varios factores ambientales y de crecimiento, tales como GM-CSF, TNF, e IL4. Las varias categorías de histiocitos, se diferencian por su morfología, por su fenotipo, y por su tamaño. Los macrófagos son altamente variables en tamaño, su citoplasma tiene numerosos lisosomas cargados con fosfatasa ácida, en relación a su capacidad fagocítica. Las células dendríticas tienen un núcleo indentado, con forma de poroto, y un citoplasma con finas prolongaciones (de ahí el término dendrítica). Su principal función, como dijimos es presentar antígenos.
Las histiocitosis son un grupo de diversos trastornos con un evento primario común, que es la acumulación e infiltración de monocitos, macrófagos, y células dendríticas en los tejidos afectados. Tal descripción excluye a las enfermedades en las que la infiltración de esas células ocurre en respuesta a una patología primaria de base (“histiocitosis secundaria”). La presentación clínica de estas enfermedades tiene un rango completamente variable, desde formas leves, hasta enfermedades que ponen en riesgo la vida.
En los últimos años ha habido nuevas clasificaciones para estos cuadros, dividiéndoselas en histiocitosis de células de Langerhans, que inicialmente incluia tres entidades: granuloma eosinófilo, enfermedad de Hand-Schüller-Chrstian, y la enfermedad de Letterer-Siwe, dependiendo del tipo y severidad, y las granulomatosis de células no Langerhans, dentro de las cuales está la enfermedad de Erdheim-Chester.
Para terminar, analizemos si podríamos haber sospechado el diagnóstico de histiocitosis en este paciente con los datos suministrados en la Historia Clínica.
Cuando uno analiza un caso clínico, trata de buscar para ordenar su diagnóstico diferencial lo que llamaremos “datos pesados”, que bien podríamos llamarlos de cualquier otra forma (signo o síntoma guía, sintoma o signo principal, etc). Como definir “dato pesado”?, creo que es aquel dato con relativa especificidad, que nos ayuda a acotar nuestra búsqueda. Debe ser un dato específico, y que en lo posible, sea expresión de un número limitado de diagnósticos diferenciales. Por ejemplo, casi nunca el decaimiento, la astenia, el adelgazamiento, van a ser datos pesados porque la cantidad de situaciones en que estos pueden verse es tan amplia, que no contribuyen a estrechar nuestro universo de causas. Si tenemos la “suerte” de que nuestro paciente tiene un dato de alta especificidad en su cuadro clínico, no tenemos más que analizar las causas descriptas en la bibliografía, para posteriormente someter a cada una de ellas al “tamizaje”, que es fácil para algunas causas, y no tan fácil para otras.
En este caso, el paciente tiene un dato pesado que es la diabetes insípida(DI). No es muy grande la lista de diagnósticos diferenciales de DI. Si uno después de analizar las causas realiza un tamizaje en base a clínica, tiempo evolutivo, datos de laboratorio e imágenes, se queda con muy pocas. Si se piensa cuales son las causas de DI que puedan además presentar panhipopituitarismo, y que además tengan manifestaciones en otra región no relacionada anatómicamente con la región hipotálamo-hipofisaria (en este caso el cerebelo), la lista se estrecha notablemente.
Si a esta acotada lista la sometemos al tamizaje de: cuáles entidades de las que quedaron analizando sólo las manifestaciones “intracraneales” del proceso, pueden dar manifestaciones extracraneales, afectando huesos, y ocasionando una infiltración de la región periaórtica desde el mediastino hasta el retroperitoneo, vemos que siguen en pie una, dos o a lo sumo tres entidades, como la sarcoidosis, los linfomas y las histiocitosis X.
De acá en adelante, ya los clínicos tenemos que escuchar a los patólogos, que con suerte, estrecharán la lista hasta quedarse con un solo diagnóstico posible que será el definitivo.
Sin embargo, hoy en día, con el advenimiento de los marcadores de membrana, del inmunofenotipo, etc, el diagnóstico definitivo se ha complejizado de tal forma, que ni siquiera la anatomía patológica la tiene tan fácil, y la quimera del diagnóstico a través del microscopio es parte ya de la Historia de la Medicina.
Fuente
From the Rheumatology, Allergy, and Immunology Division (J.A.M.) and the Department of Radiology (R.G.G.), Massachusetts General Hospital, Boston; the Departments of Rheumatology (J.A.M.) and Radiology (R.G.G.), Harvard Medical School, Boston; and the Department of Pathology, University of Pittsburgh School of Medicine, Pittsburgh (R.J.).
Referencias Bibliográficas:
1) Peeples DM, Stern BJ, Jiji V, Sahni KS. Germ cell tumors masquerading as central nervous system sarcoidosis. Arch Neurol 1991;48:554-556. [Free Full Text]
2) Dutta P, Hayatbhat M, Bhansali A, Bambery P, Kakar N. Wegener's granulomatosis presenting as diabetes insipidus. Exp Clin Endocrinol Diabetes 2006;114:533-536. [CrossRef][ISI][Medline]
3) Panegyres PK, Edis R, Beaman M, Fallon M. Primary Whipple's disease of the brain: characterization of the clinical syndrome and molecular diagnosis. QJM 2006;99:609-623. [Free Full Text]
4) Caturegli P, Newshaffer C, Olivi A, Pomper MG, Burger PC, Rose NR. Autoimmune hypophysitis. Endocr Rev 2005;26:599-614. [Free Full Text]
5) Bihan H, Christozova V, Dumas J-L, et al. Sarcoidosis: clinical, hormonal, and magnetic resonance imaging (MRI) manifestations of hypothalamic-pituitary disease in 9 patients and review of the literature. Medicine (Baltimore) 2007;86:259-268. [Medline]
6) Scott TF, Yandora K, Valeri A, Chieffe C, Schramke C. Aggressive therapy for neurosarcoidosis: long-term follow-up of 48 treated patients. Arch Neurol 2007;64:691-696. [Free Full Text]
7) Vaglio A, Salvarani C, Buzio C. Retroperitoneal fibrosis. Lancet 2006;367:241-251. [CrossRef][ISI][Medline]
8) Grois N, Prayer D, Prosch H, Lassmann H. Neuropathology of CNS disease in Langerhans cell histiocytosis. Brain 2005;128:829-838. [Free Full Text]
9) Veyssier-Belot C, Cacoub P, Caparros-Lefebvre D, et al. Erdheim-Chester disease: clinical and radiologic characteristics of 59 cases. Medicine (Baltimore) 1996;75:157-169. [Medline]
10) Haroche J, Amoura Z, Dion E, et al. Cardiovascular involvement, an overlooked feature of Erdheim-Chester disease: report of 6 new cases and a literature review. Medicine (Baltimore) 2004;83:371-392. [CrossRef][Medline]
11) Haroche J, Amoura Z, Wechsler B, Veyssier-Belot C, Charlotte F, Piette JC. Erdheim-Chester disease. Presse Med 2007;36:1663-1668. [CrossRef][ISI][Medline]
12) Weitzman S, Jaffe R. Uncommon histiocytic disorders: the non-Langerhans cell histiocytoses. Pediatr Blood Cancer 2005;45:256-264. [CrossRef][ISI][Medline]
13) Jaffe R. The other histiocytosis. Pediatr Dev Pathol 2004;7:2-4. [ISI][Medline]
14) Vencio EF, Jenkins RB, Schiller JL, et al. Clonal cytogenetic abnormalities in Erdheim-Chester disease. Am J Surg Pathol 2007;31:319-321. [CrossRef][ISI][Medline]
15) Chetritt J, Paradis V, Dargere D, et al. Chester-Erdheim disease: a neoplastic disorder. Hum Pathol 1999;30:1093-1096. [CrossRef][ISI][Medline]
16) Dickson BC, Pethe V, Chung CT, et al. Systemic Erdheim-Chester disease. Virchows Arch 2008;452:221-227. [CrossRef][ISI][Medline]
17) Case Records of the Massachusetts General Hospital (Case 9-2000). N Engl J Med 2000;342:875-883. [Erratum, N Engl J Med 2000;342:1620.] [Free Full Text]
18) Braiteh F, Boxrud C, Esmaeli B, Kurzrock R. Successful treatment of Erdheim-Chester disease, a non-Langerhans-cell histiocytosis, with interferon-alpha. Blood 2005;106:2992-2994.
Haroche J, Amoura Z, Trad SG, et al. Variability in the efficacy of interferon-alpha in Erdheim-Chester disease by patient and site of involvement: results in eight patients. Arthritis Rheum 2006;54:3330-3336. [CrossRef]