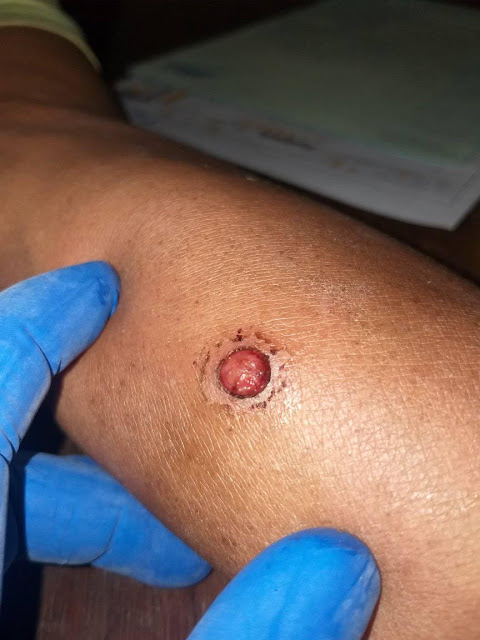
- Varón de 67 años de edad, habitante de la región del norte amazónico de La Paz Bolivia, es agricultor, que consulta por una lesión elevada indolora con tendencia al sangrado con el roce de la ropa de 2 semanas de evolución, con tendencia a sangrar con el roce de la ropa, o ante pequeños traumas. Levemente pruriginosa. Se le indicó en una farmacia, tratamiento por una semana con dicloxacilina oral sin mejoría.
La lesión tiene el aspecto típico de un granuloma
piógeno.
Gentileza:
Dr. Eugenio Alcon Fdez.
La Paz Bolivia
GRANULOMA PIÓGENO (HEMANGIOMA CAPILAR LOBULILLAR)
El granuloma piógeno (PG) o hemangioma capilar
lobulillar es un tumor vascular benigno de la piel o las membranas mucosas que
se caracteriza por un crecimiento rápido y una superficie friable [ 1 ]. El PG
ocurre a cualquier edad, aunque se ve con más frecuencia en niños y adultos
jóvenes. Por lo general, se requiere tratamiento quirúrgico porque el PG rara
vez se resuelve de manera espontánea y, a menudo, sangra de manera repetida y
profusa.
EPIDEMIOLOGÍA
El granuloma piógeno (PG) se presenta en pacientes
de todas las edades, con un pico de incidencia en la segunda y tercera décadas
de la vida [ 2,3 ]. En los niños, la edad promedio en el momento del
diagnóstico es de 6 a 10 años, y existe una predilección por los hombres [ 3-5
]. El PG mucoso es más común en mujeres adultas que en hombres y es
relativamente común en niños [ 6,7 ]. En una revisión de estudios clínicos y
patológicos que incluyeron a casi 86.000 pacientes pediátricos atendidos en
clínicas de enfermedades bucales y más de 40.000 biopsias de la mucosa oral, se
diagnosticó PG en aproximadamente el 5 por ciento de los casos [ 8 ].
Aproximadamente del 2 al 3 por ciento de las mujeres embarazadas desarrollan un
PG intraoral en los primeros cinco meses de embarazo [ 9,10 ].
PATOGÉNESIS
Aunque el nombre sugiere una etiología infecciosa,
se desconoce la causa del granuloma piógeno (PG). La mayoría de las teorías
sobre la patogenia giran en torno al PG como una respuesta neovascular
hiperplásica a un estímulo angiogénico con desequilibrio de promotores e inhibidores
[ 3,11 ]. Un análisis de 11 PG reveló marcadores de células madre embrionarias
en las células endoteliales y un patrón más diferenciado en las células
intersticiales, lo que sugiere una vasculogénesis de novo a partir de las
células madre primitivas [ 12 ].
Los factores de crecimiento angiogénicos, como el
factor de crecimiento del endotelio vascular (VEGF) y la decorina, los factores
de transcripción (pATF2 y pSTAT3) y las proteínas de la vía de transducción de
señales de la proteína quinasa activada por mitógenos (MAPK) se sobreexpresan
en las PG, pero su función exacta es indeterminada [ 11 , 13,14 ]. Un estudio
de secuenciación del exoma completo de 40 lesiones de PG encontró mutaciones
somáticas de HRAS en cuatro tumores, lo que respalda el papel de la vía
RAS-MAPK en el desarrollo de PG [ 15 ]. Se ha demostrado la activación de la
vía MAPK / ERK en PG orales [ 16 ].
Se ha sugerido el traumatismo como desencadenante,
aunque sólo del 7 al 23 por ciento de los pacientes con PG informan de una lesión
previa en el sitio [ 4,5 ]. En una serie de pacientes con PG periungueal o
subungueal, se notificó lesión local (p. Ej., Traumatismo mecánico agudo,
onicólisis o manipulación crónica de las uñas) en el 58% de los casos [ 17 ].
Se ha informado de que los pacientes que se han sometido a un trasplante de
células hematopoyéticas desarrollan PG mucoso que se cree que está relacionado
con el traumatismo de la enfermedad de injerto contra huésped oral o con
medicamentos que se toman después del trasplante [ 18 ].
La PG también puede ser inducida por fármacos [
11,17,19-29 ]. En un estudio, aproximadamente el 30 por ciento de los casos de
PG periungueal o subungueal estaban relacionados con una medicación sistémica [
17 ]. Los medicamentos involucrados incluyen:
- Retinoides sistémicos [ 30 ]
- Receptor del factor de crecimiento epidérmico (EGFR) e inhibidores de la tirosina quinasa (p. Ej., Cetuximab , imatinib [ 29,31 ])
- Inhibidores de BRAF (por ejemplo, vemurafenib , encorafenib ) [ 29,32 ]
- Capecitabina y etopósido
- Fluorouracilo tópico
- Ciclosporina , tacrolimus
- Docetaxel
- Factor estimulante de colonias de granulocitos
- Inhibidores de la proteasa del VIH
PG puede ocurrir dentro de una malformación vascular
capilar (es decir, mancha de vino de Oporto [PWS] )
espontáneamente o después de un tratamiento con láser [ 33-36 ]. Esto apoya la
hipótesis de que PG surge de anastomosis arteriovenosas microscópicas, que
pueden encontrarse en malformaciones capilares y en localizaciones comunes de
PG, como sitios acrales y mucosa oronasal [ 33 ]. En un estudio de 10 PG
surgidos en un PWS, se encontró que ocho albergaban una mutación BRAF
c.1799T> A y una mutación NRAS . Además, se identificó una mutación GNAQ
c.548G> A en todas las PG excepto una y en el respectivo PWS subyacente [ 37
]. Estos hallazgos indican que los PG se originan a partir de células
endoteliales del PWS y que las mutaciones BRAF pueden actuar como un segundo
golpe en el GNAQ.Vía de señalización de MAPK activada por mutación en las
células endoteliales, que conduce al crecimiento tumoral. El informe de PG que
surge en el contexto del tratamiento con inhibidores selectivos de BRAF apoya esta
teoría [ 18 ].
PRESENTACIÓN CLÍNICA
Características generales: el
granuloma piógeno (PG) comienza como una pequeña pápula roja que crece
rápidamente durante semanas o meses y luego se estabiliza (imagen 4). La mayoría
de las lesiones son solitarias, pero hay informes de múltiples PG que surgen de
forma diseminada. En los adultos, el PG ocurre con mayor frecuencia en el
tronco o las extremidades, mientras que en los niños, las lesiones se observan
con mayor frecuencia en la cabeza y el cuello [ 2-5 ].
Imagen 4. Granuloma piógeno del labio.
El tamaño rara vez supera el centímetro. La lesión
puede ser pediculada o sésil, y su base suele estar rodeada por un collar
característico de epidermis acantótica (imágenes 5,6,7,8,9).
Imagen 5. Granuloma piógeno. Una lesión roja
pediculada en un niño
Imagen 6. Granuloma piógeno en la cara palmar del
dedo. El "collarete" epitelial puede verse en la base de la lesión.
Imagen 7. Granuloma piógeno en el dedo.
Una pápula friable, roja, con forma de cúpula y de
rápido crecimiento con un collarete de escamas es compatible con un granuloma
piógeno.
Imagen 8. Granuloma piógeno
En el tórax hay una pápula vascular roja y
protuberante compatible con un granuloma piógeno.
Imagen 9. Granuloma piógeno: se puede ver el
"collarete" epitelial en la base de la lesión.
La mayoría de los PG surgen en superficies de piel o
mucosas de apariencia normal. Sin embargo, PG también puede surgir en una
malformación vascular capilar ( mancha de vino de Oporto, nevo simple (imagen
10)) o malformación arteriovenosa, a veces después de tratamiento con láser o
crioterapia [ 33,34,38-41 ].
Imagen 10. Granuloma piógeno que surge en un nevo
simple ("picadura de cigüeña") en la nuca de un bebé.
Los PG
periungueales también pueden desarrollarse como una complicación de la
paroniquia inducida por fármacos (imagen 11).
Imagen 11. Granulomas piógenos de los pliegues
ungueales que complican la paroniquia inducida por fármacos.
La piel está más comúnmente afectada que la mucosa.
En una revisión de 325 casos de PG, el 86 por ciento se localizó en la piel [ 2
].
VARIANTES CLÍNICAS
GRANULOMA PIÓGENO MUCOSO
El granuloma piógeno mucoso por lo general se producen en la cavidad oral.
Los sitios predominantes son el labio y la mucosa gingival (imágenes 12 y 13) [
1,6 ]. Rara vez, PG se desarrolla en el tracto gastrointestinal; los pacientes
pueden estar asintomáticos o presentar hemorragia manifiesta, anemia o disfagia
[ 42-45 ].
Imagen 12. Granuloma piógeno de labio
Imagen 13. Granuloma piógeno de la mucosa gingival.
Granuloma mucoso piógeno en una mujer de 26 años en
el cuarto mes de gestación. El crecimiento excesivo de tejido impide el
contacto y la masticación adecuados de los dientes.
El PG intraoral se presenta como una pápula o nódulo
liso, rojo o violáceo, que varía en tamaño desde varios milímetros hasta
aproximadamente 2,5 cm [ 46 ]. Las lesiones pueden ser solitarias o múltiples,
sésiles o pediculadas y sangran fácilmente después de un traumatismo menor.
GRANULOMA PIÓGENO DISEMINADO / MÚLTIPLE.
Los PG
diseminados pueden ocurrir en personas por lo demás sanas o en asociación con
erupciones medicamentosas, quemaduras o tratamiento con anticuerpos
monoclonales anti-CD20 o factor estimulante de colonias de granulocitos [
27,47-50 ]. En lactantes y niños pequeños pueden desarrollarse múltiples PG
agrupados sobre una malformación vascular preexistente, en particular
malformaciones capilares o arteriovenosas [ 51 ].
Con poca frecuencia, múltiples PG se desarrollan
como lesiones satélites de forma espontánea o después del tratamiento de un PG
solitario (PG recurrente con satelitosis) (imagen 14) [ 52-55 ]. Este fenómeno
suele ocurrir en niños y puede resolverse espontáneamente en 6 a 12 meses [ 54
].
Imagen 14. Granulomas piógenos múltiples
En este paciente, se desarrollaron múltiples
granulomas piógenos en el sitio de un granuloma piógeno solitario previamente
extirpado.
GRANULOMA PIÓGENO CONGÉNITO
Los PG
congénitos son extremadamente raras y difíciles de discernir de
hemangiomas infantiles sin examen histopatológico y transportador de glucosa 1
(GLUT1) tinción [ 56,57 ]. Los PG congénitos pueden ser solitarios o
diseminados y pueden afectar la piel y las superficies mucosas [ 58,59 ]. En
algunos lactantes se ha descrito una forma grave de PG diseminada congénita que
afecta la piel y los órganos internos (p. Ej., Sistema nervioso central,
hígado, bazo, músculos, huesos, intestino, pulmón, riñón) [ 60 ].
CURSO CLÍNICO Y COMPLICACIONES
El granuloma piógeno (PG) sangra profusamente
después de un traumatismo menor y puede ulcerarse. Hay poca información sobre
la historia natural del PG no tratado. La mayoría de las lesiones se tratan
debido a sangrado frecuente, ulceración o apariencia cosmética. El sangrado es
difícil de controlar y, a menudo, recurrente. En la experiencia clínica, los PG
generalmente no involucionan espontáneamente, pero hay excepciones:
En unos pocos pacientes se ha informado de regresión
espontánea de PG en el transcurso de 6 a 18 meses [ 4 ].
El PG inducido por fármacos puede retroceder al
suspender el fármaco causante [ 17 ].
Los PG orales que ocurren en mujeres embarazadas a
menudo retroceden después del parto [ 61 ].
PG satélites que se desarrollan espontáneamente o
después del tratamiento de un PG solitario (imagen 14) también pueden
resolverse sin tratamiento después de 6 a 12 meses [ 54 ].
En el PG diseminado, la mayoría de las lesiones
finalmente se resuelven espontáneamente [ 57,62 ].
PATOLOGÍA
El examen de baja potencia del granuloma piógeno
(PG) muestra una lesión polipoide con una disposición lobulillar de capilares
en la base (imagen 15). La epidermis que recubre la masa pediculada puede estar
aplanada, atrófica y, a menudo, ulcerada. En la base de la lesión, la epidermis
es acantótica con un crecimiento hacia adentro que representa el
"collarete epitelial" [ 5 ]. La morfología pediculada y el collarete
epitelial se observan en la mayoría de los PG que se presentan en la piel, pero
solo en el 30% de los PG de la mucosa, principalmente en los que afectan a la
mucosa oral [ 1 ].
Imagen 15. Granuloma piógeno. Anatomía patológica.
Granuloma piógeno del cuello de un niño de 4 años.
Los cortes histológicos de piel muestran una lesión polipoide con un collarete
epidérmico. Hay una arquitectura lobulillar vaga en la proliferación vascular
y, en este caso, poca inflamación.
La luz del recipiente varía en tamaño. Puede
observarse edema estromal superficial, dilatación capilar, inflamación y tejido
de granulación [ 1 ].
A mayor potencia, las células endoteliales regordetas
recubren los capilares (imagen 16). Están rodeados por una población de células
mixtas de fibroblastos, mastocitos, linfocitos, células plasmáticas y
leucocitos polimorfonucleares [ 5 ].
Imagen 16. Granuloma piógeno. Anatomía patológica.
Granuloma piógeno del cuello de un niño de 4 años. A
mayor potencia, la lesión consta de vasos condensados de pequeño calibre con
glóbulos rojos dispersos. El estroma es fibromixoide con células inflamatorias
dispersas. La atipia citológica y las mitosis no están presentes, pero pueden
verse.
La tinción inmunohistoquímica es negativa para el
transportador de glucosa 1 (GLUT1) pero positiva para la expresión del gen del
tumor de Wilms I, antígeno del factor VIII, CD31, CD34 y lectina de aglutinina
de Ulex europaeus [ 63-66 ]. La tinción de GLUT1 es útil para diferenciar el PG
de los hemangiomas infantiles, que normalmente se tiñen de forma positiva.
DIAGNÓSTICO
El diagnóstico de granuloma piógeno (PG) suele ser
sencillo, y se basa en la historia clínica de una pápula eritematosa con forma
de cúpula que sangra fácilmente y se ha desarrollado en unos pocos días o
semanas. El examen dermatoscópico revela una pápula homogénea rosada con un
collarete blanco de escamas; También se pueden ver líneas blancas que se cruzan
que representan los tabiques fibrosos que se ven en la histopatología (imagen
8) [ 67 ].
La confirmación histopatológica es útil para excluir
trastornos que pueden simular PG. La biopsia por escisión proporciona la
muestra patológica óptima para excluir tumores malignos. Sin embargo, cualquier
muestra obtenida mediante otras modalidades de tratamiento, como escisión por
raspado o legrado, también debe enviarse para examen histopatológico.
DIAGNÓSTICO DIFERENCIAL
Los trastornos que deben diferenciarse del granuloma
piógeno (PG) incluyen [ 4,68 ]:
Hemangioma infantil: los hemangiomas infantiles se
presentan como pápulas, nódulos o placas de color rojo brillante que aparecen
en la primera infancia y crecen rápidamente (imagen 17). A diferencia del PG,
el sangrado es poco común y generalmente se controla bien con presión firme.
Los hemangiomas infantiles involucionan, mientras que los PG no retroceden
espontáneamente [ 56 ]. El examen histológico durante la etapa de proliferación
demuestra la proliferación de células endoteliales angioblásticas superficiales
con pocas luces capilares. A diferencia de PG, la tinción inmunohistoquímica es
positiva para el transportador de glucosa 1 (GLUT1); sin embargo, en la mayoría
de los casos, el diagnóstico de hemangioma infantil se realiza sin biopsia.
Imagen 17. Hemangioma superficial
Los hemangiomas superficiales consisten en una
pápula, nódulo o placa de color rojo brillante que se eleva por encima de la
piel clínicamente normal.
Nevos fusiformes y de células epiteliales (nevos de
Spitz): los nevos de Spitz se presentan como pápulas firmes de color marrón o
rojo, con forma de cúpula, con una superficie intacta (imagen 18). Por lo
general, no hay antecedentes de hemorragia. En el examen dermatoscópico, pueden
verse vasos punteados y líneas blancas. Histológicamente, el nevo de Spitz es
un nevo compuesto simétrico y bien definido que consta de melanocitos
epitelioides o fusiformes.
Imagen 18. Nevo de Spitz.
Nevo de Spitz que se presenta como una pápula
rosada, simétrica y con forma de cúpula en la cara de un niño.
Tumor glómico: el tumor glómico es una neoplasia
benigna poco frecuente compuesta por células que se asemejan a las células
lisas del cuerpo glómico normal [ 69 ]. El tumor glómico generalmente se localiza
en áreas de la piel ricas en cuerpos glómicos (p. Ej., Las regiones
subungueales de los dedos o la dermis profunda de la palma, la muñeca, el
antebrazo y el pie) y se presenta como una pápula o nódulo vascular rojo
púrpura asociado con paroxismo de dolor, sensibilidad al frío y sensibilidad
(imagen 19). El tumor glómico no sangra ni se ulcera. El examen histológico
demuestra una masa sólida de células glómicas, vasos y células del músculo
liso.
Imagen 19. Tumor glómico.
Un niño de 13 años desarrolló un nódulo doloroso en
el lecho ungueal del dedo gordo del pie derecho. La biopsia reveló un tumor
glómico.
Verruga común: verrugas comunes que se presentan
como pápulas hiperqueratósicas firmes, solitarias o múltiples que
ocasionalmente pueden ser necróticas en la superficie o sangrar (imágenes 20 y
21). El examen clínico o dermatoscópico después de eliminar la capa
hiperqueratósica revela vasos trombosados ("puntos negros").
Imagen 20. Verruga vulgaris
Una pápula queratósica con hiperpigmentación periférica
está presente en la mano de este paciente con verruga vulgar (verruga común).
Imagen 21. Verruga vulgaris
Son evidentes múltiples verrugas comunes en la mano
Melanoma amelanótico: el melanoma amelanótico a
menudo se diagnostica erróneamente como PG. En el examen dermatoscópico, el
melanoma amelanótico puede tener estructuras melanocíticas sutiles o patrones vasculares
irregulares (imagen 22). El examen histológico es necesario para un diagnóstico
correcto.
Imagen 22. Melanoma amelanótico
Melanoma amelanótico que se presenta como una lesión
papular roja excoriada.
Carcinoma de células escamosas: el carcinoma de
células escamosas (SCC) generalmente se presenta como una lesión de crecimiento
lento con una superficie hiperqueratósica (imagen 23);
Imagen 23. Carcinoma cutáneo de células escamosas
Hay una pápula eritematosa e hiperqueratósica en la
piel.
El SCC de tipo queratoacantoma se desarrolla
rápidamente con un núcleo queratósico central pero no es friable (imagen 24).
Es necesario un examen histológico para confirmar el diagnóstico.
Imagen 24. Queratoacantoma
Nódulo crateriforme con hiperqueratosis central.
Carcinoma basocelular: el carcinoma basocelular
nodular se presenta como una pápula nacarada de crecimiento lento, a veces con
costra superficial o ulceración (imagen 25).
Imagen 25. Carcinoma nodular de células basales
Esta pápula nacarada con telangiectasias es
representativa de un carcinoma nodular de células basales.
En la dermatoscopia, glóbulos azules; nidos grandes,
de color azul grisáceo, ovoides; telangiectasias arborizantes; áreas similares
a hojas; o se pueden ver estructuras de ruedas de radios (imagen 26) [ 67 ]. La
histología es necesaria para confirmar el diagnóstico.
Imagen 26. Dermatoscopia de carcinomas de células
basales
(A)
Arborización de los vasos.
(B) Estructuras en forma de rueda de radios /
estructuras concéntricas (cuadrados sólidos) y estructuras en forma de hojas
(cuadrado punteado).
(C) Múltiples puntos y glóbulos no agregados de
color gris azulado.
(D) Nido ovoide grande de color azul grisáceo
(flecha sólida).
Sarcoma de Kaposi: el sarcoma de Kaposi se presenta
como pápulas y placas violáceas de crecimiento lento, generalmente múltiples en
número. Las lesiones elevadas o polipoides son raras y pueden simular PG,
aunque es inusual sangrado profuso (imagen 27) [ 70 ]. Se requiere una biopsia
para el diagnóstico definitivo del sarcoma de Kaposi.
Imagen 27. Sarcoma de Kaposi de párpado
El sarcoma de Kaposi se presenta como nódulos
violáceos en el párpado superior e inferior.
Angiomatosis bacilar: la angiomatosis bacilar es
causada por una infección por Bartonella henselae o Bartonella quintana y
generalmente ocurre en pacientes infectados por el VIH o inmunodeprimidos. Se
producen múltiples pápulas vasculares y nódulos similares a PG (imágenes 28 y
29).
Imagen 28. Angiomatosis bacilar
Hay dos lesiones rojas, lisas y brillantes sobre la
ceja.
Imagen 29. Lesión cutánea de angiomatosis bacilar
Angiomatosis bacilar que se presenta como un nódulo
vascular de color negro violáceo.
El examen histológico muestra proliferaciones
vasculares lobulares de vasos revestidos por células endoteliales regordetas
con grupos de neutrófilos y linfocitos (imagen 30). La tinción de
Warthin-Starry muestra grupos de pequeños bacilos pleomórficos (imagen 31).
Imagen 30. Microscopía óptica de angiomatosis
bacilar
Tinción con hematoxilina y eosina de una muestra de
biopsia de piel en un paciente con angiomatosis bacilar. La histología muestra
células regordetas de apariencia uniforme; muchas de estas células recubren la
luz de los canales vasculares.
Imagen 31. Tinción de Warthin-Starry en la infección
por Bartonella
Los grupos pequeños y negros representan organismos
de Bartonella que han absorbido la tinción de Warthin-Starry (flechas). El
material teñido de negro más grande representa los núcleos celulares (flechas
discontinuas).
Hiperplasia angiolinfoide con eosinofilia: la
hiperplasia angiolinfoide con eosinofilia es un trastorno raro que se presenta
como pápulas o nódulos solitarios o múltiples, eritematosos o violáceos en la
región de la cabeza y el cuello (imagen 32). Histológicamente, una
proliferación vascular prominente con células endoteliales epitelioides grandes
se asocia con un infiltrado de linfocitos y eosinófilos.
Imagen 32. Hiperplasia angiolinfoide con eosinofilia
Varias pápulas de color marrón rojizo en el cuero
cabelludo.
MANEJO
Consideraciones generales: aunque puede ocurrir una regresión espontánea
en algunos pacientes, generalmente se requiere tratamiento para el granuloma
piógeno (PG) debido a las frecuentes ulceraciones y hemorragias. Hay pocos
ensayos aleatorios que comparen tratamientos para PG y no hay consenso con
respecto al enfoque óptimo. Se han descrito muchas modalidades de tratamiento
en series retrospectivas e informes de casos. Estos incluyen tratamientos
quirúrgicos (escisión de espesor total, escisión por afeitado, legrado, terapia
con láser, crioterapia), terapias tópicas e intralesionales y combinaciones de
terapias quirúrgicas y no quirúrgicas.
En una revisión de 1162 PG tratados con 19
modalidades diferentes, en el 65% de los casos se utilizaron tratamientos
quirúrgicos, incluida la escisión de espesor total, la escisión por raspado o
el legrado [ 71 ]. Los tratamientos destructivos incluyeron crioterapia,
terapia con láser y agentes intralesionales o tópicos.
Debido a que los tumores malignos pueden imitar la
PG, es deseable que la técnica o técnicas seleccionadas para la eliminación de
PG produzcan material para el análisis histopatológico. Los factores
adicionales que influyen en la elección del tratamiento son la morfología, el
tamaño y la ubicación de la lesión; edad del paciente; y riesgo de recurrencia
y cicatrización. Los factores desencadenantes (p. Ej., Traumatismo, cuerpo
extraño o medicación), si están presentes, deben prevenirse, eliminarse o
interrumpirse si es posible.
Lesiones en áreas no cosméticamente sensibles
Escisión quirúrgica:
para adultos y niños que pueden tolerar la anestesia local, sugerimos la
escisión quirúrgica en lugar de tratamientos tópicos o destructivos para la
mayoría de los PG ubicados en áreas no cosméticamente sensibles. La escisión
quirúrgica de espesor total proporciona la muestra óptima para la confirmación
histológica del diagnóstico y tiene las tasas más bajas de recurrencia. La
cicatrización es el principal inconveniente del tratamiento quirúrgico.
Para PG no pediculados (sésiles), una escisión elíptica
y estrecha de la piel debajo de la lesión hasta la capa de grasa subcutánea
seguida de un cierre de la herida con suturas es apropiada para controlar el
sangrado y minimizar el riesgo de recurrencia. La escisión con sacabocados se
puede utilizar para PG pequeños.
Las técnicas quirúrgicas alternativas para el PG
pediculado incluyen la escisión por raspado o el legrado seguido de
fotocoagulación con láser o electrocauterización de la base. Este procedimiento
más rápido también se puede considerar para lesiones no pediculadas en niños
más pequeños que no pueden tolerar la escisión quirúrgica. Sin embargo, el
riesgo de recurrencia puede ser mayor con estas técnicas.
El tejido que se obtiene mediante escisión de
espesor total, rasurado o legrado debe colocarse en formalina y enviarse para
examen anatomopatológico. Para fines de diagnóstico, la escisión de espesor
total o la escisión por raspado proporcionan la muestra óptima para el examen
histológico.
Faltan estudios de alta calidad que comparen el tratamiento
quirúrgico con otras modalidades de tratamiento para PG. La evidencia que
respalda la escisión quirúrgica se basa en estudios observacionales; algunos
ensayos pequeños y aleatorizados; y sobre la experiencia clínica [ 1,5,71 ]:
Otros tratamientos: se han utilizado una variedad
de tratamientos para el tratamiento del PG en adultos y niños. Estos incluyen
electrocauterio, terapia con láser, crioterapia, terapia fotodinámica y
terapias tópicas e intralesionales. Estos enfoques generalmente se asocian con
una tasa de recurrencia más alta en comparación con la escisión quirúrgica, a
menudo requieren tratamientos repetidos o prolongados y, lo que es más
importante, no proporcionan muestras para la confirmación histopatológica.
Generalmente no usamos crioterapia o terapias
tópicas o intralesionales para PG. Sin embargo, el fenol tópico puede ser una
opción para los pacientes que rechazan la cirugía o para PG periungueales
pequeños.
Terapia con láser: la terapia con láser con láser de
colorante pulsado (PDL), láser de dióxido de carbono (CO 2 ) y láser de granate
de itrio y aluminio dopado con neodimio (Nd: YAG) se ha utilizado para el
tratamiento de PG en niños y adultos [ 4,74- 78 ]. La PDL y otros láseres
vasculares no permiten el examen histológico y pueden dejar hipo o
hiperpigmentación.
Con PDL, generalmente se requieren múltiples
sesiones de tratamiento debido a la penetración limitada de PDL en la dermis.
En una serie de 22 niños con PG pequeño (tamaño medio de 4 mm) tratados con
PDL, 15 requirieron de dos a seis tratamientos con láser [ 74 ]. Veinte
pacientes respondieron al tratamiento y sanaron sin dejar cicatrices, y dos
pacientes se sometieron a una posterior escisión por afeitado y
electrocauterio. En otra serie de 49 pacientes adultos y pediátricos con 51
lesiones, se requirió un promedio de dos (rango: uno a cinco) sesiones para
lesiones <5 mm, y un promedio de tres (rango: uno a seis) sesiones para
lesiones De 5 a 10 mm de tamaño [ 76 ].
El láser de CO 2 generalmente elimina las lesiones
de PG en una sesión, con tasas de recurrencia informadas del 2 al 5 por ciento
[ 71,75 ]. Puede usarse para destruir o cortar la lesión mientras se coagula la
base. El láser de CO 2 utilizado en el modo de corte puede proporcionar una
muestra adecuada para el examen histológico; sin embargo, este modo no
proporciona ninguna ventaja con respecto a las cicatrices. En una revisión de
102 PG tratados con láser de CO 2 , cinco recurrieron.
El láser Nd: YAG de pulso largo de 1064 nm se puede
utilizar después de la escisión por biopsia de PG y se sugiere como una
modalidad para ubicaciones difíciles de tratar, como las extremidades o la
matriz ungueal, o para PG sésiles más grandes [ 77,79 ] . En una revisión de 20
pacientes con PG tratados con biopsia por escisión seguida de Nd: YAG, se
obtuvo el aclaramiento en 19 de los pacientes después de una a cuatro sesiones
de tratamiento. Un paciente no respondió y finalmente fue tratado con láser de
CO 2 . En el 53% de los pacientes tratados se observaron ligeros cambios
residuales en la textura, pero sin cicatrices visibles [ 77 ].
Crioterapia: la crioterapia con nitrógeno líquido
se ha descrito como un tratamiento para PG pequeños con bajo riesgo de
recurrencia, formación de cicatrices e hipo o hiperpigmentación [ 72,73 ]. Sin
embargo, generalmente no sugerimos la crioterapia porque pueden ser necesarios
múltiples tratamientos y la crioterapia no permite la confirmación histológica.
Terapias tópicas e intralesionales: se han
utilizado una variedad de tratamientos tópicos o intralesionales para tratar la
PG. Estos incluyen escleroterapia, corticosteroides intralesionales ,
bleomicina intralesional y ligadura de suturas. Generalmente no sugerimos
terapias tópicas o intralesionales. Los inconvenientes de estas modalidades son
la imposibilidad de realizar un examen histológico y, para algunos, una alta
tasa de recurrencia:
Escleroterapia: se ha descrito escleroterapia con
inyección de oleato de etanolamina , tetradecil sulfato de sodio o polidocanol
en una pequeña serie de pacientes, con resolución completa y cicatrización poco
visible [ 80-83 ]. Un efecto secundario poco común pero potencialmente grave de
la escleroterapia es la necrosis cutánea, resultante de la extravasación del
esclerosante o la inyección directa en una arteriola cutánea. (Consulte
"Técnicas de escleroterapia con líquido, espuma y pegamento para el
tratamiento de las venas de las extremidades inferiores" ).
Cauterización química: el nitrato de plata se ha
utilizado en una pequeña serie de pacientes con PG en la mano [ 84 ]. La masa
se eliminó sin rodeos y la base de la lesión se cauterizó con nitrato de plata.
Se informó una resolución completa en 11 pacientes después de uno a tres
tratamientos. La quema de la piel normal es un efecto adverso potencial de la
cauterización con nitrato de plata.
Fenol tópico - fenol tópico ha sido utilizado para
el tratamiento de PG periungual [ 85 ]. Se coloca un trozo de algodón
humedecido en una solución de fenol al 98% sobre el PG durante tres
aplicaciones de un minuto, repetidas semanalmente hasta su resolución. En una
serie de casos de 18 pacientes, se necesitaron de 1 a 13 sesiones para el
aclaramiento [ 85 ]. La recurrencia es más común con el fenol tópico que con
los procedimientos quirúrgicos. Sin embargo, la aplicación de fenol puede ser
una opción de tratamiento para pacientes que rechazan la cirugía o para PG
periungueales más pequeños.
Imiquimod tópico: el imiquimod tópico se ha
utilizado para tratar el PG en niños y adultos [ 86-90 ]. Los regímenes de
tratamiento son variables, desde 6 días hasta 17 semanas (promedio de 40 días),
con una frecuencia de aplicación desde tres veces por semana hasta dos veces
por día, según se tolere. En una serie de 10 niños tratados con imiquimod tópico,
se informó un fracaso del tratamiento; no se produjo ninguna recidiva en los
niños que respondieron al tratamiento durante un seguimiento de aproximadamente
10 meses [ 87 ]. Los efectos secundarios del imiquimod incluyen irritación,
eritema, necrosis cutánea e infección secundaria.
Betabloqueantes tópicos: los betabloqueantes
tópicos, incluidos el propranolol tópico y el timolol , un antagonista
beta-adrenérgico no selectivo, se han utilizado para tratar el PG en un pequeño
número de niños y adultos con resultados favorables [ 91-93 ]:
Ligadura con sutura: la ligadura de la base de la
lesión con material de sutura suave (absorbible) se ha utilizado en niños con
PG facial [ 97-99 ]. Después de la ligadura, el tumor se vuelve necrótico y se
cae en días o semanas.
Inyección intralesional: la inyección intralesional
de bleomicina , corticosteroides o etanol absoluto se describe en un pequeño
número de informes de casos [ 100-103 ].
Lesiones en áreas cosméticamente sensibles: la escisión quirúrgica de espesor total y la
sutura pueden no ser deseables para los PG ubicados en áreas cosmética o
funcionalmente desafiantes debido al riesgo de cicatrización y / o deterioro
funcional. Los enfoques alternativos incluyen:
Para los adultos y los niños mayores que pueden
tolerar la anestesia local, sugerimos la escisión por rasurado seguida de
cauterización o fotocoagulación con láser de la base de la lesión. Esta
modalidad de tratamiento produce cicatrices menos visibles al tiempo que
proporciona una muestra de tejido para el examen histopatológico.
Para los niños pequeños con PG pequeños ubicados en
áreas cosméticamente sensibles, la destrucción de la lesión con electrocauterio
o PDL o fotocoagulación con láser de CO 2 , si está disponible, son opciones
razonables [ 4,74 ]. Las terapias tópicas, como los betabloqueantes o el
imiquimod (ver 'Otros tratamientos' arriba), podrían iniciarse primero para
reducir el tamaño de la lesión o, en algunos casos, para resolver completamente
el PG antes de intentar con láser o electrocauterio [ 87,91 , 94,95]. En los
niños pequeños, es menos importante tener una confirmación histológica porque
el riesgo de imitaciones malignas de PG es mucho menor que en los adultos. Sin
embargo, la necesidad de sedación o anestesia general es una preocupación,
especialmente si se necesitan múltiples sesiones de tratamiento. Por lo
general, se requieren múltiples sesiones de tratamiento con PDL debido a la
penetración limitada de PDL en la dermis; el láser de CO 2 generalmente elimina
las lesiones de PG en una sesión [ 72 ]. En una serie de 22 niños con PG
pequeño (tamaño promedio de 4 mm) tratados con PDL, 15 requirieron de dos a
seis tratamientos con láser [ 74]. Veinte pacientes respondieron al tratamiento
y sanaron sin dejar cicatrices, y dos pacientes se sometieron a una posterior
escisión por afeitado y electrocauterio. La PDL y otros láseres vasculares
pueden dejar hipo o hiperpigmentación. (Consulte "Terapia con láser y luz
para lesiones vasculares cutáneas" ).
Situaciones especiales
Lesiones recurrentes: la escisión quirúrgica es el
tratamiento de elección para los PG que recurren después del tratamiento con
afeitado o modalidades no quirúrgicas.
Lesiones múltiples o diseminadas: para
los pacientes con PG múltiple o diseminada, sugerimos la escisión quirúrgica de
algunas lesiones para confirmación histopatológica, seguida de la observación
de la regresión espontánea de las lesiones restantes para evitar la formación
de cicatrices innecesarias [ 57 ]. El tratamiento médico con betabloqueantes
orales o tópicos (p. Ej., Solución oftálmica de timolol , crema de propranolol
) se ha utilizado en unos pocos pacientes pediátricos con PG agminados
(agrupados múltiples) y en pacientes con PG periungueales múltiples inducidos
por el tratamiento con receptor del factor de crecimiento epidérmico (EGFR). )
inhibidores [ 59,104,105 ].
Lesiones Periungual
- PGs periungueales inducidos por
fármacos (imagen 23) puede retroceder después de la interrupción del fármaco
infractor. Cuando la interrupción del fármaco no es una opción, estas lesiones
pueden tratarse de forma conservadora con un ciclo corto de corticosteroides
tópicos de alta potencia y antibióticos tópicos [ 17,30 ]. Se ha informado de beneficios
con los betabloqueantes tópicos en pacientes con PG periungueales inducidos por
el tratamiento con inhibidores de EGFR [ 105 ].
Los PG periungueales que no responden al tratamiento
tópico y las lesiones no relacionadas con los medicamentos pueden tratarse con
escisión quirúrgica, legrado u otra terapia destructiva. Se recomienda un
examen histopatológico para descartar malignidad antes de proceder a
tratamientos destructivos:
Lesiones intraorales: la escisión quirúrgica hasta el
periostio es el tratamiento de elección para los PG intraorales [ 46,107 ]. La
escisión con láser de CO 2 y con láser de diodo puede ser una alternativa a la
escisión quirúrgica para la extirpación de PG de la cavidad oral [ 108-110 ].
PRONÓSTICO
Las tasas de recurrencia después del tratamiento
varían de 0 a 15 por ciento, según la modalidad de terapia y la ubicación del
granuloma piógeno (PG).
FUENTE UPTODATE 2021
REFERENCIAS
Mills SE, Cooper PH, Fechner RE. Hemangioma capilar
lobulillar: la lesión subyacente del granuloma piógeno. Un estudio de 73 casos
de las membranas mucosas oral y nasal. Am J Surg Pathol 1980; 4: 470.
Harris MN, Desai
R, Chuang TY y col. Hemangiomas capilares lobulillares:
informe epidemiológico, con énfasis en las lesiones cutáneas. J Am Acad Dermatol 2000; 42: 1012.
Giblin AV,
Clover AJ, Athanassopoulos A, Budny PG. Granuloma piógeno: la
búsqueda de un tratamiento óptimo: auditoría del tratamiento de 408 casos. J
Plast Reconstr Aesthet Surg 2007; 60: 1030.
Pagliai KA, Cohen BA. Granuloma piógeno en niños. Pediatr Dermatol 2004; 21:10.
Patrice SJ, Wiss
K, Mulliken JB. Granuloma piógeno (hemangioma capilar
lobulillar): un estudio clínico-patológico de 178 casos. Pediatr Dermatol 1991;
8: 267.
Saravana GH. Granuloma piógeno oral: revisión de 137
casos. Br J Oral Maxillofac Surg 2009; 47: 318.
Gordón-Núñez MA, de Vasconcelos Carvalho M,
Benevenuto TG, et al. Granuloma piógeno oral: análisis retrospectivo de 293
casos en una población brasileña. J Oral Maxillofac Surg 2010; 68: 2185.
Hong CHL, Dean
DR, Hull K y col. VII Taller Mundial de Medicina Oral:
Frecuencia relativa de lesiones de la mucosa oral en niños, revisión de
alcance. Oral Dis 2019; 25 Supl. 1: 193.
Kroumpouzos G, Cohen LM. Dermatosis del embarazo. J Am Acad Dermatol 2001; 45: 1.
Bett JVS,
Batistella EÂ, Melo G, et al. Prevalencia de trastornos de la
mucosa oral durante el embarazo: revisión sistemática y metanálisis. J Oral
Pathol Med 2019; 48: 270.
Piguet V, Borradori L. Lesiones similares a
granulomas piógenos durante la terapia con capecitabina. Br J Dermatol 2002; 147: 1270.
Blackwell MG,
Itinteang T, Chibnall AM y col. Expresión de marcadores
de células madre embrionarias en granuloma piógeno. J Cutan Pathol 2016; 43: 1096.
Chen SY,
Takeuchi S, Urabe K y col. Sobreexpresión de ATF2 fosforilado
y STAT3 en angiosarcoma cutáneo y granuloma piógeno. J Cutan Pathol 2008; 35:
722.
Arbiser JL, Weiss SW, Arbiser ZK y col. Expresión
diferencial de la proteína quinasa activada por mitógenos activos en neoplasias
endoteliales cutáneas: implicaciones para el comportamiento biológico y la
respuesta a la terapia. J
Am Acad Dermatol 2001; 44: 193.
Lim YH, Douglas
SR, Ko CJ, et al. Las mutaciones somáticas de activación
de RAS causan tumores vasculares, incluido el granuloma piógeno. J Invest
Dermatol 2015; 135: 1698.
Pereira TDSF, de Amorim LSD, Pereira NB, et al. Los
granulomas piógenos orales muestran activación de la vía de señalización MAPK /
ERK, que ocurre independientemente de las mutaciones BRAF, KRAS, HRAS, NRAS,
GNA11 y GNA14. J Oral Pathol Med 2019; 48: 906.
Piraccini BM, Bellavista S, Misciali C, et al.
Granuloma piógeno periungueal y subungueal. Br J Dermatol 2010; 163: 941.
Cheney-Peters D, Lund TC. Granuloma piógeno oral
después de trasplante de médula ósea en población pediátrica / adolescente:
informe de 5 casos. J Pediatr Hematol Oncol 2016; 38: 570.
Amin A, Shwayder T. Acitretina + EHK = PG: Granuloma
piógeno de la membrana del dedo del pie en un hombre con hiperqueratosis
epidermolítica corporal total con acitretina: informe de una ocurrencia única.
Dermatol Nurs 2009; 21: 345.
Exner JH, Dahod S, Pochi PE. Lesiones de acné
similares a granulomas piógenos durante la terapia con isotretinoína. Arch
Dermatol 1983; 119: 808.
Dawkins MA, Clark AR, Feldman SR. Lesión piógena
similar a un granuloma asociada con la terapia tópica con tazaroteno. J Am Acad
Dermatol 2000; 43: 154.
Segaert S, Van Cutsem E. Signos clínicos,
fisiopatología y manejo de la toxicidad cutánea durante la terapia con
inhibidores del receptor del factor de crecimiento epidérmico. Ann Oncol 2005;
16: 1425.
Alto WA. Gefitinib: una causa de lesiones piógenas
de la uña parecidas a granulomas. Arch Dermatol 2006; 142: 939.
Curr N, Saunders
H, Murugasu A, et al. Múltiples granulomas piógenos
periungueales después de 5-fluorouracilo sistémico. Australas J Dermatol 2006;
47: 130.
Lee L, Miller PA, Maxymiw WG y col. Granuloma
piógeno intraoral tras trasplante alogénico de médula ósea. Informe de tres
casos. Oral Surg Oral Med Oral Pathol 1994; 78: 607.
Devillers C, Vanhooteghem O, Henrijean A y col.
Granuloma piógeno subungueal secundario a la terapia con docetaxel. Clin Exp Dermatol 2009; 34: 251.
Lenczowski JM,
Cassarino DS, Jain A, Turner ML. Pápulas vasculares
diseminadas en un paciente inmunodeficiente en tratamiento con factor
estimulante de colonias de granulocitos. J Am Acad Dermatol 2003; 49: 105.
Bouscarat F, Bouchard C, Bouhour D. Paroniquia y
granuloma piógeno del dedo gordo del pie en pacientes tratados con indinavir. N
Engl J Med 1998; 338: 1776.
Wollina U. Paroniquia crónica inducida por fármacos
sistémicos y granuloma piógeno periungueal. Indian Dermatol Online J 2018; 9:
293.
Benedetto C, Crasto D, Ettefagh L, Nami N.
Desarrollo de granuloma piógeno periungueal con paroniquia asociada después de
la terapia con isotretinoína: informe de un caso y revisión de la literatura. J
Clin Aesthet Dermatol 2019; 12:32.
Dika E, Barisani A, Vaccari S, et al. Granuloma
piógeno periungueal después del tratamiento con imatinib en un paciente con
leucemia mielógena crónica. J Drugs Dermatol 2013; 12: 512.
Henning B, Stieger P, Kamarachev J y col. Granuloma
piógeno en pacientes tratados con inhibidores selectivos de BRAF: otra
manifestación de activación de la vía paradójica. Melanoma Res 2016; 26: 304.
Swerlick RA, Cooper PH. Granuloma piógeno
(hemangioma capilar lobulillar) dentro de las manchas de vino de Oporto. J Am
Acad Dermatol 1983; 8: 627.
Cervezas BB, Rustad OJ, Vance JC. Granuloma piógeno
tras el tratamiento con láser de una mancha en vino de Oporto. Cutis 1988; 41:
266.
Cheah S, DeKoven J. Granuloma piógeno que complica
la terapia con láser de colorante pulsado para el angioma de cereza. Australas J Dermatol 2009; 50: 141.
Olbricht SM,
Stern RS, Tang SV, et al. Complicaciones de la cirugía
cutánea con láser. Una encuesta. Arch Dermatol 1987; 123: 345.
Groesser L, Peterhof E, Evert M, et al. Mutaciones
de BRAF y RAS en granulomas piógenos esporádicos y secundarios. J Invest
Dermatol 2016; 136: 481.
Garzón MC, Enjolras O, Frieden IJ. Tumores
vasculares y malformaciones vasculares: evidencia de una asociación. J Am Acad
Dermatol 2000; 42: 275.
Ozdemir M, Engin B. Granuloma piógeno tras el
tratamiento de una mancha en vino de Oporto con luz pulsada intensa. J Cosmet
Dermatol 2007; 6: 270.
Aghaei S. Granuloma piógeno que surge en la mancha
de vino de Oporto después de la crioterapia. Dermatol Online J 2003; 9:16.
Wlotzke U, Hohenleutner U, Abd-El-Raheem TA, et al.
Efectos secundarios y complicaciones de la terapia con láser de colorante
pulsado bombeado con lámpara de destello de las manchas de vino de Oporto. Un
estudio prospectivo. Br J Dermatol 1996; 134: 475.
Moffatt DC, Warwryko P, Singh H. Granuloma piógeno:
una causa inusual de hemorragia gastrointestinal masiva del intestino delgado.
Can J Gastroenterol 2009; 23: 261.
Val-Bernal JF, Mayorga M, Cagigal ML,
Cabezas-González J. Granuloma piógeno gástrico: Reporte de dos casos y revisión
de la literatura. Pathol Res Pract 2016; 212: 68.
Castela J, Mão de Ferro S, Ferreira S, et al.
Granuloma piógeno del yeyuno: una causa inusual de anemia. J Gastrointest Surg
2018; 22: 1795.
Hirata K, Hosoe N, Imaeda H y col. Hemorragia
digestiva oscura: resección de un granuloma piógeno del íleon mediante
enteroscopia de doble balón. Clin
J Gastroenterol 2014; 7: 397.
Maymone MBC,
Greer RO, Burdine LK, et al. Lesiones benignas de la mucosa
oral: hallazgos clínicos y patológicos. J Am Acad Dermatol 2019; 81:43.
Wilson BB, Greer
KE, Cooper PH. Hemangioma capilar lobulillar diseminado
eruptivo (granuloma piógeno). J Am Acad Dermatol 1989; 21: 391.
Palmero ML, Pope E. Granulomas piógenos eruptivos
que se desarrollan después de una reacción de hipersensibilidad al fármaco. J Am Acad Dermatol 2009; 60: 855.
Shah M, Kingston
TP, Cotterill JA. Granulomas piógenos eruptivos: un
paciente tratado con éxito y revisión de la literatura. Br J Dermatol 1995; 133: 795.
Ceyhan AM, Basak
PY, Akkaya VB, et al. Un caso de granuloma piógeno eruptivo
múltiple desarrollado en una región de la piel quemada: ¿puede la eritromicina
ser una opción de tratamiento? J
Burn Care Res 2007; 28: 754.
Baselga E,
Wassef M, Lopez S, et al. Lesiones de tipo granuloma piógeno,
eruptivas, agregadas que se desarrollan sobre tinciones vasculares congénitas. Pediatr Dermatol 2012; 29: 186.
Blickenstaff RD,
Roenigk RK, Peters MS, Goellner JR. Granuloma piógeno
recurrente con satelitosis. J
Am Acad Dermatol 1989; 21: 1241.
Dillman AM,
Miller RC, Hansen RC. Granulomas piógenos múltiples en la
infancia. Pediatr Dermatol 1991; 8:28.
Benmously-Mlika R, Hammami H, Mokhtar I. Pápulas
violáceas de la espalda: una prueba. Diagnóstico: granuloma piógeno recurrente
o síndrome de Warner y Wilson-Jones (1, 2). Acta Derm Venereol 2011; 91: 491.
Gupta V, Mridha AR, Sharma VK. Photoquiz de
dermatología pediátrica: múltiples pápulas eritematosas en la espalda. Granulomas
piógenos recurrentes con satelitosis. Pediatr Dermatol 2016; 33:97.
Frieden IJ, Esterly NB. Granulomas piógenos de la
infancia disfrazados de hemangiomas en fresa. Pediatrics 1992; 90: 989.
Browning JC, Eldin KW, Kozakewich HP y col.
Granuloma piógeno diseminado congénito. Pediatr Dermatol 2009; 26: 323.
Schneider MH, García CFV, Aleixo PB, Kiszewski AE.
Granuloma piógeno cutáneo congénito: reporte de dos casos y revisión de la
literatura. J Cutan Pathol 2019; 46: 691.
Alharbi M, Eber AE, Perper M y col. Granuloma
piógeno congénito multifocal tratado con éxito con propranolol oral. Pediatr
Dermatol 2019; 36: e41.
Alomari MH, Kozakewich HPW, Kerr CL, et al.
Granuloma piógeno diseminado congénito: caracterización de un trastorno
multisistémico agresivo. J Pediatr 2020.
Løes S, Tornes K. Interpretación errónea de los
resultados histopatológicos como un factor de riesgo importante para una
cirugía innecesaria: informe de un caso de "casi accidente" en una
mujer embarazada. Patient Saf Surg 2008; 2:14.
Bozkurt M, Külahçi Y, Zor F, Aşkar I. Granuloma
piógeno diseminado gigante múltiple en una lesión por quemadura. J Burn Care
Res 2006; 27: 247.
Nappi O, Wick MR. Hemangioma capilar lobulillar
diseminado (granuloma piógeno). Estudio clínico-patológico de dos casos. Am J
Dermatopathol 1986; 8: 379.
Al Dhaybi R, Powell J, McCuaig C, Kokta
V.Diferenciación de tumores vasculares de malformaciones vasculares por
expresión del gen del tumor de Wilms 1: evaluación de 126 casos. J Am Acad Dermatol 2010; 63: 1052.
Lawley LP,
Cerimele F, Weiss SW, et al. La expresión del gen del tumor de
Wilms 1 distingue las malformaciones vasculares de las lesiones endoteliales
proliferativas. Arch
Dermatol 2005; 141: 1297.
Kuzu I, Bicknell
R, Harris AL, et al. Heterogeneidad de las células
endoteliales vasculares con relevancia para el diagnóstico de tumores
vasculares. J Clin Pathol 1992; 45: 143.
Zaballos P, Llambrich A, Cuéllar F, et al. Hallazgos
dermatoscópicos en granuloma piógeno. Br J Dermatol 2006; 154: 1108.
Hoffman DM, Shwayder T. Una pápula friable y con
costra en el cuero cabelludo de un niño de 17 meses. Pediatr Dermatol 2009; 26:
615.
Gombos Z, Zhang PJ. Tumor glómico. Arch Pathol Lab
Med 2008; 132: 1448.
Megaly M, Boshra N. Sarcoma de Kaposi similar a
granuloma piógeno. Lancet 2015.
Lee J, Sinno H, Tahiri Y, Gilardino MS. Opciones de
tratamiento para granulomas piógenos cutáneos: una revisión. J Plast Reconstr
Aesthet Surg 2011; 64: 1216.
Ghodsi SZ, Raziei M, Taheri A y col. Comparación de
crioterapia y legrado para el tratamiento del granuloma piógeno: un ensayo
aleatorizado. Br J Dermatol
2006; 154: 671.
Mirshams M,
Daneshpazhooh M, Mirshekari A, et al. Crioterapia en el
tratamiento del granuloma piógeno. J Eur Acad Dermatol Venereol 2006; 20: 788.
Tay YK, Weston
WL, Morelli JG. Tratamiento del granuloma piógeno en
niños con el láser de colorante pulsado bombeado por lámpara de destello.
Pediatrics 1997; 99: 368.
Raulin C, Greve B, Hammes S. El láser combinado de
dióxido de carbono pulsado y de onda continua para el tratamiento del granuloma
piógeno. Arch Dermatol 2002; 138: 33.
Sud AR, Tan ST. Tratamiento del granuloma piógeno
mediante raspado-escisión y / o láser de colorante pulsado. J Plast Reconstr Aesthet Surg 2010; 63: 1364.
Hammes S, Kaiser
K, Pohl L y col. Granuloma piógeno: tratamiento con láser
granate de itrio-aluminio dopado con neodimio de pulso largo de 1.064 nm en 20
pacientes. Dermatol Surg 2012; 38: 918.
Just U, Hinterhuber G, Knobler R, Neumann R. Un
láser de potasio-titanil-fosfato es una herramienta eficaz en el tratamiento de
granulomas piógenos. Un estudio retrospectivo en 28 pacientes. Photochem
Photobiol Sci 2019; 18: 343.
Bourguignon R, Paquet P, Piérard-Franchimont C,
Piérard GE. Tratamiento de granulomas piógenos con láser Nd-YAG. J Dermatolog Treat 2006; 17: 247.
Matsumoto K,
Nakanishi H, Seike T, et al. Tratamiento del granuloma piógeno
con un agente esclerosante. Dermatol Surg 2001; 27: 521.
Hong SK, Lee HJ, Seo JK y col. Lesiones vasculares
reactivas tratadas con escleroterapia con oleato de etanolamina. Dermatol Surg
2010; 36: 1148.
Moon SE, Hwang EJ, Cho KH. Tratamiento del granuloma
piógeno mediante escleroterapia con tetradecil sulfato de sodio. Arch Dermatol
2005; 141: 644.
Carvalho RA, Neto V. Carta: Escleroterapia con
polidocanol para el tratamiento del granuloma piógeno. Dermatol Surg 2010; 36
Suppl 2: 1068.
Quitkin HM, Rosenwasser MP, Strauch RJ. La eficacia
de la cauterización con nitrato de plata para el granuloma piógeno de la mano.
J Hand Surg Am 2003; 28: 435.
Losa Iglesias ME, Becerro de Bengoa Vallejo R. Fenol
tópico como tratamiento conservador del granuloma piógeno periungueal. Dermatol
Surg 2010; 36: 675.
Ezzell TI, Fromowitz JS, Ramos-Caro FA. Granuloma
piógeno recurrente tratado con imiquimod tópico. J Am Acad Dermatol 2006; 54: S244.
Tritton SM,
Smith S, Wong LC y col. Granuloma piógeno en diez niños tratados
con imiquimod tópico. Pediatr Dermatol 2009; 26: 269.
Gencoglan G, Inanir I, Gündüz K. Granuloma piógeno
en dos niños tratados con éxito con crema de imiquimod al 5%. Pediatr Dermatol
2009; 26: 366.
Goldenberg G, Krowchuk DP, Jorizzo JL. Tratamiento
exitoso de un granuloma piógeno resistente a la terapia con crema tópica de
imiquimod al 5%. J Dermatolog Treat 2006; 17: 121.
Georgiou S, Monastirli A, Pasmatzi E, Tsambaos D.
Granuloma piógeno: remisión completa con crema oclusiva de imiquimod al 5%. Clin Exp Dermatol 2008; 33: 454.
Wine Lee L, Goff
KL, Lam JM, et al. Tratamiento de granulomas piógenos
pediátricos con antagonistas de los receptores adrenérgicos β. Pediatr Dermatol
2014; 31: 203.
Piraccini BM, Alessandrini A, Dika E, et al. Crema
tópica de propranolol al 1% para granulomas piógenos de la uña: estudio abierto
en 10 pacientes. J Eur Acad Dermatol Venereol 2016; 30: 901.
Gupta D, Singh N, Thappa DM. ¿Es el timolol un
tratamiento eficaz para el granuloma piógeno? Int J Dermatol 2016; 55: 592.
Mashiah J,
Hadj-Rabia S, Slodownik D, et al. Eficacia del gel de
propranolol 4% tópico en el tratamiento del granuloma piógeno en niños. J
Dermatol 2019; 46: 245.
Neri I, Baraldi C, Balestri R, et al. Ungüento
tópico de propranolol al 1% con oclusión en el tratamiento de granulomas
piógenos: un estudio abierto en 22 niños. Pediatr Dermatol 2018; 35: 117.
DeMaria LN, Silverman NK, Shinder R. Granulomas
piógenos oftálmicos tratados con timolol tópico: características clínicas de 17
casos. Ophthalmic Plast Reconstr Surg 2018; 34: 579.
Masu T, Okuyama R, Aiba S, Tsunoda T. Ligadura de
granuloma piógeno en una cara. Int J Dermatol 2010; 49: 1075.
Hölbe HC, Frosch PJ, Herbst RA. Perla quirúrgica:
ligadura de la base del granuloma piógeno, un procedimiento atraumático, simple
y rentable. J Am Acad Dermatol 2003; 49: 509.
Scalvenzi M, Balato A, Francia MG, Lembo S.
Granuloma piógeno a cuerda! J Eur Acad Dermatol Venereol 2008; 22: 499.
Parisi E, Glick PH, Glick M. Granuloma piógeno
intraoral recurrente con satelitosis tratado con corticosteroides. Oral Dis
2006; 12:70.
Daya M. Resolución completa de un granuloma piógeno
gigante recurrente en la palma de la mano después de una dosis única de
inyección intralesional de bleomicina. J Plast Reconstr Aesthet Surg 2010; 63:
e331.
Niiyama S, Amoh Y, Katsuoka K. Granuloma piógeno que
respondió a la inyección local de esteroides. J Plast Reconstr Aesthet Surg
2009; 62: e153.
Ichimiya M, Yoshikawa Y, Hamamoto Y, Muto M.
Tratamiento exitoso del granuloma piógeno con inyección de etanol absoluto. J
Dermatol 2004; 31: 342.
Knöpfel N, Escudero-Góngora MDM, Bauzà A,
Martín-Santiago A. Timolol para el tratamiento del granuloma piógeno (PG) en
niños. J Am Acad Dermatol 2016; 75: e105.
Sibaud V, Casassa E, D'Andrea M. Son betabloqueantes
tópicos realmente efectivos "en la vida real" para la paroniquia
inducida por terapia dirigida. Support Care Cancer 2019; 27: 2341.
Panariello L, Donnarumma M, Cinelli E, Fabbrocini G.
Series de casos que muestran la eficacia de la terapia fotodinámica con ácido
5-aminolevulínico para la paroniquia inducida por el inhibidor del receptor del
factor de crecimiento epidérmico y lesiones piogénicas similares a granulomas.
Br J Dermatol 2019; 180: 676.
Jafarzadeh H, Sanatkhani M, Mohtasham N. Granuloma
piógeno oral: una revisión. J
Oral Sci 2006; 48: 167.
Truschnegg A,
Acham S, Kqiku L y col. Escisión con láser de CO2 de un
granuloma piógeno asociado a implantes dentales: reporte de un caso y revisión
de la literatura. Photomed Laser Surg 2016; 34: 425.
Lindenmüller IH, Noll P, Mameghani T, Walter
C.Tratamiento asistido por láser de CO2 de un granuloma piógeno gigante de la
encía. Int J Dent Hyg 2010; 8: 249.
Isola G, Matarese G, Cervino G, et al. Eficacia
clínica y percepción de los pacientes de la escisión de granuloma piógeno con
láser de diodo frente a técnicas quirúrgicas convencionales. J Craniofac Surg
2018; 29: 2160.