Una mujer embarazada de 33 años con colitis ulcerosa ingresó en este hospital durante el verano a las 10 semanas de gestación debido a fiebre, náuseas, vómitos, dolor y sensibilidad abdominal y dolor de cabeza.
La paciente había estado en su estado de salud
habitual hasta 3 días antes de este ingreso, cuando presentó fiebre,
escalofríos, náuseas y vómitos. Durante los siguientes 3 días, los síntomas
empeoraron; la paciente no podía comer, beber ni tomar medicamentos. Refirió
dolor abdominal y calambres en el lado izquierdo del abdomen que describió como
similares a brotes anteriores de colitis ulcerosa; ella también tenía diarrea
no sanguinolenta. La paciente llamó a la clínica de obstetricia y se le indicó
que buscara una evaluación en el departamento de emergencias de este hospital.
Una revisión de los sistemas se destacó por fatiga,
el dolor de cabeza leve, dolor de cuello y fotofobia. La paciente no refirió
hematoquecia, dolor pélvico, sangrado vaginal, disuria o dolor articular. La
colitis ulcerosa se había diagnosticado 11 años antes; en el momento del
diagnóstico, inició el tratamiento con azatioprina, pero lo dejó al cabo de 1
año debido a una fatiga intensa. La paciente había tomado mesalamina y
sulfasalazina de forma intermitente para los brotes de la enfermedad, pero por
lo general suspendía después de unos meses de tratamiento. Las exacerbaciones
de colitis ulcerosa ocurrieron
aproximadamente cada año y se asociaron con fiebre, escalofríos, náuseas,
vómitos, dolor abdominal y diarrea con sangre.
Nueve meses antes de esta admisión, desarrolló colitis por Clostridium difficile y
la paciente fue tratada con éxito con vancomicina oral. Tres semanas antes del
ingreso actual, fue ingresada en este hospital por un brote de colitis
ulcerosa; se administraron metilprednisolona, hidromorfona y ondansetrón por
vía intravenosa y se reinició la mesalamina. La sigmoidoscopia flexible reveló
eritema leve y mucosa friable con patrón vascular disminuido en el colon
sigmoide.
Una imagen de ultrasonido transvaginal obtenida durante
ese ingreso mostró un embarazo único intrauterino viable a las 7 semanas de
gestación y trazas de hemorragia subcoriónica.
La paciente fue dada de alta a los 7 días una vez
que la mayoría de los síntomas habían remitido, aunque persistieron las
náuseas. La paciente había tenido dos embarazos exitosos previos que resultaron
en partos por cesárea a término. La paciente informó que había recibido todas
las vacunas habituales de la infancia. El cribado serológico prenatal de rutina
durante el embarazo actual mostró inmunidad a la varicela pero no a la rubéola.
Las pruebas de sífilis, antígeno de superficie del virus de la hepatitis B, gonorrea,
clamidia y virus de inmunodeficiencia humana (VIH) fueron negativas. Otros
antecedentes incluyeron anemia, dolor de espalda crónico, migrañas, trastorno
de estrés postraumático, depresión y ansiedad.
En el momento de la admisión actual, los medicamentos
incluían prednisona, mesalamina, omeprazol, ondansetrón, hidromorfona,
tramadol, ciclobenzaprina, sumatriptán, gabapentina, lorazepam, sertralina,
piridoxina, colecalciferol y vitaminas prenatales. No se conocán alergias a
medicamentos. La paciente vivía en una zona urbana de Nueva Inglaterra con su
pareja masculina, con quien era monógama, y sus dos hijos. Trabajaba como
administradora. No comía sushi ni carne cruda, y no consumía leche ni queso sin
pasteurizar. No tenía contactos enfermos conocidos ni exposición a animales. No
fumaba, no bebía alcohol ni consumía sustancias ilícitas. Su madre tenía
enfermedad de las arterias coronarias, su padre enfermedad inflamatoria
intestinal y su hermana depresión. Su hermano y sus dos hijos estaban bien.
En el examen, la temperatura era de 38,2 ° C, la
presión arterial de 118/61 mm Hg, el pulso de 116 latidos por minuto, la
frecuencia respiratoria de 18 respiraciones por minuto y la saturación de oxígeno
del 100% mientras el paciente respiraba aire ambiente. Parecía cansada e
incómoda. El examen abdominal fue notable por una cicatriz quirúrgica curada;
había hipersensibilidad difusa que era más dolorosa en los cuadrantes
inferiores. El resto del examen era normal. El nivel de hemoglobina fue de 7,7
g por decilitro (rango de referencia, 12,0 a 16,0), que era similar al nivel
inicial de la paciente. El análisis de orina fue normal. Se obtuvieron muestras
de sangre para cultivo microbiológico. Otros resultados de pruebas de
laboratorio se muestran en la Tabla 1 .
Tabla 1. Datos de laboratorio.
La ecografía Doppler color del abdomen reveló una leve plenitud en el sistema pielocalicial del lado derecho ( Figura 1A ) que probablemente sea un hallazgo fisiológico durante el embarazo. Había trazas de líquido en el cuadrante inferior derecho; sin embargo, no se visualizó el apéndice ( Figura 1B ).
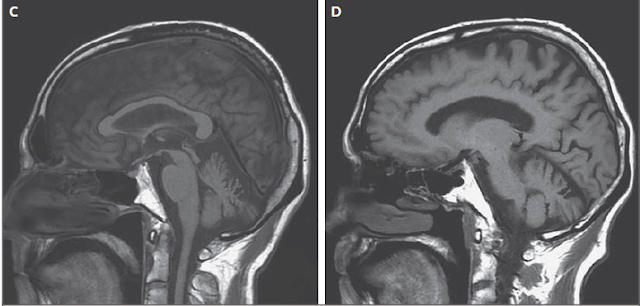
Figura 1. Una imagen de ultrasonido Doppler en color
del riñón derecho muestra una leve plenitud del sistema pielocalicial (Panel A)
que probablemente sea un hallazgo fisiológico en una mujer embarazada. Una
imagen de ecografía Doppler color sagital del cuadrante inferior derecho (Panel
B) muestra trazas de líquido; sin embargo, el apéndice no se visualiza. Imagen
de resonancia magnética abdominal, realizada sin la administración de
intravenosa material de contraste, revela un útero grávido normal. Una imagen
sagital de eco de espín rápido (SSFSE) de un solo disparo ponderada en T2 del
útero (Panel C) muestra áreas redondeadas de engrosamiento miometrial con baja
intensidad de señal (flecha), compatibles con contracciones miometriales
focales. Una imagen SSFSE coronal ponderada en T2 de gran ventana del útero
(Panel D) muestra una banda delgada de baja intensidad de señal (flechas) que
rodea el feto que es compatible con la separación corioamniótica, un hallazgo
normal en el primer trimestre. Una imagen SSFSE ponderada en T2 axial del
abdomen (Panel E) y una imagen axial del abdomen obtenida con los parámetros de
recuperación de la inversión de tau corta (STIR), (Panel F) revelan un apéndice
normal (Panel E, puntas de flecha) sin engrosamiento de la pared, dilatación o
cambios inflamatorios adyacentes. El recto, que puede ser visto en el Panel C,
no muestra engrosamiento de la pared, estratificación mural o proliferación de
grasa mesorrectal, aunque la evaluación del intestino es limitada en ausencia
de material de contraste oral e intravenoso.
Se administraron líquidos intravenosos, ondansetrón,
acetaminofén e hidromorfona; se continuó con mesalamina y se inició una
disminución gradual de la dosis de prednisona. La paciente fue ingresada en el
hospital para su posterior evaluación y atención.
Al día siguiente, el dolor abdominal persistió y fue
más severo en los cuadrantes superior e inferior derecho. El dolor de cabeza
había aumentado en severidad; era de calidad pulsante y peor en la región
frontal, con irradiación a la región occipital y posterior del cuello. Había
fotofobia leve pero sin rigidez en el cuello ni limitación en el rango de
movimiento del cuello. Se inició tratamiento empírico con ampicilina-sulbactam
intravenoso y profilaxis con vancomicina oral.
En el tercer día de hospitalización, la presión
arterial sistólica disminuyó a 70 mm Hg; después de que se administraron
líquidos por vía intravenosa, la presión arterial sistólica aumentó a 100 mm
Hg. Las imágenes de ultrasonido del útero obtenidas al lado de la cama
confirmaron latidos fetales. Se realizó una punción lumbar. El líquido cefalorraquídeo
(LCR) era transparente e incoloro, con un nivel de glucosa de 63 mg por
decilitro (3,5 mmol por litro; rango de referencia, 50 a 75 mg por decilitro) y
un nivel de proteína de 17 mg por decilitro (rango de referencia, 5 a 55).
Había 0 células nucleadas por microlitro (rango de referencia, 0 a 5). La
tinción de Gram del LCR no reveló neutrófilos y muy pocas células
mononucleares; no se identificaron organismos.
Tres días después, una resonancia magnética abdominal
( Figura 1C a 1F), realizada sin la administración de contraste intravenoso,
reveló un útero grávido normal. En las imágenes ponderadas en T2, había áreas
redondeadas de engrosamiento del miometrio con baja intensidad de señal que
coincidían con las contracciones focales del miometrio, así como una banda
delgada de baja intensidad de señal que rodeaba al feto que era compatible con
separación corioamniótica; Ambos hallazgos se consideraron normales en el
primer trimestre. El apéndice era normal, sin engrosamiento de la pared,
dilatación ni cambios inflamatorios adyacentes. Aunque la evaluación del
intestino fue limitada en ausencia de material de contraste oral e intravenoso,
el recto también parecía normal, sin signos evidentes de inflamación activa o
crónica.
Se hizo un diagnóstico.
Diagnóstico diferencial
Esta mujer embarazada de 33 años presentó fiebre,
náuseas, vómitos y dolor y sensibilidad abdominal a las 10 semanas de
gestación. También refirió dolor de cabeza y fotofobia, pero no había
meningismo en el examen. La evaluación de los síntomas de esta paciente es un
desafío debido a su historial reciente de un brote de colitis ulcerosa 3
semanas antes de esta admisión. Entre sus síntomas, la fiebre tiene el
diagnóstico diferencial más amplio; cuando ocurre durante el embarazo, lo más
probable es que se deba a una infección. Dado que la infección puede tener
serias complicaciones para la madre y el feto, centraré mi diagnóstico
diferencial en las posibles causas de fiebre e infección durante el embarazo.
EMBARAZO NORMAL
Primero, es útil considerar algunos aspectos clave
del embarazo normal y cómo se relacionan con las condiciones que pueden causar
fiebre e infección. A las 10 semanas de gestación, la placenta pesa aproximadamente
50 g la conexión vascular con la circulación materna está bien establecida. 1
Por tanto, en esta paciente se deben considerar los microorganismos con
tropismo conocido por el tejido placentario. Aunque los cambios inmunológicos
que ocurren durante el embarazo no se comprenden completamente, se cree que se
produce un cambio de las respuestas inmunitarias con un desvío de células T auxiliares tipo 1 (Th1) (que
promueven la inmunidad mediada por células), hacia las células T auxiliares tipo 2 (Th2) (que
promueve la respuesta alérgica y la inmunidad mediada por anticuerpos), lo cual
puede aumentar el riesgo de infección con patógenos intracelulares. 2 Una
infección durante el embarazo puede pasarse por alto fácilmente, porque muchas
características del embarazo normal imitan las de una infección temprana. Estos
incluyen reducciones en la resistencia vascular sistémica y la presión
arterial, un nivel más bajo de albúmina y leucocitosis leve, y un aumento de la
frecuencia respiratoria mediado por progesterona que puede conducir a alcalosis
respiratoria con excreción renal compensadora de bicarbonato. Estos mismos
cambios fisiológicos también confieren una predisposición al rápido deterioro
clínico en mujeres embarazadas con infección grave; por lo tanto, es importante
que los médicos tengan un umbral bajo para sospechar y tratar una presunta
sepsis en mujeres embarazadas. 3 Sin embargo, la mayoría de estos cambios
fisiológicos ocurren al final del tercer trimestre y, aunque es importante considerarlos
cuando se atiende a pacientes cercanas al término, es poco probable que afecten
a esta paciente, que se presentó durante el primer trimestre del embarazo.
FIEBRE DURANTE EL EMBARAZO
Además de las causas comunes de fiebre que deben
considerarse en asociación con los síntomas de esta paciente, es útil delinear
categorías amplias de infecciones para descartar al evaluar la fiebre en una
mujer embarazada. Éstas incluyen infecciones que pueden provocar complicaciones
graves en el feto o el lactante (infecciones TORCH [descritas a continuación],
paludismo, listeriosis e infección aguda por VIH); infecciones que pueden
provocar complicaciones graves en la mujer embarazada (malaria, infección por
el virus de la hepatitis E, influenza, infección primaria por el virus del
herpes simple [HSV], sarampión, infección por el virus de la varicela-zóster
[VZV] e infección bacteriana grave); infecciones que conducen a complicaciones
a las que las mujeres embarazadas son más susceptibles que otros pacientes (malaria,
listeriosis y quizás infección aguda por VIH);Infección por C. difficile en
esta paciente, dado su historial de estas condiciones.
La paciente no había viajado fuera de los Estados
Unidos en muchos años, por lo que probablemente podamos descartar la malaria y
la hepatitis E. Además, tenemos datos radiográficos muy útiles obtenidos
durante su enfermedad actual, incluidos los hallazgos de la resonancia
magnética abdominal, que se había realizado a evaluar mejor el apéndice, ya que
el apéndice no se había visualizado bien en la ecografía. La ausencia de
colitis visualizada hace poco probable un brote de colitis ulcerosa o la
recurrencia de una infección grave por C. difficile .
INFECCIONES TORCH
El acrónimo TORCH significa toxoplasmosis,
"otros" (incluida la sífilis, la infección por el virus del Zika, la
infección por parvovirus B19 y la infección por VZV), la rubéola, la infección
por citomegalovirus (CMV) y la infección por HSV. La infección por el virus del
Zika, la rubéola, la infección por VZV y la toxoplasmosis son raras entre las
mujeres embarazadas en los Estados Unidos, con incidencias de menos de 0.2
casos por cada 1000 embarazos. 4-7 Aunque la sífilis y la toxoplasmosis
ocasionalmente causan hepatitis durante el embarazo, ninguna de estas infecciones
suele causar dolor abdominal y diarrea. La infección primaria por HSV es común
durante el embarazo y las mujeres embarazadas tienen riesgo de hepatitis
asociada a HSV; sin embargo, la infección por HSV rara vez produce diarrea y es
poco probable que ocurra en ausencia de una erupción. 8Entre las infecciones
por TORCH, la infección por parvovirus B19 (con una incidencia de 30 a 160
casos por 1000 embarazos) 9,10 y la infección por CMV (con una incidencia de 20
a 240 casos por 1000 embarazos) 11 permanecen como posibles causas de los
síntomas de esta paciente.
El parvovirus B19 causa eritema infeccioso, que se
asocia con la clásica erupción de "cachetes" en los niños. En los
adultos, se asocia con fiebre, coriza y dolor de cabeza. La aplasia pura de glóbulos
rojos suele limitarse a pacientes con hemoglobinopatías subyacentes. Aunque la
artralgia se observa raramente en pacientes con infección por parvovirus
(notificada en <10% de los pacientes adultos afectados), los síntomas
gastrointestinales son frecuentes (con náuseas, vómitos o diarrea hasta en el
40% de los pacientes afectados). La infección por parvovirus B19 en el embarazo
no se asocia con alteración de la embriogénesis, pero confiere riesgo de anemia
fetal y trombocitopenia, insuficiencia cardíaca de gasto elevado (hidropesía
fetal) y muerte fetal intrauterina. 12
La infección por CMV es común durante el embarazo.
Aunque la seroprevalencia es alta en muchas poblaciones de pacientes de EE.
UU., la incidencia de infección primaria entre mujeres embarazadas no inmunes
varía del 2,3% en la población general de EE. UU, al 8,5% (en las guarderías) y al 24% (en
padres de niños que excretan CMV en orina o saliva). 11En los adultos,
incluidas las mujeres embarazadas, la infección por CMV a menudo es asintomática
o causa una enfermedad febril leve. La mononucleosis por CMV causa faringitis,
mialgia y fatiga, con un curso febril más prolongado y adenopatías menos
prominentes que las que suelen observarse con la mononucleosis por virus de
Epstein-Barr. En pacientes con enfermedad inflamatoria intestinal, los brotes
de colitis sintomática que no responden como se esperaba a la terapia
antiinflamatoria a veces se han atribuido a infección por CMV, sobre la base de
muestras de biopsia de colon que muestran CMV y cuando hay una respuesta
clínica al ganciclovir. 13La ausencia de evidencia de colitis en las imágenes
abdominales no respalda esta entidad en este paciente; incluso si la colitis
hubiera estado presente, faltan datos para determinar el efecto de la colitis
por CMV asociada a la enfermedad inflamatoria intestinal en el feto. Es
importante tener en cuenta la infección por CMV durante el embarazo, porque una
infección por CMV confirmada puede conducir a una amplia gama de resultados
fetales, que van desde la ausencia de síntomas hasta un síndrome similar a una
sepsis grave o un deterioro neurológico a largo plazo. Además, la infección
materna por CMV durante el embarazo es la principal causa no genética de
pérdida auditiva en todo el mundo. Aunque la terapia neonatal inmediata con
ganciclovir puede mejorar los resultados en los lactantes, las opciones de
tratamiento prenatal son extremadamente limitadas y el asesoramiento sobre la
prevención de la infección por CMV durante el embarazo es fundamental.
INFECCIÓN AGUDA POR VIH
Es importante considerar la infección aguda por VIH
cuando existe alguna enfermedad febril aguda. Aunque la diarrea puede estar
asociada con el síndrome retroviral agudo, los síntomas más comunes incluyen
fiebre, exantema, faringitis y linfadenopatía. 14 Es fundamental descartar la
infección aguda en mujeres embarazadas, ya que pueden tener un mayor riesgo de
contraer la infección por el VIH que las mujeres no embarazadas, y la infección
aguda que ocurre durante el embarazo o la lactancia confiere un alto riesgo de
transmisión al feto o infantil.
SÍNDROME RESPIRATORIO AGUDO SEVERO CORONAVIRUS 2
Este paciente se presentó para recibir atención
antes de la pandemia de la enfermedad por coronavirus 2019 (Covid-19). Si se
hubiera presentado durante la pandemia de Covid-19, sería importante considerar
la infección por el coronavirus 2 del síndrome respiratorio agudo severo
(SARS-CoV-2) en un paciente con fiebre y síntomas gastrointestinales. Carecemos
de datos suficientes para comprender si las mujeres embarazadas son más
susceptibles a la infección por SARS-CoV-2 que las mujeres no embarazadas, como
se ve con la influenza y otras infecciones graves por coronavirus como el
síndrome respiratorio de Oriente Medio coronavirus y el síndrome respiratorio
agudo severo coronavirus 1. 15Aunque los datos de principios de 2020 sugirieron
que los resultados clínicos no fueron más graves durante el embarazo, los
informes más recientes de los Centros para el Control y la Prevención de
Enfermedades sugieren que las mujeres embarazadas hospitalizadas pueden tener
más probabilidades que las mujeres no embarazadas hospitalizadas de ser
ingresadas en una unidad de cuidados intensivos y recibir ventilación mecánica.
16,17 Aún se están evaluando los datos sobre los resultados fetales; la
literatura incluye solo datos limitados sobre los resultados después de las
infecciones por SARS-CoV-2 que ocurren al principio del embarazo y después de
una infección leve o asintomática. Los datos existentes no han sugerido
teratogenicidad, pero pueden sugerir un mayor riesgo de muerte fetal y parto
prematuro, y la verdadera transmisión en el útero es rara. 18Las vacunas de ARN
mensajero para Covid-19 no se han asociado con un mayor riesgo de resultados
adversos del embarazo, generan altos niveles de anticuerpos en la sangre
materna y la leche materna y conducen a una transferencia eficaz de anticuerpos
transplacentarios a los fetos. 19
INFLUENZA
La influenza sigue siendo una causa importante de
muerte y complicaciones entre las mujeres embarazadas, con un mayor riesgo de
enfermedad grave más adelante en el embarazo. La vacunación de mujeres que
estarán en cualquier etapa del embarazo durante la temporada de influenza
brinda protección tanto contra enfermedades maternas graves como contra
infecciones en los recién nacidos, que reciben protección pasiva de anticuerpos
hasta que puedan vacunarse a los 6 meses de edad. Aunque un síndrome de fiebre,
vómitos y diarrea es compatible con la influenza, la presentación de este
paciente en el verano hace que la influenza sea poco probable. 20
SARAMPIÓN
Dadas las crecientes tasas de rechazo de la vacuna
en los Estados Unidos y en todo el mundo, el sarampión debe estar nuevamente en
el diagnóstico diferencial de la fiebre durante el embarazo. El embarazo
aumenta el riesgo de enfermedades graves relacionadas con el sarampión, que
incluyen neumonía y encefalitis, y la muerte. Aunque el sarampión no está
asociado con defectos de nacimiento, su presencia durante el embarazo puede
causar aborto espontáneo o muerte fetal, parto prematuro y bajo peso al nacer.
Esta paciente informó haber recibido las vacunas infantiles habituales, pero no
recordaba ni proporcionaba documentación específica sobre la vacunación contra
el sarampión; su prueba serológica para rubéola fue negativa. Las pruebas
serológicas para la rubéola, pero no para el sarampión, son parte de nuestra
evaluación prenatal de rutina. Aunque la presencia de IgG contra la rubéola
sugeriría la recepción de al menos una dosis de la vacuna contra el sarampión,
las paperas y la rubéola para los pacientes nacidos en los Estados Unidos, no
se ha validado como marcador sustituto de la inmunidad contra el sarampión. La
gastroenteritis puede ocurrir con el sarampión, generalmente durante la fase en
la que aparecen tanto la erupción como la fiebre; la ausencia de erupción en
este paciente hace que el sarampión sea poco probable.21
INFECCIONES BACTERIANAS GRAVES
La sepsis es la segunda causa principal de muerte
materna en los Estados Unidos. 22 La sepsis periparto también se asocia con un
mayor riesgo de aborto espontáneo, muerte fetal y parto prematuro. 3,23 Los
sitios más comunes de infección son los riñones (pielonefritis), los pulmones
(neumonía) y el útero (corioamnionitis, infección causada por productos retenidos
de la concepción y endometritis posparto). La infección por los patógenos
bacterianos más comunes depende del sitio y el momento de la enfermedad: la
infección por Escherichia coli es más común antes del parto; infecciones por
estreptococos del grupo B, E. coli y anaerobios ocurren con mayor frecuencia
durante la etapa intraparto; y las infecciones por estos mismos microorganismos
más estreptococos del grupo A y estafilococos son más frecuentes durante el
período posparto. Aunque cualquiera de estos patógenos puede causar sepsis en
mujeres embarazadas, la infección por Listeria monocytogenes es de particular
preocupación en esta paciente debido a su fiebre, dolor de cabeza, fotofobia y
síntomas gastrointestinales.
LISTERIA MONOCYTOGENES
La presentación de esta paciente tiene varias
características clave que son consistentes con infección por listeria. En un huésped
inmunocompetente, la ingestión de alimentos contaminados con listeria suele
provocar una infección asintomática o una gastroenteritis febril leve. 24 Sin
embargo, esta paciente tiene un mayor riesgo de infección invasiva por listeria
porque está embarazada, tiene una enfermedad inflamatoria intestinal y toma
terapia inmunosupresora. 25 La listeria tiene un mecanismo único de propagación
de célula a célula que permite que el organismo traspase la barrera epitelial
intestinal y entre al torrente sanguíneo, donde posteriormente puede cruzar la
barrera hematoencefálica para causar meningoencefalitis en personas de edad
avanzada o inmunodeprimidas o atravesar la barrera placentaria para causar
infección fetal en mujeres embarazadas ( Figura 2). 27
Figura 2. Patogenia de la listeriosis en mujeres
embarazadas.
Los resultados del embarazo se derivan de 101
infecciones materno-neonatales informadas en el estudio MONALISA (Multicentric Estudio
Nacional Observacional sobre Listeriosis y Listeria) y se presentan según el
trimestre de embarazo en el momento del diagnóstico. Los investigadores
definieron el parto anormal a término como parto con fiebre, meconio líquido o
frecuencia cardíaca fetal anormal.26 SNC denota sistema nervioso central y GI
gastrointestinal.
La infección por Listeria suele ser leve durante el
embarazo. Aproximadamente la mitad de las mujeres embarazadas con listeriosis
tienen bacteriemia, pero la afectación del sistema nervioso central (SNC), como
la rombencefalitis observada en pacientes inmunodeprimidos, es rara. 26
Aproximadamente dos tercios de las mujeres embarazadas con infección por
listeria tienen síntomas; los más comunes son fiebre, enfermedades similares a
la influenza, dolor abdominal, dolor de cabeza y vómitos o diarrea. 28 Aunque
la infección por listeria en mujeres embarazadas suele ser leve, las
infecciones fetales e infantiles pueden ser graves. El riesgo de aborto
espontáneo o muerte fetal es aproximadamente del 20%. Entre los recién nacidos
vivos, el parto prematuro es común y aproximadamente dos tercios presentarán
síntomas al nacer, como bacteriemia, neumonía, meningitis o erupción
maculopapular. Los abscesos o granulomas en la piel, hígado, bazo, pulmones,
riñones o cerebro pueden caracterizar el síndrome de granulomatosis
infantiseptica, que a menudo conduce a muerte fetal o neonatal. En una minoría
de bebés que parecen asintomáticos al nacer, la enfermedad, incluida la
bacteriemia o la meningitis, se desarrollará después de 5 días de vida. Aunque
el riesgo de infección sintomática por listeria aumenta más adelante en el
embarazo, el riesgo de un resultado fetal adverso grave parece ser mayor cuando
la infección ocurre al principio del embarazo. 29
La terapia con antibióticos para la infección por
listeria difiere levemente para las mujeres embarazadas y las pacientes no
embarazadas y depende de la presentación clínica. La gastroenteritis aislada en
pacientes no embarazadas menores de 65 años sin inmunodepresión no siempre
justifica el uso de antibióticos. Por el contrario, en el embarazo, se
recomienda el tratamiento de la gastroenteritis para prevenir la bacteriemia y
la infección placentaria. En las pacientes no embarazadas, la bacteriemia a
menudo se trata con dos antibióticos para prevenir la siembra del SNC, mientras
que en las mujeres embarazadas, dado que la enfermedad del SNC es poco común
durante el embarazo, la bacteriemia generalmente se trata con un solo fármaco. Muchos
expertos recomiendan que las mujeres embarazadas con infección por listeria
retrasen el parto tanto como sea posible para maximizar la duración de la
terapia antibiótica prenatal; este enfoque difiere del utilizado para otras
formas de corioamnionitis bacteriana, en las que a menudo está indicada la
rápida terminación del embarazo. 26,30
El riesgo de infección sintomática por listeria
aumenta durante el transcurso del embarazo, lo que hace que dicha infección sea
algo poco probable en una paciente a las 10 semanas de gestación. 29 Sin
embargo, dado los síntomas gastrointestinales predominantes de esta paciente y
la falta de una clara evidencia de otra causa, la infección por listeria es el
diagnóstico más probable en este caso.
DIAGNÓSTICO PRESUNTIVO
INFECCIÓN POR LISTERIA.
DISCUSIÓN PATOLÓGICA
Se obtuvieron hemocultivos en el momento de la
admisión. Después de 24 horas de incubación, se detectó crecimiento microbiano
en un frasco de hemocultivo anaeróbico, con crecimiento posterior en cuatro
frascos aeróbicos y anaeróbicos adicionales. Una tinción de Gram del caldo de
hemocultivo ( Figura 3A ) reveló bacilos grampositivos. Los bacilos, que eran
rectos y de tamaño pequeño a mediano y se presentaban solos o en parejas,
sugerían especies de listeria, a diferencia de las especies de corynebacterium,
que tienden a aparecer como bacilos pleomórficos y en forma de maza, o especies
de bacilos, que aparecen como bacilos grandes y en forma de caja. El caldo de
hemocultivo se subcultivó en una placa de agar sangre ( Figura 3B); las colonias
grisáceas resultantes estaban rodeadas por una zona estrecha de hemólisis. El
organismo produce catalasa y es móvil. Una colonia aislada fue identificada
como L. monocytogenes por medio de espectrometría de masas de ionización por
desorción láser asistida por matriz y tiempo de vuelo. La susceptibilidad a
ampicilina y penicilina se confirmó con el uso de un panel de microdilución en
caldo.
Figura 3. Muestra de hemocultivo.
Una tinción de Gram del caldo de hemocultivo
positivo (Panel A) muestra barras de tamaño pequeño a mediano que ocurren individualmente
o en parejas. Subcultivo del caldo de sangre de oveja placa de agar (Panel B)
muestra una zona estrecha de hemólisis que rodea las colonias.
Debido a que L. monocytogenes se asocia con una
mortalidad sustancial en mujeres inmunodeprimidas y embarazadas, muchos países,
incluido Estados Unidos, realizan un seguimiento de brotes en tiempo real
mediante la secuenciación del genoma completo de los aislados de L.
monocytogenes . 31 La secuenciación rutinaria del genoma completo del aislado
de esta paciente no reveló vínculos con ningún otro caso, y la fuente de su
infección sigue siendo desconocida. El cultivo de heces de rutina para detectar
L. monocytogenes tiene poca sensibilidad y poca especificidad y no se realizó
en este paciente.
SEGUIMIENTO
Cuando se estableció el diagnóstico de listeriosis,
el régimen de antibióticos del paciente se redujo a ampicilina intravenosa; Se
continuó con vancomicina profiláctica oral. Durante los siguientes 2 días,
continuaron la fiebre, el fuerte dolor de cabeza y el dolor abdominal difuso.
Se agregó gentamicina a su régimen de tratamiento. El séptimo día de
hospitalización, las imágenes de ultrasonido del útero obtenidas al lado de la
cama no mostraron latidos cardíacos fetales. El aborto fallido se diagnosticó a
las 11 semanas y 2 días de gestación. Se realizó dilatación y evacuación.
EVALUACIÓN PATOLÓGICA DE LA PLACENTA
El examen macroscópico de la placenta no fue
notable, sin un olor dulce ni microabscesos notables. El examen microscópico
reveló decidua inflamada y necrótica ( Figura 4A ) sin formación de abscesos
vellosos o inflamación intervellosa ( Figura 4B ). La tinción de Brown-Hopps
reveló posibles bacterias en el margen de la muestra, pero L. monocytogenes no
se recuperó con cultivo placentario, posiblemente debido al uso de terapia con
antibióticos.
Figura 4. Muestra placentaria.
La tinción con hematoxilina y eosina (Panel A)
muestra áreas de inflamación aguda marcada (flecha) en la decidua materna; el
asterisco indica decidua normal. En mayor aumento (Panel B), las vellosidades
coriónicas son inmaduras, como se esperaba a las 11 semanas de gestación, sin
abscesos o inflamación dentro de las vellosidades (flecha) o entre las vellosidades
(asterisco).
Después de que se realizó la dilatación y la
evacuación, las fiebres se resolvieron. El día 10 de hospitalización, cuando
los síntomas remitieron, la paciente fue dada de alta con planes de apoyo al
trabajo social y seguimiento estrecho.
DIAGNOSTICO FINAL
BACTEREMIA POR LISTERIA MONOCYTOGENES QUE RESULTA EN
LA PÉRDIDA DEL FETO.
Traducción de
“A 33-Year-Old
Pregnant Woman with Fever, Abdominal Pain, and Headache”
Andrea L.
Ciaranello, M.D., M.P.H., Kathy M. Tran, M.D., Craig R. Audin, M.D., and Melis
N. Anahtar, M.D., Ph.D.
https://www.nejm.org/doi/full/10.1056/NEJMcpc2107344
References
1. Rasmussen KM,
Yaktine AL. Composition
and components
of gestational weight
gain: physiology
and metabolism. In:
Weight gain
during pregnancy: reexamining
the guidelines.
Washington, DC: National
Academy Press,
2009 (https://www
.ncbi
.nlm
.nih
.gov/
books/
NBK32815/
).
2. Dashraath P,
Wong JLJ, Lim MXK, et al.
Coronavirus
disease 2019 (COVID-19)
pandemic and
pregnancy. Am J Obstet
Gynecol 2020;
222: 521-31.
3. Bauer ME,
Bateman BT, Bauer ST,
Shanks AM, Mhyre
JM. Maternal sepsis
mortality and
morbidity during hospitalization
for delivery:
temporal trends and
independent
associations for severe sepsis.
Anesth Analg
2013; 117: 944-50.
4. Zika Virus:
2020 case counts in the
US. Atlanta:
Centers for Disease Control
and Prevention,
2021 (https://www .cdc
.gov/
zika/
reporting/
2020
-case
-counts
.html).
5. Reef SE, Frey
TK, Theall K, et al. The
changing
epidemiology of rubella in the
1990s: on the
verge of elimination and
new challenges
for control and prevention.
JAMA 2002; 287:
464-72.
6. Zhang HJ,
Patenaude V, Abenhaim HA.
Maternal
outcomes in pregnancies affected
by varicella
zoster virus infections:
population-based
study on 7.7 million
pregnancy
admissions. J Obstet Gynaecol
Res 2015; 41:
62-8.
7. Maldonado YA,
Read JS, Committee
on infectious
diseases. Diagnosis, treatment,
and prevention
of congenital toxoplasmosis
in the United
States. Pediatrics
2017; 139(2):
e20163860.
8. Magawa S,
Tanaka H, Furuhashi F,
et al. A
literature review of herpes simplex
virus hepatitis
in pregnancy. J Matern Fetal
Neonatal Med 2020; 33: 1774-9.
9. Gratacós E, Torres PJ, Vidal J, et al.
The incidence of
human parvovirus B19
infection during
pregnancy and its impact
on perinatal
outcome. J Infect Dis 1995;
171: 1360-3.
10. Cartter ML,
Farley TA, Rosengren S,
et al.
Occupational risk factors for infection
with parvovirus
B19 among pregnant
women. J Infect
Dis 1991; 163: 282-5.
11. Hyde TB,
Schmid DS, Cannon MJ. Cytomegalovirus
seroconversion
rates and risk
factors:
implications for congenital CMV.
Rev Med Virol
2010; 20: 311-26.
12. Knuesel SJ,
Guseh JS, Karp Leaf R,
Ciaranello AL, Eng GM. Case 6-2018:
a 35-year-old
woman with headache, subjective
fever, and
anemia. N Engl J Med
2018; 378:
753-60.
13. Jentzer A,
Veyrard P, Roblin X, et al.
Cytomegalovirus
and inflammatory bowel
diseases (IBD)
with a special focus on
the link with
ulcerative colitis (UC). Microorganisms
2020; 8: 1078.
14. Daar ES,
Pilcher CD, Hecht FM. Clinical
presentation and
diagnosis of primary
HIV-1 infection.
Curr Opin HIV AIDS 2008;
3: 10-5.
15. Schwartz DA,
Graham AL. Potential
maternal and
infant outcomes from (Wuhan)
Coronavirus
2019-nCoV infecting
pregnant women:
lessons from SARS,
MERS, and other
human Coronavirus infections.
Viruses 2020;
12: 194.
16. Delahoy MJ,
Whitaker M, O’Halloran
A, et al.
Characteristics and maternal
and birth
outcomes of hospitalized pregnant
women with
laboratory-confirmed
COVID-19 —
COVID-NET, 13 states,
March 1–August
22, 2020. MMWR Morb
Mortal Wkly Rep
2020; 69: 1347-54.
17. Zambrano LD,
Ellington S, Strid P, et al.
Update:
characteristics of symptomatic
women of
reproductive age with laboratoryconfirmed
SARS-CoV-2 infection
by pregnancy
status — United
States, January 22–
October 3, 2020.
MMWR Morb Mortal
Wkly Rep 2020;
69: 1641-7.
18. Allotey J,
Stallings E, Bonet M, et al.
Clinical
manifestations, risk factors, and
maternal and
perinatal outcomes of coronavirus
disease 2019 in
pregnancy: living
systematic
review and meta-analysis. BMJ
2020; 370:
m3320.
19. Kotlyar AM,
Grechukhina O, Chen A,
et al. Vertical
transmission of coronavirus
disease 2019: a
systematic review and
meta-analysis. Am
J Obstet Gynecol 2021;
224(1): 35-53.e3.
20. Minodier L,
Charrel RN, Ceccaldi P-E,
et al.
Prevalence of gastrointestinal symptoms
in patients with
inf luenza, clinical
significance,
and pathophysiology of
human inf luenza
viruses in faecal samples:
what do we know?
Virol J 2015; 12:
215.
21. Honarvar B,
Moghadami M, Moattari
A, Emami A,
Odoomi N, Bagheri Lankarani
K.
Seroprevalence of anti-rubella and
anti-measles IgG
antibodies in pregnant
women in Shiraz,
Southern Iran: outcomes
of a nationwide
measles-rubella mass vaccination
campaign. PLoS
One 2013; 8(1):
e55043.
22. Declercq E,
Zephyrin L. Maternal mortality
in the United
States: a primer. The
Commonwealth
Fund. December 16, 2020
(https://www
.commonwealthfund
.org/
publications/
issue
-brief
-report/
2020/
dec/
maternal
-mortality
-united
-states
-primer#:
~:text= During%
20pregnancy%2C%20
hemorrhage%20and%20cardiovascular
,infection%20is%20the%20leading%20
cause).
23. Pregnancy
mortality surveillance system.
Atlanta: Centers
for Disease Control
and Prevention
(https://www .cdc
.gov/
reproductivehealth/
maternal
-mortality/
pregnancy
-mortality
-surveillance
-system
.htm).
24. Grif K,
Patscheider G, Dierich MP,
Allerberger F.
Incidence of fecal carriage
of Listeria
monocytogenes in three healthy
volunteers: a
one-year prospective stool
survey. Eur J
Clin Microbiol Infect Dis
2003; 22: 16-20.
25. Goulet V,
Hebert M, Hedberg C, et al.
Incidence of
listeriosis and related mortality
among groups at
risk of acquiring
listeriosis.
Clin Infect Dis 2012; 54: 652-60.
26. Charlier C,
Perrodeau É, Leclercq A,
et al. Clinical
features and prognostic factors
of listeriosis:
the MONALISA national
prospective
cohort study. Lancet Infect
Dis 2017; 17:
510-9.
27. Radoshevich
L, Cossart P. Listeria
monocytogenes:
towards a complete picture
of its
physiology and pathogenesis.
Nat Rev
Microbiol 2018; 16: 32-46.
28. Mylonakis E,
Paliou M, Hohmann EL,
Calderwood SB,
Wing EJ. Listeriosis during
pregnancy: a
case series and review of
222 cases.
Medicine (Baltimore) 2002; 81:
260-9.
29. Elinav H,
Hershko-Klement A, Valinsky
L, et al.
Pregnancy-associated listeriosis:
clinical
characteristics and geospatial
analysis of a
10-year period in Israel. Clin
Infect Dis 2014;
59: 953-61.
30. Madjunkov M,
Chaudhry S, Ito S. Listeriosis
during pregnancy.
Arch Gynecol
Obstet 2017;
296: 143-52.
31. Centers for
Disease Control and Prevention.
Vital signs:
Listeria illnesses,
deaths, and
outbreaks — United States,
2009-2011. MMWR
Morb Mortal Wkly