En este ejercicio clínico se presenta un caso que es discutido por un médico internista al que se le van proporcionando datos de la historia clínica en forma secuencial, y este analiza el cuadro a la luz de los nuevos elementos, de una manera análoga al proceso diagnóstico en la práctica real de la medicina
HISTORIA
Un hombre de 55 años de edad fue evaluado en
consultorio después de regresar de una visita de 5 meses a Pakistán. Informó
una historia de 3 meses de fiebres intermitentes y fatiga sin sudores
nocturnos, pérdida de peso, dolor de cabeza, tos, diarrea, rash, disuria o
artralgias. Sus signos vitales y el examen físico eran normales.
PONENTE
El diagnóstico diferencial para fiebre y fatiga es amplio. La nueva aparición de fiebre
después de un viaje internacional prioriza la posibilidad de un proceso
infeccioso. Infecciones que son endémicas en Pakistán y que pueden causar una
enfermedad febril prolongada e indiferenciada incluye tuberculosis, infección
visceral por leishmania, brucelosis y fiebre recurrente. Además de las
infecciones, el diagnóstico diferencial debe incluir enfermedades
autoinflamatorias y autoinmunes, cáncer
y reacciones inducidas por fármacos.
EVOLUCIÓN
El paciente había nacido y se había criado en Pakistán
y había emigrado a la Región atlántica media
de los Estados Unidos en sus 30 años. Su historia médica incluía enfermedad de
las arterias coronarias, accidente cerebrovascular, hipertensión,
hiperlipidemia y enfermedad por reflujo gastroesofágico. Sus medicamentos
incluían losartán, aspirina, clopidogrel, metoprolol, pravastatina, y
nitroglicerina sublingual según necesidad. No tenía antecedentes familiares de
cáncer o enfermedad autoinmune. Era propietario de un restaurante retirado, y tenía
un historial de tabaquismo de 60 paquetes-años pero había dejado de fumar 12
años antes. Él estaba en una relación monogámica con su esposa. Refirió que no consumía mucho
alcohol ni usaba drogas ilícitas.
PONENTE
Dada la duración de los síntomas, sería poco probable
que una infección adquirida en la región del Atlántico medio, como la
enfermedad de Lyme, la babesiosis o ehrlichiosis, sea la causa de sus síntomas. Una tuberculosis latente, adquirida antes de
la inmigración, podría haberse reactivado varias décadas después. Él no tiene
factores de riesgo para la infección por virus de la inmunodeficiencia humana
(VIH), y sus medicamentos enumerados no están comúnmente asociados con fiebre
inducida por medicamentos. El cáncer también debe considerarse como una causa
de fiebre aislada, especialmente teniendo en cuenta su historial de tabaquismo.
EVOLUCIÓN
Múltiples cursos ambulatorios de agentes
antibióticos, que incluían azitromicina, levofloxacina, y amoxicilina, cada uno
tomado por hasta 7 días, fueron recetados, pero la fiebre no se resolvió.
PONENTE
Debe evitarse la antibioticoterapia en un paciente
estable con fiebre de origen desconocido porque podría ocasionar efectos
secundarios no deseados, tratamiento parcial o disminución rendimiento de
pruebas de diagnóstico. Cursos cortos de monoterapia con los agentes que recibió
no se espera que erradiquen las infecciones que más probablemente expliquen su fiebre
prolongada.
EVOLUCIÓN
Cinco meses después, el paciente regresó a la
consulta y refirió tener fiebres diarias,
fatiga continua, había aparecido sudoración nocturna profusa que lo
obligaba a cambiar la ropa de cama, tos improductiva y mialgias. Su temperatura era 38.4 ° C. Su
pulso era de 116 latidos por minuto, la TA 124/88 mm Hg y frecuencia
respiratoria 16 con saturación de oxígeno de 97% mientras respiraba aire
ambiente. El paciente fue referido al departamento de emergencia. Allí
impresionaba incómodo, el examen cardíaco,
respiratorio, abdominal, neurológico, cutáneo y musculoesquelético fueron
normales.
Los electrolitos séricos, función renal y el
análisis de orina fue normal. La aspartato aminotransferasa era de 119 U por
litro (rango normal, 0 a 37), y la alanina aminotransferasa 48 U por litro (rango
normal, 0 a 40); la FAL, y la bilirrubina fueron normales. El recuento de
glóbulos blancos era 3410 por milímetro cúbico (56% neutrófilos, 18%
linfocitos, 25% monocitos, menos de 1% de eosinófilos). La hemoglobina era de
13.1 g por decilitro, el VCM de 86.0 fl, y el recuento de plaquetas fue 127,000
por milímetro cúbico. La VSG fue de 37
mm por hora (normal 1 a 20), y el nivel de proteína C-reactiva de 2.9 mg por decilitro (valor normal,
<0.5). La radiografía de tórax fue normal.
PONENTE
Las citopenias despiertan preocupación con respecto
a mielosupresión o infiltración de la
médula ósea, esta última podría ser causada por tuberculosis, micosis diseminada,
cáncer metastásico o cáncer hematológico. La consideración de ciertas
enfermedades infecciosas está influenciada por factores del huésped y sobre
todo exposiciones. La brucelosis puede tener un curso prolongado de varios meses a un año o más, y se
manifiesta como fiebre, fatiga, sudores nocturnos, y a menudo artralgia o
hepatoesplenomegalia. Los pacientes deben
ser interrogados con respecto al contacto con animales infectados o
consumo de productos lácteos no pasteurizados. Fiebre Q, causada por Coxiella
burnetii, también puede manifestarse como una enfermedad febril prolongada en personas
sin exposición conocida a animales de
granja infectados.
Otras condiciones que podrían explicar la fiebre y
pancitopenia incluyen linfohistiocitosis hemofagocítica, lo que puede complicar
el curso de una infección o trastorno linfoproliferativo, y lupus eritematoso
sistémico. Las vasculitis asociadas a ANCA tienen una predilección particular
por el tracto respiratorio superior e inferior y pueden causar tos, disnea y
hemoptisis además de fiebre. Aunque la ausencia de disnea y hemoptisis en este
paciente no excluye este diagnóstico, la radiografía de tórax normal y nada
especial en el análisis de orina lo hace menos probable.
EVOLUCIÓN
El paciente fue ingresado en el hospital. Se llevaron a cabo cultivos de sangre y de
esputo inducido. Se comenzó con ampicilina-sulbactam y vancomicina. El nivel de fósforo sérico era de 3.9 mg/dl (normal,
2.7 a 4.5 mg/dl), y el nivel de ácido úrico era 5.7 mg/dl (normal 3.5 a 7.2
mg/dl). El nivel de haptoglobina fue de 55 mg/dl (normal, 36 a 195) y la
ferritina fue de 508 ng por mililitro (normal, 30 a 400). El nivel de creatina
quinasa en suero fue 92 U por litro (normal, 24 a 195), y el nivel de lactato
deshidrogenasa (LDH) fue de 1942 U por litro (rango normal, 118 a 273). Los
cultivos de bacterias en sangre, esputo, y heces fueron estériles. Una PCR para
influenza tipo A y B fue negativo. VIH, anticuerpo para hepatitis C y antígeno
de superficie de hepatitis B y anti HBc fueron negativas. Una tinción para bacilos
ácido-alcohol resistentes y una PCR para Mycobacterium tuberculosis en esputo
fueron negativas, como fue un ensayo de liberación de interferón-γ. Un frotis
de sangre periférica mostró linfocitos atípicos reactivos ocasionales, y
trombocitopenia. Una electroforesis de proteínas séricas y cadenas ligeras
libres fueron normales.
PONENTE
El ensayo negativo de liberación de interferón-γ y las
tinciones para bacilos acidorresistentes negativos no excluyen tuberculosis
activa. De las pruebas mencionadas, la PCR tiene la mayor sensibilidad y
especificidad; sin embargo, el estándar diagnóstico sigue siendo el cultivo.
Aunque los hallazgos son inespecíficos, una
elevación de LDH con fiebre y citopenias puede indicar un linfoma Las imágenes
serían útiles en busca de linfadenopatía o un foco de infección. Los tumores sólidos causan
fiebre con menos frecuencia. Aunque la gran mayoría de las leucemias se
manifiestan con células malignas circulantes, su ausencia en el frotis no excluye ulteriores evaluaciones. Un aspirado y biopsia de médula
ósea serían las mejores pruebas de
diagnóstico y las muestras deben ser enviadas para cultivo y tinciones para
micobacterias y hongos patógenos. Una endocarditis subaguda con cultivos
negativos (por ejemplo, C. burnetii y especies de brucella) también deben
considerarse, dado los síntomas prolongados del paciente.
EVOLUCIÓN
Una tomografía computarizada (TC) del tórax,
abdomen, y pelvis con el uso de material de contraste no reveló anormalidades parenquimatosa,
linfadenopatía, o absceso Un ecocardiograma transtorácico mostró un posible
engrosamiento de la valva anterior de la mitral y una masa cuestionable en la
válvula tricúspide; un ecocardiograma transesofágico no mostró vegetaciones ni
masas.
El nivel de beta-d-glucano era normal. Pruebas de
PCR en suero para citomegalovirus, parvovirus y Tropheryma whipplei fueron
negativos. Anticuerpos a Brucella, Leishmania, Legionella pneumophila IgM, Entamoeba
histolytica y Francisella tularensis fueron negativos. Títulos de anticuerpos
Coxiella IgG fase II estaban elevados a 1:16.
FAN, FR, anti ADN bicatenario, Ac anti-mitocondriales,
anti-músculo liso, ANCA c y p, y las pruebas directas de Coombs fueron todas
negativas. Los antibióticos se
suspendieron después de que los cultivos de sangre fueron negativos durante 48
horas. Aunque la fiebre no se resolvió,
fue dado de alta del hospital con seguimiento ambulatorio.
PONENTE
La infección fue considerada la causa más probable
de fiebre en este paciente debido a su viaje anterior, sin embargo, las pruebas
para múltiples patógenos infecciosos no fueron reveladores. El diagnostico de infección
de coxiella se realiza sobre la base de resultados de PCR o títulos de
anticuerpos más definitivos que reflejan cualquiera de las dos fases
antigénicas de respuesta de anticuerpos (un título de IgG en fase I de> 1:
800 o un título de IgG de fase II de> 1: 128 o un aumento por un factor de 4
en el título de IgG de fase II). Hay que repetir las pruebas serológicas en aproximadamente 3
semanas. Los hemocultivos negativos y los resultados del ecocardiograma, junto
con la ausencia de factores de riesgo y la falta de hallazgos sugestivos en
examen físico, descarta endocarditis.
Una enfermedad reumatológica es menos probable, dado
la ausencia de características clínicas identificables y las pruebas
serológicas negativas. En adultos mayores de 50 años de edad, arteritis de
células gigantes es posible y puede manifestarse como fiebre, tos y fatiga. La
enfermedad de Still de inicio en adultos es una reconocida causa de fiebre de
origen desconocido pero típicamente afecta a adultos en la segunda a cuarta décadas
de vida y comúnmente se manifiesta con rash evanescente, artralgia y
leucocitosis, que están ausentes en este paciente.
EVOLUCIÓN
Dos meses después, el paciente regresó para
seguimiento y refirió tener fiebres diarias en curso, fatiga, escalofríos,
sudores nocturnos, disminución del apetito, y tos no productiva. Cultivos de
sangre y esputo fueron negativos para micobacterias a las 6 semanas.
El recuento de glóbulos blancos era de 2800 por
milímetro cúbico. El nivel de hemoglobina fue de 11.3 g por decilitro, y el
recuento de plaquetas fue de 138,000 por milímetro cúbico. El nivel de
ferritina fue de 700 ng por mililitro, y el resto de los estudios de hierro
fueron normales. Se repitieron las pruebas serológicas para coxiella que
mostraron un título de anticuerpos IgG
fase I de 1:16 y título de anticuerpos de fase II negativos. Los síntomas del
paciente no se resolvieron después de un ciclo de 14 días de doxiciclina. La
biopsia de la arteria temporal no reveló evidencia de arteritis.
PONENTE
Los resultados de las pruebas serológicas descartan
la fiebre Q. Dada su pancitopenia progresiva, una PAMO y biopsia están indicadas para evaluar un
proceso infiltrativo como la leucemia o linfoma, que puede manifestarse con
citopenias y fiebre en ausencia de anormalidades en el examen físico o radiografía.
EVOLUCIÓN
La PAMO y
biopsia de médula ósea mostraron las tres líneas hematopoyéticas. No había tumor, eritrofagocitosis,
o granulomas. Una citometría de flujo fue negativo para células fenotípicamente
anormales y no revelaron evidencia de
clonalidad.
Una tomografía de emisión de positrones de cuerpo
entero (PET)/ TAC fue negativa para la ganglios linfáticos patológicos así como
para lesiones ávidas de 18F-fluorodeoxiglucosa.
Cuatro meses más tarde (14 meses después del inicio
de la fiebre), el paciente comenzó con dolor abdominal, saciedad temprana, náuseas
y distensión abdominal. Continuó teniendo
fiebre diaria, sudores nocturna, fatiga y tos. Pasaba la mayor parte del
día en la cama. Su familia notó olvidos
intermitentes, y fue readmitido en el
hospital. En la admisión, su temperatura era de 39.3 ° C, y tenía un pulso de
100 latidos por minuto, una TA de 115/69
mm Hg, una frecuencia respiratoria de 18 respiraciones por minuto, y la saturación
de oxígeno del 92% respirando aire ambiente.
El examen reveló un hombre de aspecto cansado con distensión abdominal. Había
dolor leve sobre el cuadrante superior izquierdo sin rebote o defensa.
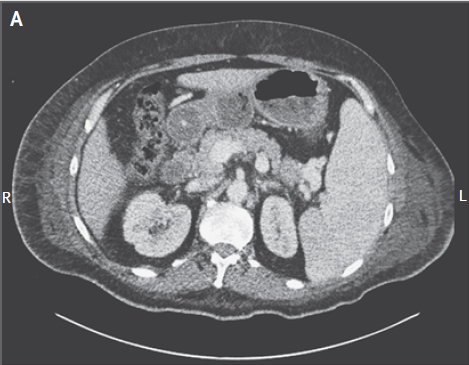
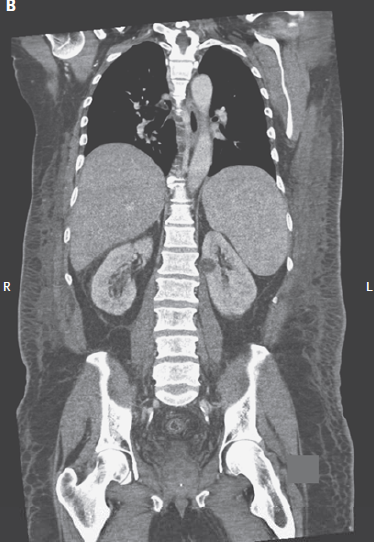
El bazo no era palpable. Tenía dificultad para recordar detalles de su historial médico, y se necesitaban varias indicaciones para que él completara tareas simples. Un examen neurológico detallado no fue realizado. Él no tenía rash. El recuento de glóbulos blancos era de 1900 por milímetro cúbico (70% neutrófilos, 12% linfocitos, 10% monocitos, 6% de bandas, 2% de metamielocitos y 0% de eosinófilos). El nivel de hemoglobina era de 9.8 g/dl, el recuento de plaquetas es de 44,000/mm3, y el nivel de LDH 2475 U por litro. La FAL era de 97 U por litro, aspartato aminotransferasa de 89 U por litro, y alanina aminotransferasa 30 U por litro, bilirrubina 0.5 mg/dl. El recuento de reticulocitos fue del 1.7% (normal, 0.5 a 1.8). Se repitió la TC tóraco-abdómino-pélvica con contraste reveló esplenomegalia leve sin linfadenopatías (Fig. 1).
Figura 1. Imágenes de CT del abdomen y la pelvis
mostrando esplenomegalia.
El panel A muestra la vista axial, y el panel B la
coronal. L denota a la izquierda y R a la derecha.
PONENTE
Desde la última evaluación del paciente, aparecieron
esplenomegalia, confusión con dificultad para responder a las preguntas, junto con empeoramiento de la pancitopenia,
elevaciones leves persistentes de las enzimas hepáticas, y un nivel
notablemente alto de LDH. Una amplia evaluación para enfermedades
infecciosas y reumatológicas no han ayudado a encontrar el diagnóstico. El cáncer, particularmente linfoma, sigue
siendo una consideración. La
participación multisistémica por linfoma puede explicar infiltración en el
hígado, el bazo, y sistema nervioso central, produciendo elevación enzimática, esplenomegalia
y confusión. Se esperarían hallazgos en las imágenes PET-CT con la gran mayoría
de los linfomas agresivos, aunque estos hallazgos pueden estar ausentes en
linfomas sistema nervioso central, linfomas
cutáneos o intravasculares. No hay erupción para sugerir linfoma cutáneo. Un
examen neurológico cuidadoso está justificado. Una biopsia de piel para buscar
posible linfoma intravascular debería ser la próxima prueba de diagnóstico.
EVOLUCIÓN
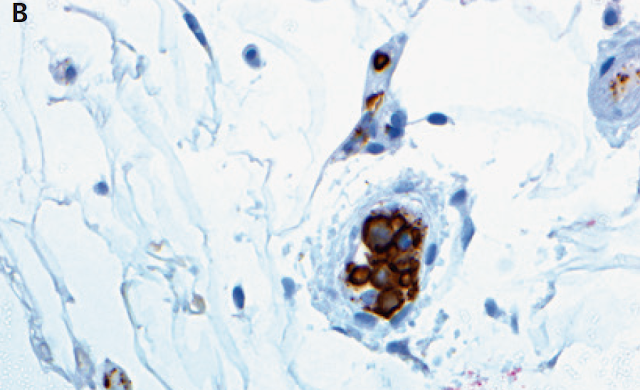
Tres muestras de biopsia de piel se obtuvieron al azar en la parte superior izquierda del brazo, el abdomen y muslo izquierdo. Examen patológico reveló linfoma de células B intravascular en todas las muestras (Figura 2).
Figura 2. Células malignas en muestras de biopsia de
piel.
El panel A muestra tinción con hematoxilina y eosina
de una biopsia de piel muestra células B
malignas grandes dentro de la luz de los pequeños vasos. El panel B muestra la
tinción de CD20 (marrón) de una muestra de biopsia de piel que muestra que las
células malignas son CD20-positivas.
EVOLUCIÓN
El paciente fue transferido a un centro de oncología
y comenzó a recibir rituximab, ciclofosfamida, doxorrubicina, vincristina y
prednisona (R-CHOP). Completó seis ciclos de terapia y tuvo una remisión
completa. Su energía y el apetito volvió a la normalidad. La repetición de la
biopsia de piel obtenidas después de la finalización de la terapia fue negativa
para linfoma intravascular. Un año
después del diagnóstico, permaneció afebril y no tenía fatiga, tos, confusión,
olvido, o síntomas abdominales.
COMENTARIO
Un viajero febril que regresa de un viaje al
extranjero la mayoría de las veces ha adquirido una infección.1 En este
paciente, que presentó fiebre después de viaje a Pakistán, se realizaron
extensos estudios de diagnóstico, sin la identificación de una causa infecciosa
u otro diagnóstico. El posterior desarrollo de síntomas B de empeoramiento (es
decir, pérdida de peso, sudores nocturnos y fiebre) y manifestaciones
multisistémicas, incluida pancitopenia, esplenomegalia y un alto nivel de LDH
sérica, sugirió fuertemente un proceso linfoproliferativo. Con un frotis de
sangre periférica no revelador, médula ósea, y estudios de imágenes, se realizó
en última instancia una biopsia de piel al azar, lo que produjo el diagnóstico
de linfoma intravascular.
El linfoma intravascular es un raro subtipo de
linfoma difuso de células B grandes extraganglionar.2 La incidencia en los
Estados Unidos es menos de 1 caso por cada 10 millones de personas, pero ha ido
en aumento, posiblemente debido a una mayor conciencia ya que este cáncer fue
categorizado como una entidad distinta en 2007.3 La mediana de edad de los
pacientes en el momento del diagnóstico es de 67 años, y el linfoma
intravascular se produce a tasas similares entre los hombres y mujeres.4,5 No
se conocen factores de riesgo.
El linfoma intravascular es tratable6. Un
estudio retrospectivo que involucró a
106 pacientes mostró una tasa de supervivencia libre de progresión del 56% y
una tasa de supervivencia global del 66% a los 2 años entre pacientes que
habían sido tratados con rituximab conteniendo regímenes de quimioterapia (por
ejemplo, R-CHOP) .6
No ha habido ensayos controlados aleatorios de terapia para esta condición. Sin
diagnosticar, sigue un curso fatal.6
El linfoma intravascular se manifiesta
característicamente como fiebre, fatiga pronunciada, disminución del apetito y
una disminución en el estado funcional.5 La variación geográfica en el fenotipo
ha sido observado en series que se han informado de países asiáticos y
occidentales, que en agregado ha incluido aproximadamente 200 pacientes.5,7-10
Hemofagocitosis y una más rápida evolución se han informado en centros asiáticos,
Considerando la participación cerebral y pulmonar son
más comunes en los centros occidentales.5,7-10 Muchos de los sistemas de
órganos pueden estar involucrados. La infiltración del sistema nervioso central
ocurre en 25 a 76% de los pacientes y puede dar lugar a confusión, ataxia de la
marcha, trastornos convulsivos o pérdida de memoria.5,7-9 La infiltración pulmonar
produce disnea, tos e hipoxemia.5 Hasta una cuarta parte de los pacientes
afectados tienen lesiones visibles en la piel, que muestran sustancial heterogeneidad,
incluidas placas y nódulos, con variación en color, carácter, ubicación y numero
8
La anemia y la trombocitopenia están presentes en más de la mitad de los pacientes con
linfoma intravascular, y leucopenia se desarrolla en una cuarta parte de los
pacientes.5 Enzimas hepáticas elevadas pueden ser observados con afectación
hepática y se ven en aproximadamente una quinta parte de los pacientes,3 y la hipoalbuminemia ocurre en aproximadamente la
mitad de los pacientes. La LDH sérica
elevada está presente en prácticamente todos los pacientes.3,5
Por lo tanto, la combinación de síntomas
neurológicos pancitopenia y niveles elevados de LDH en una persona que presenta
fiebre de origen desconocido es una pista de diagnóstico valiosa para el
linfoma intravascular.
La linfadenopatía rara vez se identifica.3,5,8 En
dos pequeñas series de casos (que involucran 29 y 13 pacientes), se observó
9,10 esplenomegalia en las imágenes del abdomen en el 45% y el 100% de los pacientes,
respectivamente.
El diagnóstico requiere una biopsia de tejido de una
persona involucrada y puede implicar biopsias repetidas.
Las pruebas histopatológicas revelan células linfoides
malignas dentro de la luz de los pequeños vasos, capilares y sinusoides de los
órganos afectados.5
El uso de tinción con hematoxilina y eosina sola puede
ser insuficiente para el diagnóstico. 5 Las células neoplásicas son típicamente
células B con alta expresión de CD20, expresión ocasional de CD5, y raroa expresión
CD10.5 Por lo tanto, CD20 inmunohistoquímico generalmente, se requiere tinción
para el diagnóstico.
Se hipotetiza que la expresión anormal de moléculas
de adhesión y receptores de inicio para la localización dentro de estos
pequeños vasos.5
Hay casos raros de linfoma intravascular con
marcadores de células T y células asesinas naturales(natural killer). Sin
embargo, estos se clasifican por separado y representan diferentes entidades.5
Biopsia de piel aleatoria (también conocida como
"ciega") con muestras de piel de apariencia normal obtenidas de los
muslos, brazos o abdomen, ha emergido como una herramienta diagnóstica valiosa y relativamente no
invasiva.10-12 En un estudio que involucró a 11 pacientes que había recibido un
diagnóstico sobre la base de la biopsia de médula ósea, 10 pacientes (91%) tuvieron resultados
positivos en la biopsia de piel al azar.13 Otras series de casos pequeños (que
involucran a 24 y 32 pacientes), también sugieren que la biopsia de piel al
azar ayuda en el diagnóstico de pacientes con fiebre de origen desconocido y un
nivel elevado de LDH cuando se sospecha
de linfoma intravascular.14,15 La rareza de la enfermedad, su curso
frecuentemente rápidamente progresivo, y la naturaleza inespecífica de la
presentación de los síntomas a menudo resultan en retrasos en el diagnóstico, y
en algunos casos, la enfermedad se identifica solo en la autopsia. 3,9 Es
esencial reconocer el potencial valor de la biopsia de piel al azar para un
diagnóstico rápido.
El presente caso resalta el linfoma intravascular como
causa de fiebre de origen desconocido. Este paciente fue sometido a una
búsqueda exhaustiva durante un período de muchos meses para investigar su
persistente fiebre y pancitopenia. En definitiva, fue la biopsia de piel, un
procedimiento relativamente simple que identificó el desorden que acechaba solo
debajo de la superficie.
Traducción de:
"Just Beneath the Surface"
Catherine Handy Marshall, M.D., M.P.H., Jordan Nahas‑Vigon, M.D., Reza
Manesh, M.D., and Allan C. Gelber, M.D.
https://www.nejm.org/doi/10.1056/NEJMcps1802664
References
1. Thwaites GE,
Day NPJ. Approach to
fever in the
returning traveler. N Engl J
Med 2017; 376:
548-60.
2. Swerdlow SH,
Campo E, Pileri SA, et al.
The 2016
revision of the World Health
Organization
classification of lymphoid
neoplasms. Blood
2016; 127: 2375-90.
3. Ponzoni M, Ferreri AJM, Campo E, et al.
Definition,
diagnosis, and management
of intravascular
large B-cell lymphoma:
proposals and
perspectives from an international
consensus
meeting. J Clin Oncol
2007; 25:
3168-73.
4. Rajyaguru DJ,
Bhaskar C, Borgert AJ,
Smith A, Parsons
B. Intravascular large
B-cell lymphoma
in the United States
(US): a
population-based study using Surveillance,
Epidemiology,
and End Results
program and
National Cancer Database.
Leuk Lymphoma
2017; 58: 1-9.
5. Shimada K,
Kinoshita T, Naoe T, Nakamura
S. Presentation
and management of
intravascular
large B-cell lymphoma. Lancet
Oncol 2009; 10:
895-902.
6. Shimada K,
Matsue K, Yamamoto K,
et al.
Retrospective analysis of intravascular
large B-cell
lymphoma treated with
rituximab-containing
chemotherapy as
reported by the
IVL study group in Japan.
J Clin Oncol
2008; 26: 3189-95.
7. Murase T,
Yamaguchi M, Suzuki R,
et al.
Intravascular large B-cell lymphoma
(IVLBCL): a
clinicopathologic study of 96
cases with
special reference to the immunophenotypic
heterogeneity of
CD5. Blood
2007; 109:
478-85.
8. Ferreri AJM,
Campo E, Seymour JF,
et al. Intravascular lymphoma: clinical
presentation,
natural history,
management and
prognostic
factors in a series of 38 cases,
with special
emphasis on the ‘cutaneous
variant.’ Br J
Haematol 2004; 127: 173-83.
9. Brunet V,
Marouan S, Routy J-P, et al.
Retrospective
study of intravascular large Bcell
lymphoma cases
diagnosed in Quebec:
a retrospective
study of 29 case reports.
Medicine (Baltimore) 2017; 96(5): e5985.
10. Matsue K, Asada N, Takeuchi M, et al.
A
clinicopathological study of 13 cases
of intravascular
lymphoma: experience
in a single
institution over a 9-yr period.
Eur J Haematol 2008; 80: 236-44.
11. Asada N, Odawara J, Kimura S, et al.
Use of random
skin biopsy for diagnosis
of intravascular
large B-cell lymphoma.
Mayo Clin Proc
2007; 82: 1525-7.
12. Le EN,
Gerstenblith MR, Gelber AC,
et al. The use
of blind skin biopsy in the
diagnosis of
intravascular B-cell lymphoma.
J Am Acad
Dermatol 2008; 59: 148-
51.
13. Matsue K,
Asada N, Odawara J, et al.
Random skin
biopsy and bone marrow
biopsy for
diagnosis of intravascular large
B cell lymphoma.
Ann Hematol 2011; 90:
417-21.
14. Pongpudpunth
M, Rattanakaemakorn
P, Fleischer AB
Jr. Usefulness of random
skin biopsy as a
diagnostic tool of intravascular
lymphoma
presenting with fever
of unknown
origin. Am J Dermatopathol
2015; 37:
686-90.
15.
Sitthinamsuwan P, Chinthammitr Y,
Pongpudpunth M,
Rattanakaemakorn
P, Fleischer AB
Jr. Usefulness of random
skin biopsy as a
diagnostic tool of intravascular
lymphoma
presenting with fever
of unknown
origin. Am J Dermatopathol
2015; 37:
686-90.
15.
Sitthinamsuwan P, Chinthammitr Y,
Pattanaprichakul
P, Sukpanichnant S.
Random skin
biopsy in the diagnosis of
intravascular lymphoma. J Cutan Pathol
2017; 44: 729-33