Fenómeno de Raynaud en un paciente con enfermedad
mixta del tejido conectivo
Gentileza
Dr. Gustavo Rabazzano
Médico Reumatólogo.
Azul. Buenos Aires.
Argentina
MANIFESTACIONES CLÍNICAS Y DIAGNÓSTICO DEL FENÓMENO
DE RAYNAUD
El fenómeno de Raynaud (FR) es una respuesta
vascular exagerada al frío o al estrés emocional. El fenómeno se manifiesta
clínicamente por cambios de color claramente delimitados de la piel de los
dedos. Se cree que la vasoconstricción anormal de las arterias digitales y las
arteriolas cutáneas debido a un defecto local en las respuestas vasculares
normales subyace al trastorno.
El FR se considera primario si estos síntomas
ocurren solos sin evidencia de ningún trastorno asociado. En comparación, el FR
secundario se refiere a la presencia del trastorno en asociación con una
enfermedad relacionada, como el lupus eritematoso sistémico y la esclerosis sistémica
(SSc; esclerodermia).
EPIDEMIOLOGÍA
El establecimiento de la verdadera prevalencia del
fenómeno de Raynaud (FR) se ve obstaculizado por la falta de una prueba de
diagnóstico "estándar de oro" reproducible y bien definida. Las manos
y los pies fríos son una respuesta fisiológica normal a la exposición al frío
que, para conservar el calor, enfría la superficie de la piel y provoca cambios
en el color de la piel; mientras que el FR es una respuesta vascular exagerada
al frío o al estrés emocional. Aunque los criterios de la encuesta varían, la
mayoría de los investigadores están de acuerdo en que un historial de al menos
dos cambios de color (palidez y cianosis) después de la exposición al frío es
necesario para un diagnóstico definitivo.
Se han realizado encuestas comunitarias para estimar
la prevalencia de RP en la población general. En estas encuestas, las
estimaciones de la prevalencia de la RP han oscilado entre el 3 y el 20 por
ciento en las mujeres y entre el 3 y el 14 por ciento en los hombres.
El FR es más
común entre las mujeres jóvenes, los grupos de edad más jóvenes y los familiares
de pacientes con FR. El FR a menudo comienza temprano en la vida, pero la
prevalencia parece permanecer relativamente constante a lo largo de la vida.
Una revisión encontró una prevalencia de 0,1 a 1 por ciento de FR de nueva
aparición entre personas mayores de 60 años. Además, la prevalencia de FR
encontrada en una población determinada está influenciada por el clima de la
región estudiada.
FENÓMENO RAYNAUD PRIMARIO Y SECUNDARIO
Se describe que los pacientes con fenómeno de
Raynaud tienen un proceso primario o
secundario.
Fenómeno de Raynaud primario: el FR
primario o enfermedad de Raynaud idiopática son términos para describir
a los pacientes sin una causa definible para sus eventos vasculares. En este
contexto, el FR se considera una exageración de la vasoconstricción normal a la
exposición al frío. La mayoría de los investigadores sienten que el término
"enfermedad" es inapropiado y prefieren usar el término FR primario
para individuos por lo demás sanos.
El FR primario suele tener una edad de aparición
entre los 15 y los 30 años, es más común en mujeres y puede ocurrir en varios
miembros de la familia. Los estudios en
niños son limitados, pero, aunque a
menudo comienza en la adolescencia, lo más importante es una evaluación
cuidadosa de las causas secundarias. Aunque los pacientes con FR primario
generalmente están sanos, pueden ocurrir condiciones comórbidas que pueden
agravar los ataques. Estos incluyen hipertensión, aterosclerosis, enfermedades
cardiovasculares y diabetes mellitus.
Hay afecciones que se asocian con FR, pero no está
claro si están vinculadas patológicamente, como se observa en varias causas
secundarias. Se ha informado de un aumento de la prevalencia entre los
pacientes con síndrome de fibromialgia. Estas encuestas pueden haber incluido
sujetos con enfermedades secundarias.
De manera similar, hay varias encuestas que apoyan
una asociación de migrañas y FR. Sin embargo, no está establecido que compartan una causa o mecanismo común de
disfunción vascular.
Fenómeno de Raynaud secundario: el FR secundario se refiere a aquellos
pacientes con FR en los que una enfermedad o causa asociada puede subyacer a
los ataques. Otros investigadores prefieren el término síndrome de Raynaud.
Dado que una variedad de posibles agresiones puede
alterar la regulación compleja normal del flujo sanguíneo regional a los dedos
y la piel, la cantidad de enfermedades y exposiciones asociadas con la FR
secundaria es extensa (tabla 1):
Tabla 1.
Las enfermedades comúnmente asociadas con FR
incluyen enfermedades reumáticas autoinmunes tales como esclerosis sistémica
(SSc; esclerodermia), lupus eritematoso sistémico, enfermedad mixta del tejido
conectivo, síndrome de Sjögren y dermatomiositis / polimiositis.
- Diversos fármacos o toxinas también pueden
precipitar o exacerbar la RP, como las anfetaminas y los agentes
quimioterapéuticos (especialmente cisplatino y bleomicina ).
- Anormalidades hematológicas asociadas con FR
incluyen crioglobulinemia, síndrome de crioaglutininas,
paraproteinemia, POEMS ( P olyneuropathy, O rganomegaly, E ndocrinopathy, M
gammapatía onoclonal, y S cambios kin) síndrome, y criofibrinogenemia.
- Las causas laborales y ambientales de la RP
incluyen traumatismo vascular (p. Ej., Lesión de la arteria cubital distal en
el síndrome del martillo hipotenar), el uso de herramientas vibratorias,
congelación y síndrome del túnel carpiano.
- El hipotiroidismo puede predisponer a la FR y puede
producirse una mejoría del vasoespasmo inducido por el frío con el reemplazo de
la hormona tiroidea. La vasculitis puede causar dígitos isquémicos, pero la
ausencia de cambios de color reversibles e inducidos por el frío previos ayuda
a distinguir esto del verdadero FR.
MANIFESTACIONES CLÍNICAS
Tanto el fenómeno de Raynaud primario como el secundario afectan con mayor frecuencia
a las manos. Los ataques también ocurren con frecuencia en los dedos de los
pies, pero es menos probable que los pacientes se quejen de síntomas en las
extremidades inferiores.
Tanto en el FR primario como en el secundario, un
episodio típico se caracteriza por la aparición repentina de dedos de manos o
dedos de los pies, fríos en asociación
con cambios de color claramente delimitados de palidez de la piel (ataque
blanco) debido a la constricción del flujo sanguíneo, seguido de piel cianótica
(ataque azul ) que indica hipoxia tisular (imagen 2). Con el recalentamiento,
la fase isquémica (ataque blanco o azul) suele durar de 15 a 20 minutos.
Posteriormente, la piel se sonroja al recuperarse, lo que resulta en el eritema
de reperfusión.
Imagen 2. Fenómeno de Raynaud.
(Panel A) Palidez marcadamente delimitada en varios
dedos como resultado del cierre de arterias digitales.
(Panel B) Cianosis digital de las yemas de los dedos
resultante de la vasoconstricción en el vaso termorregulador de la piel.
Un ataque de Raynaud generalmente comienza en un
solo dedo y luego se extiende a otros simétricamente en ambas manos. Losdedos
índice, medio y anular son los dedos afectados con mayor frecuencia, mientras
que el pulgar a menudo se respeta por completo. La afectación del pulgar puede
indicar una causa secundaria de FR. El vasoespasmo cutáneo también es común en
otros sitios, incluida la piel de las orejas, la nariz, la cara, las rodillas y
los pezones. Una característica fisiopatológica común de las áreas afectadas es
la presencia de vasos termorreguladores.
Síntomas de isquemia aguda o crónica: los síntomas del FR pueden incluir quejas
resultantes de un flujo sanguíneo bajo o isquemia. La isquemia puede ser
transitoria o prolongada, con recuperación completa o con niveles variables de
lesión tisular. La isquemia aguda se refiere al compromiso repentino de la
sangre nutricional que dura un corto período de tiempo, mientras que la
isquemia crónica se refiere al compromiso prolongado del flujo nutricional.
Por ejemplo, un episodio de isquemia aguda puede ser
leve y estar asociado con sensaciones de hormigueo, entumecimiento y / o
torpeza de la mano y dolor en los dedos. Los signos del FR leve deben ser completamente reversibles con
el recalentamiento o la reducción del estrés. La enfermedad menos grave se
observa con mayor frecuencia en personas con FR primario.
Se pueden observar síntomas y signos de isquemia de
leves a graves en pacientes con FR secundario. En el FR secundario grave, por
ejemplo, el dolor o la ulceración de la piel (típicamente las puntas de los
dedos de las manos y los pies) pueden ser el resultado de una isquemia tisular
crítica.
Livedo reticularis:
durante una respuesta al frío, los pacientes con FR pueden presentar
livedo reticularis; se trata de un patrón reticular o moteado violáceo de la
piel de los brazos y las piernas, a veces con círculos regulares ininterrumpidos.
En aquellos con FR primario, este hallazgo es benigno y completamente
reversible con el recalentamiento.
En comparación, se puede observar livedo reticularis
irreversible en pacientes con vasculitis, enfermedad vascular oclusiva (p. Ej.,
Debido a ateroembolia o trombosis) o síndrome antifosfolípido. Estos cambios
cutáneos también pueden estar asociados con círculos rotos irregulares. Debido
a estas diferencias, algunos expertos abogan por el uso del término
"livedo racemosa" en lugar de "livedo reticularis" para
estos hallazgos cutáneos en pacientes con enfermedad vascular inflamatoria o
trombótica.
Factores provocadores: los pacientes con FR tanto primario como
secundario notan que la exposición a temperaturas frías desencadena el FR. Más
importante aún, la provocación ocurre durante los cambios relativos de
temperaturas más cálidas a más frías. Como resultado, las exposiciones leves al
frío, como el aire acondicionado o el frío del corte de alimentos refrigerados
del supermercado, pueden provocar un ataque. Aunque los ataques ocurren
localmente en los dedos, un escalofrío general del cuerpo también desencadenará
un episodio, incluso si las áreas de las manos o los pies se mantienen
calientes. Por lo tanto, para evitar el FR, los pacientes deben mantener el
calor de todo el cuerpo.
También puede ocurrir un ataque de FR después de la
estimulación del sistema nervioso simpático (como estrés emocional, sobresaltos
repentinos). No es raro que el médico sea testigo de un ataque típico durante
el primer encuentro con un paciente asustado o nervioso.
Evolución: puede producirse una remisión espontánea
del FR primario. Esto se ilustró en un estudio prospectivo que encuestó a una
población blanca de mediana edad durante un período de siete años. Para
aquellos que tuvieron, o desarrollaron, FR primario durante ese período de
tiempo, las remisiones ocurrieron en el 64 por ciento de las mujeres y los
hombres. Sin embargo, algunos síntomas sugestivos de FR continuaron en
aproximadamente el 20 por ciento de los casos que se clasificaron como
"remisión".
En comparación, la remisión es poco común en
pacientes con FR secundario.
EVALUACIÓN Y DIAGNÓSTICO DEL FENÓMENO DE RAYNAUD
Nuestro enfoque para la evaluación y el diagnóstico
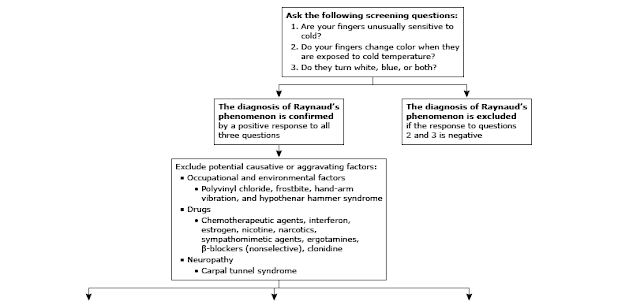
del fenómeno de Raynaud (FR) se resume en un algoritmo (algoritmo 1).
Algoritmo 1
Nuestra evaluación comienza con las siguientes tres
preguntas de detección para FR:
- ¿Tus dedos son inusualmente sensibles al frío?
- ¿Tus dedos cambian de color cuando están expuestos a
temperaturas frías?
- ¿Tus dedos se vuelven blancos, azules o ambos?
Diagnosticamos FR si el paciente tiene una respuesta
positiva a las tres preguntas. No existen pruebas sencillas en el consultorio
ni criterios de diagnóstico estándar que se utilicen habitualmente para
diagnosticar FR. NO se recomiendan los intentos de inducir un ataque, como un
desafío con agua fría, ya que las respuestas son inconsistentes incluso en
aquellos con FR definido.
DISTINGUIR FR PRIMARIO DE SECUNDARIO
Aunque no siempre son necesarias pruebas especiales
extensas, todos los pacientes con un diagnóstico de fenómeno de Raynaud (FR)
deben ser evaluados cuidadosamente para distinguir entre el trastorno primario
y el secundario.
Historia clínica y examen físico: la evaluación comienza con un intento de
identificar una causa secundaria de FR (tabla 1). Una anamnesis detallada debe
incluir la edad de aparición, los dedos afectados, el grado de simetría y la
gravedad de los ataques y la presencia de ulceraciones digitales.
También se debe preguntar a los pacientes sobre
posibles exposiciones o factores agravantes, que incluyen:
Factores laborales y ambientales: cloruro de
polivinilo, congelación, vibración mano-brazo, síndrome del martillo hipotenar.
Condiciones neurológicas y / o laborales - Síndrome
del túnel carpiano.
Medicamentos o toxinas: agentes quimioterapéuticos
(especialmente cisplatino y bleomicina ), interferón, estrógeno, nicotina,
narcóticos, agentes simpaticomiméticos, ergotaminas, clonidina .
El efecto de los betabloqueantes sobre la circulación
periférica y el riesgo de causar o agravar el FR es complejo y depende de las
propiedades específicas del fármaco. Los adrenorreceptores beta-2 son
dominantes en el músculo liso vascular bronquial y periférico, pero sólo tienen
un efecto vasodilatador leve, mientras que los adrenorreceptores alfa son más
activos en la regulación de los vasos termorreguladores. Los adrenoceptores
beta-1 son dominantes en el corazón. La alteración de la función cardíaca puede
tener diversos efectos sobre la circulación periférica. Además, la actividad
simpaticomimética intrínseca (ISA) está presente en algunos betabloqueantes,
que pueden disminuir el tono vascular periférico a través de los efectos sobre
el gasto cardíaco. Un metaanálisis encontró que solo los bloqueadores beta-adrenérgicos
selectivos y no selectivos beta-1 se asociaron con un mayor riesgo de
vasoconstricción periférica en comparación con placebo. La evidencia de que los
betabloqueantes causan o no FR se
complica por los problemas de definición deFR utilizada en una encuesta, el
agente específico en estudio y las condiciones comórbidas asociadas. Las
recomendaciones sobre qué agente evitar varían, pero es mejor evitar los
betabloqueantes selectivos o no selectivos beta-1 en pacientes con FR grave.
Otros síntomas sistémicos que pueden sugerir una
enfermedad reumática autoinmune incluyen fiebre, artralgias / artritis,
mialgias, disfagia, erupciones cutáneas y anomalías cardiopulmonares.
Un examen físico debe incluir una evaluación para
detectar hallazgos sugestivos de isquemia tisular (p. Ej., Ulceraciones) de
manos y pies. Otros sitios que pueden estar sujetos a un posible vasoespasmo
cutáneo incluyen la piel de las orejas, la nariz, la cara, las rodillas y los
pezones. Si hay esclerodactilia, se debe iniciar un estudio de esclerosis
sistémica (SSc). Un examen físico completo también debe incluir una evaluación
musculoesquelética y cardiopulmonar completa, como posibles pistas de que puede
estar presente una enfermedad reumática autoinmune subyacente.
Herramientas de diagnóstico: la capilaroscopia del lecho ungueal es el método
más comúnmente utilizado en la práctica clínica para ayudar a distinguir a los
pacientes conFR primario de aquellos con FR secundario. También se encuentran
disponibles otras técnicas, pero normalmente se utilizan en centros
especializados o con fines de investigación.
Microscopía capilar del lecho ungueal: se
realiza dejando caer aceite en la zona periungueal y examinando con un conjunto
oftalmoscopio en dioptrías 40 o con un microscopio de disección. También está
disponible un dermatoscopio de mano especializado que amplía la vista del área.
La videocapilaroscopia del pliegue ungueal de gran aumento se utiliza en algunos
centros especializados. Asas capilares agrandadas o distorsionadas y / o
abandono o pérdida de asas sugieren una enfermedad reumática autoinmune
subyacente (o una mayor probabilidad de desarrollar). Si el agrandamiento está
asociado con la pérdida de capilares, entonces es más probable que el paciente
tenga o desarrolle SSc (imagen 3).
Imagen 3. Capilaroscopia del pliegue ungueal -
fenómeno de Raynaud
(Panel A) El patrón capilaroscópico del pliegue
ungueal normal, que muestra la disposición regular de los bucles capilares a lo
largo del lecho ungueal (aumento original 200x, M Cutolo).
(Panel B) Un número reducido de bucles debe
considerarse altamente específico para el fenómeno de Raynaud secundario e
inducir la "desertificación" del lecho ungueal (aumento original
200x, M Cutolo).
Otras técnicas. Otras herramientas utilizadas para evaluar las
respuestas vasculares en los dedos y la piel incluyen termografía, angiografía,
imagenología láser Doppler y medidas directas de la temperatura de la piel y el
flujo sanguíneo local. La capilaroscopia del pliegue ungueal, la imagen térmica
y la imagen láser Doppler proporcionan, de forma independiente, una buena
discriminación entre los controles sanos y el
FR primario. La respuesta de la presión arterial sistólica digital al
enfriamiento se asocia con la frecuencia de ataque de PR y se ha utilizado en
ensayos clínicos como una medida de la gravedad de la PR. Estas herramientas de
laboratorio son útiles para estudiar la fisiología de la RP, pero pueden no
predecir la respuesta al tratamiento o la gravedad de la FR en un entorno
ambulatorio.
Fenómeno de Raynaud primario: diagnosticamos FR primario si los resultados
de una anamnesis y un examen físico completos, incluida la microscopía capilar
del pliegue ungueal, no sugieren una FR secundario.
También se puede hacer un diagnóstico tentativo de
FR primario si la anamnesis y el examen físico no sugieren una causa
secundaria, pero el médico no puede realizar una microscopía capilar del
pliegue ungueal. Entre estos pacientes, normalmente no es necesario realizar más
pruebas especializadas. Sin embargo, reconocemos que las pruebas serológicas,
como las de anticuerpos antinucleares (ANA), a menudo se realizan en este
entorno clínico. Un ANA débilmente positivo (menos de 1/160) es común en la
población general; por lo tanto, una prueba positiva debe interpretarse en el
contexto de toda la situación clínica.
Es necesario un seguimiento cuidadoso para asegurar
que no surjan signos y / o síntomas de causas secundarias de FR. La mayoría de
los estudios encuentran que una transición a una enfermedad reumática
autoinmune secundaria definida generalmente ocurre dentro de los dos a tres
años de la presentación con FR. Entre los diagnosticados inicialmente con FR primario, la presencia de autoanticuerpos y /
o anomalías en la microscopía capilar del pliegue ungueal puede ayudar a
predecir el desarrollo de FR secundario. Los siguientes ejemplos son
ilustrativos:
La combinación de autoanticuerpos y microscopía
capilar del pliegue ungueal puede ser más informativa que cualquiera de las
pruebas por sí solas. En un estudio prospectivo de 586 pacientes con FR que
inicialmente no tenían enfermedad reumática autoinmune conocida, la incidencia
global de ES limitada (variante CREST) o difusa después de un seguimiento de
3197 personas-año fue del 13%. La presencia de uno o más autoanticuerpos
específicos de SSc (anticentrómero [anti-CENP-B], anti-Th / To,
antitopoisomerasa I [Scl-70] y anti-ARN polimerasa III) o microscopía capilar
del pliegue ungueal anormal se encontró en 47 porcentaje de pacientes que
progresaron a ES definida. En aquellos con autoanticuerpos y microscopía
capilar del pliegue ungueal anormal, la incidencia de SSc definida fue casi del
80 por ciento.
Fenómeno de Raynaud secundario: los pacientes con una sospecha clínica moderada o
alta de una causa secundaria de RP pueden tener las siguientes características
clínicas:
- Edad de aparición tardía (mayor de 40 años)
- Historia de un precipitante conocido
- Sexo masculino
- Eventos dolorosos graves con signos tisulares de
isquemia (ulceración)
- Ataques asimétricos
- FR asociado con signos o síntomas de otra enfermedad
- Capilares anormales del pliegue ungueal
- Parámetros de laboratorio anormales que sugieren una
enfermedad vascular o un trastorno autoinmune
- FR asociado con signos o síntomas isquémicos
proximales a los dedos de las manos (como toda la mano o el brazo) o los dedos de los pies
(pie o extremidad)
Los pacientes que presenten síntomas o signos que
sugieran una enfermedad sistémica, con o sin capilares del pliegue ungueal
anormales, deben someterse a pruebas especiales. Las pruebas de laboratorio
deben guiarse por la historia y el examen físico, y deben incluir un ANA, así
como otras pruebas de autoanticuerpos específicos según la sospecha de
enfermedad subyacente. Como ejemplo, en un paciente con esclerodactilia y
úlceras digitales, deben solicitarse anticuerpos específicos para SSc como
antitopoisomerasa I (anti-Scl-70), anticentrómero y anti-ARN polimerasa III.
Si el estudio inicial sigue siendo negativo y el
paciente tiene signos o síntomas persistentes sugestivas de una enfermedad
sistémica subyacente, de un tratamiento adicional para excluir otras
enfermedades tales como hipotiroidismo, malignidad, crioglobulinemia,
criofibrinogenemia, o POEMS ( P olyneuropathy, O rganomegaly, E ndocrinopathy,
M gammapatía onoclonal, y Skin cambios)
Los pacientes que tienen antecedentes de ataques
asimétricos o de un solo dedo, pulsos ausentes, presión arterial asimétrica o
evidencia de isquemia crítica deben someterse a estudios vasculares (p. Ej.,
Ecografía Doppler arterial, angiografía por resonancia magnética o angiografía)
para evaluar las afecciones que causan lesiones grandes. enfermedad oclusiva de
los vasos. Los trastornos que conducen a compromiso vascular con obstrucción,
como enfermedad embólica o vasculitis, pueden simular la FR al desencadenar vasoespasmo.
DIAGNÓSTICO DIFERENCIAL
Existen varias afecciones y trastornos que pueden imitar
el fenómeno de Raynaud (FR).
Excesiva sensibilidad al frío: muchas personas
informan una excesiva sensibilidad al frío de manos y pies fríos cuando se
exponen a un ambiente frío, pero no ven cambios en el color de la piel. En un
estudio, el 10 por ciento de los encuestados tenía sensibilidad al frío. Esta
queja común de manos y pies fríos puede ser un rasgo familiar. La sensibilidad
al frío y la disminución del flujo sanguíneo cutáneo después de la exposición
al frío son más frecuentes en mujeres y en la población de edad avanzada.
Compresión externa de los vasos sanguíneos: la
compresión externa de los vasos sanguíneos (p. Ej., Llevar un paquete pesado)
puede causar una disminución transitoria del flujo sanguíneo y, como
consecuencia, la mano y los dedos pueden estar temporalmente entumecidos,
pálidos y / o fríos. A diferencia de la RP, esto no es inducido por el frío o
el estrés y se revierte fácilmente una vez que se restablece el flujo
sanguíneo.
Neuropatía periférica: la neuropatía periférica
puede causar intolerancia al frío con entumecimiento y cambios en el color de
la piel de las manos y los pies. Sin embargo, a diferencia de aquellos con FR,
los pacientes con neuropatía periférica también pueden tener pérdida distal de
la sensibilidad al pinchazo de un alfiler, al tacto ligero, al frío y a la
propiocepción..
Síndrome doloroso regional complejo: el síndrome de
dolor regional complejo (SDRC) es un trastorno de una región del cuerpo,
generalmente las extremidades, que se caracteriza por dolor, parestesia,
inestabilidad vasomotora y alteración de la temperatura de la piel. Aunque los
pacientes con CRPS pueden tener alteraciones vasomotoras que pueden producir
alteraciones del color y la temperatura, esto suele ir seguido de atrofia muscular
que no se observa en la FR primario, y
el dolor suele ser continuo (en la FR el dolor es intermitente).
Enfermedad vascular oclusiva: la enfermedad vascular
oclusiva (p. Ej., Émbolos, trombosis, aterosclerosis, tromboangitis
obliterante) puede causar una extremidad fría, una mano, un pie o un dedo o
puede asociarse con isquemia tisular con vasoespasmo secundario. A diferencia
de la FR típica, los síntomas relacionados con la enfermedad vascular oclusiva
son típicamente asimétricos y, a menudo, se limitan a un solo dedo; el
vasoespasmo puede ser irreversible con isquemia tisular crítica; Pueden ser
necesarios estudios vasculares para identificar una lesión oclusiva.
Acrocianosis: la acrocianosis es un trastorno
vascular periférico funcional caracterizado por una coloración azul persistente
e indolora simétrica de las manos o los pies, que a menudo se ve agravada por
la exposición al frío. La acrocianosis se puede diferenciar del FR por la relativa persistencia de los cambios de
color de la piel, la simetría y la ausencia de palidez paroxística. Al igual
que con el FR , la acrocianosis se ve agravada por la exposición al frío; sin
embargo, también se asocia a menudo con hiperhidrosis de manos y pies. Los
ataques de RP superpuestos a la acrocianosis no son infrecuentes y puede ser
difícil distinguir los dos trastornos. A diferencia de la RP, la acrocianosis
rara vez responde a la terapia vasodilatadora.
Dedo azul idiopático agudo: el dedo azul idiopático
agudo, también conocido como síndrome de Achenbach o hematoma paroxístico del
dedo, es un trastorno clínico que se informa raramente en el que los pacientes
presentan un inicio repentino de inflamación dolorosa de al menos un dedo, con
una decoloración similar a la equimosis que se desarrolla en la cara volar del
dedo. La coloración azul generalmente no afecta el segmento distal del dedo. El
curso clínico es benigno y los síntomas suelen resolverse sin secuelas
duraderas.
Eritromelalgia: la eritromelalgia (EM) es un rubor
exagerado de la piel que puede imitar la fase de recuperación o la fase hiperémica
del FR. A diferencia del FR, la vasodilatación asociada con la EM se
desencadena por la temperatura cálida y mejora con la exposición al frío.
TRATAMIENTO DEL FENÓMENO DE RAYNAUD: MANEJO INICIAL
PRINCIPIOS GENERALES
Objetivos de la terapia: los objetivos de la terapia son mejorar la
calidad de vida y prevenir la pérdida de tejido (es decir, ulceración,
gangrena). En la mayoría de los pacientes se pueden lograr al menos una
reducción moderada de la intensidad de los ataques y la prevención de la
pérdida de tejido. Sin embargo, no es probable abolir la sensibilidad al frío y
eliminar todos los eventos de Raynaud con las opciones de tratamiento
disponibles, particularmente en pacientes con fenómeno de Raynaud secundario,
debido a la complejidad y sensibilidad de la regulación de los vasos
termorreguladores en la piel.
Educación y autocuidado del paciente: todos los pacientes deben recibir información
sobre las posibles causas de un ataque de Raynaud, así como sobre las medidas
no farmacológicas para ayudar a prevenir y terminar un episodio. Estas medidas
no farmacológicas incluyen evitar factores provocadores como temperatura fría,
fármacos vasoconstrictores, dejar de fumar (cuando corresponda) y otras medidas
que se analizan más adelante.
También es importante explicar a los pacientes que
la respuesta al tratamiento puede variar según la presencia o ausencia de una
enfermedad subyacente; esto es particularmente importante en pacientes con
esclerosis sistémica (SSc, esclerodermia), ya que estos pacientes pueden tener
un componente estructural en su enfermedad vascular además del componente
vasoespástico que se observa en todos los pacientes con FR.
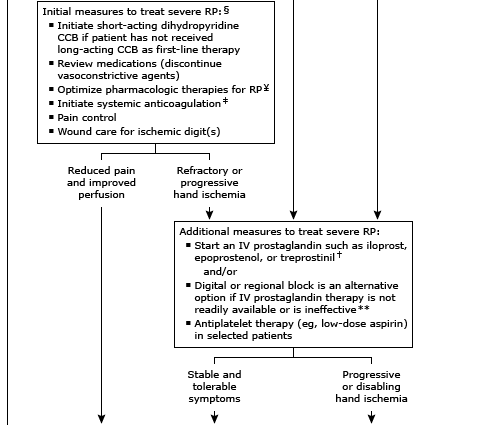
MANEJO INICIAL
La mayoría de los pacientes que presentan el
fenómeno de Raynaud (FR) responderán a las medidas típicas que se describen a
continuación con o sin la adición de terapia farmacológica (algoritmo 2). Un
subconjunto de pacientes, particularmente aquellos con FR secundario, puede
tener isquemia digital severa que requiera tratamientos o intervenciones más
avanzados. Además, es importante distinguir a los pacientes con isquemia aguda
de la mano debido a etiologías que pueden simular FR, ya que algunas afecciones
pueden empeorar con la administración de agentes farmacológicos típicamente
útiles para FR (p. Ej., Bloqueadores de los canales de calcio [BCC]).
Algoritmo 2. Manejo inicial del FR.
El tratamiento inicial del FR en la mayoría de los
pacientes incluye educación del paciente y modificaciones en el estilo de vida
para mantener el calor corporal y evitar otros factores desencadenantes de la
RP. La farmacoterapia se inicia si la terapia no farmacológica es inadecuada,
siendo los BCC dihidropiridínicos los agentes de primera línea preferidos. Sin
embargo, para los pacientes que tienen contraindicaciones o no toleran los BCC,
la monoterapia con un inhibidor de la fosfodiesterasa (PDE) tipo 5, un nitrato
tópico, un bloqueador del receptor de angiotensina o un inhibidor de la
recaptación de serotonina son opciones alternativas.
Medidas no farmacológicas: aconsejamos a todos los pacientes con FR que
tomen una serie de medidas no farmacológicas para ayudar a prevenir los ataques
o reducir su gravedad.
MEDIDAS GENERALES
Evitar la exposición al frío: evitar la exposición
al frío y los cambios bruscos de temperatura (cuando sea posible) es un
componente clave del tratamiento del FR. Los pacientes deben ser conscientes de
las circunstancias que pueden desencadenar un ataque, como poner la mano en un
refrigerador o congelador, sostener una bebida helada y entrar en un ambiente
con aire acondicionado, como la sección de alimentos congelados del
supermercado o nadar en agua fría. . Los cambios estacionales modestos, como
los días fríos y lluviosos, pueden agravar el FR.
No hay ensayos aleatorios que hayan investigado el
efecto de evitar el frío sobre los síntomas de la RP. Este enfoque de evitar un
desencadenante conocido se basa en nuestra comprensión del mecanismo de la
enfermedad junto con el sentido común y los informes anecdóticos de que tomar
medidas para reducir la exposición al frío limitará el número de ataques.
Estrategias para mantener todo el cuerpo y el calor
digital- Es importante entender que hay que mantener caliente todo el cuerpo y
no solo las manos y los pies. Por lo tanto, recomendamos que los pacientes con
FR utilicen estrategias que no solo mantengan calientes los dedos (p. Ej.,
Calentadores de manos, calcetines calientes), sino también todo el cuerpo. Las
estrategias para mantener el calor corporal incluyen vestirse de manera
abrigada con ropa interior térmica, ropa en capas y un sombrero al salir y
hacer arreglos para tener una calefacción adecuada tanto en el hogar como en el
ambiente laboral. Esto también incluye medidas para evitar la exposición al
frío de todo el cuerpo, como no quedarse quieto con la brisa fría del aire
acondicionado y evitar situaciones que impliquen cambios rápidos de una
temperatura ambiente cálida a fría. También puede ser útil mantener calientes
los dedos de las manos y los pies con guantes de invierno, calentadores de
manos con productos químicos y calcetines de lana gruesa.
Los pacientes también deben aprender métodos para ayudar
a terminar un ataque de FR. Estos incluyen colocar las manos bajo agua tibia o
en un lugar cálido (como la axila) o girar los brazos en un patrón de remolino
o molino de viento. También se puede utilizar una maniobra similar a lanzar un
frisbee. Frotarse las manos también puede ayudar a calentarlas y restaurar el
flujo sanguíneo. Un ataque típico dura aproximadamente de 15 a 20 minutos
después del recalentamiento.
Otras medidas generales:
Evitación de traumatismos repetidos en las yemas de
los dedos por parte de todos los pacientes con FR y evitación de herramientas
vibratorias por parte de pacientes con RP inducida por vibraciones.
No aconsejamos habitualmente a los pacientes con FR
que dejen de consumir bebidas que contienen cafeína, aunque algunos expertos
han recomendado hacerlo. No se ha definido el impacto de la cafeína en el FR, y
sus propiedades relacionadas con la xantina pueden producir vasodilatación
sistémica. El consumo de café se ha asociado con efectos vasoconstrictores, que
aumentan transitoriamente la presión arterial (PA). Sin embargo, el café
contiene muchos compuestos biológicamente activos además de la cafeína y, en
general, puede tener un beneficio vascular. Por lo tanto, la decisión de
suspender las bebidas que contienen cafeína debe basarse en la experiencia del
paciente.
En pacientes con FR sometidos a cirugía, el riesgo
de ataques por una mayor exposición al frío en el quirófano se puede reducir
manteniendo a los pacientes calientes. La elección de los medicamentos en los
pacientes que sufren un ataque en este entorno debe individualizarse en función
de las circunstancias clínicas específicas.
Control o limitación del estrés emocional porque los
vasos termorreguladores están constreñidos por el aumento del tono simpático.
El estrés más la exposición al frío es un desencadenante especialmente potente
del FR. El impacto exacto del estrés y la ansiedad ha sido difícil de definir
debido a la falta de estudios que expliquen la influencia de la temperatura
ambiente y las diferencias entre los estudios de laboratorio y la vida real.
experiencias. En un estudio de laboratorio de pacientes con FR primario, la
temperatura de los dedos disminuyó cuando los sujetos vieron una situación de
estrés relacionada con el frío. La mayoría de las intervenciones se han
centrado en manejar situaciones de estrés en lugar de tratar cualquier
condición de salud mental definida. Hasta la fecha, la evidencia de ensayos
clínicos no respalda la terapia conductual (p. Ej., Biorretroalimentación,
terapia de relajación) en el tratamiento del FR. El manejo de la ansiedad y el
estrés en el tratamiento del FR se basa principalmente en experiencias clínicas
y relacionadas con el paciente, y se debe prestar atención a la depresión y los
trastornos de ansiedad.
Evitación de fármacos vasoconstrictores: se debe advertir a los pacientes que eviten los
medicamentos que se sabe que empeoran el vasoespasmo, cuando sea posible. Casi
no existen estudios formales que hayan evaluado los efectos de varios fármacos
sobre el FR; sin embargo, dado que se sabe que el mecanismo terapéutico de
algunos medicamentos causa vasoespasmo, recomendamos que se eviten estos
medicamentos. Varias clases de fármacos que se sabe que están asociados con el
vasoespasmo son los siguientes:
- Descongestionantes nasales de venta libre (p. Ej.,
Fenilefrina , pseudoefedrina )
- Anfetaminas, pastillas para adelgazar y hierbas con
efedra
- Agentes utilizados para tratar el trastorno por
déficit de atención con hiperactividad (TDAH) ( metilfenidato y
dextroanfetamina )
- Algunos medicamentos utilizados para las migrañas,
incluidos los agonistas de la serotonina (p. Ej., Sumatriptán ) o ergotamina
Se sugiere un papel agravante del uso de estrógenos
por el hallazgo de que las mujeres posmenopáusicas que usan estrógenos sin
oposición tienen una mayor prevalencia de FR. Sin embargo, aunque el impacto
exacto de los estrógenos no está completamente definido, la mayoría de los
expertos evitan el reemplazo de estrógenos en pacientes con FR grave.
Cese del tabaquismo:
los efectos vasculares del tabaquismo no parecen ser diferentes en los
pacientes con FR. Por tanto, se recomienda evitar fumar, ya que los fumadores
están sensibilizados a las propiedades vasoconstrictoras de los cigarrillos.
Evitar el humo del cigarrillo para los fumadores pasivos también es prudente.
Los efectos perjudiciales del tabaquismo son
multifactoriales, con mecanismos que incluyen vasoconstricción y alteraciones en
la cicatrización de heridas. Un gran estudio que incluyó a más de 600 pacientes
con ES encontró que el tabaquismo se asoció con síntomas de FR sustancialmente
peores y que la gravedad de los síntomas disminuyó después de dejar de fumar.
Medidas farmacológicas
Terapia farmacológica inicial
Bloqueador de los canales de calcio: en pacientes con FR no complicado que no han
respondido adecuadamente a medidas no farmacológicas, sugerimos el uso de BCC
de dihidropiridina de acción prolongada. No hay datos claros que respalden el
uso de un CCB de dihidropiridina sobre otro. El autor prefiere la amlodipina
debido al perfil de seguridad más favorable. Otros pueden preferir la
nifedipina porque es el CCB que ha sido el más estudiado para FR. En general,
se deben utilizar formulaciones de BCC de acción prolongada en lugar de de
acción corta dada la facilidad de administración y el mejor perfil de seguridad
de los BCC de acción prolongada.
Las dosis efectivas de amlodipino varían de 5 a 20
mg / día y las dosis efectivas de nifedipina de acción prolongada oscilan entre
30 y 120 mg / día. Comenzamos con la dosis más baja y la aumentamos
gradualmente, dependiendo de la respuesta. La duración de un ensayo
farmacológico a una dosis determinada debe determinarse por el período de
observación necesario para evaluar si ha habido una reducción clínicamente
significativa en la frecuencia y gravedad de los ataques agudos, y por el grado
de tolerancia del fármaco. En la mayoría de las situaciones que no son
urgentes, la dosis se ajusta cada cuatro semanas y con una frecuencia no mayor
a cada 7 a 10 días. Las mediciones de la PA sistémica deben seguirse en serie
durante la titulación del CCB. Cuando sea posible, recomendamos a los pacientes
que obtengan un manguito de PA para controlar su PA diariamente hasta que la
dosis sea estable y luego semanalmente, así como cuando se presenten síntomas
de hipotensión. Los principales efectos secundarios asociados con los BCC
incluyen hipotensión, dolor de cabeza, mareos, sofocos.
Las respuestas individuales a los CCB pueden variar.
Si la nifedipina o la amlodipina son ineficaces a la dosis más alta tolerada,
se puede sustituir por otro CCB de dihidropiridina, como nicardipina ,
felodipina , lacidipina, nisoldipina , nimodipina e isradipina. Los BCC no
dihidropiridínicos generalmente se evitan porque no se ha demostrado que sean
consistentemente efectivos.
La duración del beneficio de la intervención
farmacológica en FR no se ha estudiado
formalmente. La mayoría de los ensayos clínicos informados son a corto plazo,
por lo general de cuatro a seis semanas de duración. En nuestra experiencia,
existe un beneficio sostenido del tratamiento con un CCB. Esta impresión se
basa en la ocurrencia constante de recaídas de eventos de Raynaud graves si se
suspende un BCC. Sin embargo, hay pocos datos objetivos para definir la
duración del beneficio de la terapia con fármacos únicos o combinados.
Incapacidad de tolerar o recibir la terapia inicial
preferida: es posible que se requieran
terapias alternativas en pacientes en los que los BCC están contraindicados o
mal tolerados (p. Ej., Pacientes con dismotilidad gastrointestinal severa,
hipertensión arterial pulmonar severa, enfermedad cardíaca significativa con
edema y / o presión arterial baja) . La decisión de usar un agente sobre otro
depende en gran medida del perfil de efectos secundarios y si existen beneficios
adicionales para otras comorbilidades. Como ejemplo, un inhibidor de PDE tipo 5
puede ser preferible a un CCB en un paciente con FR secundario a SSc,
particularmente en un paciente con hipertensión pulmonar concomitante.
Inhibidores de la fosfodiesterasa tipo 5: utilizamos un inhibidor de la PDE tipo 5 en
dosis bajas en pacientes con RP no complicada en los que los BCC están
contraindicados o no se toleran. Por lo general, comenzamos con 20 mg de
sildenafil una o dos veces al día y aumentamos la dosis a 20 mg tres veces al
día si no se logra ningún beneficio. La dosis puede aumentarse aún más a 40 mg
tres veces al día en pacientes que no responden y pueden tolerar la dosis más
alta. Esta dosis es similar a la que se usa en pacientes con hipertensión
pulmonar. El sildenafil también está disponible en 25 mg y puede titularse
hasta 50 mg dos o tres veces al día según se tolere de manera similar a la de
la formulación de 20 mg. Al igual que con los BCC, recomendamos que los
pacientes obtengan un manguito de PA para controlar su PA en serie mientras
ajustan la dosis.
No se debe utilizar un inhibidor de la PDE junto con
nitratos tópicos debido al mayor riesgo de hipotensión. Otros efectos adversos
que pueden ocurrir incluyen edema periférico, palpitaciones, taquicardia,
hipoacusia y alteraciones visuales.
Nitrato tópico:
en nuestra experiencia, los nitratos tópicos son más útiles para
pacientes con un número único o pequeño de dedos gravemente afectados y para
uso a corto plazo (días a semanas), en comparación con pacientes con compromiso
más difuso y con necesidad de tratamiento crónico. uso (meses a años). En
pacientes con presión arterial baja, deshidratación, insuficiencia cardíaca
aguda o crónica, hipertensión pulmonar o el uso continuo de un inhibidor de la
PDE, deben evitarse los nitratos tópicos. Se deben evitar los nitratos tópicos
en pacientes que usan inhibidores de la PDE debido al mayor riesgo de
hipotensión.
El nitrato tópico debe aplicarse a un solo dedo más
gravemente afectado o isquémico durante 6 a 12 horas. Se recomienda comenzar
con una dosis baja de 0,5 pulgadas (o 1 a 2 cm) para definir la tolerancia
antes de aumentar la dosis si no hay mejoría. La dosis de nitrato tópico puede
variar según la preparación y debe ajustarse con un estrecho seguimiento de la
tolerancia y la respuesta clínica. La nitroglicerinaEl ungüento al 2% puede
titularse según sea necesario hasta 2 pulgadas (aproximadamente 5 cm) cada 4 a
6 horas con un período libre de nitrato de 12 horas. Sin embargo, la dosis más
alta a menudo no se tolera bien y los pacientes dejan de usarla. La dosis puede
dividirse entre varios dígitos, aunque la absorción con la mayoría de las
preparaciones produce efectos sistémicos. Los efectos secundarios incluyen
dolor de cabeza, enrojecimiento, aturdimiento, disminución de la PA,
taquicardia y agravamiento del reflujo gastroesofágico.
Los bloqueantes del receptor de angiotensina II -
angiotensina II receptor bloqueantes (ARBs) puede ser utilizado para
pacientes con FR no complicado que no pueden tolerar los BCC o que pueden
beneficiarse de la utilización de un ARB para otras indicaciones (por ejemplo,
hipertensión, insuficiencia cardíaca, enfermedad renal crónica proteinúrica) .
Existe evidencia limitada que respalda el uso de ARB como efectivo para FR
Inhibidor selectivo de la recaptación de serotonina:
la fluoxetina se puede usar en pacientes
con FR no complicada que no pueden tolerar los BCC o los efectos
vasodilatadores sistémicos de algunos de los otros agentes alternativos. Las
pruebas limitadas de las observaciones preliminares y sólo un pequeño estudio
cruzado abierto sugieren que la fluoxetina puede ser beneficiosa para FR. En un
pequeño estudio que incluyó a 53 pacientes con FR primario o secundario, el uso
de fluoxetina (20 mg al día) o nifedipina (40 mg al día) durante seis semanas
dio como resultado una reducción en la frecuencia de los ataques y la gravedad
de la RP; el efecto sólo fue estadísticamente significativo para el grupo de
fluoxetina. Se recomienda que los pacientes comiencen con una dosis de 10 mg al
día durante aproximadamente una semana para la tolerabilidad antes de
aumentarla a 20 mg al día.
Seguimiento de la respuesta a la terapia
Seguimiento de rutina: los pacientes deben ser evaluados periódicamente,
idealmente cada tres a seis meses, para identificar la necesidad de
tratamientos continuos o adicionales. Es importante tener en cuenta el riesgo
del tratamiento, la evidencia clínica de su efectividad y la necesidad de
continuar la terapia en el momento de la evaluación, equilibrando los riesgos
de la terapia y el nivel de gravedad de la FR.
Isquemia refractaria o progresiva: el
manejo del FR severo resistente al tratamiento inicial o eventos severos con
úlceras digitales o lesiones isquémicas (es decir, pérdida de tejido) se
analiza en detalle por separado.
TERAPIAS SIN EFICACIA O CON BENEFICIOS INCIERTOS
Se han propuesto otros tratamientos y se han
sometido a un estudio limitado; En la actualidad, se carece de evidencia
suficiente para respaldar el uso rutinario de cualquiera de las terapias que se
describen a continuación en lugar de otras intervenciones.
Terapia conductual: no hay ensayos sólidos que
demuestren el beneficio de la terapia conductual para reducir el número o la
gravedad de los ataques en el fenómeno de Raynaud (FR). Algunas técnicas que se
han estudiado incluyen el entrenamiento de biorretroalimentación, el
entrenamiento autógeno y el acondicionamiento clásico. La mayoría de los
estudios han utilizado la biorretroalimentación de temperatura para la RP,
donde se proporcionan datos de la temperatura de los dedos a los pacientes para
ayudarlos a aprender a relajarse al monitorear sus estados internos y los
cambios de temperatura. Sin embargo, la mayoría de los ensayos de
biorretroalimentación son en general de baja calidad y han utilizado un pequeño
número de pacientes
Medicina complementaria y alternativa: una revisión
de la literatura y un metanálisis de la eficacia de la medicina complementaria
y alternativa en el tratamiento de la RP encontró que la mayoría de los
estudios no eran concluyentes y que es necesario realizar estudios bien
diseñados en esta área del tratamiento para FR.
Agentes antioxidantes - Los agentes antioxidantes
como el gluconato de zinc (50 a 150 mg / día) también se han utilizado
basándose en el fundamento de que pueden reducir el daño tisular que puede
ocurrir durante la isquemia-reperfusión por la producción de superóxido. En un
estudio, la N-acetilcisteína intravenosa (IV) redujo la frecuencia y la
gravedad de los ataques de RP en comparación con el valor inicial y, en otro
estudio no controlado, redujo las úlceras digitales y la gravedad de la RP en
pacientes con esclerosis sistémica (ES, esclerodermia). El probucol, un antioxidante sintético, mejoró
la PR en comparación con un grupo de control.
Ginkgo biloba: el ginkgo biloba es un medicamento a
base de hierbas que no utilizamos porque la preponderancia de la evidencia no
ha demostrado que sea beneficioso.
Acupuntura: se ha informado que la acupuntura mejora
la PR primaria, pero no hay pruebas suficientes para determinar la eficacia.
Irradiación con láser: se ha informado que los guantes
terapéuticos y la terapia con láser de
baja intensidad mejoran la FR, pero los datos son limitados.
Estimulación de la médula espinal: la estimulación
de la médula espinal se ha utilizado para el tratamiento del FR, pero no se
dispone de ningún estudio controlado.
Inhibidores de la enzima convertidora de
angiotensina: hay poca evidencia que sugiera que los inhibidores de la enzima
convertidora de angiotensina (ECA) sean efectivos para el FR. A pesar de un
estudio abierto que sugirió algún beneficio del uso de captopril en pacientes
con FR primaria (pero no secundaria), un ensayo aleatorizado posterior en el
que participaron 210 pacientes con FR secundario no apoyó el uso de un
inhibidor de la ECA para esta indicación. El ensayo no encontró
pruebas de beneficio del quinapril , un inhibidor de la ECA, en la incidencia
de úlceras digitales o en la frecuencia o gravedad de los ataques de FR.
Prazosin: debido a la falta de estudios sólidos y la
disponibilidad de agentes alternativos, ya no usamos prazosin en el tratamiento
de la RP. En nuestra experiencia, los pacientes eventualmente se vuelven
refractarios a este agente después de un uso prolongado. La prazosina, un
antagonista del receptor alfa-1-adrenérgico, resultó beneficiosa en dos pequeños
ensayos aleatorizados.
PRONÓSTICO
El fenómeno de Raynaud primario es una afección benigna; a menudo es de
naturaleza transitoria y puede mejorar o desaparecer con el tiempo en un tercio
o más de los pacientes durante 7 a 14 años de seguimiento. Sin embargo, muchos
pacientes con FR primario informan que tiene un impacto significativo en su
calidad de vida debido al frío e incomodidad de los dedos y las manos. Esto es
particularmente cierto en personas que tienen ocupaciones que no permiten
evitar el frío de manera efectiva. En comparación, los pacientes con FR
secundario tienen más probabilidades de tener ataques graves y enfermedad
sostenida o progresiva. Los pacientes con enfermedad reumática sistémica
asociada, en particular esclerosis sistémica (SSc, esclerodermia), pueden
desarrollar isquemia digital persistente que requiere una intervención
agresiva, que no siempre es eficaz. Es notable que una encuesta de 443
pacientes con FR primario o secundario autoinformada de 15 países encontró que
el 64 por ciento informó una capacidad actual deficiente o muy pobre para
prevenir / controlar los ataques de RP a pesar de los cambios en el estilo de
vida y los medicamentos recetados.
Puede producirse una remisión espontánea del FR
primario. Esto se ilustró en un estudio prospectivo que encuestó a una
población estadounidense blanca de mediana edad durante un período de siete
años. Para aquellos que tuvieron, o desarrollaron, FR primario durante ese
período de tiempo, las remisiones ocurrieron en el 64 por ciento tanto de
mujeres como de hombres. Sin embargo, algunos síntomas sugestivos de RP
continuaron en aproximadamente el 20 por ciento de los casos que se
clasificaron como en "remisión".
En comparación, la remisión es poco común en
pacientes con RP secundaria.
TRATAMIENTO DEL FENÓMENO DE RAYNAUD: ISQUEMIA
REFRACTARIA O PROGRESIVA
ISQUEMIA AGUDA GRAVE
La isquemia aguda se refiere a un inicio rápido de
flujo reducido que compromete la integridad del tejido (algoritmo 3). El fenómeno
de Raynaud severo o el vasoespasmo refractario
a los tratamientos de FR de primera línea requieren medidas adicionales para
prevenir la pérdida de tejido. La isquemia aguda también puede superponerse a
la isquemia crónica, particularmente si hay una enfermedad estructural
subyacente de los vasos sanguíneos asociada con una reactividad vascular
anormal y un vasoespasmo prolongado. El tratamiento inicial de la RP, incluida
una discusión detallada de las terapias de RP de primera línea, se analiza por
separado.
Algoritmo 3. Manejo
de la isquemia aguda severa o progresiva en un paciente con fenómeno de Raynaud
confirmado.
Medidas iniciales: el tratamiento agresivo es importante en
pacientes que desarrollan isquemia aguda grave que amenaza todo o una parte de
un dedo (algoritmo 3). Para los pacientes que experimentan un evento isquémico
agudo severo, inmediatamente instituimos lo siguiente:
Los pacientes con signos prolongados de flujo
sanguíneo comprometido (palidez o cianosis con lesión tisular o dolor severo)
típicos de un dedo o dedos isquémicos deben ser hospitalizados, mantenerse
cálidos y tranquilos, y evaluarse por completo para detectar un proceso
secundario reversible que esté causando o agravando el isquemia. Esto incluye
una evaluación cuidadosa de la enfermedad arterial oclusiva, estados de
hipercoagulabilidad, ciertas afecciones neurológicas y exposiciones ambientales
o tóxicas (tabla 1).
- Durante un evento isquémico agudo severo que
amenaza la pérdida del dedo, iniciamos la anticoagulación para minimizar la
propagación de cualquier posible trombo. En ausencia de un proceso trombótico
superpuesto, hay pocos datos que apoyen la terapia anticoagulante o trombolítica
en curso en pacientes con FR e isquemia aguda o crónica asociada. Suspendemos
la anticoagulación una vez que se excluye una causa trombótica de isquemia
aguda (por lo general, solo se necesitan uno o dos días).
El dolor debido a la isquemia grave puede ser
intenso y el control adecuado del dolor puede requerir el uso de analgésicos
opioides.
En un paciente con isquemia digital aguda grave
relacionada con FR que no ha recibido
tratamiento de primera línea para FR, normalmente iniciamos un bloqueador de
los canales de calcio de acción corta (BCC) como vasodilatador en el entorno
hospitalario agudo. En pacientes hospitalizados estrechamente observados,
comenzamos con nifedipina de liberación inmediata oral a 10 mg tres veces al
día y titulamos en incrementos de 10 mg cada cuatro a seis horas si es
necesario hasta 30 mg tres veces al día antes de pasar a una formulación de
liberación prolongada. Los CCB generalmente se consideran de primera línea en
el manejo inicial de la RP, y la evidencia que respalda su uso se analiza en
detalle por separado. (Ver "Tratamiento del fenómeno de Raynaud: manejo
inicial", sección sobre "Bloqueadores de los canales de calcio"
).
Intervenciones y procedimientos farmacológicos
Prostaglandinas intravenosas: para pacientes con isquemia digital aguda o
prolongada que no han respondido a la terapia óptima con vasodilatadores orales
o tópicos, sugerimos el tratamiento con infusiones intravenosas (IV) de una
prostaglandina (PG), preferiblemente una prostaciclina (PGI 2 , epoprostenol )
o un análogo sintético como iloprost o treprostinil, dependiendo de la
disponibilidad (que varía entre países). En un evento isquémico agudo,
generalmente ocurre una rápida reversión de los síntomas y se pueden esperar
varias semanas de mejoría. La terapia con PG IV a menudo se administra en un
entorno hospitalario, pero es posible que no se requiera hospitalización en
pacientes con un diagnóstico establecido que no están gravemente enfermos y si
hay disponible un centro de infusión para pacientes ambulatorios con monitoreo
establecido. El último enfoque se usa a menudo para administrar iloprost fuera
de los Estados Unidos. La terapia generalmente se administra a intervalos
intermitentes (generalmente cada 10 a 12 semanas) y la continuación de la
terapia está determinada por la respuesta clínica.
También existe una justificación para tratar a los
pacientes con prostaciclina que tienen síntomas graves que afectan
negativamente su calidad de vida (especialmente durante los meses de invierno
en climas fríos), aquellos con antecedentes de úlceras digitales recurrentes
para prevenir la recurrencia o aquellos con isquemia aguda o isquemia
prolongada con vasoespasmo que amenaza con ulceración o pérdida digital.
Se debe realizar una revisión cuidadosa de la
terapia vasodilatadora en curso antes de usar IV PG para asegurar que el uso de
estos agentes de primera línea se haya optimizado, dados los inconvenientes
sustanciales y el costo potencial de las terapias IV PG . Los BCC y otros
agentes, como los nitratos tópicos o los inhibidores de la fosfodiesterasa
(PDE), se mantienen brevemente mientras los pacientes reciben un ciclo de
tratamiento de PG IV. Los efectos secundarios de la terapia con PG IV incluyen
dolor de cabeza, rubor, náuseas, dolor de mandíbula e hipotensión, que
generalmente son reversibles con una reducción de la dosis. La dosis de PG IV
debe ajustarse al nivel que se tolere.
La elección de PG parenterales y análogos para
pacientes con FR grave se basa en gran medida en la disponibilidad del fármaco
(p. Ej., Epoprostenol intravenoso , pero no iloprost , está disponible en
Estados Unidos), así como en la preferencia y experiencia del médico.
Presentamos varios estudios que han examinado la eficacia de iloprost, epoprostenol,
treprostinil y alprostadil para la PR severa refractaria y en pacientes con y
sin úlceras digitales isquémicas:
Iloprost: el iloprost (un análogo de PGI 2 ) se
administra típicamente durante un ciclo de tres a cinco días consecutivos, a
una dosis (continua) de 0,5 a 2 ng / kg por minuto (titulada hasta la dosis
máxima tolerada por el paciente). La infusión se puede realizar durante ocho
horas si se realiza en un entorno ambulatorio o continua si se realiza en un
entorno hospitalario.
Epoprostenol: el epoprostenol (PGI 2 ) se
administra típicamente a través de una vía periférica, se inicia con una dosis
de 2 ng / kg por minuto y se aumenta durante un período de uno a dos días,
según la tolerancia, a 4 a 8 ng / kg por minuto por una duración de cinco horas.
El epoprostenol se ha utilizado más ampliamente para el tratamiento de la
hipertensión pulmonar idiopática, así como la hipertensión pulmonar asociada
con la ●Treprostinil : el treprostinil (un análogo de PGI 2 ) puede
administrarse por vía intravenosa, por inyección subcutánea o inhalado [ 10 ].
El treprostinil está disponible para el tratamiento de la hipertensión
pulmonar, pero su uso en pacientes con síntomas graves de RP o isquemia digital
aguda o crónica por vía subcutánea o intravenosa no se ha investigado para
proporcionar pautas de tratamiento específicas. Su uso en el contexto de la PR
se basa en gran medida en pruebas indirectas limitadas de que puede tener
efectos beneficiosos sobre las úlceras digitales o la necrosis en pacientes con
ES.
Alprostadil - Alprostadil (PGE1) es un PG que se ha
administrado a una dosis de 6 a 10 ng / kg por minuto a través de una vía
intravenosa central. Varios pequeños estudios observacionales sugirieron
beneficios para los síntomas relacionados con la PR, así como una mejoría en la
cicatrización de la úlcera; sin embargo, estos hallazgos no fueron corroborados
en un pequeño ensayo aleatorizado.
Bloqueo local o regional: para
pacientes con isquemia aguda grave, cuando la terapia vasodilatadora oral y / o
tópica no da como resultado rápidamente una mejora en el flujo sanguíneo
digital y / o cuando los PG IV no están fácilmente disponibles, sugerimos
bloqueo digital o bloqueo regional para transitorios. alivio de la isquemia
digital aguda, que puede proporcionar un alivio rápido del dolor.
Un bloqueo digital o regional (p. Ej., Muñeca) se
suele realizar con infiltración local de lidocaína o bupivacaína (sin epinefrina
). Estos bloqueos nerviosos regionales para FR no se han evaluado
sistemáticamente en ensayos clínicos, y su uso en este entorno se basa en gran
medida en la experiencia clínica y la extrapolación de otros entornos clínicos.
Esta intervención puede considerarse una medida temporal, ya que tampoco
existen estudios formales para definir el impacto sobre las complicaciones como
las úlceras digitales recurrentes. Los efectos secundarios incluyen disminución
de la sensibilidad y cambios ortostáticos, pero no parálisis.
Los bloqueos de nervios más proximales, como las
inyecciones cervicales o lumbares, rara vez se utilizan a menos que otros
enfoques hayan fallado. A veces es temporalmente eficaz para revertir el
vasoespasmo agudo [ 18,19 ]. (Consulte 'Papel limitado de la simpatectomía
proximal' a continuación).
Tratamientos que carecen de eficacia o de beneficio
incierto
Toxina botulínica A: la toxina botulínica A intradigital y palmar
también se ha utilizado para la terapia de inyección local. El papel de las
inyecciones de toxina botulínica en el tratamiento de la RP no está bien
definido.
Prostaglandinas y análogos orales: las
preparaciones de prostaciclina y análogos orales están disponibles para
su estudio en Japón, Europa y los Estados Unidos, pero se necesitarán más
estudios, incluidos ensayos aleatorizados, para establecer la función de una
prostaciclina oral en el tratamiento de la RP grave . Se han obtenido
resultados mixtos para varios agentes orales diferentes en estudios que evalúan
su eficacia en FR, incluidos misoprostol, limaprost, cisaprost , beraprost ,
iloprost y treprostinil .
ISQUEMIA REFRACTARIA O PROGRESIVA
Los ataques isquémicos que son refractarios a las
medidas conservadoras iniciales o los tratamientos discutidos anteriormente
pueden dar como resultado niveles variables de lesión tisular debido a la
reducción progresiva o prolongada del flujo (es decir, isquemia crónica).
Las opciones para el tratamiento de los pacientes
con fenómeno de Raynaud con isquemia refractaria o progresiva incluyen
medicamentos vasoactivos combinados, esfuerzos para revertir el proceso de
enfermedad vascular subyacente y estrategias para proteger los vasos afectados
de lesiones u oclusiones adicionales (algoritmo 1). Por ejemplo, en pacientes
con esclerosis sistémica (SSc, esclerodermia) y úlceras digitales
recalcitrantes o recurrentes, un inhibidor de endotelina ( bosentan ) en
combinación con terapia vasodilatadora puede prevenir nuevos eventos
isquémicos. La simpatectomía es una opción cuando persiste la enfermedad
refractaria. Cuando se elige la simpatectomía, se prefiere la simpatectomía
periférica al nivel de la mano (p. Ej., Simpatectomía palmar o digital) a los
procedimientos más centrales (p. Ej., Cervical o lumbar).
Simpatectomía digital: la simpatectomía digital debe limitarse a
pacientes que no responden adecuadamente a los tratamientos médicos y que
continúan teniendo isquemia refractaria o progresiva que amenaza el dedo o los
dedos afectados, en ausencia de una causa reversible, como vasculitis, que se
puede tratar de otra manera . Es una técnica microquirúrgica que aísla las
ramas terminales de los nervios simpáticos que viajan con los nervios
periféricos, dividiendo estas ramas y despojando la adventicia de las arterias
digitales. Es importante que el procedimiento se realice antes de que ocurra un
daño irreversible del tejido profundo. [ 42 ]. Es un procedimiento altamente
especializado, realizado solo en centros especializados.
Aunque algunos casos han informado de resultados
satisfactorios y pocas complicaciones después de la simpatectomía digital, su
función exacta para la PR refractaria no se ha definido mediante
investigaciones controladas. Una revisión observó que las diferencias en la
técnica quirúrgica, las causas de la isquemia digital y las medidas de
resultado dificultaban las comparaciones de las series informadas. La
amputación y la ulceración recurrente después de la simpatectomía digital
fueron frecuentes (14 y 18 por ciento, respectivamente). Entre los pacientes
con PR y ES con isquemia digital, la tasa de complicaciones perioperatorias fue
del 37%.
Terapia antitrombótica
Agentes antiplaquetarios en pacientes
seleccionados : limitamos el uso de aspirina en dosis bajas
(75 u 81 mg / día) a pacientes con RP secundaria que tienen antecedentes de
úlceras isquémicas u otros eventos trombóticos, y que no tienen riesgos
adicionales asociados con el uso de aspirina. . El beneficio de la terapia
antiplaquetaria con aspirina es en general incierto debido a la falta de
evidencia general para su uso en pacientes con FR. Sólo ha habido un ensayo
pequeño con tratamiento con ácido acetilsalicílico más dipiridamol , ácido
acetilsalicílico solo o dipiridamol solo en pacientes con RP, pero la mayoría tenía
RP primaria. Los agentes antiplaquetarios no parecieron tener ningún efecto
sobre los síntomas de la RP. La aspirina debe evitarse en pacientes
seleccionados, como aquellos con SSc que tienen un mayor riesgo de hemorragia
gastrointestinal por ectasia vascular antral gástrica subyacente.)
La anticoagulación a largo plazo no desempeña ningún
papel :
no hay pruebas sólidas que respalden la anticoagulación a largo plazo en
pacientes con isquemia crónica por PR. El único estudio para evaluar la anticoagulación
en el contexto de la PR fue un pequeño estudio controlado con placebo en el que
la heparina de bajo peso molecular (HBPM) se asoció con una reducción de la
gravedad de los ataques de PR después de 4 y 20 semanas [ 64 ]. Sin embargo,
este estudio solo incluyó a 30 pacientes y nunca se ha repetido.
Atención local de los dedos isquémicos: el desbridamiento quirúrgico de las áreas de
necrosis y, en ocasiones, la amputación puede ser necesario para la isquemia
irreversible. Las úlceras digitales ocurren hasta en la mitad de los pacientes
con SSc. Entre 1459 pacientes con SSc y úlceras digitales, las úlceras fueron
recurrentes en el 46,2% y crónicas en el 11,2%. La amputación ocurrió en el 7,6
y el 15,9 por ciento de estos pacientes, respectivamente. La mayoría de las
amputaciones son menores y afectan al dedo distal. Cuando se brinda el cuidado
adecuado a las úlceras digitales, la curación generalmente ocurre dentro de 6 a
12 semanas. El tratamiento de la úlcera digital o la gangrena se revisa por
separado.
MEDICAMENTOS ADICIONALES PARA LAS ÚLCERAS
RECURRENTES EN LA ESCLEROSIS SISTÉMICA
El tratamiento del fenómeno de Raynaud grave en
pacientes con esclerosis sistémica (SSc, esclerodermia) es generalmente el
mismo que para aquellos con RP secundaria por otras causas. Sin embargo,
algunos medicamentos pueden conferir beneficios adicionales específicamente
para pacientes con SSc que tienen úlceras digitales recurrentes.
Inhibidores de la fosfodiesterasa tipo 5: en pacientes con SSc y úlceras recalcitrantes
o recurrentes, sugerimos la adición de inhibidores de la fosfodiesterasa tipo 5
(PDE) en lugar de bloqueadores de los canales de calcio (BCC) solos. Hay datos
limitados que sugieren que los inhibidores de la PDE tipo 5 reducen el número
de formaciones de úlceras en pacientes con ES. En un estudio observacional de
19 pacientes con ES y úlceras digitales, el tratamiento con sildenafil durante
seis meses resultó en una reducción del número de úlceras digitales desde el
inicio (de tres a una por paciente) . Los síntomas de RP también mejoraron
desde el inicio. Un metanálisis posterior encontró que los inhibidores de la
PDE eran beneficiosos en la cicatrización de las úlceras en comparación con el
placebo (riesgo relativo 3,28 [IC del 95%: 1,32-8,13)].
Bosentan:
para pacientes con úlceras digitales recurrentes asociadas con SSc a
pesar del uso de otras terapias, incluidos los CCB más inhibidores de PDE,
sugerimos el uso de bosentan , un inhibidor del vasoconstrictor endotelina-1
administrado por vía oral, como alternativa a la administración intravenosa
(IV) repetida. prostaciclina. Esto se basa en ensayos aleatorizados en
pacientes con ES que demostraron una frecuencia reducida de nuevas úlceras
digitales en estos pacientes [ 69,70 ]. No se ha demostrado que bosentan
aumente la tasa de curación de las úlceras ni reduzca la intensidad de la PR,
por lo que generalmente limitamos su uso a pacientes seleccionados con ES con
úlceras recurrentes. Bosentan se ha utilizado principalmente para el
tratamiento de la hipertensión pulmonar. (Ver"La hipertensión pulmonar
arterial en la esclerosis sistémica (esclerodermia): Tratamiento y
pronóstico", sección en 'antagonistas del receptor de endotelina-1' y
"Tratamiento de la hipertensión arterial pulmonar (grupo 1) en adultos: la
terapia pulmonar-hipertensión específica" ).
El tratamiento con bosentan se inicia con una dosis
de 62,5 mg dos veces al día durante cuatro semanas. La dosis debe aumentarse a
125 mg dos veces al día en pacientes que no se benefician de la dosis inicial.
Las pruebas de función hepática deben obtenerse mensualmente en pacientes que
reciben el medicamento para controlar la toxicidad hepática. Los efectos
secundarios comúnmente reportados son dolor de cabeza, rubor, edema (18 por
ciento), hipotensión, elevación de las enzimas hepáticas (12 por ciento) y fatiga.
Las reacciones menos comunes pero más graves incluyen insuficiencia hepática,
supresión de la médula ósea y angioedema. En los ensayos clínicos,
aproximadamente el 15 por ciento de los pacientes interrumpieron la terapia
debido a los efectos secundarios.
Los datos de los ensayos clínicos sugieren que el
bosentan puede ayudar a reducir el número de nuevas úlceras digitales en
pacientes con ES, pero no se ha demostrado que mejore la curación de las
úlceras existentes. Un ensayo aleatorizado de 122 pacientes con SSc informó una
reducción del 50 por ciento en nuevas úlceras entre aquellos que tenían
ulceración al inicio del estudio; sin embargo, no hubo reducción en la
frecuencia o intensidad de los ataques de RP y no hubo mejoría en la
cicatrización de la úlcera en pacientes con úlceras digitales al inicio del
estudio. Un ensayo posterior en 188 pacientes con SSc con úlceras digitales al
ingresar al ensayo encontró una reducción estadísticamente significativa del 30
por ciento en las nuevas úlceras digitales en comparación con el placebo (1,9
frente a 2,7), pero tampoco observó diferencias en la tasa de curación de la
úlcera cardinal. El edema periférico y las aminotransferasas elevadas se
asociaron con el uso de bosentan.
Puede haber un beneficio adicional de la terapia
combinada de iloprost intravenoso con bosentan para la prevención de úlceras
digitales recurrentes en pacientes con ES. En un estudio observacional
prospectivo con 30 pacientes con SSc que recibieron iloprost IV por PR
secundaria grave, la mitad de los pacientes también recibieron bosentan después
del desarrollo de úlceras digitales o hipertensión arterial pulmonar. Después
de cuatro años de seguimiento, el grupo de iloprost más bosentan mostró una
mejora significativa en la estructura y función de la microvasculatura digital
basada en el número absoluto de capilares del pliegue ungueal y la perfusión
sanguínea de la yema de los dedos, respectivamente, lo que también se
correspondió con una reducción significativa en la incidencia de nuevas úlceras
digitales. . Este estudio limitado necesita confirmación, pero sugiere que la
terapia combinada puede ser útil en pacientes con ES compleja con úlceras
digitales recurrentes.
A diferencia del bosentan, otro antagonista no
selectivo de la endotelina-1, macitentan , que también se utiliza para tratar
la hipertensión pulmonar, no logró reducir la frecuencia de nuevas úlceras
digitales isquémicas durante 16 semanas, en comparación con placebo, en dos
ensayos aleatorizados que incluyeron un total de 554 pacientes. pacientes con
SSc y úlceras digitales activas al inicio del estudio. Los antagonistas
selectivos de la endotelina-1 que son menos tóxicos para el hígado pueden tener
el potencial de ser útiles, pero no hay evidencia disponible sobre su uso en
esta población.
Estatinas:
para los pacientes con SSc con úlceras digitales recurrentes, es
razonable probar la terapia con estatinas, además de las terapias descritas
anteriormente. Un pequeño ensayo que incluyó 84 pacientes con SSc encontró que
los pacientes del grupo de estatinas desarrollaron menos úlceras por paciente
en comparación con los pacientes del grupo de placebo (media de 1,6 frente a
2,6 úlceras, respectivamente) . También hubo mejoras en otros resultados informados
por los pacientes, incluido el dolor y la gravedad del ataque de Raynaud. Otro
ensayo pequeño de etiqueta abierta también informó efectos favorables a largo
plazo. La justificación del uso de estos agentes incluye sus efectos
pleiotrópicos, que pueden ayudar a proteger la vasculatura o prevenir eventos
vasculares.
SEGUIMIENTO DE LA RESPUESTA A LA TERAPIA
Seguimiento de rutina: los pacientes deben ser evaluados periódicamente
para detectar la necesidad de una intervención en particular, idealmente cada
tres meses si el paciente es inestable o hasta seis meses si el escenario es
menos complejo. Es importante tener en cuenta el riesgo de la intervención, la
evidencia clínica de su efectividad y la necesidad de continuar el tratamiento en
el momento de la evaluación. Además, la evaluación cuidadosa de la enfermedad
subyacente que causa vasoespasmo o fenómeno de Raynaud es importante para
definir cualquier proceso patológico reversible.
Duración de la terapia: no hay ensayos clínicos para definir
claramente los resultados a largo plazo de las prostaglandinas (PG)
intravenosas (IV) o las terapias de inyección. La mayoría de los ensayos
clínicos informados son a corto plazo, y la mayoría de los estudios informan
datos basados en tres meses de seguimiento. Por lo tanto, como se mencionó
anteriormente, cada paciente debe ser evaluado periódicamente para determinar
la necesidad de continuar el tratamiento, equilibrando los riesgos del
tratamiento y el nivel de gravedad de la RP.
Los estudios cuidadosos a largo plazo del resultado
después de la intervención quirúrgica o la terapia con inyecciones no son
adecuados para proporcionar orientación. Nuestra experiencia es que la PR
reaparece después de la simpatectomía digital quirúrgica, pero generalmente no
es tan grave como antes de la cirugía.
FUENTE UPTODATE MAYO 2021