Un hombre de 37 años fue ingresado en este hospital debido a una asimetría facial, disartria e insuficiencia renal.
El paciente había estado bien hasta una semana antes
del ingreso, cuando apareció debilidad del brazo y la mano derechos, junto con
dificultad para mantener el equilibrio al caminar.
Dos días antes del ingreso, los familiares le
dijeron al paciente que su conversación sonaba confusa mientras hablaba por
teléfono. En el día del ingreso, los familiares notaron que el paciente
presentaba nueva asimetría facial que no había estado presente 2 meses antes;
además, hacía una pausa prolongada antes de responder preguntas y hablaba con
lentitud y dificultad. Los familiares llevaron al paciente al servicio de
urgencias de este hospital para evaluación.
En la evaluación, el paciente refirió malestar y
letargo. Vomitó una vez en el servicio de urgencias, pero dijo no tener náuseas
ni dolor abdominal. No tenía fiebre, escalofríos, dolor de cabeza, cambios en
la visión, disuria, hematuria o frecuencia o urgencia urinarias. Había
antecedentes de depresión, ansiedad y déficit de atención /desorden de
hiperactividad.El paciente había consumido heroína por vía intravenosa desde
los 16 años de edad y venas perdidas con frecuencia durante las inyecciones; su
última inyección fue en la mañana de esta evaluación. En raras ocasiones, había
consumido cocaína, 3,4-metilendioximetanfetamina, dietilamida del ácido
lisérgico, anfetaminas, opiáceos recetados, benzodiazepinas y marihuana. Había
fumado un paquete de cigarrillos diarios durante los últimos 20 años y rara vez
bebía alcohol. El paciente había sido
homeless anteriormente, pero en el momento de esta evaluación, vivía solo en un
departamento. Estaba desempleado pero había trabajado anteriormente en consultoría
sin fines de lucro. Nunca había sido sexualmente activo. Su padre, hermano,
hermana, y el primo paterno tenía trastornos por uso de sustancias; su madre
estaba sana. No tomaba medicamentos y no tenía alergias a medicamentos
conocidas.
La temperatura era de 36,8 ° C, la presión arterial
130/86 mm Hg, el pulso 92 por minuto, la
frecuencia respiratoria 18 por minuto, y la saturación de oxígeno 99%
respirando aire ambiente.
El índice de masa corporal era 26,6. El paciente parecía crónicamente
enfermo, con afectividad plana. Estaba alerta y orientado pero tenía dificultad para indicar los días de la semana
hacia atrás. Podía seguir órdenes simples después de un retraso. Su discurso
era lento y disártrico. Había una caída facial del lado derecho. Las pupilas eran iguales, redondas y
reactivas. La fuerza era 4 + / 5 en el
brazo derecho y 5− / 5 en la pierna derecha. El reflejo pronador estaba
presente en el lado derecho. La fuerza era normal en el brazo y pierna
izquierdos. La sensibilidad y reflejos tendinosos profundos eran normales.
El Babinski estaba presente en el pie
derecho. La dorsiflexión de los tobillos fue seguido de siete latidos de clonus
del pie derecho y tres en el pie izquierdo. Había temblor intermitente espontáneo
de la pierna derecha en episodios de aproximadamente 10 segundos de duración. El
examen de la piel reveló múltiples marcas en los brazos, con áreas dispersas de
induración eritematosa sin fluctuación o dolor. El resto del examen era normal.
Los resultados de las pruebas de función hepática
fueron normales, así como resultados de un screening toxicológico de rutina en
orina y sangre. El nivel sanguíneo de nitrógeno ureico fue de 124 mg/dl ( 8 a
25), creatininina 16,1 mg/dl ( 0.6 a 1,5), y dióxido de carbono 9 mmol por
litro (23 a 32). Cuatro años antes de esta evaluación, el nivel de creatinina
había sido normal.
Otros resultados de pruebas de laboratorio se muestran
en las tablas 1 y 2. El examen del sedimento urinario reveló cilindros
granulares y glóbulos blancos dispersos, sin cilindros celulares. Pruebas de
anticuerpos antinucleares, anticuerpos anti-ADN bicatenario, anticuerpos anticitoplasma
de neutrófilos (ANCA), y el factor reumatoide fueron negativos. Niveles de
sangre de C3, C4, lactato deshidrogenasa y hemoglobina glucosilada eran normales.
Muestras de sangre se obtuvieron para cultivo. Los anticuerpos contra el virus
de la inmunodeficiencia (VIH) tipo 1 y 2 y el antígeno p24 fueron negativos; no
se detectó ARN del VIH tipo 1 en plasma. Pruebas para IgM anti-core del virus
de la hepatitis B (VHB), anticuerpos del virus (VHC), anticuerpos contra
Treponema pallidum, y anticuerpos contra Toxoplasma gondii fueron negativos. Un
ensayo de liberación de interferón-γ para Mycobacterium tuberculosis fue
negativa, y 1,3-β-dglucano no se detectó en un análisis de sangre.
TABLA 1
TABLA 2. Orina
Se obtuvieron estudios de imágenes.
La tomografía computarizada (TC) de la cabeza (Fig.
1A), realizado sin contraste intravenoso, reveló áreas de hipoatenuación mal
definida en la sustancia blanca frontal profunda y la región estriatal del lado
izquierdo. Las imágenes de resonancia
magnética de la cabeza (Fig. 1B a 1F), realizada sin contraste intravenoso
mostró una lesión expansiva en los núcleos grises profundos y sustancia blanca
profunda en el lado izquierdo asociada con hiperintensidad de señal en T2
ponderado y FLAIR con aumento de la perfusión en las imágenes de espín
arterial. Dentro de la anormalidad, había un foco de 4 mm de difusión restringida
en el globo pálido izquierdo y la rama posterior de la cápsula interna izquierda.
Había un efecto de masa asociado con borramiento parcial del ventrículo lateral
izquierdo y un desplazamiento de la línea media hacia la derecha de 7 mm.
Figura 1. Estudios de neuroimagen.
Una imagen axial de una tomografía computarizada de
la cabeza (panel A) muestra áreas de hipoatenuación mal definida (flecha) en la
profundidad de la sustancia gris y
sustancia blanca frontal adyacente en el lado izquierdo. Este hallazgo
corresponde a hallazgos de resonancia magnética que incluyen regiones de señal
aumentada en una imagen axial ponderada en T2 (Panel B, flecha) y un FLAIR
(Panel C, flecha) y perfusión levemente elevada en una imagen de espín arterial
(Panel D, flecha). En una imagen ponderada en difusión (Panel E), se muestran
focos de difusión restringida anormal (flechas) en el globo pálido izquierdo y
cápsula interna posterior izquierda. En una secuencia de eco de gradiente
(Panel F), no se muestra hemorragia intralesional.
Se comenzó con vancomicina, cefepima y metronidazol, y el paciente fue ingresado en el hospital. Siete horas después de iniciado el tratamiento antimicrobiano, se llevó a cabo una punción lumbar. La presión de apertura fue de 23 cm de agua y el LCR era incoloro. La glucosa y los niveles de proteína total eran normales, el recuento de células nucleadas fue de 1 por microlitro (rango de referencia, 0 a 5), y el recuento de glóbulos rojos fue 61 por microlitro (rango de referencia, 0 a 5). La tinción de Gram del LCR reveló una moderada cantidad de células mononucleares, raros polimorfonucleares, sin organismos.
Al día siguiente, ecografía renal (Fig.2) reveló riñones
levemente agrandados (riñón derecho de 12,7 cm de longitud y riñón izquierdo
13,5 cm; rango de referencia, 10.1 a 12.8) 1 con ecotextura parenquimatosa
normal. El riñón izquierdo tenía múltiples quistes y no había hidronefrosis. La
TC de tórax, abdomen y pelvis, realizado sin contraste intravenoso, reveló
esplenomegalia pero sin otra cosa destacable.
Figura 2. Imágenes ecográficas renales.
En las imágenes ecográficas longitudinales de los
riñones derecho e izquierdo (paneles A y
B, respectivamente), se conserva la ecotextura renal. Quistes renales (Panel B,
flechas) están presentes en el riñón izquierdo.
En el tercer día de hospitalización, una ecocardiografía transtorácica reveló una
fracción de eyección del ventrículo izquierdo del 66% sin anomalías valvulares;
estos hallazgos fueron confirmado por ecocardiografía transesofágica.
Durante los próximos 3 días, los déficits neurológicos del paciente no mejoraron.
Líquidos conteniendo bicarbonato de sodio se administraron por vía intravenosa;
el nivel de dióxido de carbono aumentó a 19 mmol por litro. El nivel de creatinina
disminuyó a 10,5 mg/dl. No se detectaron proteínas de Bence Jones en orina. Los
hemocultivos y el LCR no mostraron desarrollo a las 72 horas. En el cuarto día
de hospitalización, el paciente refirió más fatiga; había más errores en su
discurso, y estaba más lento para responder a las preguntas. Una tomografía de
emisión de positrones desde la base del cráneo hasta la mitad de los muslos,
realizado después de la administración intravenosa de 18F-fluorodesoxiglucosa (FDG),
reveló inespecífico focos de captación moderada inespecíficas de FDG en un
multinodular bocio pero no mostró otra captación de FDG.
En el sexto día de hospitalización, se observó actividad
similar a convulsiones por lo que se administró lorazepam y levetiracetam. En
un análisis de sangre repetido, el nivel de 1,3-β-dglucano fue de 256 pg por
mililitro (referencia menos de 60). Una biopsia estereotáctica de la lesión que
involucra la cápsula interna izquierda se realizó con guía de TC y se aspiró material
extremadamente purulento. El examen patológico revelódetritos con abundantes
neutrófilos e hifas de hongos.
Se realizó una prueba de diagnóstico.
DIAGNÓSTICO DIFERENCIAL
Este hombre de 37 años con antecedentes del uso de
drogas inyectables se presentó con una caída facial y debilidad leve en el lado
derecho del cuerpo, disartria, que aparentemente había sido causado por un absceso
cerebral por hongos e insuficiencia renal grave.
La primera pregunta para desarrollar un diagnóstico
diferencial es si el paciente tiene un proceso que puede explicar todos los
hallazgos o tiene dos enfermedades potencialmente mortales. Aunque varias de
las características de presentación podrían conducir en última instancia al
diagnóstico correcto, me enfocaré en las causas de la enfermedad renal con el
fin de identificar un diagnóstico que explique el desarrollo de insuficiencia
renal con proteinuria intensa y ofrezca una explicación plausible para el
desarrollo de un absceso cerebral.
Dado que este paciente supuestamente había tenido función
renal normal 4 años antes, hay varias preguntas a considerar: ¿La insuficiencia
renal, es aguda o crónica? ¿Qué estructuras en el los riñones están afectados?
Y, si son los glomérulos los principalmente involucrados, es el trastorno
inflamatorio ("Nefrítico") o no inflamatorio ("nefrótico")?
INSUFICIENCIA RENAL
Características clínicas sugestivas de insuficiencia
renal aguda incluyen la ausencia de reducción del tamaño de los riñones en los
estudios de imágenes, oliguria y la reciente aparición de síntomas u otras
manifestaciones de enfermedad sistémica. Los pacientes que tienen pocos síntomas
urémicos a pesar de la presencia de azotemia severa y riñones pequeños tienen más probabilidades de
tener enfermedad renal crónica que insuficiencia renal aguda.
El análisis de orina puede ser de gran ayuda; la
presencia de glóbulos rojos dismórficos y cilindros de glóbulos rojos, por ejemplo,
sugiere glomerulonefritis aguda.
Otras pruebas de laboratorio de rutina no
discriminan tanto. Por ejemplo, puede ocurrir anemia severa tanto en enfermedad renal crónica como en la insuficiencia renal aguda. Este
paciente tenía proteinuria en rango nefrótico con sedimento urinario
relativamente "blando", hallazgos sugestivos de enfermedad glomerular
no inflamatoria.
ENFERMEDAD RENAL ASOCIADA CON CONSUMO DE DROGAS
INYECTABLES
Varias enfermedades renales están asociadas con el
consumo de drogas inyectables. Las infecciones por VIH, VHC y VHB están
asociadas con glomerulopatías específicas. Pacientes con nefropatía asociada al
VIH puede presentarse con insuficiencia renal avanzada y proteinuria en rango
nefrótico. A menudo tienen riñones de tamaño normal o riñones grandes en la
ecografía, pero los riñones a menudo se describen como muy
"ecodensos",2 que no fue el caso de este paciente.
El hallazgo típico en el análisis histológico de una
muestra de biopsia renal es la glomeruloesclerosis segmentaria focal, comúnmente
con túbulos dilatados y nefritis intersticial crónica extensa. También puede
ocurrir glomerulonefritis aguda mediada
por complejos inmunes.
Enfermedades renales que pueden desarrollarse en pacientes
con infección por VHC o VHB incluyen glomerulonefritis membranoproliferativas,
nefropatía membranosa y poliarteritis
nudosa3,4. La nefropatía asociada a la heroína, que comparte algunos aspectos
clínicos y características patológicas con la nefropatía asociada al VIH, se ha vuelto poco común en los últimos
años.5 Las infecciones bacterianas y, con mucha menos frecuencia, las infecciones
por hongos relacionadas con la inyección de drogas puede conducir a la
glomerulonefritis con formación de semilunas mediadas por complejos inmunes.
Los hongos también pueden causar nefritis intersticial granulomatosa. Se ha
asociado microangiopatía trombótica con el uso de cocaína y, en menor medida,
con otras drogas. Vasculitis pauciinmune se ha asociado con la cocaína, así
como con levamisol, un adulterante que se mezcla con cocaína.6,7
Dada la proteinuria en rango nefrótico de este
paciente, centraré el diagnóstico diferencial en enfermedades glomerulares. El
paciente tenía clínica de un componente
significativo de proteinuria no
albúmina. Este hallazgo a menudo se debe a la presencia de cadenas ligeras de
inmunoglobulina en la orina, pero una prueba para estas fue negativa, lo que
sugiere la posibilidad de un proceso de enfermedad tubulointersticial
concomitante que condujo a la excreción urinaria de cantidades anormales de proteínas
de bajo peso molecular, una característica conocida como proteinuria tubular.
El aumento de los niveles sanguíneos de cadenas livianas kappa y lambda, que se observaron en este
paciente, se encuentran típicamente en pacientes con insuficiencia renal, con
una mayor elevación de cadenas ligeras kappa que de las cadenas ligeras lambda
y con un aumento en la relación kappa: lambda.8 Además, la presencia de glucosuria
en ausencia de hiperglucemia sugieren la posibilidad de una enfermedad
tubulointersticial que causa disfunción tubular proximal, dado que
prácticamente toda la glucosa filtrada es normalmente reabsorbida en este
segmento de la nefrona.
ENFERMEDAD GLOMERULAR PRIMARIA
En este caso, vale la pena considerar enfermedades
glomerulares primarias que no estarían relacionadas con el proceso neurológico
y la lesión cerebral por hongos, incluyendo nefropatía por IgA, glomeruloesclerosis
focal y segmentaria, y la nefropatía membranosa.
Los pacientes con estas enfermedades pueden
presentar insuficiencia renal grave y proteinuria de rango nefrótico. Suelen
presentarse para recibir atención médica temprano en el proceso de la enfermedad
debido al desarrollo de edema, hematuria (en el caso de IgA nefropatía), u
otros síntomas, pero pueden ocurrir presentaciones tardías. Estas tres
entidades juntas representar al menos el 50% de las presentaciones con
enfermedades glomerulares primarias que ocurren en el grupo de edad de este
paciente. Aunque no hay análisis de sangre de diagnóstico para nefropatía por
IgA o glomeruloesclerosis focal y segmentaria, el análisis de sangre para
anticuerpos de la fosfolipasa A2 de tipo M receptor (anticuerpos anti-PLA2R) es
sensible y altamente específico para la nefropatía membranosa8,9. Se requeriría
una biopsia renal para diagnosticar los otros trastornos. La nefropatía por IgA
y, menos comúnmente, la nefropatía membranosa pueden manifestarse como una
glomerulonefritis proliferativo endocapilar
rápidamente evolutiva con formación de semilunas.
GLOMERULONEFRITIS INMUNOMEDIADAS ASOCIADAS A
INFECCIONES
En presencia del uso de drogas inyectables, una glomerulonefritis
proliferativa mediada por complejos inmunes que a menudo se asocian con semilunas
glomerulares y con una progresión rápida debe ser considerado.10 Esta
manifestación puede estar relacionada con endocarditis infecciosa, infecciones
agudas y crónicas de piel, otras infecciones bacterianas superficiales o
profundas aguda o, en casos raros, infecciones
por hongos. La hipocomplementemia está a menudo presente. En los últimos años,
ha habido reconocimiento de una glomerulonefritis mediada por inmunocomplejos asociado
con depósitos glomerulares que a menudo son IgA dominantes o codominantes con IgG
o C3. Este tipo de glomerulonefritis están
relacionadas con la infección por Staphylococcus aureus meticilino
resistente o, con menos frecuencia, S. aureus meticilino sensible u otros
estafilococos. Algunos los pacientes afectados han tenido pruebas positivas de anticuerrpos
contra el citoplasma de neutrófilos ANCA
C (a proteinasa 3), ANCA perinuclear (a
mieloperoxidasa), o ambos o para otros antígenos celulares.
AMILOIDOSIS AA
La proteína amiloide A sérica es un reactante de
fase aguda que se produce principalmente en el hígado; sus niveles plasmáticos
puede aumentar desde aproximadamente 0.03 mg por decilitro a 100 a 200 mg por
decilitro en presencia de enfermedades inflamatorias.11
La amiloidosis AA sistémica es resultado de la deposición
de fibrillas de proteína amiloide A sérica en los tejidos.
La amiloidosis AA ocurre principalmente en pacientes
con trastornos inflamatorios crónicos (p. ej., artritis reumatoide, artritis idiopática juvenil o enfermedad
inflamatoria intestinal) o infecciones crónicas (por ejemplo, osteomielitis o
tuberculosis); en algunos pacientes, la causa no está identificada. En años
recientes, presumiblemente con tratamientos mejorados, algunos de estos
trastornos ahora se asocian con menos frecuencia con amiloidosis AA.12 Sin
embargo, parece haber habido un aumento con respecto a las pasadas una o dos
décadas en la fracción de pacientes con amiloidosis
AA que tienen infecciones crónicas de piel
u otro tejido blando relacionadas con el uso de drogas inyectables, causado
por lo que a menudo se conoce como “skin popping” o “muscling.”13-
"estallido de la piel" o "musculación". 13-15
En pacientes con amiloidosis AA, la afectación renal
es casi universal, por lo general resulta en una función renal reducida y proteinuria
que puede estar en el rango nefrótico. La hematuria microscópic puede estar
presente pero no es común.
Muchos pacientes presentan enfermedad renal crónica
avanzad que puede progresar rápidamente, durante un período de meses, hasta la
insuficiencia renal terminal.
Algunos pacientes tienen disfunción tubular proximal
o diabetes insípida nefrogénica. Hay muy raros informes de glomerulonefritis
pauciinmune en media luna, quizás relacionado con la ruptura de asas capilares
glomerulares debido al depósito de amiloide.
En casos de amiloidosis AA asociada con uso de drogas
inyectables, la heroína es la droga más
comúnmente implicada. Un tipo específico de heroína "alquitrán negro"
(“black tar”), es más probable que
cause amiloidosis AA que otros tipos.15
La mayoría de los pacientes que tienen amiloidosis AA asociada con el uso de
heroína tienen evidencia de infección por VHC; las infecciones por VIH y por
VHB son menos comunes.
Sobre la base de la historia de este paciente y la características
de su presentación, la causa más probable de insuficiencia renal grave es la
amiloidosis AA asociada al uso de heroína. Al establecer este diagnóstico, la
aspiración de la almohadilla de grasa abdominal puede ser útil para la
detección de amiloidosis sistémica. Sin embargo, en este paciente se justifica
una biopsia renal.
Aunque existe cierta preocupación con respecto a
riesgo elevado de sangrado asociado con biopsia renal en pacientes con
amiloidosis, la la elevación del riesgo no es significativa16.
ABSCESO CEREBRAL POR HONGOS
En este caso, el único cabo suelto es el concurrente
desarrollo de un absceso cerebral por hongos. La explicación más probable es que,
lamentablemente, el paciente adquiriera dos enfermedades relacionadas con la
inyección de drogas. Es probable que un hongo haya ganado la puerta de entrada
a través del uso de drogas inyectables y por vía hematógena se diseminó al
cerebro, causando un absceso. Este proceso probablemente se exacerbó en el
contexto de acidosis profunda y fracaso renal grave.
IMPRESIÓN CLÍNICA
Desarrollamos un diagnóstico diferencial de la causa
de la enfermedad renal en este paciente, que no tenía antecedentes de diabetes
mellitus o hipertensión y tenía los riñones levemente agrandados y albuminuria
de rango nefrótico. Este diagnóstico diferencial incluía nefropatía asociada al
VIH, glomerulonefritis relacionada con
infección mediada por inmunocomplejos, y enfermedad renal de tipo
infiltrativo, como linfoma, sarcoidosis o amiloidosis. Pensamos que la biopsia renal
era el siguiente paso diagnóstico apropiado.
DIAGNÓSTICO PRESUNTIVO
AMILOIDOSIS AA Y ABSCESO CEREBRAL POR HONGOS
RELACIONADA CON EL USO DE DROGAS
INYECTABLES.
DISCUSIÓN PATOLÓGICA
HALLAZGOS RENALES
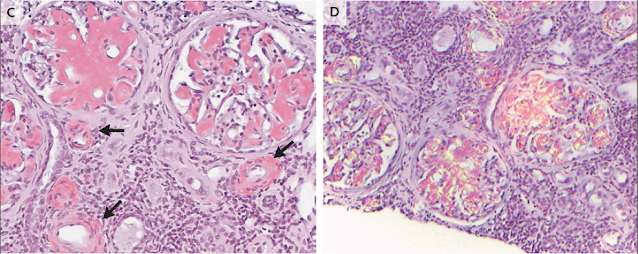
La porción del tejido renal que se envió para microscopía de luz constaba
de dos núcleos de corteza renal con 44 glomérulos, 1 de los cuales estaba
globalmente esclerosado y 41 de los cuales mostraban expansión mesangial global y segmentaria y
engrosamiento de la pared capilar con material eosinofílico amorfo pálido (Fig.
3). Las arteriolas mostraron depósito de material similar. El material amorfo
era también pálido en la tinción de ácido periódico-Schiff y fue muy positivo
en la tinción con rojo Congo, con birrefringencia verde manzana bajo luz
polarizada, un hallazgo consistente con amiloide. La tinción con rojo Congo
también reveló depósito de amiloide focal en el intersticio y, raramente, en
las membranas basales tubulares. No se identificaron cicatrices segmentarias,
semilunas, semilunas, necrosis o trombos.
Había fibrosis intersticial avanzada y atrofia
tubular, así como inflamación intersticial moderada, que se componía principalmente
de linfocitos con algunos eosinófilos y células plasmáticas y se localizaban
principalmente en áreas de cicatrización. Los túbulos mostraron evidencia de
lesión en forma de dilatación luminal,
pérdida del borde en cepillo, y aplanamiento de células epiteliales.
Estudios de inmunofluorescencia realizados en tejido
congelado reveló una fuerte tinción de extracelular material mesangial para
amiloide A y fue negativo para otros reactivos, incluida la IgG, inmunoglobulina
IgA, IgM, C3, C1q y cadenas ligeras kappa y lambda. También hubo focalmente tinción
positiva para amiloide A en vasos. La microscopía electrónica reveló una
extensa deposición de fibrillas no ramificadas dispuestas al azar en el
mesangio y a lo largo de la membrana basal
glomerular, con un diámetro medio (± DE) de fibrillas de 10,6 ± 1 nm,
una característica consistente con amiloide. La deposición de amiloide se
asoció con borramiento generalizado del pie del proceso podocitario. No se
identificaron depósitos electrón densos.
También había depósito focal de amiloide en membranas basales tubulares.
Figura 3. Muestra de biopsia renal.
En un estudio microscópico de luz (Panel A), casi
todos los glomérulos muestran afectación segmentaria o global por pálidos
amorfos material eosinofílico. El material amorfo también es pálido en la
tinción de ácido peryódico-Schiff (Panel B). Las arteriolas muestran afectación por material similar, que es
fuertemente congofílico en la tinción con rojo Congo (Panel C, flechas) y
muestra birrefringencia verde manzana bajo luz polarizada (Panel D), hallazgos
indicativos de amiloide. En estudios de inmunofluorescencia, el material es
positivo para amiloide A (Panel E) y negativo para otros reactivos (no
mostrado). El estudio de microscopíaelectrónica (Panel F) muestra una extensa
deposición de fibrillas no ramificadas dispuestas al azar (recuadro; diámetro medio
de las fibrillas, 10,6 nm), hallazgo compatible con amiloide.
Los hallazgos generales fueron consistentes con amiloidosis
AA con afectación extensa de glomérulos, así como intervención vascular y
tubulointersticial ocasional. Otras características histológicas incluyó lesión
tubular aguda y cambios crónicos avanzados del parénquima. El intersticio mostró
inflamación intersticial activa crónica, que no se asoció típicamente con
amiloide pero se ha informado en amiloidosis AA
y evaluación justificada para otras causas potenciales.
HALLAZGOS MICROBIOLÓGICOS
El examen
histológico de la lesión que afectaba a la cápsula interna izquierda reveló un
absceso cerebral con numerosas hifas fúngicas que se vieron fácilmente con tinción
con hematoxilina eosina (Fig. 4). Las hifas eran anchas, medían de 5 a 15 μm de
ancho, con ocasionales formas en forma de cinta, tabiques muy raros, y
ramificación predominantemente de gran angular. La tinción de Gomori, de metenamina de plata delineada débilmente las
hifas. La apariencia histológica de un moho hialino pauciseptado fue más
consistente con un organismo del orden mucorales, de qué especies de rhizopus
son las más comunes.18
Figura 4. Muestra de absceso cerebral.
La tinción con hematoxilina y eosina muestra un tejido
cerebral necrótico con abundantes neutrófilos e hifas fúngicas. Las hifas son
anchas con ramificaciones de gran ángulo y tabiques muy raros (puntas de
flecha).
No se observó crecimiento en cultivo de hongos. Posteriormente,
se envió tejido cerebral congelado a un laboratorio de referencia para
polimerasa específica de mucorales prueba de reacción en cadena (PCR), que
detectó ADN complejo de Rhizopus oryzae. Es de destacar que el organismo no se
detectó en ninguno de los dos embebidos en parafina o tejido cerebral congelado
cuando una amplia gama
Se realizó un ensayo de PCR fúngico, que destaca la
mayor sensibilidad de patógenos específicos
métodos de PCR anidados.
R. oryzae es un patógeno ambiental ubicuo que se
encuentra comúnmente en el suelo y en la fruta en descomposición. Crece
rápidamente in vivo, lo que resulta en infecciones agresivas asociadas con una
alta mortalidad.
La mayoría de los pacientes con mucormicosis tienen una
condición predisponente subyacente, como diabetes mal controlada, cáncer,
antecedentes de trasplante de órganos sólidos o drogas inyectables 19 Este
paciente tenía un factor de riesgo adicional, acidosis metabólica, que promueve
el crecimiento de R. oryzae aumentando la disponibilidad de hierro en el suero
y alteración de la función de los fagocitos.20,21
DISCUSIÓN DEL MANEJO
MANEJO DE LA ENFERMEDAD INFECCIOSA.
Cuando el diagnóstico de mucormicosis fue
considerado, recomendamos tratamiento con anfotericina B liposomal y control
acelerado de la fuente quirúrgica. Mientras se esperaban datos microbiológicos
adicionales, recomendamos continuación de la terapia antibacteriana empírica.
Las alternativas a la anfotericina B liposomal
incluyen isavuconazol, que en un estudio abierto se asoció con resultados
similares a los observados con anfotericina B.22 liposomal Sin embargo, el
fracaso del tratamiento con isavuconazol se ha descrito recientemente23. El
posaconazol es otra alternativa que se puede utilizar para terapia de salvataje
salvamento, aunque normalmente la usamos para el mantenimiento de la terapia
después del tratamiento con anfotericina B liposomal.
Después de que este paciente se sometió a un
desbridamiento quirúrgico y se hizo un diagnóstico definitivo de infección por
R. oryzae, fue tratado con anfotericina B liposomal durante 6 semanas. Su régimen fue
finalmente cambiado a posaconazol oral para terapia de mantenimiento
prolongada; la duración de este tratamiento será determinado por su progresión clínica.
MANEJO RENAL
Los resultados de la biopsia renal confirmaron el diagnóstico
de amiloidosis AA que era más probablemente
asociado con el uso de heroína. Sin embargo, los resultados no alteró el
manejo renal, porque no hay ninguna terapia específica para esta condición que
no sea el cese del uso de drogas inyectables. Para el manejo del absceso
cerebral relacionado con la mucormicosis, una infusión intravenosa de bicarbonato isotónico
fue administrado agresivamente para mantener una sangre nivel de bicarbonato en
el rango de 21 a 28 mmol por litro. Rhizopus prospera especialmente en un medio
ambiente ácido, 24 y por lo tanto nuestro objetivo era eliminar este factor de
riesgo.
La producción de orina del paciente se mantuvo
excelente y en 2 semanas, su nivel de creatinina en sangre disminuyó
gradualmente hasta un nadir de 6,5 mg por decilitro, sin necesidad de terapia
de reemplazo renal.
La mejora en la función renal probablemente fue debido
a la resolución de la lesión tubular aguda.
Sin embargo, durante las siguientes 4 semanas, tuvo
un aumento gradual de su azotemia y creatinina y el aclaramiento de creatinina fue de 8 ml por minuto. Su la elección de la terapia
de reemplazo renal fue la diálisis peritoneal; se colocó un catéter a los 2
meses y el tratamiento se inició a los 3 meses después la admisión actual. Durante
este tiempo, el paciente fue visto por nuestro equipo de consulta de adicciones
. Le ofrecieron metadona o suboxone, pero se negó. Ocho meses más tarde,
informó que no había consumido más sustancias, los déficits neurológicos se
habían resuelto por completo, y se sentía bien mientras recibía diálisis peritoneal
continua ambulatoria en su casa.
DIAGNOSTICO FINAL
AMILOIDOSIS AA COMPLICADA POR MUCORMICOSIS CEREBRAL.
Traducción de:
Case 11-2020: A
37-Year-Old Man with Facial Droop, Dysarthria, and Kidney Failure
Jeffrey S. Berns, M.D., Otto Rapalino, M.D., Andrew
Z. Fenves, M.D., Joseph B. El Khoury, M.D., Veronica E. Klepeis, M.D., Ph.D.,
and Melis N. Anahtar, M.D., Ph.D.
https://www.nejm.org/doi/10.1056/NEJMcpc1916252
Referencias
1. Emamian SA, Nielsen MB, Pedersen
JF, Ytte L.
Kidney dimensions at sonography:
correlation with
age, sex, and habitus
in 665 adult
volunteers. AJR Am J
Roentgenol 1993;
160: 83-6.
2. Cohen SD,
Kopp JB, Kimmel PL. Kidney
diseases
associated with human immunodeficiency
virus infection.
N Engl J
Med 2017; 377:
2363-74.
3. Pol S, Parlati
L, Jadoul M. Hepatitis C
virus and the
kidney. Nat Rev Nephrol
2019; 15: 73-86.
4. Kupin WL.
Viral-associated GN: hepatitis
B and other
viral infections. Clin J
Am Soc Nephrol
2017; 12: 1529-33.
5. Sethi S. The
changing spectrum of
heroin-associated
kidney disease. Clin J
Am Soc Nephrol 2018; 13: 975-6.
6. Marquez J, Aguirre L, Muñoz C, Echeverri
A, Restrepo M, Pinto LF. Cocainelevamisole-
induced
vasculitis/vasculopathy
syndrome. Curr
Rheumatol Rep 2017;
19: 36.
7. Dartevel A,
Chaigne B, Moachon L,
et al. Levamisole-induced vasculopathy: a
systematic
review. Semin Arthritis Rheum
2019; 48: 921-6.
8. Hutchison CA,
Harding S, Hewins P,
et al.
Quantitative assessment of serum
and urinary
polyclonal free light chains in
patients with
chronic kidney disease. Clin
J Am Soc Nephrol
2008; 3: 1684-90.
9. Francis JM,
Beck LH Jr, Salant DJ.
Membranous
nephropathy: a journey from
bench to
bedside. Am J Kidney Dis 2016;
68: 138-47.
10. Satoskar AA, Parikh SV, Nadasdy T.
Epidemiology,
pathogenesis, treatment
and outcomes of
infection-associated glomerulonephritis.
Nat Rev Nephrol
2020;
16: 32-50.
11. Sack GH Jr.
Serum amyloid A — a review.
Mol Med 2018;
24: 46.
12. Lane T,
Pinney JH, Gilbertson JA, et al.
Changing
epidemiology of AA amyloidosis:
clinical
observations over 25 years at a
single national
referral centre. Amyloid
2017; 24: 162-6.
13. Lejmi H, Jen
K-Y, Olson JL, James SH,
Sam R.
Characteristics of AA amyloidosis
patients in San
Francisco. Nephrology
(Carlton) 2016;
21: 308-13.
14. Harris M, Brathwaite
R, Scott J, et al.
Drawing
attention to a neglected injecting-
related harm: a
systematic review of
AA amyloidosis
among people who inject
drugs. Addiction
2018; 113: 1790-801.
15. Sharma A,
Govindan P, Toukatly M,
et al. Heroin
use is associated with AAtype
kidney
amyloidosis in the Pacific
Northwest. Clin
J Am Soc Nephrol 2018;
13: 1030-6.
16. Soares SM,
Fervenza FC, Lager DJ,
Gertz MA, Cosio
FG, Leung N. Bleeding
complications
after transcutaneous kidney
biopsy in
patients with systemic amyloidosis:
single-center
experience in 101
patients. Am J
Kidney Dis 2008; 52: 1079-83.
17. Verine J,
Mourad N, Desseaux K, et al.
Clinical and
histological characteristics
of renal AA
amyloidosis: a retrospective
study of 68
cases with a special interest
to
amyloid-associated inflammatory response.
Hum Pathol 2007;
38: 1798-809.
18. Jeong W,
Keighley C, Wolfe R, et al.
The epidemiology
and clinical manifestations
of mucormycosis:
a systematic review
and
meta-analysis of case reports.
Clin Microbiol
Infect 2019; 25: 26-34.
19. Roden MM,
Zaoutis TE, Buchanan
WL, et al.
Epidemiology and outcome of
zygomycosis: a
review of 929 reported
cases. Clin
Infect Dis 2005; 41: 634-53.
20. Artis WM,
Fountain JA, Delcher HK,
Jones HE. A
mechanism of susceptibility
to mucormycosis
in diabetic ketoacidosis:
transferrin and
iron availability. Diabetes
1982; 31:
1109-14.
21. Chinn RY,
Diamond RD. Generation
of chemotactic
factors by Rhizopus oryzae
in the presence
and absence of serum:
relationship to
hyphal damage mediated
by human
neutrophils and effects of hyperglycemia
and
ketoacidosis. Infect Immun
1982; 38:
1123-9.
22. Marty FM,
Ostrosky-Zeichner L, Cornely
OA, et al.
Isavuconazole treatment for
mucormycosis: a
single-arm open-label
trial and
case-control analysis. Lancet Infect
Dis 2016; 16:
828-37.
23. Bellanger
A-P, Berceanu A, Scherer E,
et al. Invasive
fungal disease, isavuconazole
treatment
failure, and death in acute
myeloid leukemia
patients. Emerg Infect
Dis 2019; 25:
1778-9.
24. Gebremariam
T, Lin L, Liu M, et al.
Bicarbonate
correction of ketoacidosis alters
host-pathogen
interactions and alleviates
mucormycosis. J
Clin Invest 2016;