Un hombre de 74 años fue evaluado en nefrología por enfermedad renal crónica.
El paciente se encontraba en su estado de salud
habitual cuando fue derivado a nefrología para una evaluación preoperatoria de
su enfermedad renal crónica, antes de un reemplazo valvular aórtico
transcatéter (TAVR) por estenosis aórtica. Dieciocho años antes de esta
evaluación, se había encontrado un nivel elevado de creatinina incidentalmente
durante una evaluación de fatiga, malestar y rigidez articular. El paciente fue
evaluado en nefrología y se realizó biopsia del riñón derecho (Fig. 1) que reveló
glomérulos con paredes capilares engrosadas e hipercelularidad mesangial leve.
Una tinción de plata de Jones mostró "picos" y "burbujas"
en la membrana basal glomerular, características típicas de la nefropatía
membranosa. El intersticio tenía un infiltrado de células mononucleares,
células plasmáticas y eosinófilos, con tubulitis y sin granulomas ni
neutrófilos. La inmunofluorescencia mostró tinción de depósitos granulares para
IgG y C3 a lo largo de la membrana basal glomerular y en el mesangio. Otras
tinciones (C1q, IgA, IgM, fibrinógeno y albúmina) fueron negativas. La
microscopía electrónica mostró depósitos subepiteliales amorfos diseminados a
lo largo de la membrana basal glomerular y en el mesangio, con picos circundantes
y borramiento de los procesos podocitarios. También se vio arteriosclerosis y
glomeruloesclerosis, que se interpretaron como nefropatía membranosa, nefritis
tubulointersticial aguda con eosinófilos y arterionefroesclerosis con glomeruloesclerosis
global.
Se le dijo al paciente que su enfermedad renal era
compatible con un diagnóstico de síndrome de Sjögren, y se administró
prednisona durante 6 meses y luego se fue bajando la dosis
Figura 1. Muestra de biopsia renal.
La tinción con hematoxilina y eosina (paneles A y B)
muestra glomérulos con paredes capilares engrosadas (panel A, flechas) e hipercelularidad
mesangial. Hay un infiltrado intersticial de eosinófilos (Panel B, flecha) y
células plasmáticas (Panel B, ovalado). La inmunofluorescencia (panel C)
muestra la tinción de depósitos granulares de IgG a lo largo de la pared
capilar glomerular (flechas) y en el mesangio (asterisco). La microscopía
electrónica de un glomérulo (Panel D) muestra depósitos subepiteliales amorfos
(flechas) con picos adyacentes en la membrana basal glomerular (puntas de
flecha) y en el mesangio (asterisco); Estos hallazgos son típicos de la
nefropatía membranosa.
Se inició tratamiento con bicarbonato de sodio y furosemida, al igual que el tratamiento con losartán, aunque losartán se interrumpió de forma intermitente debido a hiperpotasemia; se continuó con prednisona. Durante los siguientes 18 años, el nivel de creatinina aumentó gradualmente a 3,28 mg/dl.
Veinticinco años antes de la actual evaluación, el
paciente había recibido un diagnóstico de pancreatitis crónica complicada por
diabetes mellitus e insuficiencia pancreática exocrina. Un año después, se
produjo un agrandamiento indoloro de la glándula lagrimal derecha. La escisión
quirúrgica de la glándula lagrimal derecha que reveló una inflamación inespecífica.
Al año siguiente, desarrolló un agrandamiento de la glándula lagrimal izquierda
y las glándulas submandibulares y parótidas bilaterales.
Una resonancia magnética del cuello, realizada antes
y después de la administración de material de contraste intravenoso, reveló
anomalías en forma de masa de las glándulas submandibulares y parótidas
bilaterales. Las anomalías eran hipointensas en las imágenes ponderadas en T1 y
en T2. El paciente rechazó otra biopsia glandular y se le dijo que
probablemente se tratara de síndrome de
Sjogren. El agrandamiento glandular se resolvió y durante los siguientes 23
años, el paciente fue tratado con prednisona por presunto síndrome de Sjögren.
Dos años antes de la evaluación actual, desarrolló dificultad para respirar y presión
torácica subesternal con el esfuerzo; estos síntomas se resolvían después de
aproximadamente 20 minutos de descanso. El paciente fue evaluado en el otro
hospital y se le diagnosticó estenosis aórtica; cuatro meses antes de la
evaluación actual, la disnea y la presión torácica subesternal empeoraron, de
tal manera que el paciente no podía llevar sus provisiones a poca distancia de
su casa. Se obtuvieron estudios de imagen y cardiología adicionales.
La tomografía computarizada (TC) de corazón, tórax,
abdomen y pelvis, realizada antes y después de la administración de contraste
intravenoso, reveló múltiples aneurismas de gran tamaño que afectaban a todas
las arterias coronarias, con trombo mural asociado (fig.2A a 2D). Existía una
extensa calcificación de las arterias coronarias, junto con nódulos pulmonares diseminados
que medían hasta 4 mm de diámetro, múltiples ganglios linfáticos mediastinales
levemente agrandados y calcificación en la cola del páncreas.
La ecocardiografía mostró estenosis aórtica
tricúspide severa, con calcificación voluminosa de las hojas de la válvula aórtica
con movimiento restringido, así como una calcificación severa de la raíz
aórtica en la unión sinotubular. La angiografía coronaria reveló grandes
aneurismas con calcificación parcial que afectaban a todas las arterias
coronarias, específicamente, la coronaria izquierda distal, la descendente
anterior proximal y medial, la circunfleja proximal izquierda y la arterias
coronarias derecha media y proximal, con estrechamiento calcificado entre los
segmentos aneurismáticos (Fig. 2E a 2H). Las luces distales eran de calibre
normal y no se visualizaban bien debido al lento flujo a través de los
segmentos aneurismáticos proximales. Había enfermedad moderada y difusa en la
arteria circunfleja izquierda media.
Figura 2 Tomografía computarizada cardíaca y
angiografía coronaria.
Las imágenes de TC curvadas, multiplanares y
reformateadas de la arteria descendente anterior izquierda (panel A), la
arteria circunfleja izquierda (panel B) y la arteria coronaria derecha (panel
C) muestran aneurismas que afectan a todas las arterias coronarias, con trombo
mural (asteriscos blancos) adyacente a las arterias coronarias con contraste
(puntas de flecha blancas). Hay una extensa calcificación de las arterias
coronarias. Una imagen de tomografía computarizada tridimensional del corazón
(panel D) muestra aneurismas que afectan el tronco de la coronaria izquierda (punta de flecha negra), la arteria
descendente anterior izquierda (punta de flecha blanca), la arteria circunfleja
izquierda (flecha blanca) y arteria coronaria derecha (flecha negra), con la
luz realzada con contraste representada en rojo y el trombo mural adyacente
representado en amarillo. Las imágenes de angiografía coronaria de la arteria
coronaria izquierda obtenidas en la vista craneal oblicua anterior derecha
(paneles E y F) y en la vista caudal oblicua anterior derecha (panel G)
muestran aneurismas masivos que involucran el tronco de la coronaria izquierda
(puntas de flecha blancas), la descendente anterior izquierda proximal y medial (flechas blancas) y la arteria circunfleja
izquierda proximal (flechas negras), en comparación con los segmentos normales
de las arterias coronarias (puntas de flecha negras). La coronariografía de la
arteria coronaria derecha obtenida en la proyección craneal oblicua anterior
izquierda (Panel H) también muestra aneurismas en los segmentos proximales y
medios (punta de flecha blanca), en comparación con los segmentos normales de
la arteria coronaria (punta de flecha negra).
Se realizó una valvuloplastia aórtica con balón 3 meses antes de la evaluación actual y se planificó una TAVR posterior. Durante la evaluación actual, el paciente indicó que la disnea y la presión torácica de ejercicio habían disminuido desde la valvuloplastia aórtica con balón. Se obtuvo una historia adicional. El paciente tenía dolor crónico de espalda y cuello debido a cifoescoliosis severa, estenosis espinal y mielopatía cervical; el dolor había sido tratado 2 meses antes con discectomía cervical anterior y fusión. Tenía hipertensión, anemia, gota, osteopenia e hipertrofia prostática benigna. Los medicamentos incluyeron prednisona, metoprolol, aspirina, rosuvastatina, furosemida, insulina, bicarbonato de sodio, epoetina alfa, colecalciferol, calcitriol, pancrelipasa, alfuzosina, alopurinol y gaba-pentina. No se conocieron alergias a medicamentos. Había fumado 10 cigarrillos al día durante 6 años, pero lo había dejado cuatro décadas antes; bebía alcohol en raras ocasiones y no consumía drogas ilícitas. El paciente se había retirado de su carrera como profesional de la salud durante 2 años. Estaba casado y vivía en una casa en un área suburbana de Nueva Inglaterra. Su padre había tenido diabetes mellitus tipo 2 y había muerto de cáncer de próstata a los 67 años, su madre había tenido cáncer de páncreas y había fallecido a los 65 años, y su hermano menor había tenido diabetes mellitus tipo 2 y había fallecido después de un infarto de miocardio a los 46 años de edad. En el examen físico, la temperatura era de 36,1 ° C, la presión arterial de 176/75 mm Hg, la frecuencia cardíaca de 77 latidos por minuto y el índice de masa corporal 24,8. Hubo un soplo sistólico crescendo-decrescendo que se escuchaba mejor en el borde esternal superior derecho. El nivel de creatinina fue de 3,41 mg/dl, que fue similar a otros niveles obtenidos durante los últimos 1,5 años. El nivel de proteína urinaria fue de 149,6 mg por decilitro (rango de referencia, 0,0 a 13,5); la proporción de proteína total a creatinina fue de 2,23 (rango de referencia, menos de 0,15). Los resultados de las pruebas de función hepática fueron normales. En la Tabla 1 se muestran otros resultados de pruebas de laboratorio.
Tabla 1.
Análisis de laboratorio
Se realizó una prueba de diagnóstica.
DIAGNÓSTICO DIFERENCIAL
NEFROPATÍA MEMBRANOSA
La nefropatía membranosa es causada por la
acumulación gradual de depósitos inmunes en la cara subepitelial de la membrana
basal glomerular, lo que conduce a daño de los podocitos y proteinuria. La
nefropatía membranosa primaria, una enfermedad renal aislada que resulta de
autoanticuerpos dirigidos contra antígenos específicos de podocitos endógenos
en ausencia de una causa identificable, representa la mayoría de los casos.
Alternativamente, la nefropatía membranosa puede ser secundaria a una condición
predisponente, como una enfermedad autoinmune (p. Ej., Lupus eritematoso
sistémico), infección (p. Ej., Hepatitis B o sífilis), uso de medicamentos (p.
Ej., Uso de antiinflamatorios no esteroideos [AINE]) ), cáncer o trasplante
alogénico de células madre.1 El receptor de fosfolipasa A2 de tipo M (PLA2R) es
el antígeno diana en aproximadamente el 70% de los pacientes con nefropatía
membranosa primaria.2 El diagnóstico de nefropatía membranosa asociada a PLA2R
puede establecerse mediante la identificación de anticuerpos anti-PLA2R
circulantes o tinción positiva para PLA2R en una muestra de biopsia de riñón.
Sin embargo, la prueba de anticuerpos anti-PLA2R no estaba disponible hace 18
años, cuando este paciente recibió el diagnóstico de nefropatía membranosa.
Otras características patológicas pueden ayudar a diferenciar la nefropatía
membranosa primaria de la secundaria. En la nefropatía membranosa secundaria,
el antígeno diana es extrínseco al podocito y alcanza la membrana basal
glomerular a través de la circulación3. Esto a menudo da como resultado la
generación de depósitos subendoteliales y mesangiales, además de los depósitos
subepiteliales que son característicos de la nefropatía membranosa. Además, la
inmunoglobulina dominante en la nefropatía membranosa primaria es de la
subclase IgG4, mientras que las otras subclases de IgG predominan en la mayoría
de las causas de nefropatía membranosa secundaria4.La presencia de depósitos
mesangiales en este caso sugiere la posibilidad de nefropatía membranosa
secundaria. Además, la presencia de nefritis tubulointersticial concomitante
sugiere fuertemente un proceso de enfermedad diferente a la nefropatía
membranosa primaria.
NEFRITIS INTERSTICIAL
Además de mostrar evidencia de nefropatía
membranosa, se observó que la muestra de biopsia renal de este paciente tenía
un infiltrado intersticial que contenía eosinófilos, un hallazgo compatible con
nefritis tubulointersticial. La mayoría de los casos de nefritis
túbulo-intersticial son causados por el uso de un medicamento como
antibióticos, AINE, inhibidores de la bomba de protones o, como se describió
más recientemente, inhibidores del punto de control inmunológico.5,6 Otras
causas de nefritis túbulo-intersticiales son las sistémicas, enfermedad autoinmunitaria (p. ej., lupus
eritematoso sistémico, sarcoidosis o síndrome de Sjögren), infección (p. ej.,
infección por legionella o Mycobacterium tuberculosis) y nefritis
tubulointersticial y síndrome de uveítis.5 Pocas características patológicas
ayudan a identificar la causa de la nefritis intersticial. La identificación de
granulomas, que no estaban presentes en este caso, despertaría la sospecha de
sarcoidosis, pero los granulomas también pueden observarse con infección y
nefritis tubulointersticial inducida por fármacos. La presencia de eosinófilos es compatible con la nefritis
túbulo-intersticial inducida por fármacos, pero este hallazgo no es específico
para esta entidad. En casos raros, los AINE pueden causar la combinación de
nefritis intersticial y síndrome nefrótico, aunque en este contexto, la lesión
glomerular es causada clásicamente por enfermedad de cambios mínimos.7 Es
posible que el uso de AINE condujera a nefropatía tubulointersticial y nefropatía
membranosa en este paciente, y se le debe preguntar sobre cualquier uso previo
de AINE clínicamente significativo. El otro hallazgo inexplicado en la historia
de este paciente sin embargo, sugiere que su enfermedad renal es una
manifestación de una enfermedad autoinmune sistémica.
LUPUS ERITEMATOSO SISTÉMICO
Aproximadamente del 10 al 20% de los pacientes con
nefritis lúpica tienen nefropatía membranosa lúpica aislada (clase V), sin
lesiones proliferativas asociadas.8 La nefritis tubulointersticial a menudo
acompaña a las lesiones glomerulares en pacientes con nefritis lúpica y es un
factor de riesgo de mala evolución renal.9 A diferencia de los pacientes con
enfermedad proliferativa focal o nefritis lúpica proliferativa difusa, los
pacientes con nefropatía membranosa lúpica pura a menudo presentan niveles
normales de C3 y C4 y tienen pruebas negativas para anticuerpos anti-ADN
bicatenario.10 Sin embargo, existen otras características patológicas, además
de los hallazgos característicos de nefropatía membranosa, que sugieren un
diagnóstico de nefropatía membranosa lúpica. Estos incluyen un patrón de
"casa llena" (es decir, la presencia de depósitos glomerulares que se
tiñen para IgG, IgM, IgA, C3 y C1q) en la inmunofluorescencia, así como la
presencia de estructuras tubulorreticulares en células endoteliales en la microscopía
electrónica. .11 La aparente ausencia de estas características en el examen de
la muestra de biopsia renal, junto con el sexo del paciente y la ausencia de
características extrarrenales características, hacen que el diagnóstico de
lupus sea poco probable.
SÍNDROME DE SJÖGREN
Este paciente había recibido un diagnóstico de
enfermedad de Sjögren, que fue considerado como la causa de su enfermedad
renal. La nefritis intersticial es la manifestación renal más común del
síndrome de Sjögren y a menudo se asocia con acidosis tubular renal distal.12
La enfermedad glomerular en el síndrome de Sjögren es rara. Cuando ocurre, el
patrón más común de lesión es la glomerulonefritis mebrano proliferativa, que
es típicamente causada por la producción de una paraproteína kappa IgM
monoclonal con actividad de factor reumatoide que conduce a crioglobulinemia mixta
tipo II.13 Se ha descrito nefropatía membranosa en el contexto del síndrome de
Sjögren en casos raros.14 No está claro si estos casos reflejan la ocurrencia
simultánea de dos procesos de enfermedad distintos o muestran causalidad. Es de
destacar que la mayoría de los informes de casos de nefropatía membranosa
atribuida al síndrome de Sjögren se publicaron antes de la disponibilidad de
las pruebas de anticuerpos anti-PLA2R.12,15 La combinación de nefropatía
tubulointersticial y nefropatía membranosa sería una manifestación inusual del
síndrome de Sjögren. Además, la pancreatitis y los aneurismas de las arterias
coronarias no pueden atribuirse fácilmente a este diagnóstico. Estas
consideraciones deben impulsar la reevaluación del diagnóstico de síndrome de
Sjögren en este paciente. Los resultados de las pruebas de anticuerpos contra
los antígenos Ro (SSA) y La (SSB) no se proporcionan en la presentación del
caso y no se informan los síntomas de sicca. El diagnóstico de síndrome de Sjögren en
este paciente se basó en la inflamación de las glándulas lagrimales, parótidas
y submandibulares, una constelación de hallazgos compatibles con la enfermedad
de Mikulicz. En las últimas dos décadas, se ha hecho evidente que la mayoría de
los casos de enfermedad de Mikulicz son causados por una enfermedad
relacionada con IgG4 y no por el síndrome de Sjögren.
ENFERMEDAD RELACIONADA CON LA IGG4
La enfermedad relacionada con IgG4 es una enfermedad
sistémica fibroinflamatoria que se reconoció por primera vez como un factor
unificador de un proceso de enfermedad a principios de la década de 2000.
Muchas afecciones que antes se pensaba que eran entidades aisladas, incluida la
pancreatitis autoinmune tipo 1, la enfermedad de Mikulicz, la sialodenitis
esclerosante crónica (llamada tumor de Küttner cuando están involucradas las
glándulas submandibulares), la tiroiditis fibrosa (tiroiditis de Riedel) y
muchos casos de fibrosis retroperitoneal idiopática (enfermedad de Ormond), ahora se sabe que son manifestaciones de la
enfermedad relacionada con IgG4.17 Independientemente del órgano involucrado,
la enfermedad se caracteriza por dos características histopatológicas
dominantes: un infiltrado linfoplasmocítico con células plasmáticas IgG4 + y
fibrosis estoriforme18. La eosinofilia tisular y la flebitis obliterante
también son hallazgos comunes en algunos órganos. El nivel sérico de IgG4 está
elevado en la mayoría de los pacientes con enfermedad relacionada con IgG4.19
El riñón es único entre los órganos afectados por enfermedad relacionada con
IgG4 en que se asocia con dos patrones histológicos distintos de lesión.20 La manifestación
renal más común de la enfermedad relacionada con IgG4 es la nefritis
tubulointersticial, que a menudo se acompaña de hipocomplementemia y lesiones
nodulares hipodensas en la TC con contraste. Además de las características
patológicas distintivas de la enfermedad, a menudo se observan eosinofilia
tisular y depósitos en la membrana basal tubular.21 El segundo patrón de lesión
es la nefropatía membranosa relacionada con IgG4, que puede ocurrir sola o en
combinación con nefritis tubulointersticial relacionada con IgG4.22 Al igual
que con la nefropatía membranosa primaria, la inmunoglobulina dominante que se
encuentra en los depósitos inmunitarios es la IgG4. Sin embargo, la prueba de
anticuerpos anti-PLA2R es característicamente negativa en pacientes con
nefropatía membranosa relacionada con IgG4. Los resultados de la biopsia renal
de este paciente podrían ser compatibles con la enfermedad renal relacionada
con IgG4. La enfermedad relacionada con la IgG4 también unifica las otras
características inexplicables en este caso. La pancreatitis crónica del
paciente es probablemente el resultado de una pancreatitis autoinmune tipo 1
(relacionada con IgG4), que a menudo ocurre en hombres mayores y puede conducir
a insuficiencia pancreática endocrina y exocrina.23 La enfermedad relacionada
con IgG4 también puede causar vasculitis y formación de aneurismas. La
vasculitis de grandes vasos que afecta a la aorta torácica y abdominal es la
más común, pero también se ha descrito arteritis coronaria con formación de aneurisma
resultante24,25. Finalmente, aunque los nódulos pulmonares incidentales y la
linfadenopatía hiliar que se observan en la TC son inespecíficos, pueden
también pueden ser manifestaciones de enfermedad relacionada con IgG4.26 Un
nivel elevado de IgG4 en suero en este paciente sería de gran apoyo pero no
diagnóstico de enfermedad relacionada con IgG4. Se necesita la integración de
datos clínicos, de laboratorio e histopatológicos para establecer el
diagnóstico de manera confiable. Una biopsia de riñón, o un reexamen de las
muestras obtenidas previamente del riñón y la glándula lagrimal, si están
disponibles, confirmarían el diagnóstico.
IMPRESIÓN CLÍNICA
Comprender la causa subyacente de la enfermedad
renal crónica de este paciente era importante antes de la cirugía cardíaca,
porque cualquier cosa que se pueda hacer para estabilizar o incluso afectar la función
renal atenuará el riesgo de lesión renal aguda posoperatoria. Aunque el
síndrome de Sjögren se ha asociado con nefritis tubulointerstitial y, en casos
raros, con nefropatía membranosa, no pudo explicar la historia del paciente de
pancreatitis, agrandamiento glandular o aneurismas de las arterias coronarias.
En cambio, esta constelación de hallazgos sugirió fuertemente una enfermedad
relacionada con IgG4, un diagnóstico que podría impulsar otros enfoques de
tratamiento. Por lo tanto, cuando el paciente fue evaluado en la clínica de
nefrología, obtuvimos los niveles séricos de IgG4 y buscamos los especímenes
previamente obtenidos de riñón y glándula lagrimal para realizar la tinción de
células plasmáticas IgG4 +.
DIAGNÓSTICO
CLÍNICO
ENFERMEDAD RELACIONADA CON IGG4.
DISCUSIÓN PATOLÓGICA.
El nivel de IgG en suero fue de 2741 mg por
decilitro (rango de referencia, 614 a 1295). El nivel de IgG4 fue de 925,4 mg
por decilitro (rango de referencia, 3,9 a 86,4), un hallazgo que apoya
enormemente el diagnóstico de enfermedad relacionada con IgG4. A pedido, la muestra
de biopsia renal que se había obtenido 18 años antes se tiñó para IgG e IgG4
(figura 3). Las células plasmáticas IgG + eran predominantemente IgG4 +, con
más de 30 células IgG4 + por campo de gran aumento. Los depósitos en la
membrana basal glomerular fueron positivos para IgG4, al igual que los
depósitos a lo largo de la membrana basal tubular. Estos hallazgos son típicos
de la enfermedad relacionada con IgG4 que afecta al riñón.20 Aproximadamente el
8% de los pacientes con enfermedad relacionada con IgG4 que se someten a una
biopsia renal tienen nefropatía membranosa (40% de los cuales tienen depósitos
mesangiales) y 70 a 80% tienen depósitos a lo largo de la membrana basal
tubular.21,22
Figura 3. Muestra de biopsia de riñón.
La tinción inmunohistoquímica retrospectiva muestra
células plasmáticas dispersas que son IgG + (Panel A, ovalado). Un campo
similar muestra que la mayoría de las células plasmáticas en la misma área son
IgG4 + (Panel B, ovalado). Los depósitos granulares en la membrana basal
glomerular también son IgG4 + (Panel C, flechas). Depósitos granulares
similares están presentes focalmente en la membrana basal tubular (Panel D,
flechas)
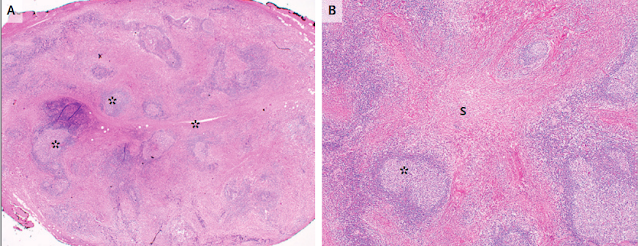
También se revisó el espécimen de glándula lagrimal que se había obtenido 24 años antes. La glándula lagrimal agotada medía 3,2 cm por 2,5 cm por 1,2 cm. El examen patológico del espécimen (Fig. 4) reveló un infiltrado difuso de células mononucleares, células plasmáticas y eosinófilos incrustados en fibrosis extensa con un patrón estoriforme. Los centros germinales estaban presentes, al igual que los restos dispersos de la glándula lagrimal. La tinción inmunohistoquímica mostró inmunoglobulina politípica en células plasmáticas, células B (CD20 +) y células T (CD3 + CD5 +). No hubo evidencia de cáncer. Las células plasmáticas IgG4 + prominentes estaban presentes y representaban más del 90% de las células plasmáticas IgG +. No hubo arteritis transmural ni flebitis obliterativa. En resumen, el reexamen de las muestras fue diagnóstico de enfermedad relacionada con IgG4 que afectaba al riñón y la glándula lagrimal.
Figura 4. Muestra de glándula lagrimal.
La tinción retrospectiva con hematoxilina y eosina
(paneles A a D) muestra una masa redondeada con numerosos centros germinales
(panel A, asteriscos) separados por fibrosis eosinofílica (panel B, asterisco)
en un patrón estoriforme ("S" ), o patrón tejido similar a una
estera. Hay infiltrados prominentes de eosinófilos (Panel C, flechas) y células
plasmáticas (Panel C, ovalado). En la masa inflamatoria pueden verse restos
esparcidos de glándula lagrimal (Panel D, flechas). La tinción
inmunohistoquímica retrospectiva (paneles E y F) muestra numerosas células
plasmáticas que son IgG + (panel E, ovalado). La mayoría de las células
plasmáticas en la misma área son IgG4 + (Panel F, ovalado
DISCUSIÓN DEL MANEJO
Dr. John H.
Stone: este caso ilustra varias características notables de la
enfermedad relacionada con IgG4. Primero, la enfermedad tiene la propensión a
afectar múltiples órganos. De hecho, la aparición de enfermedad relacionada con
IgG4 se ha descrito en prácticamente todos los órganos.17 Este caso muestra
manifestaciones clásicas de la enfermedad: pancreatitis autoinmune, afectación
de las glándulas lagrimales y salivales mayores (Mikulicz’s disease),
y la manifestaciones renales más
comunes,la nefritis tubulointersticial y la nefropatía membranosa.27 Los
aneurismas de arterias coronarias fueron sorprendentes en este caso y también
han sido descritos en enfermedad relacionada con IgG 4 pero mucho menos
frecuentemente que las otras manifestaciones. En nuestra cohorte de más de 400
pacientes con enfermedad relacionada con IgG4 en este hospital, hemos observado
aneurismas de las arterias coronarias en menos del 1% de los pacientes.
En segundo
lugar, la aparición de la enfermedad relacionada con IgG4 se produce en
diferentes momentos en diferentes órganos. Veinticinco años antes de la
presentación actual, la pancreatitis autoinmune anunció el inicio de la
enfermedad clínica de este paciente. Un año después de eso, la dacrioadenitis
se hizo evidente, lo que provocó la escisión de la glándula lagrimal, pero la
causa subyacente no se reconoció porque la enfermedad relacionada con IgG4 no
era una entidad descrita en ese momento. Durante el año siguiente, ocurrió un
agrandamiento de la glándula lagrimal contralateral y de las glándulas
parótidas y submandibulares bilaterales, pero estos hallazgos se atribuyeron a
un diagnóstico de síndrome de Sjögren. Siete años después de que comenzara la
pancreatitis autoinmune del paciente, se desarrolló una enfermedad renal y
comenzó a recibir tratamiento intensivo con glucocorticoides. Sin embargo, no
fue hasta su presentación en este hospital para una evaluación previa a la
TAVR, un cuarto de siglo después de la primera manifestación de su enfermedad,
que se identificó el diagnóstico unificador. El patrón de inicio de la
enfermedad y la progresión indolente en muchos órganos probablemente
contribuyeron al hecho de que la enfermedad relacionada con IgG4 no se reconoció
como una enfermedad multiorgánica única hasta 2003.28,29 El inicio preciso de
la arteritis coronaria de este paciente que llevó a la formación de aneurisma
no es conocido, pero con toda probabilidad, se había estado desarrollando
durante años. En tercer lugar, aunque la enfermedad relacionada con IgG4 tiene
una progresión de la enfermedad más indolente que la glomerulonefritis
rápidamente progresiva, con frecuencia causa daños clínicamente significativos
relacionados con la enfermedad. El páncreas y el árbol biliar a menudo son los
más afectados por la enfermedad relacionada con IgG4, y el caso de este
paciente no fue una excepción: su pancreatitis autoinmune relacionada con IgG4
resultó no solo en diabetes insulinodependiente sino también en insuficiencia
pancreática exocrina. La insuficiencia pancreática exocrina, que a menudo se
subestima como una forma importante de daño en la enfermedad relacionada con
IgG4, es la explicación más común de la dramática pérdida de peso que se puede
observar en pacientes con enfermedad relacionada con IgG427; los pacientes no
pueden absorber suficientes calorías y nutrientes debido a la ausencia de
enzimas pancreáticas. Los pacientes informan con frecuencia una pérdida de peso
de 18 kg (40 lb) o más.27 Además, la enfermedad renal de este paciente se había
acercado a la enfermedad en etapa terminal en el momento de esta evaluación, a
pesar de la administración de glucocorticoides. Los pacientes con nefropatía
relacionada con IgG4 a menudo tienen atrofia renal importante después de lo que
parece haber sido un tratamiento exitoso con glucocorticoides. El efecto
potencial completo de los aneurismas de las arterias coronarias en la
enfermedad relacionada con IgG4 no se conoce en la actualidad, porque esta
complicación se ha descrito solo en unos pocos casos, pero el riesgo de
trombosis por los aneurismas masivos que afectaban a todos los vasos coronarios
es probablemente alta en este paciente. Los glucocorticoides son la piedra
angular del tratamiento de la enfermedad relacionada con IgG4. Aunque los
glucocorticoides son inicialmente eficaces en la mayoría de los pacientes, la
tasa de recaída después de que se reduce o se suspende el curso es alta.30
Además, como en el caso de este paciente, la enfermedad puede progresar a pesar
del tratamiento de mantenimiento con glucocorticoides. Para mantener la función
renal, aumentar las posibilidades de un procedimiento TAVR exitoso y prevenir
más complicaciones de la enfermedad relacionada con IgG4, optamos por tratarlo
con rituximab. Un creciente cuerpo de evidencia sugiere que el agotamiento de
las células B es eficaz en la enfermedad relacionada con IgG4 debido a su
efecto directo sobre las células del linaje de linfocitos B y su efecto
indirecto sobre los linfocitos T citotóxicos CD4 +, que se cree que son
cruciales para fisiopatología de la enfermedad 31-35 El paciente tuvo una
respuesta al tratamiento con rituximab. Dos meses después del inicio de este
tratamiento, el nivel de IgG4 en suero disminuyó a 785,7 mg por decilitro. Se
inició tratamiento con rivaroxaban debido al trombo mural asociado a los
aneurismas de las arterias coronarias. La función renal del paciente se
mantiene estable y se encuentra a la espera de TAVR.
DIAGNÓSTICO FINAL
ENFERMEDAD RELACIONADA CON IGG4, CON NEFRITIS
TUBULOINTERSTICIAL, NEFROPATÍA MEMBRANOSA Y PSEUDOTUMOR INFLAMATORIO QUE AFECTA
LA GLÁNDULA LAGRIMAL.
Traducción de:
A 74-Year-Old
Man with Chronic Kidney Disease
Frank B.
Cortazar, M.D., Eugene P. Rhee, M.D., Sumit Gupta, M.B., B.S., Ph.D., Rahul Sakhuja,
M.D., M.P.P., John H. Stone, M.D., M.P.H., and Robert B. Colvin, M.D.
https://www.nejm.org/doi/full/10.1056/NEJMcpc2002415
References1. Couser WG. Primary membranous ne-phropathy. Clin
J Am Soc
Nephrol 2017;12: 983-97.2. Beck
LH Jr, Bonegio
RGB, Lambeau G, et al. M-type phospholipase A2 recep-tor
as target antigen in idiopathic mem-branous nephropathy. N Engl J Med 2009;361:
11-21.3. Glassock RJ. Human idiopathic
mem-branous nephropathy — a mystery solved? N Engl J Med 2009;361:81-3.4. Haas
M. IgG subclass
deposits in glomeruli
of lupus and
nonlupus mem-branous
nephropathies. Am J Kidney Dis 1994; 23: 358-64.5. Muriithi AK, Leung N, Valeri AM, et al.
Biopsy-proven acute interstitial nephritis, 1993-2011: a case series. Am J
Kidney Dis 2014; 64: 558-66.6. Cortazar
FB, Kibbelaar ZA, Glezerman IG, et al. Clinical features and outcomes of immune
checkpoint
inhibitor-associ-ated AKI: a multicenter study.
J Am Soc
Nephrol 2020; 31: 435-46.7. Warren GV, Korbet SM, Schwartz MM, Lewis EJ.
Minimal change glomerulopa-thy
associated with nonsteroidal
anti-inf lammatory drugs. Am
J Kidney Dis
1989; 13: 127-30.8. Huong DL,
Papo T, Beaufils H, et al. Renal involvement in systemic lupus ery-thematosus:
a study of 180 patients from a single center. Medicine
(Baltimore) 1999;78: 148-66.9. Yu F, Wu
L-H, Tan Y, et al. Tubuloin-terstitial lesions
of patients with
lupus nephritis classified
by the 2003
Interna-tional Society of
Nephrology and Renal
Pathology Society system. Kidney Int 2010;77: 820 -9.10.
Austin HA III,
Illei GG, Braun
MJ, Balow JE. Randomized,
controlled trial of prednisone,
cyclophosphamide, and cy-closporine in lupus membranous
nephrop-athy. J Am
Soc Nephrol 2009;20:901-11.11. Jennette JC, Iskandar SS, Dalldorf FG.
Pathologic differentiation between lupus and nonlupus membranous
glomerulopa-thy. Kidney Int 1983;24:377-85.12.
Maripuri S, Grande JP, Osborn TG, et al. Renal involvement
in primary Sjögren’s
syndrome: a clinicopathologic study. Clin J Am Soc Nephrol 2009;4: 1423-31.13.
Goules A, Masouridi S, Tzioufas AG, Ioannidis JP, Skopouli FN,
Moutsopoulos HM. Clinically significant
and biopsy-documented renal
involvement in primary Sjögren
syndrome. Medicine (Baltimore)
2000; 79: 241-9.14. Kidder D,
Rutherford E, Kipgen
D, Fleming S, Geddes C, Stewart
GA. Kidney biopsy findings in
primary Sjögren syn-drome. Nephrol Dial Transplant
2015;30:1363-9.15. Stefanidis I,
Giannopoulou M, Liako-poulos V, et al. A
case of membranous
nephropathy associated with Sjögren syn-drome, polymyositis
and autoimmune hepatitis.
Clin Nephrol 2008;70:
245-50.16. Himi T,
Takano K, Yamamoto
M, Naishiro Y,
Takahashi H. A
novel con-cept of Mikulicz’s
disease as IgG4-related disease.
Auris Nasus Larynx
2012;39:9 -17.17. Stone JH, Zen
Y, Deshpande V. IgG4-related disease. N
Engl J Med
2012;366:539-51.18. Kamisawa T,
Zen Y, Pillai S, Stone JH. IgG4-related
disease. Lancet 2015;385:
1460-71.19. Wallace ZS, Deshpande
V, Mattoo H, et al. IgG4-related
disease: clinical and
laboratory features in one hundred twenty-five patients.
Arthritis Rheumatol 2015;67:
2466 -75.20. Cortazar FB,
Stone JH. IgG4-related
disease and the kidney. Nat Rev Nephrol 2015; 11: 599-609.21. Raissian Y, Nasr SH, Larsen CP, et al.
Diagnosis of IgG4-related tubulointersti-tial nephritis. J Am Soc Nephrol 2011;22:1343-52.22. Alexander MP, Larsen CP, Gibson IW, et al.
Membranous glomerulonephritis is a
manifestation of IgG4-related
disease. Kidney Int
2013; 83: 455-62.23. Hart PA,
Kamisawa T, Brugge
WR, et al. Long-term outcomes of
autoimmune pancreatitis: a multicentre, international analysis. Gut
2013; 62: 1771-6.24. Stone JR.
Aortitis, periaortitis, and
retroperitoneal fibrosis, as manifestations of IgG4-related
systemic disease. Curr
Opin Rheumatol 2011; 23: 88-94.25. Keraliya
AR, Murphy DJ,
Aghayev A, Steigner
ML. IgG4-related disease
with coronary arteritis. Circ
Cardiovasc Imag-ing 2016; 9(3):
e004583.26. Zen Y, Inoue D, Kitao A, et al. IgG4-related lung and pleural
disease: a clinico-pathologic study of
21 cases. Am
J Surg Pathol
2009; 33: 1886-93.27. Zhang W,
Stone JH. Management
of IgG4-related disease.
Lancet Rheumatol
2019; 1(1): e55-e65.28.
Kamisawa T, Funata
N, Hayashi Y, et
al. A new
clinicopathological entity of IgG4-related autoimmune disease. J
Gas-troenterol 2003; 38: 982-4.29. Kamisawa
T, Egawa N,
Nakajima H. Autoimmune
pancreatitis is a
systemic autoimmune disease. Am J
Gastroenterol 2003; 98: 2811-2.30.
Khosroshahi A, Wallace ZS, Crowe JL, et
al. International consensus
guidance statement on the
management and treat-ment of IgG4-related
disease. Arthritis Rheumatol
2015; 67: 1688-99.31. Carruthers MN, Topazian MD, Khos-roshahi A,
et al. Rituximab
for IgG4- related disease: a prospective, open-label
trial. Ann Rheum Dis 2015;74:
1171-7.32. Ebbo M, Grados A, Samson M, et al. Long-term efficacy
and safety of
ritux-imab in IgG4-related
disease: data from a
French nationwide study of thirty-three patients. PLoS
One 2017;12(9):e0183844.33. Perugino CA,
Mattoo H, Mahajan VS, et al. Emerging
treatment models in rheu-matology:
IgG4-related disease: insights
into human immunology
and targeted therapies.
Arthritis Rheumatol 2017;69:
1722-32.34. Maehara T, Mattoo H, Ohta M, et al. Lesional CD4+
IFN-γ+ cytotoxic
T lym-phocytes in
IgG4-related dacryoadenitis and
sialoadenitis. Ann Rheum
Dis 2017;76: 377-85.35. Mattoo
H, Mahajan VS,
Maehara T, et al. Clonal expansion of CD4(+) cytotoxic
T lymphocytes in patients with
IgG4- related disease.
J Allergy Clin
Immunol 2016; 138: 825-38.