Un hombre de 29 años ingresó en este hospital debido
a dolor de cabeza, vómitos y diplopía.
El paciente había estado bien hasta 3 semanas antes
del ingreso, cuando se desarrollaron dolores de cabeza, visión borrosa, náuseas
y vómitos, seguidos de anorexia y pérdida de peso (7,3 kg). Según los informes,
la evaluación en un centro de salud para estudiantes, incluida la tomografía
computarizada (TC) del cerebro, no reveló anomalías. Tres días antes del
ingreso, desarrolló fotofobia, diplopía, rigidez en el cuello, temblor de la
mano izquierda y somnolencia. El día de la admisión, el paciente quedó mudo.
Ese mismo día, se realizó una resonancia magnética (IRM) del cerebro y la
columna cervical en otro hospital después de la administración de gadolinio, y
una imagen ponderada por difusión mostró hiperintensidad en la corteza a lo
largo de la región frontoparietal izquierda, así como realce leptomeníngeo (más
prominente a lo largo de la cisterna basal, protuberancias y cerebelo). Fue
trasladado a este hospital.
La historia del paciente se obtuvo de su hermana.
Dos meses antes de la admisión, se había caído mientras practicaba snowboard y
posiblemente se había golpeado la cabeza. Había tenido una cirugía a los 11
años de edad por disfunción de la trompa de Eustaquio. Había nacido en un campo
de refugiados en el sudeste asiático y posiblemente recibió la vacuna con
bacilo Calmette – Guérin; emigró al noroeste de los Estados Unidos a los 5 años
de edad. Había viajado a Texas y Medio Oriente para el servicio militar más de
10 años antes de la admisión y a Texas 3 semanas antes de la admisión. Sus
medicamentos eran analgésicos no especificados para los dolores de cabeza y
supositorios para los vómitos. No tenía alergias conocidas. Era estudiante y
vivía con un compañero de cuarto. De vez en cuando bebía alcohol y no fumaba ni
usaba drogas ilícitas. Mientras su madre estaba en un campo de refugiados, tuvo
una enfermedad prolongada que requirió múltiples medicamentos; sus hermanas
estaban sanas y no había antecedentes familiares de enfermedades autoinmunes o
cáncer.
En el examen, los signos vitales del paciente eran
normales. Estaba somnoliento pero respondía a estímulos verbales. El cuello
estaba rígido. No hablaba pero podía escribir su nombre y ubicación actual y
seguir comandos simples. Las pupilas eran iguales, redondas y reactivas a la
luz (de 4 a 2 mm), sin un defecto pupilar aferente relativo, y no había defecto
del campo visual. No podía abducir completamente el ojo derecho con la mirada
lateral derecha extrema. Había una leve debilidad facial inferior en el lado
derecho. Levantaba sus extremidades contra la gravedad. El resto de los exámenes
neurológicos y generales fue normal. El hematocrito, el nivel de hemoglobina,
el recuento de plaquetas, el tiempo de protrombina, la velocidad de
sedimentación globular y los resultados de las pruebas de función renal fueron
normales, al igual que los niveles sanguíneos de potasio, calcio, fósforo,
magnesio, albúmina, globulina, fosfatasa alcalina, bilirrubina total y directa.
y proteína C reactiva. La prueba de anticuerpos contra el virus de la
inmunodeficiencia humana (VIH) fue negativa; otros resultados de la prueba se
muestran en la Tabla 1. Una radiografía de tórax era normal. Un
electrocardiograma mostró ritmo sinusal a una frecuencia de 64 latidos por
minuto y elevaciones del segmento ST en las derivaciones inferiores que no se
consideraban clínicamente significativas.



TABLA 1
Datos de laboratorio.
Se administró lorazepam y resultó en alguna mejora
en el habla; se añadió levetiracetam. Se realizó una punción lumbar; los
resultados se muestran en la Tabla 1. El paciente ingresó en la unidad de
cuidados intensivos neurológicos. Tres conjuntos de hemocultivos eran estériles
y tres cultivos de micobacterias de muestras de esputo inducido fueron
negativos; En un cultivo de esputo desarrollaron levaduras. Se administraron
dexametasona, etambutol, isoniazida, rifampicina, pirazinamida, piridoxina,
vancomicina, ceftriaxona, aciclovir, dalteparina, insulina en una escala móvil
y un ciclo de ivermectina de 2 días.
Se realizó una resonancia magnética del cerebro
después de la administración de material de contraste (Figura 1). Las imágenes
ponderadas en T1 muestran un realce leptomeníngeo difuso que es más pronunciado
en la región frontal izquierda y las cisternas basales. Hay un foco de difusión
restringida en el giro precentral izquierdo, hallazgo consistente con la isquemia. Los
resultados de la angiografía por resonancia magnética fueron normales. Las
imágenes de las órbitas de cortes finos, realzadas con gadolinio, obtenidas el
día 4, muestran un realce leptomeníngeo que rodea los nervios ópticos, que
parecen normales en las imágenes ponderadas en T2.
FIGURA 1
Imágenes de resonancia magnética del cerebro
obtenidas en la primera admisión.
Las imágenes sagitales potenciadas potenciadas en T1 (panel A) y axiales (paneles
B, C y D) muestran un realce leptomeníngeo difuso que es más pronunciado en la
región frontal izquierda y las cisternas basales. Una imagen de recuperación de
inversión atenuada por líquido (FLAIR) (Panel E) y una imagen ponderada por
difusión (Panel F) muestran una lesión hiperintensa (flechas) en el giro
precentral izquierdo que es consistente con un foco isquémico subagudo.
El día 2, un electroencefalograma mostró una
disminución generalizada intermitente del fondo, sin actividad epileptiforme.
El examen oftalmológico reveló márgenes borrosos del disco óptico, parálisis
del VI par bilateral y disminución de la agudeza visual (20/800 en cada ojo).
El día 3, se suspendieron la ceftriaxona y el aciclovir, y se inició la
administración de metronidazol y ceftazidima. La anfotericina B liposómica se
administró porun período corto y se detuvo debido a una erupción cutánea. Una
prueba cutánea de tuberculina y un ensayo de liberación de interferón-γ (prueba
QuantiFERON-TB Gold) fueron negativos. La miringotomía se realizó por otitis
media serosa del lado derecho; Los cultivos del aspirado fueron estériles. Se
realizó repitió la punción lumbar. El examen citológico del líquido
cefalorraquídeo (LCR) no reveló células malignas, y la citometría de flujo no
mostró poblaciones anormales de linfocitos; otros resultados de la prueba se
muestran en la Tabla 1.
El día 7, se realizó una craniectomía y biopsias de
las meninges frontales derechas y el cerebro y se colocó un drenaje ventricular
externo. El examen patológico de las muestras reveló fibrosis leptomeníngea y
gliosis reactiva en la corteza. Los cultivos de tejido cerebral y LCR fueron
estériles. Una prueba para anticuerpos antinucleares fue positiva a diluciones
1:40 y 1: 160, con un patrón moteado; una prueba de anticuerpos de superficie
de hepatitis B también fue positiva, y las pruebas de anticuerpos de virus de
hepatitis C, antígeno de superficie de hepatitis B y anticuerpos contra ADN
bicatenario, Ro, La, Sm y RNP fueron negativos. Los niveles de IgG (total y
subtipos) fueron normales.
Durante las siguientes 3 semanas, persistieron dolor
de cabeza, náuseas, vómitos y disminución del apetito; se desarrollaron
temblores posturales e intencionales y alucinaciones visuales; y fiebre de bajo grado ocurrió
intermitentemente. Se suspendieron el etambutol y la ceftazidima, y se inició
la administración de moxifloxacina, aztreonam y trimetoprima-sulfametoxazol. El
día 24, se colocó una derivación ventriculoperitoneal y se retiró el drenaje
ventricular externo. Los niveles sanguíneos de lactato deshidrogenasa y
haptoglobina fueron normales; otros resultados de la prueba se muestran en la
Tabla 1. Tres días después, las parálisis de diplopía y las parálisis del VI
par se habían resuelto, la agudeza visual había mejorado (20/40 en el ojo
derecho y 20/30 en el ojo izquierdo), y los discos ópticos estaban planos.
Vancomicina y aztreonam fueron descontinuados.
El día 34, el paciente fue dado de alta a un centro
de rehabilitación. Sus medicamentos incluían rifampicina, isoniazida,
pirazinamida, moxifloxacina, piridoxina, trimetoprima-sulfametoxazol, un curso
cónico de 3 semanas de dexametasona, trazodona, omeprazol y ondansetrón.
Durante las siguientes 2.5 semanas, estuvo caminando e interactuando, con menos
náuseas y mejoría en la ingesta oral. Veinte días después del alta de este
hospital, los dolores de cabeza y los temblores empeoraron y caminó menos. Dos
días después, lo llevaron a la clínica de neurología; En el examen, estaba
alerta y orientado, con disminución de la producción del habla y problemas de
atención y repetición (la incapacidad de repetir el habla de los demás). Hubo
una deriva sutil del pronador en la mano derecha, temblores posturales e
intencionales moderados bilateralmente, y una postura y zancada de base
estrecha, con inestabilidad e inclinación hacia el lado izquierdo. Los signos
vitales, el examen funduscópico y el resto de los exámenes neurológicos y generales
fueron normales.
La TC de la cabeza, realizada sin la administración de
material de contraste, reveló una masa de 3,6 cm en el lóbulo frontal inferior
izquierdo con márgenes irregulares y necrosis central. Las imágenes potenciadas
en gadolinio y ponderadas en T1 que se obtuvieron el mismo día muestran un
realce periférico de la masa (Figura 2). Hay focos de susceptibilidad en la
masa, una característica consistente con hemorragia, neovascularización o
ambas. También hay difusión restringida en el borde de la masa. Las imágenes
ponderadas en T2 muestran una cantidad moderada de edema asociado. Existe un
realce leptomeníngeo difuso persistente.
FIGURA 2
Imágenes de resonancia magnética del cerebro
obtenidas en la segunda admisión.
Hay una masa de 3.6 cm en el lóbulo frontal inferior
izquierdo. Las imágenes axiales (Panel A), coronal (Panel B) y sagital (Panel
C) potenciadas con T1 potenciadas con gadolinio muestran que la masa tiene un
realce de borde grueso e irregular. Una imagen ponderada por difusión (Panel D)
muestra difusión restringida en el borde. Una imagen de eco de gradiente (Panel
E) muestra focos de susceptibilidad, una característica consistente con
hemorragia, neovascularización o ambas.
Una imagen FLAIR (Panel F) muestra una cantidad moderada de edema asociado.
El paciente fue readmitido en este hospital y se
realizó un procedimiento de diagnóstico.
DIAGNÓSTICO DIFERENCIAL
El diagnóstico sindrómico en este caso es meningitis
crónica.
MENINGITIS CRÓNICA
Este diagnóstico está respaldado por la evolución y
persistencia de los síntomas durante un período de semanas, pleocitosis y un
nivel elevado de proteínas en el LCR, y la prominencia de dolor de cabeza,
rigidez en el cuello, fotofobia, náuseas, vómitos y somnolencia. La disminución
de la agudeza visual, el papiledema, la diplopía, el temblor y la somnolencia
podrían explicarse por un aumento de la presión intracraneal sin afectación
directa del parénquima, una causa respaldada por los hallazgos en la resonancia
magnética. El pequeño infarto en el lóbulo frontal izquierdo podría explicarse
por una vasculopatía en un paciente con meningitis en la base del cerebro.
La meningitis crónica difiere de manera importante
de la meningitis aguda. Los síntomas de la meningitis crónica suelen ser más
leves, y los pacientes con menos frecuencia presentan un síndrome de meningitis
completo. Con el tiempo, sin embargo, pueden acumularse déficits neurológicos
focales y difusos. Los casos que involucran meningitis prominente en la base
del cerebro pueden ser particularmente graves, con parálisis de nervios
craneales, vasculopatía en el círculo de Willis y obstrucción del flujo de
salida del LCR que conduce a hidrocefalia. Estas meningitis crónicas graves
pueden ir acompañadas de radiculopatías multifocales asimétricas, el síndrome
de la cola de caballo o ambos. El diagnóstico diferencial de la meningitis
crónica es extremadamente amplio e incluye causas infecciosas y no infecciosas.
CAUSAS INFECCIOSAS DE MENINGITIS CRÓNICA
Las causas infecciosas de meningitis crónica tienden
a ser difíciles de diagnosticar, porque los organismos causantes son
frecuentemente indolentes, fastidiosos o secuestrados en granulomas o exudados
unidos a las meninges, o tienen una combinación de estos rasgos. Factores del
huésped como el inmunocompromiso y el historial de viajes e inmigración son
fundamentales para el diagnóstico diferencial de causas infecciosas.
Históricamente, la causa infecciosa más común de meningitis crónica en series
de casos ha sido Mycobacterium tuberculosis.1 Otros organismos que causan
meningitis crónica son Borrelia burgdorferi, Treponema pallidum y Ehrlichia
chaffeensis. Las bacterias piógenas rara vez causan meningitis crónica, pero
pueden hacerlo en personas con foco parameníngeo, endocarditis o meningitis
bacteriana aguda parcialmente tratada.
El VIH es la causa viral más común de meningitis
crónica, pero la meningitis relacionada con el VIH rara vez es sintomática2,3.
Los organismos fúngicos son una causa típica de meningitis crónica en personas
inmunocomprometidas. Sin embargo, varios hongos, especialmente el criptococo,
pueden causar meningitis en huéspedes aparentemente normales. Los otros hongos
dimórficos que frecuentemente causan meningitis son los coccidioides,
blastomyces e histoplasma. Candida es típicamente una causa oportunista de
meningitis. La cisticercosis debida a la infección por Taenia solium es la
causa parasitaria más importante de meningitis crónica; sin embargo, la
meningitis generalmente ocurre en personas con quistes cisticercal
subaracnoideos preexistentes.
CAUSAS NO INFECCIOSAS DE MENINGITIS CRÓNICA
Existe una extensa lista de causas no infecciosas de
meningitis crónica. Varias formas de vasculitis se asocian con meningitis
crónica, incluida la vasculitis primaria del sistema nervioso central, el
síndrome de Churg-Strauss, la granulomatosis con poliangitis (antes conocida
como granulomatosis de Wegener) y el síndrome de Cogan. Las enfermedades del
tejido conectivo asociadas con la meningitis incluyen lupus eritematoso
sistémico, artritis reumatoide y síndrome de Sjögren. Varios otros procesos
inflamatorios sistémicos se han asociado con meningitis crónica, la más
importante de las cuales es la neurosarcoidosis. La irritación química puede
causar meningitis crónica en personas que tienen un quiste dermoide con liberación
intermitente de cristales de colesterol, en quienes se han sometido a una
craneotomía y en quienes han recibido tratamiento con inmunoglobulina
intravenosa o trimetoprima-sulfametoxazol. Finalmente, las neoplasias, más
comúnmente carcinoma de mama, carcinoma de pulmón, melanoma y leucemia, son
causas relativamente frecuentes de meningitis crónica.
PISTAS PARA EL DIAGNÓSTICO EN ESTE CASO
En este caso, varias pistas reducen el diagnóstico
diferencial. Primero, el síndrome está dominado por síntomas meningíticos con
poca afectación parenquimatosa primaria o sistémica. El paciente presentaba una
forma subaguda grave de meningitis manifestada por parálisis de nervio craneal,
aumento de la presión intracraneal y un infarto que posiblemente se deba a
vasculopatía. El examen del perfil del LCR revela un alto nivel de proteína, un
bajo nivel de glucosa (hipoglucorraquia) y solo pleocitosis mononuclear
moderada. Por lo tanto, podemos limitar el diagnóstico diferencial a entidades
que causan meningitis crónica grave. Las posibles causas infecciosas son la
tuberculosis, los hongos y los parásitos, y las posibles causas no infecciosas
son la paquimeningitis hipertrófica, las neoplasias, la vasculitis primaria del
sistema nervioso central y la vasculitis asociada a anticuerpos anticitoplasma
de neutrófilos. Aunque existe un extenso diagnóstico diferencial de las causas
de hipoglucorraquia, las causas infecciosas más prominentes son las bacterias
piógenas, la tuberculosis y los hongos, y las causas no infecciosas más importantes
son las neoplasias, la sarcoidosis y la sangre subaracnoidea; Las bacterias y
neoplasias piógenas tienden a causar los niveles más bajos de glucosa. Por lo
tanto, el diagnóstico diferencial se reduce aún más a entidades que causan
meningitis crónica grave y niveles bajos de glucosa en LCR; Estos son
tuberculosis, hongos y neoplasias.
Hay evidencia en apoyo de un diagnóstico de
meningitis tuberculosa en este caso. El paciente nació en un área donde la
tuberculosis es endémica y posiblemente fue expuesta a ella por su madre. Otra
evidencia incluye la aparición subaguda de síntomas, el perfil típico de LCR,
el accidente cerebrovascular que ocurrió temprano en el curso de la enfermedad
y la mejora aparente de los síntomas con el tratamiento antituberculoso, con la
advertencia de que también se administraron glucocorticoides y se realizó la
derivación del LCR. Los argumentos en contra de un diagnóstico de meningitis
tuberculosa en este caso incluyen la prueba cutánea de tuberculina negativa y
el ensayo de liberación de interferón-γ, la radiografía de tórax normal, la
pleocitosis moderada, la tinción y cultivo negativos para ácido-alcohol
resistentes en LCR, y las tinciones y el cultivo negativos de las muestras de
biopsia meníngea. Las punciones lumbares de alto volumen en serie pueden ser
útiles para establecer el diagnóstico de meningitis tuberculosa, pero incluso
con múltiples muestras y procesamiento inmediato, las pruebas de LCR tienen una
sensibilidad de solo el 80% .4 En este paciente, las punciones lumbares se realizaron
en el departamento de emergencias y en los días hospitalarios 1, 3 y 5, pero no
arrojaron un diagnóstico.
La meningitis criptocócica y la meningitis coccidioidomicóticas
son otras consideraciones importantes. El perfil del LCR del paciente y el
aumento de la presión intracraneal son típicos de cada infección. Sin embargo,
el paciente no tenía fiebre ni inmunocompromiso aparente, características que
también son típicas de estas infecciones. El accidente cerebrovascular debido a
la vasculopatía es característico de la meningitis coccidioidal, pero no de la
meningitis criptocócica. Además, los coccidioides son endémicos en partes del
suroeste de los Estados Unidos, incluido Texas, donde este paciente había
visitado. Es importante tener en cuenta que la prueba de LCR para el antígeno
criptocócico es altamente sensible y fue negativa en este paciente.
El diagnóstico de meningitis neoplásica en este
paciente está respaldado por la ausencia de fiebre, la aparición subaguda de
síntomas y el bajo nivel de glucosa en LCR. La combinación inusual de un alto
nivel de proteína en LCR y una pleocitosis relativamente moderada es
característica de la meningitis neoplásica. Un argumento en contra del
diagnóstico de meningitis neoplásica en este paciente es la ausencia de
síntomas sistémicos y signos de una enfermedad maligna; no hay lesiones masivas
parenquimatosas para dar pistas. Los pacientes con meningitis neoplásica no
suelen presentar accidente cerebrovascular, aunque no es imposible. Los
resultados de las pruebas citológicas y la citometría de flujo del LCR y el
examen de las muestras de biopsia meníngea fueron normales, pero estas pruebas
solo tienen una sensibilidad moderada para afecciones malignas6,7.
RESUMEN
La mejoría clínica inicial del paciente podría
atribuirse a una respuesta específica al tratamiento antituberculoso, pero fue
más probable una respuesta inespecífica a la derivación del LCR y los
glucocorticoides. El desarrollo posterior de signos focales y una lesión en
masa podría representar una reacción paradójica al tratamiento antituberculoso
apropiado o la evolución de una lesión en masa neoplásica. Basado en gran
medida en los datos demográficos del paciente y las muestras normales de
biopsia meníngea y cerebral, mi diagnóstico fue meningitis tuberculosa con una
respuesta paradójica al tratamiento antimicobacteriano. Sin embargo, fue
necesaria una biopsia y una posible resección de la lesión en masa para
establecer un diagnóstico definitivo y determinar un tratamiento adicional.
DIAGNÓSTICO PRESUNTIVO
MENINGITIS TUBERCULOSA CON RESPUESTA PARADÓJICA AL
TRATAMIENTO ANTIMICOBACTERIANO.
DISCUSIÓN PATOLÓGICA
La muestra de biopsia inicial del lóbulo frontal
derecho mostró solo fibrosis en las leptomeninges y gliosis reactiva en la
corteza. El procedimiento de diagnóstico en el segundo ingreso fue una
craneotomía frontal derecha, y la intención original era realizar una biopsia y
una posible escisión de la masa en el lóbulo frontal izquierdo. Sin embargo, al
abrir la duramadre, se observó material gelatinoso cubriendo el cerebro y
exudando desde la incisión. Un examen intraoperatorio de sección congelada de
este material reveló una neoplasia maligna de células pequeñas; el diagnóstico
diferencial incluyó linfoma y otras neoplasias de células pequeñas, como el
glioma. No se realizó biopsia ni resección de la lesión en masa, hasta la
clasificación final del tumor. Se obtuvieron muestras adicionales del material
gelatinoso para secciones permanentes.
El examen de secciones permanentes reveló una
neoplasia marcadamente celular en las leptomeninges, que consiste en células
pequeñas y poco diferenciadas (Figura 3A), y gliosis reactiva en la corteza
cerebral adyacente. La tinción inmunohistoquímica de las células tumorales
reveló proteína ácida fibrilar glial (Figura 3B) pero no marcadores de
sinaptofisina o linfocitos (Figura 3C). La neoplasia presentaba proliferación
microvascular y necrosis. Los hallazgos fueron diagnósticos de glioblastoma,
grado IV de IV de la Organización Mundial de la Salud (OMS), y fueron
consistentes con la variante de células pequeñas del glioblastoma. La
amplificación del gen que codifica el receptor del factor de crecimiento
epidérmico (EGFR) es común en los glioblastomas de células pequeñas, 8 y los
glioblastomas con amplificación de EGFR pueden experimentar un rápido crecimiento
entre los exámenes de neuroimagen. 9 Por lo tanto, la hibridación fluorescente
in situ se realizó en este paciente para evaluar el número de copias del gen de
EGFR; La amplificación genética no estaba presente.
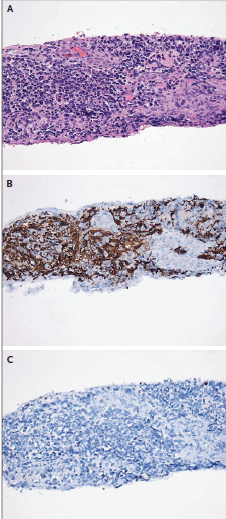
FIGURA 3
Muestras de biopsia leptomeníngea.
El tumor es marcadamente celular y consiste en
células pequeñas y poco diferenciadas (Panel A, hematoxilina y eosina). La
tinción inmunohistoquímica de las células tumorales revela la proteína ácida
fibrilar glial (Panel B) pero no el antígeno leucocitario común (Panel C).
No es raro que los gliomas malignos parenquimatosos
primarios, como el glioblastoma, involucren las leptomeninges, pero no había
evidencia de glioblastoma en el parénquima cerebral subyacente en este caso, y
la masa frontal izquierda que se observó en las imágenes podría haber sido
extraaxial. Estas características sugieren que este caso podría representar un
raro ejemplo de gliomatosis leptomeníngea primaria (es decir, un glioma que
nace en las leptomeninges). Sin embargo, sin un examen detallado del cerebro,
no podemos descartar la posibilidad de que la enfermedad leptomeníngea
represente una diseminación difusa de un glioblastoma parenquimatoso.
DISCUSIÓN DE MANEJO
Me involucré en la atención de este paciente después
de que se hizo el diagnóstico de glioblastoma. La terapia estándar para el
glioblastoma recién diagnosticado consiste en 6 semanas de radioterapia
fraccionada en el campo involucrado y la administración simultánea diaria de
temozolomida, un agente de quimioterapia alquilante oral. Luego, la
quimiorradiación es seguida por seis ciclos de tratamiento de 28 días en los
que se administra una dosis más alta de temozolomida durante los primeros 5
días de cada ciclo.10 Sin embargo, debido a la presentación inusual en este
caso, no estaba claro si la terapia estándar estaba indicada.
Se han caracterizado varios subtipos genéticos de
glioblastoma, y cada uno está asociado con un pronóstico sustancialmente
diferente. Por ejemplo, los pacientes cuyos tumores se someten a la metilación
del promotor del gen O6-metilguanina-ADN metiltransferasa (MGMT) tienen tiempos
de supervivencia más largos que los pacientes cuyos tumores no están metilados
en este sitio.11 Además, mutaciones puntuales específicas en dos genes que
codifican la isocitrato deshidrogenasa (IDH1 y IDH2) se encuentran en pacientes
con ciertos subtipos de glioblastoma que se asocian con una edad más temprana
en el momento del diagnóstico y una mayor supervivencia. 12 Sin embargo, a
pesar de las diferentes historias naturales asociadas con cada subtipo genético
de glioblastoma, no está claro si el tratamiento para estos subtipos debería
diferir, porque la estratificación genética aún no se ha estudiado en ensayos
prospectivos y aleatorizados.
Además, independientemente de sus características
morfológicas, los tumores gliales pueden causar distintos síndromes clínicos
definidos por características anatómicas y radiográficas únicas; Este es el
caso de la gliomatosis cerebral (que causa una infiltración difusa en todo el
cerebro) y los gliomas pontinos y del mesencéfalo (que tienen pronósticos
marcadamente diferentes a pesar de sus características morfológicas similares).
Este paciente parecía tener un síndrome de glioma distinto (gliomatosis
leptomeníngea primaria), que se define por infiltración difusa de células
gliales neoplásicas en las leptomeninges sin evidencia de un tumor
intraparenquimatoso primario. Este es un diagnóstico raro; hay aproximadamente
50 casos confirmados por autopsia en la literatura.13,14 Esta enfermedad tiende
a afectar a personas relativamente jóvenes, y el pronóstico generalmente es
extremadamente pobre, con un tiempo medio de supervivencia desde el diagnóstico
de 4 meses en una revisión. 13 El diagnóstico puede ser difícil de hacer, como
fue el caso de este paciente, porque los síntomas iniciales son con frecuencia
inespecíficos. Los pacientes generalmente presentan síntomas de meningismo
subagudo, como rigidez en el cuello, fiebre leve y dolor de cabeza. El
tratamiento con terapia antituberculosa en algún momento durante el curso, como
en este caso, es común.13 El aumento de la presión intracraneal y los signos
neurológicos focales a menudo se desarrollan más adelante en el curso de la
enfermedad. Con frecuencia ocurren neuropatías craneales y espinales, y los
abducens y los nervios ópticos son los nervios craneales que son los más
comúnmente afectados. En este paciente se desarrollaron parálisis bilaterales
de abducens y parálisis del nervio óptico, aunque probablemente se debieron al
aumento de la presión intracraneal, más que a la afectación directa de las
células tumorales por el nervio. En los estudios de imagen, las características
frecuentes (además de la mejora difusa del contraste leptomeníngeo) incluyen
compromiso de la médula espinal y ventriculomegalia.
Las pruebas de diagnóstico son comúnmente negativas
en casos de gliomatosis leptomeníngea primaria, como lo fue en este caso. A
pesar de la amplia participación de las leptomeninges, las pruebas de LCR son
frecuentemente no diagnósticas; en una revisión, la primera prueba de LCR fue
diagnóstica en solo 1 de 37 casos, y la repetición de la prueba de LCR también
fue a menudo no diagnóstica.13 Incluso el examen de las muestras de biopsia
meníngea puede no ser diagnóstico; En la mayoría de los casos informados, el
diagnóstico se realizó post mortem. Sin embargo, una característica
aparentemente universal de la gliomatosis leptomeníngea primaria es un nivel de
proteína total notablemente elevado en el LCR, que se observó en este paciente.
Finalmente, quedó claro que este paciente tenía un
glioblastoma y muy probablemente tenía gliomatosis leptomeníngea primaria. Poco
después de la craneotomía, se desarrollaron incontinencia y debilidad en las
piernas, y se realizó una resonancia magnética de la columna vertebral.
Las imágenes de la columna mejoradas con gadolinio
(Figura 4), obtenidas 7 días después de la craneotomía, muestran una amplia
mejora leptomeníngea a lo largo de toda la médula espinal y la cola de caballo.
FIGURA 4
Imágenes de resonancia magnética de la columna
obtenidas después de la craneotomía.
Las imágenes sagitales mejoradas con gadolinio de la
columna cervical (Panel A), torácica (Panel B) y lumbar (Panel C) muestran un
aumento leptomeníngeo extenso y grueso.
Las opciones terapéuticas eran limitadas. La
radioterapia de campo involucrado habría requerido el tratamiento de la
neuropatía completa, un procedimiento que habría sido difícil de tolerar para
el paciente. No se pudieron establecer pautas consensuadas a partir de la
literatura, que consiste en informes de casos únicos y series de casos
pequeñas, y los regímenes de quimioterapia informados variaron ampliamente,
desde aquellos que involucran agentes quimioterapéuticos únicos hasta regímenes
de nueve medicamentos que incorporan quimioterapia intratecal.15 La evidencia
anecdótica sugirió que la temozolomida puede ser clínicamente activo en esta
enfermedad; un informe documentó la regresión radiográfica después de tres
ciclos de temozolomida.16 Finalmente, ninguno de los métodos de tratamiento que
consideramos mostró evidencia convincente de eficacia y todos se asociaron con
algún riesgo de efectos tóxicos.
Desafortunadamente, el estado del paciente
evolucionó mal rápidamente a pesar de la administración de altas dosis de
glucocorticoides y el uso de una derivación ventriculoperitoneal. Se volvió
somnoliento y respondía solo de forma intermitente por estimulación vigorosa.
Debido a su deterioro repentino, mal estado funcional y mal pronóstico, no se
recomendó ninguna terapia adyuvante. Fue trasladado a cuidados paliativos y
murió varias semanas después, 5 meses después del inicio de los síntomas y 1
mes después del diagnóstico. No se obtuvo el permiso para una autopsia.
PREGUNTAS
La masa en el lóbulo frontal podría haber sido
extraparenquimatosa?
La masa era periférica. Al principio se pensó que era intraaxial; sin embargo, en imágenes
sagitales y coronales, parece tener una base amplia en la interfaz con el
hueso, y podría ser extraaxial.
Dado que todas las pruebas de diagnóstico de
tuberculosis tienen baja sensibilidad, ¿cuándo es apropiado comenzar el
tratamiento empírico para la meningitis tuberculosa?
Las pruebas de LCR para el diagnóstico
microbiológico de la meningitis tuberculosa tienen una sensibilidad máxima del
80%, suponiendo que tenga condiciones de muestreo óptimas y acceso al
procesamiento inmediato, puede obtener grandes volúmenes de LCR y puede repetir
la prueba varias veces. Sin embargo, en las áreas de recursos limitados donde
prevalece la tuberculosis, la sensibilidad de las pruebas de LCR es
probablemente más cercana al 50% .4 La meningitis tuberculosa es una enfermedad
grave que se asocia con una alta morbilidad y mortalidad, y el tratamiento temprano
definitivamente mejora los resultados. La meningitis subaguda o crónica sin
ninguna causa identificada, particularmente si es grave, debe tratarse
empíricamente con un tratamiento antituberculoso hasta que se encuentre un
diagnóstico alternativo. Este paciente tenía síntomas clásicos de meningitis
tuberculosa, pero luego supimos que tenía un glioma. Aunque me equivoqué con
este diagnóstico, trataría al paciente exactamente de la misma manera dada la
información disponible, particularmente dada la falta de otras terapias
efectivas.
Ahora que se conoce el diagnóstico, ¿comentaría
retrospectivamente la causa del pequeño infarto que se observó en la primera
resonancia magnética del paciente?
La vasculopatía puede ocurrir en cualquier caso de
meningitis crónica que afecta las cisternas basales. Los infartos tienden a
ocurrir en los ganglios basales y las porciones más profundas del cerebro,
incluidas las áreas suministradas por las arterias estriadas medianas y
talamoperforantes, a veces denominadas zona de tuberculosis.17 Este caso fue
atípico porque el infarto estaba en la corteza. La vasculopatía parece estar
más típicamente asociada con procesos infecciosos que con procesos neoplásicos,
pero cualquier proceso que cause meningitis en la base del cerebro podría
afectar los vasos que pasan.
El infarto cerebral debido a la infiltración de
células tumorales en los vasos leptomeníngeos también se ha descrito en
pacientes con gliomatosis leptomeníngea primaria.
DIAGNOSTICO ANATOMICO
GLIOBLASTOMA, GRADO IV DE IV DE LA OMS, QUE
INVOLUCRA LAS LEPTOMENINGES Y ES COMPATIBLE CON LA GLIOMATOSIS LEPTOMENÍNGEA
PRIMARIA.
Traducción:
“A 29-Year-Old
Man with Headache, Vomiting, and Diplopia”
Tracey A. Cho,
M.D., Andrew S. Chi, M.D., Ph.D., Pamela W. Schaefer, M.D., and David N. Louis,
M.D.
N Engl J Med
2014; 370:1049-1059March 13, 2014DOI: 10.1056/NEJMcpc1214216
REFERENCES
1Anderson NE,
Willoughby EW. Chronic meningitis without predisposing illness -- a review of
83 cases. Q J Med 1987;63:283-295
Web of Science |
Medline
2Hildebrand J,
Aoun M. Chronic meningitis: still a diagnostic challenge. J Neurol
2003;250:653-660
CrossRef | Web
of Science | Medline
3Atwood WJ,
Berger JR, Kaderman R, Tornatore CS, Major EO. Human immunodeficiency virus
type 1 infection of the brain. Clin Microbiol Rev 1993;6:339-366
Web of Science |
Medline
4Thwaites GE,
Chau TT, Farrar JJ. Improving the bacteriological diagnosis of tuberculous
meningitis. J Clin Microbiol 2004;42:378-379
CrossRef | Web
of Science | Medline
5Tanner DC,
Weinstein MP, Fedorciw B, Joho KL, Thorpe JJ, Reller L. Comparison of commercial
kits for detection of cryptococcal antigen. J Clin Microbiol 1994;32:1680-1684
Web of Science |
Medline
6Straathof CS,
de Bruin HG, Dippel DW, Vecht CJ. The diagnostic accuracy of magnetic resonance
imaging and cerebrospinal fluid cytology in leptomeningeal metastasis. J Neurol
1999;246:810-814
CrossRef | Web
of Science | Medline
7Gleissner B,
Chamberlain MC. Neoplastic meningitis. Lancet Neurol 2006;5:443-452
CrossRef | Web
of Science | Medline
8Burger PC,
Pearl DK, Aldape K, et al. Small cell architecture -- a histological equivalent
of EGFR amplification in glioblastoma multiforme? J Neuropathol Exp Neurol
2001;60:1099-1104
Web of Science |
Medline
9Tortosa A, Ino Y, Odell N, et al. Molecular genetics of radiographically defined de novo
glioblastoma multiforme. Neuropathol Appl Neurobiol 2000;26:544-552
CrossRef | Web
of Science | Medline
10Stupp R, Mason
WP, van den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant
temozolomide for glioblastoma. N Engl J Med 2005;352:987-996
Free Full Text |
Web of Science | Medline
11Hegi ME,
Diserens A-C, Gorlia T, et al. MGMT gene silencing and benefit from
temozolomide in glioblastoma. N Engl J Med 2005;352:997-1003
Free Full Text |
Web of Science | Medline
12Parsons DW,
Jones S, Zhang X, et al. An integrated genomic analysis of human glioblastoma
multiforme. Science 2008;321:1807-1812
CrossRef | Web
of Science | Medline
13Yomo S, Tada T, Hirayama S, et al. A case report and review of the literature. J
Neurooncol 2007;81:209-216
CrossRef | Web
of Science | Medline
14Cooper IS,
Kernohan JW. Heterotopic glial nests in the subarachnoid space: histopathologic
characteristics, mode of origin and relation to meningeal gliomas. J
Neuropathol Exp Neurol 1951;10:16-29
CrossRef | Web of Science | Medline
15Beauchesne P,
Pialat J, Duthel R, et al. Aggressive treatment with complete remission in
primary diffuse leptomeningeal gliomatosis -- a case report. J Neurooncol
1998;37:161-167
CrossRef | Web
of Science | Medline
16Franceschi E, Cavallo G, Scopece L, et al. Temozolomide-induced partial response in a patient
with primary diffuse leptomeningeal gliomatosis. J Neurooncol 2005;73:261-264
CrossRef | Web
of Science | Medline
17Hsieh FY, Chia
LG, Shen WC. Locations of cerebral infarctions in tuberculous meningitis. Neuroradiology
1992;34:197-199
CrossRef | Web of Science | Medline