Un hombre de 57 años consultó al hospital por confusión,
tos, fiebre y pérdida de peso involuntaria.
El paciente había estado en su estado habitual de
salud hasta aproximadamente 7 semanas, cuando comenzó a presentar malestar y anorexia. Cuatro semanas después,
comenzó con una tos no productiva, asociada a fiebre con una temperatura máxima
de 37.6 ° C, por lo que buscó atención
médica. En ese momento, una radiografía de tórax mostró una opacidad en el
lóbulo inferior izquierdo (Fig. 1A). Además, una tomografía computada (TC) de tórax, realizada sin administración
intravenosa de contraste, reveló consolidación en el lóbulo inferior izquierdo.
El paciente fue ingresados, y se comenzó con cefdinir y azitromicina
intravenosos. Al día siguiente, el tratamiento se cambió a levofloxacina oral. Después
de que el paciente recibió levofloxacina durante 6 días, fue dado de alta a su
domicilio.
Figura 1. Radiografía de tórax inicial y
electrocardiograma.
Una radiografía de tórax (Panel A) muestra una opacidad en el lóbulo
inferior izquierdo.
Figura 2. Un electrocardiograma obtenido en el
ingreso inicial (Panel B) muestra ritmo sinusal a 99 latidos por minuto, con
elevaciones del segmento ST cóncavos de 1 mm y depresión del segmento PR en las
derivaciones 2, 3 y aVF; sutil elevación del segmento PR en aVR; y depresiones ascendentes submilimétricas
del segmento ST en caras anterior y
lateral. Los hallazgos podrían indicar cambios pericardíticos o isquémicos.
Un día después del alta, la fiebre y la tos
persistían y el paciente fue readmitido. Se obtuvo un cultivo de esputo. El tratamiento
con levofloxacina fue suspendido y se
administró piperacilina-tazobactam y vancomicina por vía intravenosa. Después
de 2 días de terapia parenteral, el paciente presentó algunos síntomas de alivio;
piperacilina – tazobactam y vancomicina se suspendieron, y se comenzó con amoxicilina–
ácido clavulánico. El paciente fue dado de alta con un plan para completar un
curso de 10 días de terapia antibacteriana.
La fatiga, la tos y el malestar continuaron
agregándose sudores nocturnos y fiebre
con una temperatura máxima de
37.8 ° C la cual ocurría diariamente. Además, empeoró la anorexia y se agregó una debilidad
que le impedía caminar sin ayuda. Diez
días después de la segunda alta (2 días antes de la presentación actual), la esposa del paciente
notó que el paciente estaba incoherente, desorientado, enojado y beligerante, y
ella lo encontró orinando inadecuadamente alrededor de su casa. En la noche de
la presentación, ella lo encontró duchándose
vestido. Se llamaron servicios médicos de emergencia, y el paciente fue
nuevamente internado.
En el nuevo ingreso al hospital, la temperatura fue
de 38.3 ° C, la frecuencia cardíaca 111 latidos por minuto, la presión arterial
135/73 mm Hg, la frecuencia respiratoria 24 respiraciones por minuto, y la
saturación de oxígeno 94% respirando
aire ambiente. Estaba confundido e incapaz de responder a las preguntas
adecuadamente.
Los resultados de las pruebas de laboratorio fueron
notables para un nivel de troponina de
13.4 ng por mililitro (rango de referencia menor de 0.04), un nivel de lactato
de 22 mg por decilitro (rango de referencia, 6 a 18 mg por decilitro), y un
recuento de glóbulos blancos de 21,800 por milímetro cúbico (rango de referencia,
4500 a 10,500). Se obtuvieron cultivos de sangre. El informe del electrocardiograma
fue: taquicardia sinusal, latidos
auriculares prematuros, y elevaciones submilimétricas del segmento ST en cara
inferior. Dado que la paciente tenía
taquipnea y aumento de la somnolencia,
la tráquea fue intubada y se comenzó con ventilación mecánica.
Se comenzó con vancomicina intravenosa,
piperacilina-tazobactam, ciprofloxacina, lorazepam y propofol, y el paciente
fue trasladado por helicóptero al departamento de urgencias de un hospital de
mayor complejidad para angiografía
coronaria.
A la llegada del paciente al nuevo hospital, una
historia bastante limitada se obtuvo de su esposa. Ella refirió que el paciente
no se había quejado de dolor torácico, disnea, edema o síntomas de arritmia. Tenía antecentes de eczema. No
tomaba medicamentos y no había efectos adversos conocidos oreacciones a los
medicamentos, pero tenía una historia de anafilaxia a las picaduras de abejas. El
paciente fumaba cigarrillos y habia fumado 1 paquete diario durante los últimos
41 años; también bebía de 8 a 10 cervezas por noche, ocasionalmente junto con 2
a 3 vasos de vino, y fumaba marihuana diariamente. Era granjero, y había restaurado casas de granjas y limpiado establo de caballos.
Poseía ovejas y cabras y anteriormente había poseído aves exóticas. Había antecedentes familiares de cáncer; su hermana
había muerto de cáncer de mama a los 42 años de edad, y su padre había muerto
de un cáncer desconocido cuando tenía 45 años.
La temperatura era de 37.2 ° C, la frecuencia
cardíaca. 100 latidos por minuto, la presión arterial. 120/82 mm Hg, y la saturación
de oxígeno de 100% mientras el paciente recibía ventilación mecánica. a una
velocidad de 18 respiraciones por minuto, con un volumen tidal de 500 ml, una
presión final espiratorio positivo de 8
cm de agua, y una fracción de Oxígeno inspirado de 0,80. Las pupilas
medían 2 mm de diámetro y con reactividad
lenta. Cuando el nivel de sedación se redujo, el paciente abrió sus ojos e hizo
una mueca espontánea pero no seguía órdenes. No parpadeaba en respuesta a la
amenaza ni se alejaba de estímulos dolorosos. Los reflejos corneanos estaban
intactos. No había rash cutáneo. El
resto del examen fue normal
Losniveles sanguíneos de fósforo, bilirrubina, fosfatasa
alcalina, globulina, lipasa, hemoglobina glucosilada, tirotropina y el KPTT tiempo eran normales; otros resultados de
laboratorio se muestran en la Tabla 1.
TABLA 1
Un test en suero fue negativa para paracetamol,
etanol, antidepresivos tricíclicos y salicilatos, pero en orina la prueba de toxicología
fue positiva para canabinoides. Se obtuvieron
cultivos de sangre, orina y esputo.
Pruebas para ácidos nucleicos de un hisopado nasofaríngeo fue negativo
para el virus de la gripe tipos A y B y virus sincitial respiratorio. Un
electrocardiograma mostró ritmo sinusal a 99 latidos por minuto, con elevación
del segmento ST de 1 mm cóncavo y depresión del segmento PR en las
derivaciones 2, 3 y aVF; una sutil elevación del segmento PR en aVR; y depresión
del ST submilimétrica ascendente en
caras lateral y anterior. (Fig. 2). En la
radiografía de tórax una opacidad parcheada persistente en el lóbulo
inferior izquierdo (Fig. 3A), sin evidencia de edema pulmonar o derrames
pleurales. La TC de cerebro, realizada
sin contraste intravenoso, reveló hipoatenuación sutil y pérdida de
diferenciación entresustancia gris y blanca en el territorio de la arteria
cerebral media izquierda, hallazgos que
plantearon inquietudes dudas sobre un infarto agudo a subagudo; no había evidencia
de hemorragia intracraneal. La TC de tórax, abdomen y pelvis, realizada después
de la administración intravenosa de contraste y contraste oral de contraste, mostró consolidación en
lóbulo inferior izquierdo (Fig. 3B), que había progresado desde la TC anterior
realizada 4 semanas antes en otro hospital.
Cambios consistentes con embolias pulmonares segmentaria y subsegmentarias en
el lóbulo inferior derecho, sin evidencia de sobrecarga de presión en el lado derecho del corazón. Una consolidación
subpleural en forma de cuña en el lóbulo
inferior derecho (Fig. 3C) fue consistente con un infarto pulmonar. Había
nuevos pequeños derrames pleurales bilaterales. Múltiples lesiones de
hipoatenuación esplénicos y renales en forma de cuña eran visibles y
consistentes con infartos esplénico y renal. (fig. 3D).
Mientras el paciente estaba en el departamento de
emergencia, se produjo un episodio de 23 segundos de taquicardia ventricular.
Se le administró aspirina por vía rectal rectal y magnesio y cefepima por vía
intravenosa; infusiones de propofol, solución salina normal, y amiodarona
también fueron administrados.
Se consideró cateterización cardiaca pero fue diferida.
El paciente ingresó en la unidad de Cuidados Intensivos donde se
obtuvieron estudios de imagen adicionales.
Figura 3. Estudios de imagen adicionales.
Radiografía anteroposterior del tórax (panel A) que
muestra consolidación en el lóbulo inferior izquierdo. Una imagen axial de una tomografía computarizada del tórax,
obtenida después de la administración intravenosa de contraste (Panel B), muestra
densa, masiva de consolidación en lóbulo inferior izquierdo (flechas). Hay un
defecto de llenado no oclusivo en la arteria pulmonar segmentaria basal
posterior del lóbulo inferior derecho (punta de flecha), un hallazgo
consistente con embolia pulmonar. Una imagen de una tomografía computarizada de
tórax obtenido con ventanas de pulmón (panel C) muestra una consolidación
subpleural en forma de cuña en la lóbulo inferior derecho (flecha) con opacidad
en vidrio esmerilado de fondo, hallazgo sugestivo de infarto pulmonar. Una imagen
axial de una tomografía computarizada del abdomen (Panel D), muestra múltiples
lesiones hipoatenuantes en forma de cuña, en la corteza de ambos riñones y en
la periferia del bazo (flechas), hallazgos consistentes con infartos.
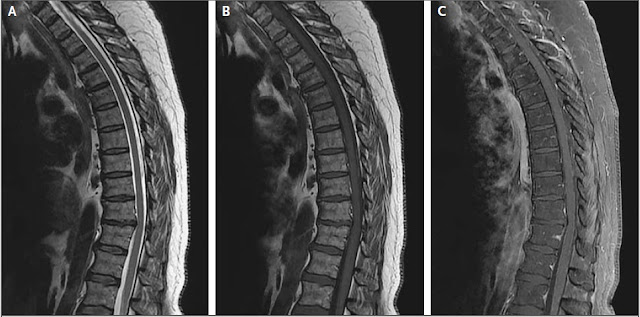
Una MRI ponderada por difusión (Panel E) muestra
imágenes de infartos cerebrales bilaterales, en los lóbulos parietales
(flechas), más extensos en el lado izquierdo
que en el lado derecho, y en el lóbulo frontal izquierdo (punta de flecha).
La resonancia magnética y angiografía de la cabeza y
cuello revelaron numerosos bilaterales agudos-tosubacudos. Infartos cerebrales
(fig. 3E) y punteados. Infartos diseminados por los hemisferios cerebelosos. Algunos
focos puntiformes dispersos de susceptibilidad suscitaron preocupación por microhemorragias.
Imágenes de Time-of-flight revelaron una señal de
susceptibilidad lineal en las ramas distales de la división superior de la
arteria cerebral media izquierda y pérdida de realce relacionado con el flujo. en
la arteria cerebral media superior izquierda, hallazgos ugestivos de trombosis.
Se realizó ecocardiografía transtorácica (TTE) que
mostró un ventrículo izquierdo con una fracción
de eyección del 35%, con con hipoquinesia difusa más prominente en territorio
inferior. Sobre los estudios obtenidos tras la administración de solución
salina agitada, no hubo evidencia. de un foramen oval permeable. Las hojas de
la válvula mitral estaban engrosadas focalmente,
con leve regurgitación mitral. Un pequeño derrame pericárdico circunferencial estaba presente un (Fig. 4A).
Figura 4: Estudios ecocardiográficos.
Un ecocardiograma transtorácico, obtenido en la
vista del eje largo paraesternal (Panel A), muestra el engrosamiento focal y
brillo en la punta de la valva mitral anterior - válvula (flecha). Un
ecocardiograma transesofágico, obtenido en
ventana medioesofágica en la vista del omniplano de 90 grados (Panel B),
muestra las vegetaciones que están unidas a la vertiente auricular de las puntas de las valvas de la
válvula mitral (flecha). Un ecocardiograma transesofágico tridimensional,
obtenido en la "vista del cirujano" de la válvula mitral (con la
válvula aórtica y la valva mitral anterior - válvula en la parte superior de la
imagen, la parte lateral de la válvula mitral a la izquierda y la parte medial
de la válvula mitral a la derecha) (Panel C), muestra vegetaciones a lo largo
de la cara medial de la línea de coaptación de las valvas (flechas) de la
válvula mitral.
Las vegetaciones parecen estar unidas tanto a los
pliegues anteromediales (A3) como
posteromediales (P3) de la válvula mitral.
Un ecocardiograma transesofágico con Doppler a
color, obtenido en la ventana medioesofágica en los 90 grados en vista
omniplano (Panel D) muestra una insuficiencia mitral de gravedad leve a
moderada (flecha negra) a pesar de la vegetación mitral - valvular (flechas
blancas). LA denota aurícula izquierda y LV ventrículo izquierdo.
Las pruebas para anticoagulante lúpico dieron negativas,
anticuerpos anticardiolipina IgM e IgG, β2-glicoproteína IgM y anticuerpos IgG, anticuerpo peptídico anti cíclico citrulinado,
y anticuerpo anti-reumatoide; una prueba para anticuerpos antineutrófilos fue
positivo a títulos de 1:40 y 1: 160, con un patrón homogéneo. Se administró vancomicina, tiamina y doxiciclina IV y atorvastatina,
omeprazol y metoprolol por VO
En el segundo día, la temperatura era 38.4 ° C y Se
repitieron los cultivos de sangre, orina,
y se obtuvieron de esputo. Las pruebas fueron
negativas para anticuerpos anti-Ro (SSA), anti-La (SSB) y anti-Jo-1, así como
los anticuerpos IgM e IgG para brucella y coxiella (el agente que causa la
fiebre Q) y el anticuerpo citoplasmático antineutrófilo. La ecografía de brazos
y piernas fue negativa para trombos. La
broncoscopia con lavado broncoalveolar (BAL) reveló secreciones teñidas de
sangre en múltiples segmentos de la vía aérea. La tinción de Gram del líquido
BAL no reveló leucocitos u organismos La
preparación húmeda para hongos y bacilos
ácido-alcohol resistentes del
fluido BAL fueron negativas, al igual que la tinción para Pneumocystis jiroveci
y Las p de ácidos nucleicos ruebas para virus de influenza tipos A y B y virus
sincitial respiratorio. Además, las pruebas de anticuerpos fluorescentes del fluido del BAL fue negativo
para adenovirus, metaneumovirus humano, y los tipos de virus parainfluenza 1, 2
y 3.
Se realizó una prueba diagnóstica.
DIAGNÓSTICO DIFERENCIAL
Éste paciente de 57 años previamente sano desarrolló
una enfermedad a lo largo de varias semanas que se
caracterizó por fiebre, opacidades pulmonares, cardíacas, disfunción valvular,
y embolias en múltiples lechos vasculares. En el desarrollo de un diagnóstico
diferencial, hay que considerar las condiciones que están asociadas con
trombosis generalizada o embolia a múltiples territorios vasculares, como las
embolias paradojales paradójicos, el síndrome del anticuerpo antifosfolípido,
la trombocitopenia inducida por heparina, trombos murales asociados a
miocardiopatías, mixoma auricular, fiebre reumática aguda, endocarditis
infecciosas con cultivos negativos, y las endocarditis trombóticas no
bacterianas.
EMBOLIA PARADÓJICA
El embolismo paradójico es el paso de tromboembolias
venosas a la circulacion arterial, lo
que resulta en embolización sistémica. Se puede producir a través de un foramen oval
permeable, un hallazgo común en la población general. Éste paciente había sido
hospitalizado y estaba sedentario, es probable que tuviera neumonía y de esa
manera estuviera cursando un estado
hipercoagulable; las características clínicas que presentó son consistentes con
embolias paradójicas. Sin embargo, el ecocardiograma que se realizó después de la administración de
solución salina agitada no reveló evidencia de un shunt, y la ecografía de los
brazos y las piernas fueron negativas para trombos. Aunque el embolismo
paradojal es poco probables en este caso, debería destacarse que la ecocardiografía se llevó a cabo mientras
el paciente recibía ventilación mecánica, por lo que es poco probable que pudiese
realizarse una maniobra de Valsalva para potenciar o sensibilizar la detección
de un shunt, y sin embargo, la ventilación
con presión positiva puede aumentar la presión auricular derecha y aumentar un
shunt interauricular de derecha a izquierda. Además hay que decir,que el
paciente se sometió a un ecocardiograma transtorácico (TTE), mientras que el
ecocardiograma transesofágico (ETE) es más sensible para la detección de un foramen oval permeable.2 Finalmente,
también hay que decir que el paciente recibió la inyección de solución salina
agitada en una vena del brazo, mientras que la inyección en la pierna es más
sensible para la detección de un foramen oval permeable.
SÍNDROME DE ANTICUERPOS ANTIFOSFOLÍPIDOS
El síndrome de anticuerpos antifosfolípidos se
caracteriza por trombosis, trombocitopenia, livedo reticularis, y embolismo. El
cuadro isquémico puede ser resultado de la trombosis in situ o de una embolia
debida a la enfermedad valvular del corazón. Este paciente posiblemente tenía
una infección, y los pacientes con infección comúnmente tienen positividad
transitoria para anticuerpos antifosfolípidos. El síndrome de anticuerpo
antifosfolípido es un diagnóstico poco probable en este caso, dado que por lo
general se asocia con microtrombosis y no con macrothrombosis, 5, y porque además, el paciente tuvo una prueba
negativa para el anticoagulante lúpico. Sin embargo, una prueba negativa para
anticoagulante lúpico no descarta el diagnóstico, porque sólo la mitad de los
pacientes con tormenta trombótica se informan comopositivos para
anticuerpos antifosfolípidos, presumiblemente
debido al consumo del anticuerpo.5
TROMBOCITOPENIA INDUCIDA POR HEPARINA
La trombocitopenia inducida por heparina es un
estado protrombótico que es causado por anticuerpos contra complejos de factor
plaquetario 4 y heparina6. Cuando el síndrome no es reconocido, puede llevar a
un estado de coagulación macrovascular; lo más probable es que sea considerado
en pacientes recientemente hospitalizados con trombosis.6 Sin embargo, este
paciente tuvo un recuento normal de plaquetas en el momento de la presentación,
cuando ya tenía evidencia de embolización sistémica. Cabe destacar que no había
tenido exposición previa a heparina.
TROMBOS MURALES ASOCIADOS CON MIOCARDIOPATÍAS
Trombos murales asociados a miocardiopatía son el resultado
de la estasis del flujo sanguíneo en el ventrículo izquierdo, y pueden causar embolización
sistémica generalizada. 7 La incidencia de trombos murales son probablemente
subestimados; ya que ocurren en 5 a 8% de los pacientes con disfunción sistólica
ventricular izquierda.7 Los trombos murales son poco probables en este caso, porque
el riesgo de embolia con trombos murales es de aproximadamente 10 a 15%, incluso
en ausencia de anticoagulación, 8 y porque los
pacientes con trombos murales suelen tener una fracción de eyección ventricular
izquierda inferior al 30%, en comparación con una medida del 35% en éste paciente.
Además, no había evidencia de un segmento discinético en el TTE, y la
disfunción ventricular fue probablemente de reciente aparición.7 Sin embargo, cabe
señalar que las ventanas para la realización de ecocardiografía en este
paciente puede haber sido limitada, y además no se administró un agente de
opacificación para la detección de un trombo ventricular izquierdo durante la
ecocardiografía, y porque además, la ecocardiografía es menos sensible que la
RM cardiaca para la detección de un trombo (23% vs. 88%) 9.
MIXOMA AURICULAR
¿Podría un tumor intracardíaco haber causado embolización
sistémica en este paciente? Los mixomas auriculares son los tumores primarios
más comunes del corazón, y los pacientes afectados pueden presentarse con síntomas
constitucionales como fiebre y embolismo generalizado.10 Sin embargo, los
hallazgos de la ecocardiografía en este paciente no son típicos de un mixoma,
que es más comúnmente manifestado por una masa que se une al tabique
interauricular.
CAUSAS INFECCIOSAS DE EMBOLIZACIÓN SISTÉMICA
La fiebre reumática aguda es una enfermedad
inflamatoria que se desarrolla como una complicación de una infección
estreptocóccica.11 Sus manifestaciones clínicas incluyen carditis, valvulitis y
compromiso del sistema nervioso central. 11 La carditis se produce en
aproximadamente 40 a 50% de los pacientes con fiebre reumática aguda, y la
pericarditis se presenta en 5 a 10%. Sin embargo, éste paciente era mayor de 25
años y vivía en los Estados Unidos, donde la incidencia de fiebre reumática es
baja. Además, no se presentó con los síntomas o signos de una infección estreptocócica,
como la faringitis ouna erupción, y fue tratado con antibacterianos que se
supone serían efectivos contra la mayoría de los estreptococos.
La endocarditis infecciosa con cultivos negativos
representan el 2 al 30% de todos los casos de endocarrditis.12 Algunos aspectos
de la historia de este paciente sugieren que es un posible diagnóstico. El
paciente habia sido tratados con varios agentes antibióticos. Había tenido
contacto con animales de granja (asociados con infección por especies de
brucella o coxiella), suelo y paja (coxiella), gatos (Bartonella henselae), y aves
(Chlamydia psittaci), todas causantes posibles
de endocarditis infecciosas con cultivos negativos. También existía
alcoholismo crónico (B. quintana) y disfunción hepática potencial con inmunosupresión
resultante (criptococo). 13 Sin embargo, las pruebas de anticuerpos para
brucella y la coxiella fueron negativas. Además, las endocarditis infecciosa
con cultivos negativos son un diagnóstico poco probable dada la discordancia
entre el aspecto sutil de la lesión valvular y la extensa embolización
generalizada. No obstante, estas
entidades infecciosas son importantes a considerar, ya que el diagnóstico de
endocarditis infecciosa con cultivo negativo es notoriamente difícil de establecer.14
ENDOCARDITIS TROMBÓTICA NO BACTERIANA
Podría tener endocarditis trombótica no bacteriana
(ETNB) como causa de embolización sistémica
este paciente? 15 La ETNB es un fenómeno inmunomediado caracterizado por
la presencia de vegetaciones estériles compuestas de trombos blandos de
fibrina-plaqueta, que se forma en las hojas valvulares. Típicamente ocurre en pacientes
con cáncer avanzado (conocida en esos casos como endocarditis marántica) y en
aquellos con lupus eritematoso sistémico (conocido en estos casos como endocarditis de Libman-Sacks).16 Sin
embargo, también puede complicar otras enfermedades crónicas, como la
tuberculosis, la uremia, y el síndrome de inmunodeficiencia adquirida. Se
considera la endocarditis trombótica no bacteriana una condición poco común, y
es más menudo encontrada post mortem, con tasas de series autopsia que van del 0,9 al 1,6% .16 Casi el
50% de los casos postmortem se asocian con adenocarcinoma del pulmón o de
ovario, y un 25% adicional se asocia con cáncer hematológico. Sin embargo, la
frecuencia de endocarditis trombótica no bacteriana puede ser subestimada. En
un estudio con 200 pacientes con cáncer que no tenían embolia clínica o
endocarditis, se encontraron vegetaciones
valvulares en el 19% de los pacientes, en comparación con solo el 2% de los
controles.
Las vegetaciones de las ETNB son típicamente
friables y tienen una alta propensión a la embolización dada la mínima reacción
inflamatoria en el sitio de la fijación de lavegetación a la hoja valvular.18,19
Se encuentran clásicamente a lo largo líneas de coaptación valvular (es decir,
donde se encuentran los bordes de la válvula) y no están asociados con
destrucción del tejido valvular. Las vegetaciones son típicamente pequeñas
(menos de 1 cm de diámetro), de base amplia, de forma irregular, 20 y están
frecuentemente ubicadas en las válvulas mitral y aórtica; los casos de endocarditis
trombótica no bacteriana que involucran las válvulas en el lado derecho del
corazón son raras.
Las vegetaciones en las válvulas
aurículo-ventriculares se encuentran comúnmente en la superficie auricular,
mientras que las vegetaciones en las válvulas semilunares suelen ser
encontradas en la superficie ventricular.
La manifestación inicial más común de endocarditis
trombótica no bacteriana es un evento embólico que resulta en síntomas
neurológicos.21 Aunque la incidencia de embolización sistémica en esta entidad
no está bien estudiada, parece estar en un rango de 14 a 91%, con embolia
pulmonar ocurriendo en el 50% de los casos, a veces sin la presencia obvia de
lesiones valvulares en el lado derecho del corazón.21 Los pacientes con endocarditis trombótica no
bacteriana tienden a tener evidencia de infartos cerebrales ampliamente
distribuidos en la resonancia magnética
ponderada por difusión, mientras que las lesiones únicas o los infartos focales
son más característicos de la endocarditis infecciosa.22 La disfunción valvular
cardíaca en la ETNB no es común.
Dada la marcada discordancia entre las sutiles
lesiones valvulares, y la amplia y generalizada embolización sistémica, junto
con las evaluaciones infectológicas y reumatológicas negativas, sospechamos que
éste paciente probablemente tenía endocarditis
trombótica no bacteriana. Dado que la mayoría de los casos de endocarditis
trombótica no bacterianas están asociados con cáncer y éste paciente tenía un
antecedente de tabaquismo severo, me gustaría
considerar la posibilidad de cáncer de pulmón como enfermedad subyacente.
Para establecer este diagnóstico, yo recomendaría un
ecocardiograma trans esofágico (TEE) para evaluar más a fondo las anomalías
valvulares y consideraría realizar una broncoscopia para buscar evidencias de
una lesión pulmonar subyacente.
DIAGNÓSTICO PRESUNTIVO
ENDOCARDITIS TROMBÓTICA NO BACTERIANA DEBIDA A
CÁNCER SUBYACENTE.
ESTUDIOS DE DIAGNOSTICO
Se realizó un ETE para evaluar la anomalía de la válvula mitral y para
descartar otras fuentes cardiacas de embolia. Se visualizó material ecogénico
difuso a lo largo de la superficie auricular izquierda de las valvas anterior y posterior de la válvula mitral, a lo largo de la línea
de coaptación valvular (Fig. 4B y 4C). El material tenia uuna base amplia de
implantación a la válvula mitral, con movilidad mínima. La severidad de la
regurgitación mitral fue de leve a moderada (Fig. 4D), y el chorro regurgitante
originado en el punto de coaptación central de las valvas. No se observó invasión
ni absceso perivalvular ni absceso. No
había otras anomalías valvulares u otras fuentes cardiogénicas de un embolia.
Basados en el aspecto, el patrón de movilidad, y
localización del material ecogénico, el diagnóstico diferencial incluyó
endocarditis bacteriana, la trombosis, o ambas cosas. La ausencia de un hemocultivo
positivo y la ausencia aparente de destrucción marcada del tejido valvular
subyacente hace que una causa bacteriana de la vegetación sea poco probable.
La evaluación
citológica del lavado bronquial reveló grandes células atípicas, aisladas y en
pequeños clusters , sobre un fondo de abundante sangre (Fig. 5A). Estas células
tenían características diagnósticas de
carcinoma pobremente diferenciado: modesta cohesion y morfologia epitelioide a
pleomorfo, con núcleos irregulares, hipercromáticos que eran de 5 a 8 veces el
tamaño de los núcleos de pequeños linfocitos maduros, a menudo con nucléolos
prominentes. La presencia de abundante citoplasma espumoso a vacuolado sugirió
una diferenciación de adenocarcinoma.
Figura 5. Muestras de lavado bronquial y autopsia.
La tinción de Papanicolaou de un lavado bronquial
(Panel A) muestra células epitelioides malignas, aisladas y en grupos pequeños (clusters), con grandes
núcleos hipercromáticos, irregulares
sobre un fondo de abundante sangre. Una fotografía de la muestra de autopsia
del pulmón izquierdo (Panel B) muestra masas nodulares firmes, de color blanco
bronceado, centradas en el parénquima pulmonar izquierdo, un hallazgo
compatible con el carcinoma primario de
pulmón.
Los ganglios linfáticos hiliares agrandados también
son visibles. La tinción con hematoxilina y eosina del tumor (Panel C) muestra
una diferencia pobremente diferenciada pero con formación de glándulas de adenocarcinoma focalmente.En la tinción
inmunohistoquímica, las células malignas son difusamente positivas para queratina 7 (Panel D), positivo para el factor
de transcripción tiroidea 1 (Panel E) y positivo para napsina A (Panel F),hallazgos
que apoyan el diagnóstico de un adenocarcinoma primario de pulmón. Una
fotografía de la superficie auricular de la válvula mitral (Panel G), muestra vegetaciones granulares, friables de
color amarillo bronceado. La tinción tricrómica de una vegetación (Panel H) muestra
que está compuesta de fibrina (en magenta). Esta vegetación está bien demarcada
de la válvula mitral (en azul), y hay una notable ausencia de inflamación
asociada.
En el contexto de cultivos negativos y tinciones
especiales para organismos negativos, estos hallazgos son compatibles con endocarditis
trombótica no bacteriana.
DISCUSIÓN DEL MANEJO
Una vez realizado el
diagnóstico de endocarditis trambótica no bacteriana, se debe instituir el manejo de la condición subyacente, ya que el objetivo de
la terapia es detener el proceso que está impulsando la deposición valvular
mediada por el sistema inmune. Se recomienda la anticoagulación sistémica,
hasta que se controle o trate el proceso subyacente que aunque a menudo se forman nuevas vegetaciones a pesar
de la anticoagulación terapéutica. El anticoagulante de elección suele ser laheparina
no fraccionada o de bajo peso molecular en lugar de warfarina, ya que el
tromboembolismo recurrente puede ocurrir en pacientes con endocarditis
trombótica no bacteriana asociada a cáncer que están recibiendo warfarina.21,23
A pesar del potencial desarrollo de grandes vegetaciones valvulares
la incompetencia valvular es amenudo leve o inexistente. Por este motivo, la
cirugía (desbridamiento valvular o escisión) rara vez se indica, pero puede ser
considerada en los casos en que la relación riesgo-beneficio y la esperanza de
vida es favorable, con el objetivo de prevenir la embolización recurrente o
para el tratamiento de la insuficiencia cardíaca o grave incompetencia
valvular.
Éste paciente desarrolló anemia, trombocitopenia,
aguda,lesiones renales, y coagulación
intravascular diseminada. Su estado mental se deterioró , y a pesar del
destete de la sedación, no respondía al dolor y no interaccionaba en forma
significativa. La esposa del paciente y suhija, que estaban presentes junto a
su cama, recordaron múltiples
conversaciones previas sobre sus preferencias al final de la vida en vista de
su estilo de vida activo y de acuerdo con sus deseos, y los de su familia se instituyeron medidas de
paliación y el paciente falleció dentro de 1 minuto después de la extubación.
Se realizó autopsia.
DISCUSION PATOLOGICA
En la autopsia, se observaron nódulos de color
blanco en la superficie pleural del pulmón izquierdo. El examen de los cortes
del tejido pulmonar estudiado mostraron una masa nodular firme a carnosa subyacente que se
centró en el parénquima, un hallazgo consistente con carcinoma pulmonar primario.
También se identificaron ganglios linfáticos hiliares agrandados. (Fig. 5B). El
examen microscópico reveló un adenocarcinoma pobremente diferenciado pero
formando glándulas focales (Fig. 5C) con una población de células gigantes
pleomórficas; la enfermedad metastásica fue identificada en múltiples ganglios hilires
y mediastínicos. La tinción inmunohistoquímica reveló que las células tumorales
fueron positivas para queratina 7,factor de transcripción tiroideo 1 y napsina
A (Fig. 5D, 5E y 5F); estos hallazgos apoyan el
diagnóstico de adenocarcinoma mal diferenciado de origen pulmonar.
El corazón estaba ligeramente agrandado, pesaba 530
g, y tenía múltiples vegetaciones con aspecto de gránulos de color amarillento,
friables, en la superficie auricular de
la válvula mitral. (Fig. 5G). En el examen microscópico, las vegetaciones
estaban compuestas de fibrina acelular, sin inflamación asociada, y estaban
bien demarcadas de la válvula mitral (Fig. 5H). En el contexto de los cultivos
negativos y tinciones especiales negativas
para organismos, estos hallazgos son compatibles con endocarditis trombótica no
bacteriana. Se identificaron trombos en los pulmones, corazón, bazo, riñones y
cerebro, con los consiguientes infartos de esos órganos. En los riñones, los trombos
de fibrina estaban presentes en los capilares glomerulares, un hallazgo que
apoya el diagnóstico clínico de coagulación intravascular diseminada.
DIAGNOSTICO ANATOMICO
ADENOCARCINOMA PULMONAR, COMPLICADO POR UN ESTADO
HIPERCOAGULABLE CON ENDOCARDITIS TROMBÓTICA
NO BACTERIANA.
TRADUCCIÓN DE
Case 33-2018: A
57-Year-Old Man with Confusion, Fever, Malaise, and Weight Loss
Tomas G. Neilan,
M.D., M.P.H., Melissa C. Price, M.D., Danita Y. Sanborn, M.D., Justin F.
Gainor, M.D., and Athena Chen, M.D.
The New England
Journal of Medicine
References
1. Homma S,
Sacco RL. Patent foramen
ovale and
stroke. Circulation 2005; 112:
1063-72.
2. Davison P,
Clift PF, Steeds RP. The
role of
echocardiography in diagnosis,
monitoring
closure and post-procedural
assessment of
patent foramen ovale. Eur J
Echocardiogr
2010; 11(10): i27-i34.
3. Gin KG,
Huckell VF, Pollick C. Femo- ral vein delivery of contrast medium enhances
transthoracic
echocardiographic
detection of
patent foramen ovale. J Am
Coll Cardiol
1993; 22: 1994-2000.
4. Levine JS,
Branch DW, Rauch J. The
antiphospholipid
syndrome. N Engl J Med
2002; 346:
752-63.
5. Unlu O, Erkan
D. Catastrophic antiphospholipid
syndrome:
candidate therapies
for a
potentially lethal disease. Annu
Rev Med 2017;
68: 287-96.
6. Greinacher A.
Heparin-induced thrombocytopenia.
N Engl J Med
2015; 373:
1883-4.
7. Weinsaft JW,
Kim HW, Shah DJ, et al.
Detection of
left ventricular thrombus by
delayed-enhancement
cardiovascular magnetic
resonance
prevalence and markers
in patients with
systolic dysfunction. J Am
Coll Cardiol
2008; 52: 148-57.
8. Vaitkus PT,
Barnathan ES. Embolic
potential,
prevention and management
of mural
thrombus complicating anterior
myocardial
infarction: a meta-analysis.
J Am Coll
Cardiol 1993; 22: 1004-9.
9. Srichai MB,
Junor C, Rodriguez LL,
et al. Clinical,
imaging, and pathological
characteristics
of left ventricular thrombus:
a comparison of
contrast-enhanced
magnetic
resonance imaging, transthoracic
echocardiography,
and transesophageal
echocardiography
with surgical or pathological
validation. Am
Heart J 2006; 152:
75-84.
10. Reynen K.
Cardiac myxomas. N Engl J
Med 1995; 333:
1610-7.
11. Gewitz MH,
Baltimore RS, Tani LY,
et al. Revision
of the Jones criteria for
the diagnosis of
acute rheumatic fever
in the era of
Doppler echocardiography:
a scientific
statement from the American
Heart
Association. Circulation 2015; 131:
1806-18.
12. Hoen B,
Duval X. Infective endocarditis.
N Engl J Med
2013; 369: 785.
13. Houpikian P,
Raoult D. Blood culturenegative
endocarditis in
a reference center:
etiologic
diagnosis of 348 cases.
Medicine
(Baltimore) 2005; 84: 162-73.
14. Lamas CC,
Eykyn SJ. Suggested modifications
to the Duke
criteria for the clinical
diagnosis of
native valve and prosthetic
valve
endocarditis: analysis of 118 pathologically
proven cases.
Clin Infect Dis
1997; 25: 713-9.
15. Gross L,
Friedberg CK. Nonbacterial
thrombotic
endocarditis: classification and
general
description. Arch Intern Med (Chic)
1936; 58: 620-40
(https://jamanetwork .com/
journals/
jamainternalmedicine/ article
-abstract/
542036).
16. Deppisch LM,
Fayemi AO. Non-bacterial
thrombotic
endocarditis: clinicopathologic
correlations. Am
Heart J 1976; 92:
723-9.
17. Edoute Y,
Haim N, Rinkevich D,
Brenner B,
Reisner SA. Cardiac valvular
vegetations in
cancer patients: a prospective
echocardiographic
study of 200 patients.
Am J Med 1997;
102: 252-8.
18. MacDonald
RA, Robbins SL. The significance
of nonbacterial
thrombotic endocarditis:
an autopsy and
clinical study
of 78 cases. Ann
Intern Med 1957; 46: 255-
73.
19. Kim HS,
Suzuki M, Lie JT, Titus JL.
Nonbacterial
thrombotic endocarditis
(NBTE) and
disseminated intravascular
coagulation
(DIC): autopsy study of 36
patients. Arch
Pathol Lab Med 1977; 101:
65-8.
20. Hojnik M,
George J, Ziporen L, Shoenfeld
Y. Heart valve
involvement (Libman-
Sacks
endocarditis) in the antiphospholipid
syndrome.
Circulation 1996; 93: 1579-87.
21. Lopez JA,
Ross RS, Fishbein MC, Siegel
RJ. Nonbacterial
thrombotic endocarditis:
a review. Am
Heart J 1987; 113: 773-84.
22. Singhal AB,
Topcuoglu MA, Buonanno
FS. Acute
ischemic stroke patterns in
infective and
nonbacterial thrombotic endocarditis:
a
diffusion-weighted magnetic
resonance
imaging study. Stroke 2002;
33: 1267-73.
23. Salem DN,
Stein PD, Al-Ahmad A,
et al.
Antithrombotic therapy in valvular
heart disease —
native and prosthetic: the
Seventh ACCP
Conference on Antithrombotic
and Thrombolytic
Therapy. Chest
2004; 126:
Suppl: 457S-482S.
24. Oken MM,
Creech RH, Tormey DC,
et al. Toxicity
and response criteria of the
Eastern
Cooperative Oncology Group. Am
J Clin Oncol
1982; 5: 649-55.
25. Goldstraw P,
Crowley J, Chansky K,
et al. The IASLC
Lung Cancer Staging
Project:
proposals for the revision of the
TNM stage
groupings in the forthcoming
(seventh)
edition of the TNM Classification
of Malignant
Tumours. J Thorac Oncol
2007; 2: 706-14.
26. Hanna N,
Johnson D, Temin S, et al.
Systemic therapy
for stage IV non-smallcell
lung cancer:
American Society of
Clinical
Oncology clinical practice guideline
update. J Clin Oncol 2017; 35: 3484-
515.
27. Reck M, Rodríguez-Abreu D, Robinson
AG, et al. Pembrolizumab versus chemotherapy
for
PD-L1–positive non–smallcell
lung cancer. N
Engl J Med 2016; 375:
1823-33.