La pustulosis palmoplantar (PPP) es una afección
inflamatoria crónica caracterizada por grupos de pústulas estériles en las
palmas y las plantas que erupcionan repetidamente con el tiempo. Las máculas de
color amarillo-marrón (restos de pústulas en resolución), eritema, escamas y
fisuras son hallazgos frecuentes adicionales. Otros términos que se han usado
para referirse a PPP son psoriasis pustulosa palmoplantar, pustulosis
palmoplantaris y pustulosis palmaris et plantaris.
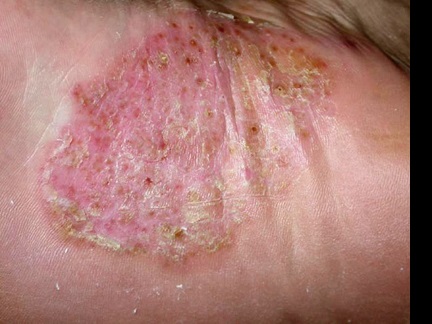
Figura 1.Pustulosis palmoplantar
Múltiples máculas y pústulas marrones están
presentes en una placa eritematosa e hiperqueratótica en el pie plantar.
Figura 2. Pustulosis palmoplantar
Pústulas dentro de una placa eritematosa y escamosa
en el talón lateral.
Figura 3. Pustulosis palmoplantar
Pústulas profundas con eritema circundante y escamas
que afectan toda la superficie palmar de este paciente con pustulosis
palmoplantar. Las lesiones más antiguas generalmente aparecen de color
rojo-marrón oscuro con costras.
Figura 4. Pustulosis palmoplantar
Pústulas, máculas marrones (restos de pústulas),
eritema e hiperqueratosis en las plantas de los pies.
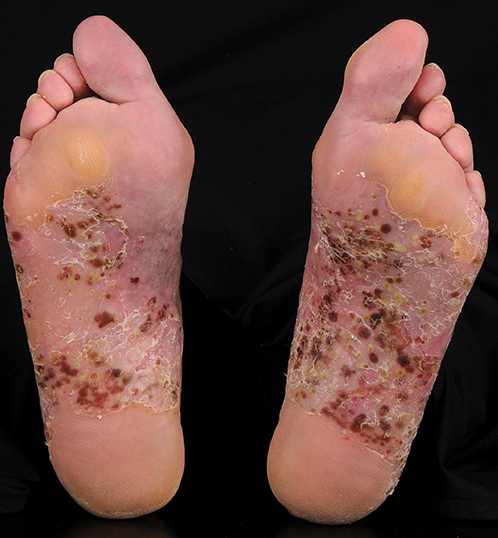
Figura 5. Pustulosis palmoplantar
Numerosas pústulas, máculas marrones (restos de
pústulas), eritema e hiperqueratosis en las plantas de los pies.
Figura 6. Pustulosis palmoplantar
Área focal de pústulas, máculas marrones (restos de
pústulas), eritema e hiperqueratosis en la planta del pie.
A pesar del área limitada de participación de la
piel en la PPP, la afección puede tener un efecto negativo significativo en la
calidad de vida. Los síntomas de prurito, sensación de ardor o dolor a menudo
están presentes. En casos severos, la incomodidad asociada con la afectación de
la piel puede causar dificultad para caminar u otras actividades de la vida
diaria.
La clasificación de la pustulosis palmoplantar (PPP)
es controvertida. Mientras que algunos autores proponen que la PPP es una
variante de la psoriasis, otros consideran que la enfermedad es una condición
separada.
Los autores que consideran la PPP como un subtipo de
psoriasis lo han hecho basándose en el reconocimiento de similitudes entre las
condiciones. Un estudio retrospectivo que comparó 39 pacientes con PPP y 51
pacientes con psoriasis en placa palmoplantar (una forma no pustulosa de
psoriasis caracterizada por placas escamosas eritematosas en las palmas y las
plantas) no encontró diferencias estadísticamente significativas en la edad de
inicio, enfermedad duración, antecedentes familiares de psoriasis, artritis
concomitante o tabaquismo entre los dos grupos. Además, las placas eritematosas
y escamosas similares a las de la psoriasis en placa palmoplantar
frecuentemente acompañan a las pústulas en PPP.
Otros hallazgos que sugieren una relación directa
entre PPP y psoriasis incluyen la detección de placas similares a psoriasis en
el tronco o las extremidades de algunos pacientes con PPP. Además, se han
reportado antecedentes familiares de psoriasis en 10 a 43 por ciento de los
pacientes con PPP. Un estudio retrospectivo escocés de 73 pacientes con PPP
encontró antecedentes familiares de psoriasis en placas crónica o PPP en 21 y 3
por ciento de los pacientes, respectivamente, un diagnóstico concomitante de
PPP y psoriasis en placas crónica en 27 por ciento, y artritis psoriásica
concurrente en 12 por ciento. Estas prevalencias son 10 a 15 veces más altas
que en la población general y sugieren una estrecha asociación entre las dos
enfermedades.
Las observaciones utilizadas para negar la
designación de PPP como una variante de la psoriasis incluyen la fuerte
asociación de PPP con el tabaquismo (una asociación mucho más fuerte que la
psoriasis vulgar), el predominio femenino en PPP, la falta de una asociación
entre PPP y el locus de susceptibilidad a psoriasis PSORS1 (el principal
determinante genético para la psoriasis vulgar), la asociación de PPP con
alergias a metales y las diferencias en
la respuesta de PPP y psoriasis a la terapia. Un estudio adicional de los
mecanismos patogénicos de la PPP puede ayudar a resolver la controversia sobre
la relación entre la psoriasis y la PPP.
EPIDEMIOLOGÍA
Los datos epidemiológicos sobre la pustulosis
palmoplantar (PPP) son limitados. En general, la PPP parece ser poco común en
la población general. Un estudio de 1971 que utilizó datos de registros
ambulatorios de un departamento de dermatología sueco encontró una prevalencia
de PPP en relación con otras enfermedades de la piel del 0,37 por ciento de los
pacientes. Los pacientes con signos de psoriasis en otras partes del cuerpo
fueron excluidos en este estudio. Además, una revisión de los datos de reclamos
recopilados entre abril de 2010 y marzo de 2011 de una base de datos nacional
japonesa encontró una prevalencia de PPP del 0,12 por ciento, de los cuales el
8,5 por ciento tenía un diagnóstico concomitante de psoriasis. En nuestra
experiencia personal en una práctica académica de dermatología, PPP parece
presentarse un poco más a menudo.
La PPP generalmente se desarrolla en adultos de
mediana edad. La edad media de inicio en un estudio retrospectivo que incluyó a
39 pacientes con PPP fue de 48 años. En el estudio japonés a nivel nacional,
las prevalencias más altas de PPP ocurrieron entre las edades de 50 y 69 años.
La PPP ocurre con mayor frecuencia en mujeres que en hombres; Los estudios
observacionales de varias partes del mundo han encontrado proporciones de
pacientes femeninas que van del 58 al 94 por ciento.
PATOGÉNESIS
La patogenia de la pustulosis palmoplantar (PPP) no
se conoce completamente. Se proponen contribuciones de componentes de los
sistemas inmunes innatos y adaptativos. La exposición ambiental y la
susceptibilidad genética también pueden contribuir a la PPP.
Mecanismo : los estudios que investigan los
mecanismos de la PPP han arrojado varias observaciones sobre el desarrollo de
esta enfermedad:
•El acrosyringium, que es el conducto espiral
intraepidérmico de las glándulas écrinas, parece ser el sitio primario de
formación de vesículas / pústulas e inflamación, y una anormalidad en la
sudoración puede contribuir a la formación de vesículas y pústulas en PPP. El
hallazgo de que los pacientes con PPP en Japón aumentan el uso de los servicios
de atención médica durante la temporada de calor en comparación con la
temporada de frío también puede apoyar el papel de la sudoración como
contribuyente a la PPP.
•El proceso inflamatorio que destruye el
acrosyringium involucra linfocitos, neutrófilos, eosinófilos y mastocitos.
•Se ha detectado un mayor número de células de
Langerhans alrededor de los conductos de sudor en la piel PPP, lo que sugiere
la posibilidad de un proceso impulsado por antígenos.
•Factores quimiotácticos específicos pueden
contribuir al desarrollo o propagación del proceso inflamatorio en PPP:
-Aumento de la expresión de interleucina (IL) -8 (un
quimioatrayente neutrófilo conocido) y citocinas relacionadas con IL-17 (por
ejemplo, IL-17A, IL-17C, IL-17 D, IL-17 F, IL-22, IL-23A, IL-23 receptor) se ha
detectado en el tejido PPP [ 19 , 20 ]; En particular, la expresión de IL-17 se
ha detectado en el acrosyringium.
-Se han detectado niveles séricos elevados de factor
de necrosis tumoral alfa (TNF-alfa), IL-17, IL-22 e interferón gamma (IFN-gamma)
en pacientes con PPP.
Se necesitan estudios adicionales para dilucidar
cómo interactúan estos factores en el desarrollo de PPP.
Factores ambientales: las observaciones clínicas
sugieren que fumar, el estrés, las infecciones y las drogas pueden contribuir
al desarrollo o exacerbación de la PPP.
•Fumar : existe una fuerte asociación entre fumar y
PPP, lo que sugiere que fumar tiene un papel en la patogénesis de esta
enfermedad. Las prevalencias reportadas de tabaquismo actual o anterior entre
pacientes con PPP oscilan entre 42 y 100 por ciento. No se ha establecido el
mecanismo a través del cual fumar podría contribuir a la PPP. Los mecanismos
propuestos han incluido los efectos de la nicotina sobre la función de las
glándulas sudoríparas o la función de los queratinocitos (p. Ej., Aumento
inducido por la nicotina en la cornificación de los queratinocitos). Además,
las diferencias en los patrones de tinción del receptor de acetilcolina de
nicotina en la piel PPP observadas en un estudio de muestras de biopsia tomadas
de pacientes con PPP, fumadores sanos y no fumadores sanos llevaron a
considerar que una respuesta anormal a la nicotina podría contribuir a la
inflamación.
•Estrés : la observación de que los pacientes con
PPP informan con frecuencia un empeoramiento de los síntomas con estrés llevó a
un estudio que investiga las fibras nerviosas de la piel en la piel afectada.
El estudio encontró un mayor número de contactos entre los nervios y los
mastocitos y una inmunorreactividad intensa similar a la sustancia P en los
neutrófilos en las pústulas y la dermis papilar, lo que sugiere un papel para
la neuromedicación en el proceso inflamatorio de PPP. Además, un estudio de 21
pacientes con PPP y 21 controles pareados por edad y sexo encontró una tasa más
alta de ansiedad moderada a alta entre los pacientes con PPP que en la
población de control (61 versus 19 por ciento).
•Infección : las infecciones focales (p. Ej.,
Amigdalitis aguda o crónica, infección dental, sinusitis crónica) pueden estar
asociadas con PPP. Los informes de Japón documentan episodios de PPP que siguen
a la infección, empeoran en el contexto de la infección o mejoran después del
tratamiento de la infección. Además, se han detectado diferencias en las
respuestas inmunitarias en el tejido amigdalar en pacientes japoneses con PPP.
•Fármacos : existen múltiples informes sobre el
desarrollo de PPP después del tratamiento con inhibidores biológicos de
TNF-alfa. El mecanismo detrás de este hecho no se conoce definitivamente.
Paradójicamente, los inhibidores biológicos de TNF-alfa también se han
utilizado para el tratamiento de la PPP.
•Alergia al metal: algunos autores han sugerido un
papel para la alergia al metal en el desarrollo de PPP basándose en
observaciones en un pequeño número de pacientes. Un informe describe una
exacerbación de PPP luego de una prueba de parche de níquel fuertemente positiva.
Sin embargo, faltan datos suficientes para confirmar una asociación.
●Genética: aunque la PPP no parece estar asociada
con el locus PSORS1 que está fuertemente asociado con la psoriasis vulgaris,
otros factores genéticos comunes a ambas enfermedades pueden influir en el
riesgo de un individuo de desarrollar PPP. Los resultados de un estudio de 43
pacientes con PPP y 149 controles sanos sugieren que las variaciones de los
genes IL19, IL20 e IL24 pueden influir en el riesgo de PPP y psoriasis vulgar.
Además, las variantes sin sentido en el gen CARD14 pueden estar involucradas en
la patogénesis de la PPP, así como en la psoriasis vulgar y la psoriasis
pustulosa generalizada [ 10 ].
Se han comparado los hallazgos genéticos de
pacientes afectados por PPP con y sin psoriasis en placa concomitante. Un
estudio que utilizó microarrays de expresión génica para comparar biopsias de
piel de PPP con psoriasis en placa concomitante con biopsias de piel de PPP sin
psoriasis en placa concomitante encontró que estas entidades no podían
distinguirse en función de la expresión génica, lo que sugiere una relación
entre estas condiciones. Los mismos autores encontraron un aumento en la expresión
del gen IL-17 sin un aumento en IL-23 en PPP con y sin psoriasis en placa
concomitante, una característica que puede contribuir a respuestas pobres de
PPP a ustekinumab , un inhibidor de IL-12 e IL- 23.
MANIFESTACIONES CLÍNICAS
Las manifestaciones clínicas de la pustulosis
palmoplantar (PPP) consisten en los hallazgos clásicos en las palmas o las
plantas y las características clínicas cutáneas y extracutáneas asociadas.
Manifestaciones cutáneas : la
PPP se caracteriza por el desarrollo de cultivos recurrentes de pústulas
estériles discretas de 1 a 10 mm limitadas a las palmas y / o plantas de los
pies ( imágenes 1 a 6). Las pústulas a menudo se unen y se resuelven después de
varios días, dejando máculas marrones e hiperqueratosis. El eritema bien delimitado,
la hiperqueratosis y la descamación a menudo rodean los sitios de pustulación.
Los pacientes con PPP pueden tener afectación solo
de las palmas o solo las plantas de los pies; sin embargo, la participación de
las palmas y las plantas es más común. En las manos, las eminencias tenar e
hipotenar y la palma central son sitios comunes para el desarrollo de la
pústula. El empeine, los bordes medial y lateral del pie frente al empeine, y
los lados o la parte posterior del talón son sitios comunes de PPP en los pies.
La afectación difusa de las palmas o las plantas también puede ocurrir (Figuras
7,8,9). La distribución suele ser bilateral, pero también puede ser unilateral,
especialmente al inicio de la enfermedad.
Figura 7. Pustulosis palmoplantar
Pústulas, escamas y eritema en la palma de la mano.
Figura 8. Pustulosis palmoplantar
Eritema, escamas, pústulas y máculas marrones en las
palmas.
Figura 9. Pustulosis palmoplantar
Pústulas profundas con eritema circundante y escamas
que afectan toda la superficie palmar de este paciente con pustulosis
palmoplantar. Las lesiones más antiguas generalmente aparecen de color
rojo-marrón oscuro con costras.
El impacto de la PPP en la calidad de vida puede ser
significativo y no debe subestimarse. Con frecuencia, los pacientes
experimentan síntomas de picazón y ardor en las áreas afectadas, y pueden
formarse fisuras, que causan dolor y sangrado. Las erupciones graves pueden
inhibir la capacidad del paciente para caminar o realizar otras actividades que
requieren el uso de las manos o los pies.
Hallazgos clínicos asociados : los
pacientes con PPP pueden desarrollar hallazgos clínicos adicionales, que
incluyen erupciones cutáneas no pustulares, distrofia ungueal y artritis.
● ●Afectación de la piel extrapalmoplantar: el
desarrollo de erupciones cutáneas similares a la psoriasis no pustulosa en
otras áreas, como antebrazos, codos, pies dorsales, piernas, rodillas o
glúteos, se ha descrito en pacientes con PPP. Estas lesiones cutáneas
extrapalmoplantarias tienden a ser menos pronunciadas y menos delimitadas que
la psoriasis en placas clásica ( figura 8 ). Otros hallazgos potenciales
incluyen escamas y eritema en el cuero cabelludo y, con poca frecuencia,
pústulas solitarias en áreas distintas de las manos y los pies. Los cambios en
la piel extrapalmoplantar pueden ser más probables en pacientes con PPP grave
que en pacientes con enfermedad más leve.
La proporción de pacientes con afectación de la piel
extrapalmoplantar es difícil de evaluar porque algunos estudios han excluido
intencionalmente a los pacientes con lesiones psoriásicas extrapalmoplantares y
las estimaciones reportadas para la psoriasis extrapalmoplantar en pacientes
con PPP varían ampliamente, variando del 4 al 73 por ciento.
● ●Anomalías de la uña - anomalías de las uñas son
comunes en pacientes con PPP. Se pueden observar pústulas subungueales,
onicólisis, picaduras, destrucción de la uña o decoloración de la placa ungueal
( imagen 9 ) . En una serie de 50 adultos con PPP, las anormalidades ungueales
estuvieron presentes en 15 pacientes (30 por ciento) y la pustulación
subungueal fue la anormalidad ungueal más común observada.
● ●Artritis : un subconjunto de pacientes con PPP
tiene artritis concomitante, artralgias o formas de artritis no especificadas.
En nuestro estudio retrospectivo de 39 pacientes con PPP, 10 pacientes también
tenían artritis (26 por ciento), de acuerdo con otros informes de la literatura.
Ninguno de estos pacientes tenía síndrome de SAPHO.
TRASTORNOS ASOCIADOS
Varias anomalías sistémicas se han relacionado con
la pustulosis palmoplantar (PPP).
Síndrome de SAPHO
- PPP es una de las
manifestaciones cutáneas que pueden ocurrir en pacientes con síndrome de SAPHO
(sinovitis, acné, pustulosis, hiperostosis, osteitis), una artropatía rara
caracterizada por diversas presentaciones de artropatía y una variedad de
trastornos de la piel neutrofílica. La artropatía del síndrome de SAPHO
comúnmente involucra la pared torácica anterior y puede presentarse con dolor,
sensibilidad e hinchazón del esternón y sus articulaciones.
Las características osteoarticulares a menudo
preceden a los hallazgos de la piel, pero pueden aparecer de manera
concomitante o posterior a la afectación de la piel. Otros trastornos de la
piel pustulosa que pueden ocurrir en el contexto del síndrome de SAPHO son la
psoriasis, el acné conglobata, el acné fulminante, la celulitis disecante del
cuero cabelludo y la hidradenitis supurativa.
Enfermedades sistémicas: la
relación entre PPP y enfermedades sistémicas es controvertida. Los datos
limitados sugieren que pueden producirse varias anormalidades sistémicas con
mayor frecuencia en pacientes con PPP, como enfermedad tiroidea, homeostasis de
calcio alterada, diabetes y dislipidemia.
Se necesitan más estudios para confirmar una relación entre PPP y estas
condiciones. Un estudio sueco de 123 pacientes con PPP sugirió una mayor
prevalencia de sensibilidad al gluten; sin embargo, un estudio alemán no
encontró una asociación entre PPP y la sensibilidad al gluten, lo que sugiere
una variabilidad geográfica o étnica.
CURSO DE LA ENFERMEDAD
La pustulosis palmoplantar a menudo persiste durante
varios años o décadas, con períodos frecuentes de exacerbación de la enfermedad
y remisiones parciales. La enfermedad puede afectar significativamente la
calidad de vida secundaria a la incomodidad y la discapacidad funcional
resultante.
DIAGNÓSTICO
El diagnóstico de pustulosis palmoplantar
generalmente se puede hacer en base al reconocimiento de los hallazgos clínicos
de una erupción pustulosa limitada a las palmas y / o plantas con eritema e
hiperqueratosis asociados y una evaluación clínica para descartar otras
afecciones. El rendimiento de una preparación de hidróxido de potasio (KOH) (o
cultivo fúngico) es particularmente importante para descartar la infección
micótica cutánea como la causa de los síntomas en pacientes con afectación
plantar.
Por lo general, no es necesaria una biopsia de piel,
pero puede ser útil para apoyar el diagnóstico en pacientes con presentaciones atípicas
o enfermedad refractaria. Se debe realizar una preparación de KOH antes de una
biopsia de piel para evitar una biopsia innecesaria.
Historia y examen físico: los
hallazgos físicos esperados de PPP son pústulas múltiples en las palmas y / o
plantas de los pies, a menudo con eritema e hiperqueratosis circundantes. Las
máculas marrones en los sitios de resolución de pústulas, fisuras y cambios en
las uñas también pueden estar presentes. Si las vesículas en lugar de las
pústulas son el hallazgo primario, se debe considerar la posibilidad de eccema
palmoplantar agudo (eczema dishidrótico).
Además de un examen físico de las palmas y las
plantas, se indica un examen completo de la piel y las uñas. El examen completo
de la piel permite al médico descartar la psoriasis pustular generalizada con
afectación palmoplantar, identificar la presencia de lesiones cutáneas
extrapalmoplantarias y detectar manifestaciones adicionales de la piel que
podrían sugerir síndrome de SAPHO (p. Ej., Acné, celulitis disecante,
hidradenitis supurativa) .
La evaluación clínica también debe incluir una
revisión de los sistemas que incluye preguntas sobre el dolor óseo o articular
para identificar síntomas sugestivos de artritis concomitante o síndrome de
SAPHO. Debido a la posible asociación de PPP con anormalidades de la tiroides y
la sensibilidad al gluten, también cuestionamos a los pacientes sobre los
síntomas de la enfermedad de la tiroides o la sensibilidad al gluten (p. Ej.,
Diarrea, esteatorrea, flatulencia), así como los antecedentes personales o
familiares de estas enfermedades.
Preparación de hidróxido de potasio :
generalmente realizamos una preparación de KOH en pacientes que
presentan hallazgos clínicos sugestivos de PPP para descartar la posibilidad de
una infección por dermatofitos como causa de la erupción. Alternativamente, se
puede realizar un cultivo fúngico.
Cultivo bacteriano
: las pústulas de PPP son
estériles. Los cultivos bacterianos se reservan principalmente para
presentaciones atípicas para descartar infección.
Biopsia de piel
- Las biopsias de piel a menudo
no son necesarios para el diagnóstico. Sin embargo, en los casos en que el
diagnóstico es incierto, las biopsias pueden ser útiles para respaldar el
diagnóstico. Nuestro procedimiento preferido es una biopsia por punción de 4 mm
que incluye al menos una porción de una pústula y eritema circundante.
Histopatología: los hallazgos histológicos que
son consistentes con un diagnóstico de PPP incluyen:
● ●Cambios epidérmicos (paraqueratosis, pérdida de
capa granular, hiperplasia epidérmica psoriasiforme)
● ●Espongiosis o formación de vesículas epidérmicas
(en lesiones tempranas)
● ●Pústulas llenas de neutrófilos y eosinófilos en
la epidermis superior.
● ●Acumulación de mastocitos y eosinófilos debajo de
las pústulas en la dermis superior
● ●Infiltrado mixto perivascular y difuso en la
dermis (linfocitos, neutrófilos, eosinófilos, mastocitos)
Los estudios de laboratorio - Se
espera que las pruebas de laboratorio a ser normal. Si existe sospecha clínica
de trastornos que pueden ocurrir con mayor frecuencia en pacientes con PPP,
incluida la enfermedad de la tiroides, la sensibilidad al gluten o la diabetes,
se debe iniciar una evaluación de laboratorio para estos trastornos.
DIAGNÓSTICO DIFERENCIAL
Varios otros trastornos de la piel que pueden
presentarse con pústulas, eritema y / o escamas en las palmas o las plantas se
incluyen en el diagnóstico diferencial de la pustulosis palmoplantar (PPP).
● ●Psoriasis en placa palmoplantar: la psoriasis en
placa palmoplantar es una psoriasis en placa que afecta principalmente al área
palmoplantar. Los pacientes presentan placas eritematosas y escamosas en las
palmas y / o plantas de los pies ( figura 10 ). Las fisuras son comunes. La
ausencia de pústulas distingue la psoriasis en placa palmoplantar de la PPP.
Figura 10 Placas eritematosas y escamosas en las
palmas de una paciente con psoriasis.
● ●Eccema palmoplantar agudo: el eccema palmoplantar
agudo (eczema dishidrótico, pompholyx) es un trastorno recurrente del
palmoplantar vesiculobuloso que se presenta comúnmente como una erupción aguda
e intensamente pruriginosa de vesículas pequeñas a ampollas grandes en las
caras laterales de los dedos, palmas y / o plantas de los pies. ( imagen 11,
12, 13) Aunque las pústulas no son una característica principal del eccema
palmoplantar agudo, las pústulas pueden desarrollarse como resultado de una
infección secundaria. La ausencia de lesiones eritematosas hiperqueratósicas y
bien definidas que tienden a agrietarse en el eccema palmoplantar agudo
facilita la distinción clínica entre PPP y eccema palmoplantar agudo. Los
hallazgos histológicos de PPP pueden ser difíciles de distinguir del eccema
palmoplantar agudo con pústulas porque los trastornos comparten múltiples características
histopatológicas.
Figura 11. Eccema dishidrótico
Vesículas y ampollas en las palmas y los dedos.
Figura 12. Eczema dishidrótico de gravedad moderada.
En el eczema dishidrótico agudo palmar, las
vesículas son tensas, profundas y multiloculares, lo que resulta en una
apariencia de "pudín de tapioca".
Figura 13. Eczema dishidrótico severo
Las vesículas coalescentes involucran toda la
superficie palmar en este paciente con eczema dishidrótico severo.
● ●Acrodermatitis continua de Hallopea: la
acrodermatitis continua de Hallopeau es una variante rara y crónica de la
psoriasis pustulosa caracterizada por la presencia de pústulas estériles que
afectan las uñas y la piel circundante de los dedos de manos y pies ( imagen 14
y 15 ). Pueden ocurrir paroniquia asociada, onicodistrofia, cambios atróficos
en la piel y osteólisis de las falanges distales. El término acropustulosis
repens se ha utilizado para describir una presentación más leve . La
participación primaria de los dígitos distingue este trastorno de la PPP.
Figura 14. Acrodermatitis continua de Hallopeau
Pústulas que involucran el lecho ungueal.
Figura 15. Acrodermatitis continua de Hallopeau
El eritema, las pústulas y la distrofia ungueal
están presentes en la zona distal del
dedo.
● ●Tiña del pie vesicular / ampollosa o manuum - La
tiña del pie vesicular (pie) o manuum resultan de la infección por dermatofitos
en las áreas palmar, plantar o interdigitales. Los pacientes afectados
presentan vesículas o vesicopústulas con escala asociada y eritema ( imagen 16
y 17 ). Una preparación de hidróxido de potasio (KOH) o cultivo fúngico es útil
para diagnosticar esta afección.
Figura 16. Tinea pedis ampollosa
Vesículas y ampollas en la piel plantar de un
paciente con tinea pedis.
Figura 17. Tiña pedis aguda
El parte medial del dedo gordo del pie izquierdo
muestra lesiones papulovesiculares eritematosas causadas por Trichophyton
mentagrophytes .
En casos raros, el pénfigo vulgar puede presentarse
como una erupción vesicular o vesiculopustular en las palmas de las manos o las
plantas de los pies que puede confundirse con eczema dishidrótico o PPP. Un
paciente en el que el pénfigo vulgar que se manifiesta como vesiculopústulas en
las palmas y las plantas precedió a otras manifestaciones de pénfigo ha sido
documentado en un informe de caso. Una biopsia que revela disqueratosis acantolítica
intraepidérmica y suprabasilar e inmunofluorescencia directa que demuestra
depósitos intraepidérmicos de IgG confirma el diagnóstico de pénfigo vulgar.
TRATAMIENTO
MEDIDAS GENERALES
Independientemente de la gravedad de la enfermedad,
alentamos a todos los pacientes a participar en los siguientes cambios de
comportamiento en un intento de minimizar los síntomas y las exacerbaciones de
la enfermedad:
● ●Hidratación de la piel - hidratación de la piel
puede ayudar a mediar en el malestar asociado con palmoplantar pustulosis (PPP)
al ayudar a minimizar la formación de grietas y fisuras en la piel. Alentamos a
los pacientes a aplicar una crema hidratante suave, sin perfume y emoliente en
las áreas afectadas y la piel circundante varias veces al día, según sea
necesario.
● ●Evitar irritantes : la experiencia clínica
sugiere que la irritación de la piel puede contribuir a las exacerbaciones de
PPP. En particular, alentamos a los pacientes a evitar el trabajo húmedo con
las manos (p. Ej., Lavar artículos con detergentes o jabones) o usar guantes
cuando participen en dicha actividad.
● ●Dejar de fumar : aunque los datos son
insuficientes para obtener conclusiones definitivas sobre el efecto de dejar de
fumar en el curso de la PPP, alentamos a todos nuestros pacientes con PPP a
dejar de fumar en base al conocimiento del fuerte vínculo entre fumar y PPP .
Los resultados de un estudio prospectivo no controlado de 63 fumadores adultos
con PPP sugieren que puede ser beneficioso dejar de fumar; Se observaron mejoras
estadísticamente significativas en el número de pústulas y puntuaciones de
pacientes para la gravedad de la enfermedad después de tres a seis meses entre
los pacientes que dejaron de fumar, pero no entre el resto de los pacientes [
3] Una alta tasa de abandono fue una de las limitaciones de este estudio.
TERAPIA DE PRIMERA LINEA
Las opciones terapéuticas de primera línea para la
pustulosis palmoplantar (PPP) incluyen corticosteroides tópicos, un retinoide
oral y fotoquimioterapia.
Los corticosteroides tópicos son a menudo nuestra
elección inicial para la PPP limitada (afectación focal en las palmas de las
manos o las plantas de los pies) en función de la facilidad de administración y
la naturaleza bien tolerada de estos agentes. Sin embargo, cuando los pacientes
presentan una enfermedad extensa (afectación palmar o plantar difusa),
generalmente comenzamos el tratamiento con retinoides o la fotoquimioterapia
por vía oral inmediatamente junto con la terapia tópica con corticosteroides.
Los corticosteroides tópicos -
terapia corticosteroide tópico es una terapia de primera línea aceptado
para PPP y es el tratamiento más ampliamente utilizado. La principal ventaja de
la terapia con corticosteroides tópicos es que es un tratamiento dirigido a la
piel con un bajo riesgo de efectos adversos graves que el paciente puede
administrar. Todavía se requiere un seguimiento clínico para garantizar el uso
adecuado de los corticosteroides tópicos.
● ●Eficacia : existen pocos datos sobre la eficacia
de los corticosteroides tópicos para la PPP. Un ensayo abierto de derecha a
izquierda en el que 19 pacientes con PPP bilateral fueron asignados
aleatoriamente para aplicar crema de triamcinolona al 0.1% (un corticosteroide
tópico de potencia media) debajo de un apósito hidrocoloide a sitios de PPP en
un lado del cuerpo cada tres días y a aplicar propionato de clobetasol en crema
al 0.05% (un corticosteroide tópico de súper alta potencia) dos veces al día
sin oclusión en el lado contralateral encontró que ambos tratamientos indujeron
una mejoría en PPP después de cuatro semanas.
Sin embargo, se desarrolló una mejoría clínica significativamente mayor
en los sitios tratados con triamcinolona bajo oclusión que en los sitios tratados
con clobetasol sin oclusión. Además, el aclaramiento completo se produjo con
mayor frecuencia en la triamcinolona debajo de las áreas de oclusión (63 frente
al 16 por ciento de las áreas tratadas). Las respuestas a ambos tratamientos
fueron transitorias; los síntomas reaparecieron a las pocas semanas después del
cese del tratamiento.
El estudio retrospectivo también sugiere el
beneficio de la terapia tópica con corticosteroides. Entre 49 pacientes con PPP
que fueron tratados con corticosteroides tópicos de alta potencia (dos veces al
día durante un máximo de cuatro semanas seguidos de un uso menos frecuente de
corticosteroides tópicos de baja potencia), se documentaron mejoras marcadas,
moderadas, parciales y ninguna mejora en 27, 29, 20. y 24 por ciento de los
pacientes, respectivamente.
● ●Administración : nuestro régimen preferido para
la terapia con corticosteroides tópicos es un corticosteroide tópico de super
alta potencia aplicado bajo oclusión. Por lo general, instruimos a los
pacientes a aplicar el corticosteroide tópico debajo de un apósito
hidrocoloide. El corticosteroide tópico y un apósito hidrocoloide se vuelven a
aplicar cada tres días hasta que se elimine la PPP activa o durante un máximo
de cuatro semanas. Una respuesta al tratamiento generalmente es evidente dentro
de las primeras dos semanas.
Si no hay signos de mejoría clínica después de
cuatro semanas o si empeora los síntomas, generalmente comenzamos el
tratamiento con retinoides o la fotoquimioterapia. Si el paciente tiene una
mejoría parcial que parece continuar mejorando con un curso más prolongado de
terapia con corticosteroides tópicos, continuamos con la monoterapia con
corticosteroides tópicos por hasta cuatro semanas adicionales, pero disminuimos
la intensidad del tratamiento según lo tolerado.
Los métodos alternativos para realizar la oclusión
(p. Ej., Envoltura de plástico) son una opción, pero pueden requerir cambios de
apósito más frecuentes. Cuando se utiliza la oclusión con envoltura plástica,
les pedimos a los pacientes que apliquen la envoltura plástica sobre el
corticosteroide tópico todas las noches durante una semana, luego cada dos
noches durante dos semanas seguidas de aplicaciones dos veces por semana bajo
envoltura plástica durante hasta 13 semanas adicionales. Los corticosteroides
tópicos no se aplican en los días libres de oclusión. A menudo vemos una mejora
parcial en los primeros 10 a 20 días.
Una vez que los pacientes logran la resolución de la
enfermedad activa con la terapia tópica con corticosteroides, instituimos la
terapia de mantenimiento. Nuestro objetivo es reducir la intensidad del
tratamiento para la aplicación del corticosteroide tópico de alta potencia sin
oclusión dos días por semana.
La atrofia cutánea es un posible efecto adverso de
la terapia con corticosteroides tópicos, particularmente cuando se usan
corticosteroides tópicos de alta potencia.
Los retinoides orales - El
tratamiento sistémico con retinoides orales (por ejemplo, acitretina ,
etretinato) pueden ser eficaces para PPP.
● ●Eficacia : una revisión sistemática de 2006
identificó varios ensayos aleatorios que evaluaron la terapia con retinoides
orales para PPP. La combinación de datos de cuatro ensayos aleatorios que
compararon etretinato con placebo demostró que el 72 por ciento de 67 pacientes
tratados con etretinato en comparación con el 28 por ciento de 60 pacientes que
recibieron placebo mostraron alguna mejora en la PPP (índice de frecuencia
2,54, IC 95% 1,65-3,91). Además, el 39 frente al 17 por ciento,
respectivamente, logró respuestas buenas o excelentes (tasa de tasa 2,31; IC
del 95%). Las dosis utilizadas para la terapia con etretinato en estos ensayos
variaron; La duración del tratamiento varió de 8 a 16 semanas.
Aunque el etretinato ya no está disponible en muchos
lugares, incluidos los Estados Unidos, la acitretina , un metabolito del
etretinato, parece ser igualmente efectiva para la PPP. Un ensayo aleatorizado
que comparó etretinato con acitretina en 60 adultos con PPP encontró que ambos
tratamientos fueron igualmente efectivos para mejorar las manifestaciones
clínicas de PPP [ 7 ]. Los pacientes de ambos grupos recibieron 30 mg del
medicamento asignado durante cuatro semanas seguido de ajustes de dosis
ascendentes o descendentes de acuerdo con la mejoría clínica y la tolerancia al
tratamiento.
Aunque la alitretinoína , un retinoide oral más
nuevo, parecía beneficioso para la PPP en un estudio no controlado [ 8 ], un
ensayo aleatorizado de fase 2, en el que 33 adultos con PPP (con o sin
psoriasis) fueron asignados aleatoriamente en una proporción de 2: 1 a la
alitretinoína ( 30 mg una vez al día) o placebo durante un máximo de 24
semanas, no encontraron alitretinoína más efectiva que el placebo [ 9 ]. Se
necesitan estudios adicionales para confirmar los efectos de la alitretinoína
en la PPP.
● ●Administración : nuestro régimen de tratamiento
preferido para la PPP en adultos es un ciclo inicial de tres meses de
acitretina (50 mg por día). Por lo general, comenzamos con una dosis de 25 mg
de acitretina y aumentamos la dosis en 10 mg por semana según lo tolerado.
Algunas veces es necesario reducir la dosis para reducir los efectos
secundarios.
Una vez que se logra una mejora satisfactoria,
nuestro objetivo es reducir el medicamento a la dosis más baja requerida para
mantener la mejora. En dos ensayos aleatorizados, el tratamiento de
mantenimiento con etretinato demostró una mayor eficacia para mantener las
remisiones que el placebo.
Los efectos secundarios de los retinoides orales
pueden ser factores limitantes para la terapia. Los posibles efectos adversos incluyen
xerosis, queilitis, membranas mucosas secas, hipertrigliceridemia, pérdida de
cabello, anomalías en las pruebas de función hepática, cambios óseos y cambios
visuales. Los retinoides orales son teratogénicos y se debe evitar el embarazo
durante tres años después de la terapia con acitretina . Por lo tanto, la
acitretina tiene una contraindicación relativa para su uso en mujeres en edad
fértil.
Fotoquimioterapia
: la fotoquimioterapia con
psoraleno más ultravioleta A (PUVA), que implica la administración oral o
tópica de un psoraleno ( metoxsaleno ) antes de la exposición de las áreas
afectadas a la luz ultravioleta A, puede ser eficaz para la PPP. Por lo
general, administramos PUVA oral en lugar de PUVA tópico porque existe un mayor
apoyo para la eficacia de la terapia de PUVA oral. Además, en nuestra
experiencia, el PUVA tópico puede ser irritante para la piel y algunos
pacientes lo toleran mal.
El segundo ensayo comparó PUVA oral (tres veces por
semana), etretinato (0.6 mg / kg por día), terapia de combinación con PUVA oral
y etretinato, y placebo y ningún PUVA en un curso de 12 semanas. En este ensayo
abierto, treinta pacientes con PPP bilateral severa fueron asignados
aleatoriamente a terapia con etretinate o placebo, y después de dos semanas
comenzaron la fotoquimioterapia oral con PUVA en las áreas afectadas de un lado
del cuerpo. La proporción de las 12 áreas que recibieron 12 semanas de
monoterapia con PUVA que eliminaron o mostraron una mejoría fue
significativamente mayor que entre las 12 áreas afectadas asignadas a placebo y
sin PUVA (75 versus 17 por ciento). Los resultados entre las áreas tratadas con
monoterapia con etretinate no difirieron significativamente de la monoterapia
con PUVA oral, un hallazgo que contrasta con otro ensayo de 12 semanas que
favoreció etretinate sobre PUVA oral. La terapia combinada con un retinoide
oral y PUVA parece ser la terapia más efectiva.
Aunque se han documentado respuestas favorables al
PUVA tópico, los ensayos aleatorios que evalúan el PUVA tópico no han
demostrado una eficacia superior sobre el placebo. Un ensayo que comparó PUVA
oral y PUVA tópico no encontró una diferencia significativa en la eficacia. Sin
embargo, las tasas de respuesta al PUVA oral informadas en este ensayo fueron
más bajas que las informadas en otros estudios.
● ●Administración : por lo general, nuestro objetivo
es administrar PUVA oral tres veces por semana y continuar el tratamiento
durante al menos 12 semanas antes de concluir la ineficacia del tratamiento.
Los posibles efectos adversos del PUVA incluyen quemaduras, ampollas, náuseas,
prurito, fototoxicidad, hiperpigmentación, envejecimiento prematuro de la piel
y cáncer de piel. Los efectos adversos de PUVA se discuten en mayor detalle por
separado.
TERAPIA DE SEGUNDA LINEA
Los pacientes que no responden lo suficiente al
tratamiento de primera línea pueden beneficiarse de la terapia de combinación
con un retinoide oral y PUVA o de la terapia inmunosupresora.
Re-PUVA
: el término "Re-PUVA"
a menudo se usa para referirse a la terapia de combinación con un retinoide
oral y psoraleno oral o tópico más fotoquimioterapia ultravioleta A (PUVA). Los
pequeños ensayos aleatorios que han investigado la eficacia de este tratamiento
respaldan una mayor eficacia de Re-PUVA en comparación con un retinoide oral o
PUVA solo. Como ejemplo, un ensayo sin
cegamiento en el que 20 pacientes con pustulosis palmoplantar bilateral (PPP)
fueron asignados aleatoriamente a tratamiento con etretinato oral o sin
etretinato y se les administró PUVA tópico solo en la mano derecha y en el pie,
se encontró un aclaramiento completo en 6 de 10 sitios tratados con etretinate
y PUVA, 2 de 10 sitios tratados con etretinate solo, 1 de 10 sitios tratados
con PUVA solo, y ninguno de los 10 sitios que no recibieron tratamiento después
de 12 semanas. Un ensayo aleatorizado
separado de 20 semanas que comparó el etretinato y el PUVA oral con el PUVA
oral y el placebo en 17 pacientes con PPP y 3 pacientes con psoriasis
palmoplantar hiperqueratótica descubrió que la terapia combinada se asociaba
con una mayor probabilidad de respuesta, significativamente menos tratamientos
necesarios para el aclaramiento, y un tiempo de respuesta más corto [ 17 ]. El
PUVA oral se inició dos semanas después del inicio de la terapia con etretinato
y se administró tres veces por semana.
Por lo general, comenzamos la terapia con acitretina
(25 a 50 mg por día) dos a cuatro semanas antes del comienzo de la terapia con
PUVA cuando administramos el tratamiento con Re-PUVA. Una vez que se inicia el
tratamiento con PUVA, reducimos la dosis de acitretina a 10 a 20 mg por día.
Los tratamientos con PUVA se administran dos o tres días por semana. Somos
cautelosos con la dosis inicial de PUVA en esta población debido a la
preocupación por el adelgazamiento del estrato córneo inducido por retinoides,
lo que resulta en una mayor propensión a quemarse. Por lo tanto, reducimos
nuestra dosis inicial de PUVA en un 30 a 50 por ciento en comparación con la
dosis que usaríamos para un paciente que no está en tratamiento con retinoides
orales.
Inmunosupresores
: la terapia inmunosupresora con
ciclosporina o metotrexato puede ser beneficiosa para algunos pacientes con
PPP. Se debe considerar la posibilidad de efectos adversos graves antes del
inicio de estas terapias.
● ●Ciclosporina : algunos ensayos aleatorios
respaldan el uso de ciclosporina para la PPP. En un ensayo en el que 40
pacientes con PPP fueron asignados al azar al tratamiento con ciclosporina oral
(2.5 mg / kg por día) o placebo, 17 de 19 pacientes que completaron la fase de
tratamiento de cuatro semanas tuvieron al menos una reducción del 50 por ciento
en el número de pústulas en comparación con 4 de 15 pacientes en el grupo
placebo (89 versus 27 por ciento). Dosis más bajas de ciclosporina también
pueden ser efectivas. Un ensayo aleatorizado por el mismo grupo en el que 58
pacientes fueron asignados aleatoriamente a ciclosporina oral (1 mg / kg por
día) o placebo durante un mes encontró al menos una reducción del 50 por ciento
en las pústulas en el 48 por ciento de los 27 pacientes en el grupo de
ciclosporina en comparación con el 19 por ciento de 31 pacientes en el grupo
placebo.
Los estudios no controlados también han sugerido
beneficios. En un estudio prospectivo en el que 48 adultos con PPP recibieron
ciclosporina oral (3 mg / kg por día) durante ocho semanas, el 17 por ciento
logró la remisión completa (reducción ≥ 90 por ciento en el puntaje del área de
psoriasis palmoplantar y el índice de gravedad [PPPASI]), 6 por ciento no tuvo
respuesta, y los pacientes restantes tuvieron una mejoría parcial.
En general, tratamos a adultos con una dosis de 3 mg
/ kg de ciclosporina y comenzamos a disminuir la dosis después de 10 días de
mejoría clínica sostenida (al menos un 75 por ciento de mejoría desde el
inicio). Disminuimos la dosis de ciclosporina en 25 a 50 mg por semana.
Se prefiere el uso a corto plazo de la dosis
efectiva más baja de ciclosporina para minimizar los efectos adversos como la
hipertensión y la toxicidad renal. Nuestra duración típica del tratamiento con
ciclosporina dura de 12 a 24 semanas. Se requiere una estrecha vigilancia de
los efectos secundarios. (Ver "Farmacología de ciclosporina y
tacrolimus", sección "Efectos secundarios" ).
Nuestra experiencia personal sugiere que dosis más
altas de ciclosporina pueden ser efectivas para algunos pacientes que no
responden a 3 mg / kg por día; Hemos utilizado con éxito dosis de hasta 8 mg /
kg por día. Sin embargo, un mayor riesgo de efectos secundarios es una
preocupación para el tratamiento con dosis más altas.
● ●Metotrexato : aunque nuestra experiencia personal
sugiere que el metotrexato puede ser útil para la PPP, los datos que respaldan
esta afirmación son limitados. Un estudio retrospectivo de 114 pacientes con
PPP o psoriasis palmoplantar encontró que cuatro de siete pacientes con PPP que
fueron tratados con 15 a 25 mg por semana de metotrexato (57 por ciento)
lograron una mejora notable en su enfermedad. Un estudio independiente no
controlado en el que los pacientes fueron tratados con 25 mg de metotrexato
durante dos meses encontró una resolución completa o casi completa de PPP en 8
de 25 pacientes (32 por ciento) . La mayoría de los respondedores también
tenían lesiones psoriásicas en la piel en otros sitios.
Por lo general, tratamos con 7,5 a 20 mg de
metotrexato por semana administrados por vía intramuscular o subcutánea. El
metotrexato no se administra a diario. La administración oral de metotrexato
(10 a 25 mg por semana) es una opción adicional, aunque el riesgo de malestar
gastrointestinal relacionado con el medicamento puede ser mayor.
Los métodos para comenzar la terapia con metotrexato
varían. Por lo general, comenzamos la terapia con metotrexato con una dosis
baja (p. Ej., 7,5 mg por semana) y titulamos al alza en 2,5 mg por semana si un
recuento sanguíneo completo con diferencial realizado una semana después del
inicio (y aumentos de dosis) no revela toxicidad hematológica y el tratamiento
es tolerado El curso de tiempo en el que esperamos ver una mejora es de 12 a 16
semanas. Después de una mejora satisfactoria, nuestro objetivo es reducir la
dosis a 5 a 7,5 mg por semana para la terapia de mantenimiento.
El monitoreo de los efectos adversos es importante
durante la terapia con metotrexato , particularmente al inicio de la terapia y
después de los aumentos de dosis. La toxicidad hematológica es un efecto
secundario potencialmente mortal. La dificultad gastrointestinal y la toxicidad
hepática o pulmonar son efectos secundarios adicionales. Las pruebas de función
hepática y renal deben controlarse periódicamente. Se debe administrar
suplementos de ácido fólico a los pacientes que reciben terapia con metotrexato
para reducir el riesgo de algunos efectos secundarios.
ENFERMEDAD RECALCITRANTE GRAVE
A pesar de la observación de que los medicamentos
biológicos contra el factor de necrosis tumoral (anti-TNF) ( infliximab ,
etanercept y adalimumab ) pueden inducir la pustulosis palmoplantar (PPP),
existen algunas pruebas de que estos agentes pueden ser eficaces para tratar la
PPP . Un ensayo aleatorizado de 24 semanas respalda la eficacia de etanercept
para PPP. También se ha informado que los inhibidores de TNF-alfa son efectivos
para el tratamiento del síndrome de SAPHO (sinovitis, acné, pustulosis,
hiperostosis, osteitis), un trastorno que puede presentarse con PPP.
Se ha intentado el tratamiento con otros agentes
biológicos para la PPP grave o recalcitrante que ocurre con o sin psoriasis en
placas asociada. Los datos que sugieren un papel para la producción de interleucina
(IL) -23 y la proliferación resultante de células T helper tipo 17 (Th17) y
citocinas Th17 (por ejemplo, IL-17A, IL-17F, IL-22) en la patogénesis de PPP
han contribuido a ensayos de terapias que inhiben esta vía. (
La eficacia de ustekinumab , un inhibidor biológico
de IL-12 e IL-23, para PPP es incierta. Un ensayo aleatorizado de 16 semanas
que incluyó a 13 pacientes con PPP y 20 pacientes con psoriasis pustular
palmoplantar no logró encontrar una diferencia estadísticamente significativa
en la respuesta de los pacientes al ustekinumab (45 mg administrados en las
semanas 0 y 4) versus placebo. Sin embargo, el beneficio de ustekinumab para
PPP o psoriasis pustulosa palmoplantar se ha informado en un estudio no
controlado, series de casos e informes de casos.
Dos ensayos aleatorios sugieren el beneficio de
guselkumab , otro agente biológico dirigido a IL-23. En un ensayo de fase 3,
159 adultos con PPP refractaria fueron asignados aleatoriamente a guselkumab
100 mg, guselkumab 200 mg o placebo administrado en las semanas 0, 4 y 12 y
luego cada 8 semanas a partir de entonces. Los pacientes en el grupo de placebo se
volvieron a aleatorizar a guselkumab 100 mg o guselkumab 200 mg después de la
semana 16. En la semana 16, tanto los grupos de guselkumab de 100 mg como los
de 200 mg mostraron una mejoría mayor en el puntaje total del Área de Psoriasis
Palmoplantar y el Índice de Severidad (PPPASI) que en el puntaje total. grupo
placebo (cambio medio de mínimos cuadrados de -15,3, -11,7 y -7,6, respectivamente).
Además, más pacientes en el grupo de 100 mg de guselkumab tuvieron al menos una
mejora del 50 por ciento en la puntuación total de PPPASI (PPPASI-50) en la
semana 16 que en el grupo de placebo (57 versus 34 por ciento). Aunque la
proporción de pacientes que alcanzaron este punto final en el grupo de 200 mg
de guselkumab (37 por ciento) fue similar al grupo de placebo, con el tiempo se
detectó una respuesta creciente al guselkumab,
Se necesitan estudios adicionales para aclarar los
efectos del secukinumab , un anticuerpo monoclonal anti-IL-17A. En el ensayo
2PRECISE (n = 237), los pacientes con psoriasis pustular palmoplantar moderada
a grave fueron asignados aleatoriamente a 300 mg de secukinumab, 150 mg de
secukinumab o placebo administrado en las semanas 1, 2, 3 y 4 y luego cada
cuatro semanas. . El ensayo no logró el objetivo primario de superioridad de
las dosis de 300 o 150 mg de secukinumab sobre placebo después de 16 semanas
(27, 18 y 14 por ciento logró una mejora del 75 por ciento en la puntuación
PPPASI, respectivamente). Aunque se propuso el beneficio de un curso de
tratamiento más prolongado basado en una segunda fase en la que a los pacientes
en los grupos de secukinumab se les permitió continuar el tratamiento y los no
respondedores en el grupo de placebo se aleatorizaron a 300 o 150 mg de
secukinumab, se justifica un estudio adicional para confirmar el beneficio . En
la semana 52, el 42 por ciento de los pacientes en el grupo de 300 mg de
secukinumab y el 35 por ciento de los pacientes en el grupo de 150 mg de
secukinumab lograron al menos una mejora del 75 por ciento en la puntuación
PPPASI.
La eficacia de otras terapias biológicas utilizadas
para la psoriasis, como ixekizumab , brodalumab , tildrakizumab y risankizumab
, así como el inhibidor oral de fosfodiesterasa 4 apremilast y el inhibidor de
la quinasa Janus tofacitinib , no está clara. Mejora de PPP con tofacitinib o
apremilast se ha informado en pacientes individuales. En una serie de cuatro
pacientes tratados con brodalumab (incluidos dos que no respondieron al
secukinumab) para la PPP grave y recalcitrante asociada con psoriasis en placas
y / o artritis psoriásica, tres no respondieron al tratamiento y uno tuvo una
respuesta parcial, pero interrumpió el tratamiento debido a la candidiasis oral.
Se necesitan más estudios para determinar la
eficacia de los inhibidores biológicos de IL-1 (p. Ej., Anakinra , canakinumab
) para la PPP. La mejora de la psoriasis pustular palmoplantar severa o
recalcitrante o la acrodermatitis continua de Hallopeau (psoriasis pustulosa de
los dedos) durante el tratamiento con anakinra se ha documentado en informes de
casos [ 47,48 ]. Canakinumab no fue eficaz para la psoriasis pustular
palmoplantar en un informe de caso [ 49 ].
OTRAS TERAPIAS
Se ha informado que otras intervenciones son útiles
para la PPP, incluidos otros medicamentos tópicos y sistémicos, amigdalectomía,
una dieta libre de gluten en pacientes con intolerancia al gluten asociada y
radioterapia o basada en la luz. Los datos sobre la mayoría de estas terapias
son limitados.
● ●Otros medicamentos tópicos : además de los
corticosteroides tópicos, que representan el pilar de la terapia tópica para
PPP, las terapias tópicas como los retinoides tópicos, alquitrán, antralina o
calcipotriol a veces se usan en el entorno clínico, aunque hay pocos datos para
respaldar su eficacia . Ningún ensayo aleatorizado ha evaluado la eficacia de
estas terapias. No hemos tenido éxito con estas terapias.
● ●Tetraciclinas orales: las tetraciclinas orales son
un tratamiento menos utilizado para la PPP. Dos ensayos cruzados aleatorios en
los que los pacientes fueron tratados con tetraciclina o clomociclina respaldan
la eficacia de estos medicamentos sobre el placebo para inducir una mejora en
la PPP. No utilizamos tetraciclinas orales para PPP.
● ●Colchicina : aunque la colchicina se asoció con
una mejora notable en 15 de los 25 pacientes tratados por PPP en un estudio
retrospectivo, los hallazgos de los ensayos aleatorios han sido decepcionantes.
Además, las tasas de efectos adversos (diarrea, dolores de cabeza y náuseas) en
los ensayos aleatorios fueron altas.
● ●Itraconazol : dos pequeñas series de casos
documentan la mejoría clínica en la PPP (especialmente la formación de nuevas
pústulas) durante el tratamiento con itraconazol. Las recaídas ocurrieron
después del cese de la terapia. Ningún ensayo aleatorizado ha evaluado la
eficacia del tratamiento con itraconazol.
● ●Amigdalectomía : los estudios japoneses que
relacionan la PPP con las infecciones de las amígdalas y los informes de
mejoría en la PPP después de la amigdalectomía sugieren que algunos pacientes
pueden beneficiarse de este procedimiento. La mejora de la PPP después de la
amigdalectomía se ha informado en varias series japonesas.
● ●Dieta sin gluten : los pacientes con sensibilidad
al gluten y PPP pueden beneficiarse de una dieta sin gluten. En una serie
sueca, los nueve pacientes que tenían anticuerpos anti-gliadina elevados y / o
anticuerpos transglutaminasa tisulares elevados y se adhirieron a una dieta
libre de gluten experimentaron un aclaramiento o una gran mejoría en la PPP. La
mejora fue lenta, ocurriendo en el transcurso de unos pocos meses en pacientes
con PPP moderada y durante varios años en pacientes con PPP severa de larga
data.
● ●Otras terapias basadas en la luz : la exposición
a una fuente de luz excimer o una fuente de luz ultravioleta B (UVB) de banda
estrecha se ha asociado con una mejora en la PPP en estudios no controlados. Un
láser ultravioleta A1 (UVA1) de 355 nm pareció efectivo para PPP en un estudio
no controlado. Las respuestas a la terapia fotodinámica se han documentado en
informes de casos.
● ●Radioterapia : los datos limitados sugieren el
beneficio de la radioterapia superficial. Un ensayo de seis semanas en el que
17 pacientes con PPP fueron asignados aleatoriamente al tratamiento de PPP en
un lado del cuerpo con terapia de rayos Grenz y un tratamiento simulado en el
lado contralateral encontró una mejoría mayor en PPP en el lado del cuerpo
expuesto a Grenz rayos. Sin embargo, la respuesta fue moderada y ningún
paciente logró la eliminación de la enfermedad. En dos informes de casos, la
radioterapia superficial administrada con una técnica de haces de megavoltaje
se asoció con una mejora dramática y rápida de la PPP severa y refractaria [ 69
].
Otras intervenciones descritas como beneficiosas en
los informes de casos incluyen tofacitinib oral y braquiterapia de alta tasa de dosis .
Fuente:
UpToDate 2020
REFERENCES
Brunasso AM,
Puntoni M, Aberer W, et al. Clinical and epidemiological comparison of patients
affected by palmoplantar plaque psoriasis and palmoplantar pustulosis: a case
series study. Br J Dermatol 2013; 168:1243.
Farley E,
Masrour S, McKey J, Menter A. Palmoplantar psoriasis: a phenotypical and
clinical review with introduction of a new quality-of-life assessment tool. J
Am Acad Dermatol 2009; 60:1024.
de Waal AC, van de Kerkhof PC. Pustulosis palmoplantaris is a disease distinct from
psoriasis. J Dermatolog Treat 2011; 22:102.
Ammoury A, El
Sayed F, Dhaybi R, Bazex J. Palmoplantar pustulosis should not be considered as
a variant of psoriasis. J Eur Acad Dermatol Venereol 2008; 22:392.
Griffiths CE,
Christophers E, Barker JN, et al. A classification of psoriasis vulgaris
according to phenotype. Br J Dermatol 2007; 156:258.
Kubota K, Kamijima Y, Sato T, et al. Epidemiology of psoriasis and palmoplantar pustulosis:
a nationwide study using the Japanese national claims database. BMJ Open 2015;
5:e006450.
Becher G,
Jamieson L, Leman J. Palmoplantar pustulosis--a retrospective review of
comorbid conditions. J Eur Acad Dermatol Venereol 2015;
29:1854.
Liu F, Zhang M, Lou Y, et al. The spontaneous regression of palmoplantar pustulosis
following removal of dental amalgams: A report of two cases. Australas J
Dermatol 2016; 57:e93.
Ito T, Mori T,
Fujiyama T, Tokura Y. Dramatic exacerbation of palmoplantar pustulosis
following strongly positive nickel patch testing. Int J Dermatol 2014; 53:e327.
Mössner R,
Frambach Y, Wilsmann-Theis D, et al. Palmoplantar Pustular Psoriasis Is Associated
with Missense Variants in CARD14, but Not with Loss-of-Function Mutations in
IL36RN in European Patients. J Invest Dermatol 2015; 135:2538.
Yamamoto T.
Extra-palmoplantar lesions associated with palmoplantar pustulosis. J
Eur Acad Dermatol Venereol 2009; 23:1227.
Asumalahti K, Ameen M, Suomela S, et al. Genetic analysis of PSORS1 distinguishes guttate
psoriasis and palmoplantar pustulosis. J Invest Dermatol 2003; 120:627.
Song H, Yin W,
Ma Q. Allergic palmoplantar pustulosis caused by cobalt in cast dental crowns:
a case report. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2011; 111:e8.
Hellgren L,
Mobacken H. Pustulosis palmaris et plantaris. Prevalence, clinical observations
and prognosis. Acta Derm Venereol 1971; 51:284.
Twelves S,
Mostafa A, Dand N, et al. Clinical and genetic differences between pustular
psoriasis subtypes. J Allergy Clin Immunol 2019; 143:1021.
Murakami M,
Ohtake T, Horibe Y, et al. Acrosyringium is the main site of the
vesicle/pustule formation in palmoplantar pustulosis. J Invest Dermatol 2010;
130:2010.
Hagforsen E,
Edvinsson M, Nordlind K, Michaëlsson G. Expression of nicotinic receptors in
the skin of patients with palmoplantar pustulosis. Br J Dermatol 2002; 146:383.
Hagforsen E,
Hedstrand H, Nyberg F, Michaëlsson G. Novel findings of Langerhans cells and
interleukin-17 expression in relation to the acrosyringium and pustule in
palmoplantar pustulosis. Br J Dermatol 2010; 163:572.
Kim DY, Kim JY,
Kim TG, et al. A comparison of inflammatory mediator expression between palmoplantar
pustulosis and pompholyx. J Eur Acad Dermatol Venereol 2013;
27:1559.
Murakami M, Hagforsen E, Morhenn V, et al. Patients with palmoplantar pustulosis have increased
IL-17 and IL-22 levels both in the lesion and serum. Exp Dermatol 2011; 20:845.
Eriksson MO,
Hagforsen E, Lundin IP, Michaëlsson G. Palmoplantar pustulosis: a clinical and
immunohistological study. Br J Dermatol 1998; 138:390.
Hagforsen E,
Nordlind K, Michaëlsson G. Skin nerve fibres and their contacts with mast cells
in patients with palmoplantar pustulosis. Arch Dermatol Res 2000;
292:269.
Sáez-Rodríguez M, Noda-Cabrera A, Alvarez-Tejera S,
et al. The role of
psychological factors in palmoplantar pustulosis. J Eur Acad Dermatol Venereol
2002; 16:325.
Takahara M.
Clinical outcome of tonsillectomy for palmoplantar pustulosis and etiological
relationship between palmoplantar pustulosis and tonsils. Adv Otorhinolaryngol
2011; 72:86.
Kikuchi N,
Yamamoto T. Dental infection as a triggering factor in palmoplantar pustulosis.
Acta
Derm Venereol 2013; 93:721.
Akiyama T, Seishima M, Watanabe H, et al. The relationships of onset and exacerbation of
pustulosis palmaris et plantaris to smoking and focal infections. J Dermatol
1995; 22:930.
Koshiba S,
Ichimiya S, Nagashima T, et al. Tonsillar crypt epithelium of palmoplantar
pustulosis secretes interleukin-6 to support B-cell development via p63/p73
transcription factors. J Pathol 2008; 214:75.
Ueda S, Takahara
M, Tohtani T, et al. Up-regulation of ß1 integrin on tonsillar T cells and its
induction by in vitro stimulation with α-streptococci in patients with pustulosis Palmaris et
Plantaris. J Clin Immunol 2010; 30:861.
Sakiyama H, Kobayashi S, Dianzani U, et al. Possible involvement of T cell co-stimulation in
pustulosis palmaris et plantaris via the induction of inducible co-stimulator
in chronic focal infections. J Dermatol Sci 2008; 50:197.
Yoshizaki T,
Bandoh N, Ueda S, et al. Up-regulation of CC chemokine receptor 6 on tonsillar
T cells and its induction by in vitro stimulation with alpha-streptococci in
patients with pustulosis palmaris et plantaris. Clin Exp Immunol 2009; 157:71.
Takahara M,
Kishibe K, Nozawa H, Harabuchi Y. Increase of activated T-cells and
up-regulation of Smad7 without elevation of TGF-beta expression in tonsils from
patients with pustulosis palmaris et plantaris. Clin Immunol 2005; 115:192.
Nozawa H,
Kishibe K, Takahara M, Harabuchi Y. Expression of cutaneous
lymphocyte-associated antigen (CLA) in tonsillar T-cells and its induction by
in vitro stimulation with alpha-streptococci in patients with pustulosis
palmaris et plantaris (PPP). Clin Immunol 2005; 116:42.
Mrowietz U, van
de Kerkhof PC. Management of palmoplantar pustulosis: do we need to change? Br
J Dermatol 2011; 164:942.
Shmidt E, Wetter
DA, Ferguson SB, Pittelkow MR. Psoriasis and palmoplantar pustulosis associated
with tumor necrosis factor-α inhibitors: the Mayo Clinic experience, 1998 to 2010.
J Am Acad Dermatol 2012; 67:e179.
Shelling ML,
Vitiello M, Lanuti EL, et al. A Case of Palmoplantar Pustulosis Induced by Certolizumab
Pegol: New Anti-TNF-alpha Demonstrates the Same Class Effect. J Clin Aesthet
Dermatol 2012; 5:40.
Brunasso AM,
Laimer M, Massone C. Paradoxical reactions to targeted biological treatments: A
way to treat and trigger? Acta Derm Venereol 2010; 90:183.
Seol JE, Park IH, Lee W, et al. Palmoplantar Pustulosis Induced by both Adalimumab and
Golimumab for Treatment of Ankylosing Spondylitis. Ann Dermatol 2016; 28:522.
Yanagi T,
Shimizu T, Abe R, Shimizu H. Zinc dental fillings and palmoplantar pustulosis.
Lancet 2005; 366:1050.
Nakamura K,
Imakado S, Takizawa M, et al. Exacerbation of pustulosis palmaris et plantaris
after topical application of metals accompanied by elevated levels of
leukotriene B4 in pustules. J Am Acad Dermatol 2000; 42:1021.
Kingo K, Mössner
R, Kõks S, et al. Association analysis of IL19, IL20 and IL24 genes in
palmoplantar pustulosis. Br J Dermatol 2007; 156:646.
Bissonnette R,
Suárez-Fariñas M, Li X, et al. Based on Molecular Profiling of Gene Expression,
Palmoplantar Pustulosis and Palmoplantar Pustular Psoriasis Are Highly Related
Diseases that Appear to Be Distinct from Psoriasis Vulgaris. PLoS One 2016;
11:e0155215.
Bissonnette R,
Nigen S, Langley RG, et al. Increased expression of IL-17A and limited
involvement of IL-23 in patients with palmo-plantar (PP) pustular psoriasis or
PP pustulosis; results from a randomised controlled trial. J Eur Acad Dermatol
Venereol 2014; 28:1298.
Enfors W, Molin
L. Pustulosis palmaris et plantaris. A follow-up study of a ten-year material.
Acta Derm Venereol 1971; 51:289.
Barber HW.
Acrodermatitis continua vel perstans (dermatitis repens) and psoriasis pustule.
Br J Dermatol Syph 1930; 42:500.
Griffiths CE,
Barker JN. Psoriasis. In: Rook's Textbook of Dermatology, 8th ed, Burns T,
Breathnach S, Cox N, et al (Eds), Wiley-Blackwell, 2010. p.20.1.
Trattner H,
Blüml S, Steiner I, et al. Quality of life and comorbidities in palmoplantar
pustulosis - a cross sectional study on 102 patients. J Eur Acad Dermatol
Venereol 2017.
Burden AD,
Kemmett D. The spectrum of nail involvement in palmoplantar pustulosis. Br J
Dermatol 1996; 134:1079.
Olazagasti JM,
Ma JE, Wetter DA. Clinical Features, Etiologic Factors, Associated Disorders,
and Treatment of Palmoplantar Pustulosis: The Mayo Clinic Experience, 1996-2013.
Mayo Clin Proc 2017; 92:1351.
Kundu BK, Naik
AK, Bhargava S, Srivastava D. Diagnosing the SAPHO syndrome: a report of three
cases and review of literature. Clin Rheumatol 2013; 32:1237.
Rosén K,
Lindstedt G, Mobacken H, Nyström E. Thyroid function in patients with
pustulosis palmoplantaris. J Am Acad Dermatol 1988; 19:1009.
Giménez-García R, Sánchez-Ramón S, Cuellar-Olmedo
LA. Palmoplantar
pustulosis: a clinicoepidemiological study. The relationship between tobacco
use and thyroid function. J Eur Acad Dermatol Venereol 2003;
17:276.
Hagforsen E, Michaëlsson K, Lundgren E, et al. Women with palmoplantar pustulosis have disturbed
calcium homeostasis and a high prevalence of diabetes mellitus and psychiatric
disorders: a case-control study. Acta Derm Venereol 2005; 85:225.
Michaëlsson G,
Kristjánsson G, Pihl Lundin I, Hagforsen E. Palmoplantar pustulosis and gluten
sensitivity: a study of serum antibodies against gliadin and tissue
transglutaminase, the duodenal mucosa and effects of gluten-free diet. Br J Dermatol
2007; 156:659.
Weisenseel P,
Kuznetsov AV, Ruzicka T, Prinz JC. Palmoplantar pustulosis is not inevitably
associated with antigliadin antibodies. Br J Dermatol 2007; 156:1399.
Marsland AM,
Chalmers RJ, Hollis S, et al. Interventions for chronic palmoplantar
pustulosis. Cochrane Database Syst Rev 2006; :CD001433.
Yoon SY, Park
HS, Lee JH, Cho S. Histological differentiation between palmoplantar pustulosis
and pompholyx. J Eur Acad Dermatol Venereol 2013; 27:889.
Weedon D. The
vesicobullous reaction pattern. In: Weedon's Skin Pathology, 3rd ed, Elsevier,
Edinburgh 2010. p.123.
Proença NG.
Acropustulosis repens. Int J Dermatol 2006; 45:389.
Gurgen J, Dorton
D. Unusual case of pemphigus vulgaris mimicking localized pustular psoriasis of
the hands and feet. Cutis 2010; 86:138.
Marsland AM,
Chalmers RJ, Hollis S, et al. Interventions for chronic palmoplantar
pustulosis. Cochrane Database Syst Rev 2006; :CD001433.
Brunasso AM,
Puntoni M, Aberer W, et al. Clinical and epidemiological comparison of patients
affected by palmoplantar plaque psoriasis and palmoplantar pustulosis: a case
series study. Br J Dermatol 2013; 168:1243.
Michaëlsson G,
Gustafsson K, Hagforsen E. The psoriasis variant palmoplantar pustulosis can be
improved after cessation of smoking. J Am Acad Dermatol 2006; 54:737.
Adişen E, Tekin
O, Gülekon A, Gürer MA. A retrospective analysis of treatment responses of
palmoplantar psoriasis in 114 patients. J Eur Acad Dermatol Venereol 2009;
23:814.
Sevrain M,
Richard MA, Barnetche T, et al. Treatment for palmoplantar pustular psoriasis:
systematic literature review, evidence-based recommendations and expert
opinion. J Eur Acad Dermatol Venereol 2014; 28 Suppl 5:13.
Kragballe K,
Larsen FG. A hydrocolloid occlusive dressing plus triamcinolone acetonide cream
is superior to clobetasol cream in palmo-plantar pustulosis. Acta Derm Venereol
1991; 71:540.
Lassus A, Geiger
JM. Acitretin and etretinate in the treatment of palmoplantar pustulosis: a
double-blind comparative trial. Br J Dermatol 1988; 119:755.
Irla N, Navarini
AA, Yawalkar N. Alitretinoin abrogates innate inflammation in palmoplantar
pustular psoriasis. Br J Dermatol 2012; 167:1170.
Reich K, Graff
O, Mehta N. Oral alitretinoin treatment in patients with palmoplantar
pustulosis inadequately responding to standard topical treatment: a randomized
phase II study. Br J Dermatol 2016; 174:1277.
Lassus A,
Lauharanta J, Juvakoski T, Kanerva L. Efficacy of etretinate (Tigason) in
clearing and prevention of relapse of palmoplantar pustulosis. Dermatologica
1983; 166:215.
Aldrich MS,
Foster NL, White RF, et al. Sleep abnormalities in progressive supranuclear
palsy. Ann Neurol 1989; 25:577.
Murray D,
Corbett MF, Warin AP. A controlled trial of photochemotherapy for persistent
palmoplantar pustulosis. Br J Dermatol 1980; 102:659.
Rosén K,
Mobacken H, Swanbeck G. PUVA, etretinate, and PUVA-etretinate therapy for
pustulosis palmoplantaris. A placebo-controlled comparative trial. Arch
Dermatol 1987; 123:885.
Lassus A,
Lauharanta J, Eskelinen A. The effect of etretinate compared with different
regimens of PUVA in the treatment of persistent palmoplantar pustulosis. Br
J Dermatol 1985; 112:455.
Matsunami E, Takashima A, Mizuno N, et al. Topical PUVA, etretinate, and combined PUVA and
etretinate for palmoplantar pustulosis: comparison of therapeutic efficacy and
the influences of tonsillar and dental focal infections. J Dermatol 1990;
17:92.
Layton AM,
Sheehan-Dare R, Cunliffe WJ. A double-blind, placebo-controlled trial of
topical PUVA in persistent palmoplantar pustulosis. Br J Dermatol 1991;
124:581.
Lawrence CM,
Marks J, Parker S, Shuster S. A comparison of PUVA-etretinate and PUVA-placebo
for palmoplantar pustular psoriasis. Br J Dermatol 1984;
110:221.
Reitamo S, Erkko P, Remitz A, et al. Cyclosporine in the treatment of palmoplantar
pustulosis. A randomized, double-blind, placebo-controlled study. Arch Dermatol
1993; 129:1273.
Erkko P,
Granlund H, Remitz A, et al. Double-blind placebo-controlled study of long-term
low-dose cyclosporin in the treatment of palmoplantar pustulosis. Br J Dermatol
1998; 139:997.
Jin XH, Chen X,
Mou Y, Xia JX. Effects of Cyclosporine on Palmoplantar Pustulosis and Serum
Expression of IL-17, IL-23, and TNF-α. Dermatol Ther (Heidelb) 2019; 9:547.
Thomsen K.
Pustulosis palmaris et plantaris treated with methotrexate. Acta Derm Venereol
1971; 51:397.
Brunasso AM,
Laimer M, Massone C. Paradoxical reactions to targeted biological treatments: A
way to treat and trigger? Acta Derm Venereol 2010; 90:183.
Shmidt E, Wetter
DA, Ferguson SB, Pittelkow MR. Psoriasis and palmoplantar pustulosis associated
with tumor necrosis factor-α inhibitors: the Mayo Clinic experience, 1998 to 2010.
J Am Acad Dermatol 2012; 67:e179.
Bissonnette R,
Poulin Y, Bolduc C, et al. Etanercept in the treatment of palmoplantar
pustulosis. J Drugs Dermatol 2008; 7:940.
Hampton SL,
Youssef H. Successful treatment of resistant SAPHO syndrome with anti-TNF
therapy. BMJ Case Rep 2013; 2013.
De Souza A,
Solomon GE, Strober BE. SAPHO syndrome associated with hidradenitis suppurativa
successfully treated with infliximab and methotrexate. Bull NYU Hosp Jt Dis
2011; 69:185.
Arias-Santiago
S, Sanchez-Cano D, Callejas-Rubio JL, et al. Adalimumab treatment for SAPHO
syndrome. Acta Derm Venereol 2010; 90:301.
Ben Abdelghani
K, Dran DG, Gottenberg JE, et al. Tumor necrosis factor-alpha blockers in SAPHO
syndrome. J Rheumatol 2010; 37:1699.
Fruehauf J, Cierny-Modrè B, Caelen Lel-S, et al. Response to infliximab in SAPHO syndrome. BMJ Case Rep
2009; 2009.
Sabugo F,
Liberman C, Niedmann JP, et al. Infliximab can induce a prolonged clinical
remission and a decrease in thyroid hormonal requirements in a patient with
SAPHO syndrome and hypothyroidism. Clin Rheumatol 2008; 27:533.
Murakami M,
Hagforsen E, Morhenn V, et al. Patients with palmoplantar pustulosis have
increased IL-17 and IL-22 levels both in the lesion and serum. Exp Dermatol
2011; 20:845.
Hagforsen E,
Hedstrand H, Nyberg F, Michaëlsson G. Novel findings of Langerhans cells and
interleukin-17 expression in relation to the acrosyringium and pustule in
palmoplantar pustulosis. Br J Dermatol 2010; 163:572.
Kim DY, Kim JY,
Kim TG, et al. A comparison of inflammatory mediator expression between
palmoplantar pustulosis and pompholyx. J Eur Acad Dermatol Venereol 2013;
27:1559.
Bissonnette R,
Nigen S, Langley RG, et al. Increased expression of IL-17A and limited
involvement of IL-23 in patients with palmo-plantar (PP) pustular psoriasis or
PP pustulosis; results from a randomised controlled trial. J Eur Acad Dermatol
Venereol 2014; 28:1298.
Gerdes S, Franke
J, Domm S, Mrowietz U. Ustekinumab in the treatment of palmoplantar pustulosis.
Br J Dermatol 2010; 163:1116.
Bertelsen T,
Kragballe K, Johansen C, Iversen L. Efficacy of ustekinumab in palmoplantar
pustulosis and palmoplantar pustular psoriasis. Int J Dermatol 2014; 53:e464.
Morales-Múnera
C, Vilarrasa E, Puig L. Efficacy of ustekinumab in refractory palmoplantar
pustular psoriasis. Br J Dermatol 2013; 168:820.
Chu DH, Van
Voorhees AS, Rosenbach M. Treatment of refractory tumor necrosis factor
inhibitor-induced palmoplantar pustulosis: a report of 2 cases. Arch Dermatol
2011; 147:1228.
Puig L,
Morales-Múnera CE, López-Ferrer A, Geli C. Ustekinumab treatment of TNF
antagonist-induced paradoxical psoriasis flare in a patient with psoriatic arthritis:
case report and review. Dermatology 2012; 225:14.
Pinto-Almeida T,
Torres T, Sanches M, Selores M. Treatment of palmoplantar pustulosis with
ustekinumab--the importance of interfering with the IL23/Th17 pathway. Eur J
Dermatol 2013; 23:916.
Terui T,
Kobayashi S, Okubo Y, et al. Efficacy and Safety of Guselkumab, an
Anti-interleukin 23 Monoclonal Antibody, for Palmoplantar Pustulosis: A
Randomized Clinical Trial. JAMA Dermatol 2018; 154:309.
Terui T, Kobayashi S, Okubo Y, et al. Efficacy and Safety of Guselkumab in Japanese Patients
With Palmoplantar Pustulosis: A Phase 3 Randomized Clinical Trial. JAMA
Dermatol 2019.
Mrowietz U,
Bachelez H, Burden AD, et al. Secukinumab for moderate-to-severe palmoplantar
pustular psoriasis: Results of the 2PRECISE study. J Am Acad Dermatol 2019;
80:1344.
Haynes D, Topham
C, Hagstrom E, Greiling T. Tofacitinib for the treatment of recalcitrant
palmoplantar pustulosis: A case report. Australas J Dermatol 2020; 61:e108.
Haebich G,
Kalavala M. Successful treatment of refractory palmoplantar pustulosis with
apremilast. Clin Exp Dermatol 2017; 42:471.
Pinter A,
Wilsmann-Theis D, Peitsch WK, Mössner R. Interleukin-17 receptor A blockade
with brodalumab in palmoplantar pustular psoriasis: Report on four cases. J
Dermatol 2019; 46:426.
Tauber M, Viguier M, Alimova E, et al. Partial clinical response to anakinra in severe
palmoplantar pustular psoriasis. Br J Dermatol 2014; 171:646.
Lutz V, Lipsker
D. Acitretin- and tumor necrosis factor inhibitor-resistant acrodermatitis
continua of hallopeau responsive to the interleukin 1 receptor antagonist
anakinra. Arch Dermatol 2012; 148:297.
Mansouri B,
Kivelevitch D, Campa M, Menter A. Palmoplantar pustular psoriasis unresponsive
to the interleukin-1β antagonist canakinumab. Clin Exp Dermatol 2016;
41:324.
Thomsen K,
Osterbye P. Pustulosis palmaris et plantaris. Br J Dermatol 1973; 89:293.
Ward JM, Corbett
MF, Hanna MJ. A double-blind trial of clomocycline in the treatment of
persistent palmoplantar pustulosis. Br J Dermatol 1976; 95:317.
Thestrup-Pedersen
K, Reymann F. Treatment of pustulosis palmaris et plantaris with colchicine. A
double-blind cross-over trial. Acta Derm Venereol 1984; 64:76.
Mann RJ. Failure
of colchicine for palmo-plantar pustulosis. Br J Dermatol 1982; 106:373.
V'lckova-Laskoska
MT, Caca-Biljanovska NG, Laskoski DS, Kamberova SJ. Palmoplantar pustulosis
treated with itraconazole: a single, active-arm pilot study. Dermatol
Ther 2009; 22:85.
Mihara M, Hagari Y, Morimura T, et al. Itraconazole as a new treatment for pustulosis
palmaris et plantaris. Arch Dermatol 1998; 134:639.
Takahara M.
Clinical outcome of tonsillectomy for palmoplantar pustulosis and etiological
relationship between palmoplantar pustulosis and tonsils. Adv Otorhinolaryngol
2011; 72:86.
Kikuchi N,
Yamamoto T. Dental infection as a triggering factor in palmoplantar pustulosis.
Acta
Derm Venereol 2013; 93:721.
Akiyama T, Seishima M, Watanabe H, et al. The relationships of onset and exacerbation of
pustulosis palmaris et plantaris to smoking and focal infections. J Dermatol
1995; 22:930.
Ono T.
Evaluation of tonsillectomy as a treatment for pustulosis palmaris et
plantaris. J Dermatol 1977; 4:163.
Ono T, Jono M, Kito M, et al. Evaluation of tonsillectomy as a treatment for
pustulosis palmaris et plantaris. Acta Otolaryngol Suppl 1983; 401:12.
Noda Y, Ura M.
Pustulosis palmaris et plantaris due to tonsillar focal infections. From the
analysis of long-term observed cases. Acta Otolaryngol Suppl 1983; 401:22.
Michaëlsson G,
Kristjánsson G, Pihl Lundin I, Hagforsen E. Palmoplantar pustulosis and gluten
sensitivity: a study of serum antibodies against gliadin and tissue
transglutaminase, the duodenal mucosa and effects of gluten-free diet. Br J
Dermatol 2007; 156:659.
Fumimori T,
Tsuruta D, Kawakami T, et al. Effect of monochromatic excimer light on
palmoplantar pustulosis: a clinical study performed in a private clinic by a
dermatological specialist. J Dermatol 2013; 40:1004.
Aubin F, Vigan M, Puzenat E, et al. Evaluation of a novel 308-nm monochromatic excimer
light delivery system in dermatology: a pilot study in different chronic
localized dermatoses. Br J Dermatol 2005; 152:99.
Kawada A,
Matsuda H, Oiso N. Efficacy and safety of targeted narrowband ultraviolet B
therapy using a flat-type fluorescent lamp for the treatment of palmoplantar
pustulosis. J Dermatol 2013; 40:754.
Nisticò SP, Saraceno R, Chiricozzi A, et al. UVA-1 laser in the treatment of palmoplantar pustular
psoriasis. Photomed Laser Surg 2013; 31:434.
Kim JY, Kang HY,
Lee ES, Kim YC. Topical 5-aminolaevulinic acid photodynamic therapy for
intractable palmoplantar psoriasis. J Dermatol 2007; 34:37.
Lindelöf B,
Beitner H. The effect of grenz ray therapy on pustulosis palmoplantaris. A
double-blind bilateral trial. Acta Derm Venereol 1990; 70:529.
King BJ,
Langeveld AP, Davis MDP, Martenson JA. Skin-directed radiation therapy for
palmoplantar pustulosis. JAAD Case Rep 2019; 5:478.
Koga T, Sato T,
Umeda M, et al. Successful treatment of palmoplantar pustulosis with rheumatoid
arthritis, with tofacitinib: Impact of this JAK inhibitor on T-cell
differentiation. Clin Immunol 2016; 173:147.
Timerman D,
Devlin PM, Nambudiri VE, et al. Novel application of high-dose rate
brachytherapy for severe, recalcitrant palmoplantar pustulosis. Clin
Exp Dermatol 2016; 41:498.