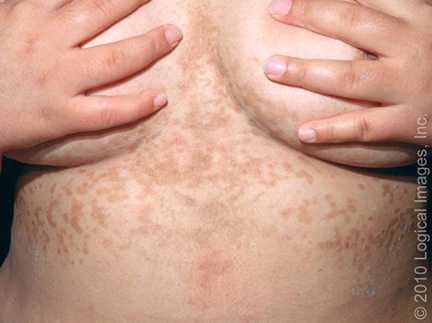
Imágenes características en un paciente con papilomatosis confluente y reticulada de Gougerot Carteaud.

Presentó
Dr. Roberto Miranda Chapa
Dermatólogo. Docente de Postgrado de Medicina Familiar y Medicina Interna.
Hospital General Regional 6 del IMSS Tampico
Tamaulipas Mexico.
PAPILOMATOSIS CONFLUENTE Y RETICULADA DE
GOUGEROT-CARTEAUD
INTRODUCCIÓN
La papilomatosis confluente y reticulada (CARP) es
una dermatosis infrecuente caracterizada por máculas escamosas hiperpigmentadas
o pápulas papilomatosas que se unen en parches o placas confluentes
centralmente con un patrón reticular periférico ( imágenes 1,2,3,4). Ocurre más
comúnmente en el tronco. La antibioticoterapia oral es la base del tratamiento.
Figura 1. Papilomatosis confluente y reticulada
Parches reticulados, hiperpigmentados y placas
delgadas con escamas leves están presentes en el pecho y las áreas
inframamarias.
Figura 2: Papilomatosis confluente y reticulada
Parches reticulados, hiperpigmentados y placas
delgadas con escamas finas están presentes en la parte superior de la espalda.
Figura 3: Papilomatosis confluente y reticulada
Vista cercana de placas delgadas hiperpigmentadas y
reticuladas en papilomatosis reticulada confluente.
Figura 4: Papilomatosis confluente y reticulada
Placas reticuladas hiperpigmentadas con escamas
finas en la parte posterior.
PAPILOMATOSIS CONFLUENTE ULADA DE GOUGEROT CARTAUD
EPIDEMIOLOGÍA
Descrita por primera vez por dos dermatólogos
franceses, Gougerot y Carteaud, CARP se ha informado en todo el mundo y se
presenta en todos los grupos raciales y etnias [ 1 ]. Se estima que la
incidencia de CARP en la población libanesa es de alrededor del 0,02 por ciento
[ 2 ]. No se ha realizado ningún estudio epidemiológico en los Estados Unidos.
Sin embargo, solo se identificaron 39 pacientes en una revisión retrospectiva
recopilada entre 1972 y 2003 en la Clínica Mayo [ 3 ].
CARP típicamente afecta a adultos jóvenes; El
estudio retrospectivo de Mayo Clinic encontró una edad media de inicio de 15
años y un rango de 8 a 32 años. CARP ocurre tanto en hombres como en mujeres [
3 ].
ETIOLOGÍA
Décadas después de su descripción inicial, la
patogénesis y la etiología de CARP siguen siendo esquivas y controvertidas. Se
han propuesto varias teorías, aunque ninguna ha sido probada definitivamente.
Entre todos los factores etiológicos propuestos,
existe la evidencia más sólida para apoyar la CARP como un trastorno de
queratinización que resulta en un estado hiperproliferativo. La microscopía
electrónica (ME) de la piel afectada muestra alteración de las estructuras
celulares cornificadas, un mayor número de gránulos lamelares en la capa
granular y un aumento de melanosomas en las capas córneas [ 4 ]. En otro
estudio de ME , se observó un mayor número de células de transición entre el
estrato córneo y el estrato granuloso [ 5 ]. Además, en un estudio con hermanos
con CARP, se demostró una mayor expresión de queratina 16 en áreas focales del
estrato granuloso [ 6] Otros factores genéticos también pueden, al menos en
alguna parte, contribuir al desarrollo de CARP, ya que se han reportado varios
otros casos familiares [ 7-10 ].
Muchos informes han relacionado Malassezia ,
formalmente conocido como Pityrosporum , con CARP debido a su parecido clínico
con la tiña versicolor. Aunque la CARP y la tiña versicolor pueden coexistir, y
se postula que la CARP puede representar una respuesta inflamatoria inapropiada
a Malassezia que resulta en queratinización anormal [ 6,11-13 ], la evidencia
disponible no respalda la participación de Malassezia en la patogénesis de la
CARP [ 3 ] Del mismo modo, no se han aislado consistentemente especies
bacterianas de pacientes con CARP [ 1]] Otras causas menos probables de CARP
incluyen una reacción a la luz ultravioleta, una respuesta cutánea a una
endocrinopatía subyacente y un proceso que involucra amiloide [ 1 ].
PRESENTACIÓN CLÍNICA
La CARP se caracteriza con mayor frecuencia por
máculas escamosas hiperpigmentadas o pápulas papilomatosas que se unen en
parches o placas confluentes centralmente y exhiben un patrón reticular periférico
( imágenes 1,2,3,4). En raras ocasiones, CARP también puede aparecer como
máculas atróficas con una superficie parecida al papel de cigarrillo [ 1 ].
La CARP generalmente comienza en la parte superior
del tronco, especialmente en las áreas intermamaria e interescapular, con el
desarrollo posterior de lesiones en el cuello y la axila, donde las marcas de
la piel a veces son exageradas [ 1,3 ]. Se ha informado la participación
simultánea o aislada de la cara, los hombros, la parte superior de los brazos,
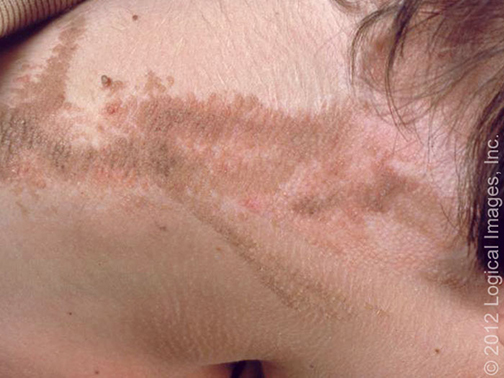
la fosa antecubital, la fosa poplítea y las áreas púbicas ( imágenes 5,6,7) [
3,14-19 ]. La CARPA no afecta la mucosa o las uñas. En un estudio retrospectivo
de 39 pacientes con CARP, el 80 por ciento no informó ningún síntoma, mientras
que el 20 por ciento informó un prurito leve [ 3 ].
Figura 5: Papilomatosis confluente y reticulada
Placas reticuladas hiperpigmentadas en la cara.
Figura 6: Papilomatosis confluente y reticulada
Placas reticuladas hiperpigmentadas en el área
púbica y los muslos proximales.
Figura 7: Papilomatosis confluente y reticulada
Placas reticuladas hiperpigmentadas en los pliegues
antecubitales y el área axilar.
CARP generalmente persiste si no se trata, aunque se
ha informado de resolución espontánea [ 3,20 ]. En un estudio retrospectivo de
39 pacientes con CARP evaluados en un centro médico académico, la duración
media de la enfermedad hasta el momento de la presentación clínica fue de 3
años (rango de 3 meses a 20 años) [ 3 ].
HISTOPATOLOGÍA
Comparte características histológicas con la acantosis
nigricans, incluyendo hiperqueratosis, papilomatosis y un infiltrado
linfocítico perivascular superficial leve. El taponamiento folicular, presente
en 9 de 10 pacientes en un estudio, puede ayudar a distinguir entre las dos
condiciones [ 2 ]. Las tinciones para hongos deben ser negativas.
DIAGNÓSTICO
Se debe sospechar fuertemente un diagnóstico de CARP
en adultos jóvenes con parches o placas hiperpigmentados reticulados y
papilomatosos en el tronco, el cuello o las áreas de flexión. En la práctica
clínica, el diagnóstico generalmente se basa en el reconocimiento de estos
hallazgos físicos clásicos y la ausencia de elementos fúngicos en una
preparación de hidróxido de potasio (KOH) realizada para descartar tiña
versicolor. Si el diagnóstico sigue siendo incierto debido a hallazgos físicos
atípicos, se puede realizar una biopsia de piel para identificar
características histológicas compatibles con CARP u otros trastornos; sin
embargo, CARP no tiene hallazgos histológicos patognomónicos.
DIAGNOSTICO DIFERENCIAL
Varias otras enfermedades cutáneas pueden
confundirse con CARP [ 3,21,22 ].
- Tiña versicolor : clínicamente, la CARP se suele
confundir con tiña versicolor, una infección micótica superficial que puede
presentarse con máculas o parches hiperpigmentados en el tronco o las
extremidades superiores proximales ( Figuras 8,9). Una preparación de hidróxido
de potasio (KOH) de la escala revelará hifas y células de levadura.
Figura 8: Tiña versicolor.
Múltiples máculas hiperpigmentadas y coalescentes y
placas delgadas en el pecho.
Figura 9: Tiña versicolor.
Múltiples máculas hiperpigmentadas y coalescentes y
placas delgadas en el tórax.
- Acantosis nigricans: CARP y acantosis nigricans
comparten muchas características clínicas e histológicas. La acantosis
nigricans se caracteriza por placas aterciopeladas e hiperpigmentadas con
predilección por las áreas de flexión y hallazgos histológicos de
hiperqueratosis y papilomatosis epidérmica ( Figuras 10,11) ). Las pacientes
con acantosis nigricans a menudo tienen obesidad asociada, diabetes y / o
síndrome de ovario poliquístico (PCOS).
Figura 10: Acantosis nigricans.
Una placa hiperpigmentada y aterciopelada está
presente en el cuello de este paciente con acantosis nigricans.
Figura 11: Acantosis nigricans.
Una placa aterciopelada e hiperpigmentada con
acrocordones asociados está presente en la axila.
- Nevo epidérmico: los nevos epidérmicos se presentan
con mayor frecuencia al nacer o durante el primer año de vida y suelen ser lineales.
Comienzan como parches lineales sutiles o placas muy delgadas compuestas de
pápulas de color marrón claro a piel. Alrededor de la pubertad, los nevos
epidérmicos pueden volverse más gruesos y oscuros ( figura 12 ).
Figura 12: Nevo epidérmico.
Una placa hiperpigmentada, verrugosa y lineal está
presente en el cuello.
- Verruga plana: las verrugas planas (verrugas planas)
son pápulas de color plano o hiperpigmentadas de parte superior plana causadas
por una infección cutánea por el virus del papiloma humano (VPH) ( figura 13 ).
La verruga plana no tiene el aspecto reticular típico visto en la periferia de
CARP.
Figura 13: verrugas planas
Múltiples pápulas planas por VPH de color carne
están presentes en la frente.
- Epidermodisplasia verruciforme: pacientes con
epidermodisplasia verruciforme, un trastorno autosómico recesivo caracterizado
por una alta susceptibilidad a la infección por VPH, presente con múltiples
lesiones cutáneas durante la primera infancia o la infancia. Los hallazgos
cutáneos varían ampliamente, desde lesiones papilomatosas similares a verrugas,
hasta pápulas planas de color de piel, pápulas o placas de color rojo a marrón
rojizo en la cara, el cuello y el tronco ( Figura 14 ).
Figura 14: Epidermodisplasia verruciforme.
Típicas lesiones de tipo pitiriasis versicolor like en
el cuello de un paciente con epidermodisplasia verruciforme.
- Enfermedad de Darier: la enfermedad de Darier es una
enfermedad hereditaria autosómica dominante poco frecuente con hallazgos en la
piel, las uñas y las membranas mucosas. La afectación de la piel generalmente
aparece como pápulas céreas de color marrón amarillento, del color de la piel o
hiperpigmentadas en el pecho y la espalda que pueden unirse en placas con costra
( Figura 15) La afectación de la ingle, axila e inframamaria también está
presente en la mayoría de los pacientes. La queratosis punteada y los hoyos a
veces se notan en las palmas. Las bandas
longitudinales blancas y rojas en las uñas, así como las muescas en forma de V
en el margen de la uña libre, son hallazgos característicos y patognomónicos.
Se pueden observar pápulas blancas en la mucosa oral de algunos pacientes. La
biopsia de la piel de las lesiones cutáneas muestra acantólisis focal suprabasal
característica y disqueratosis con "cuerpos de cuerpo" y
"granos" rosados característicos.
Figura 15: Enfermedad de Darier.
Múltiples placas hiperpigmentadas e
hiperqueratósicas en tórax
- Liquen amiloide y amiloidosis macular: el liquen amiloide se
presenta como pápulas liquenoides escamosas de color de piel pruriginosas y de
color rosa a marrón claro que se presentan con mayor frecuencia en las espinillas
bilaterales ( Figura 16 ), mientras que la amiloidosis macular generalmente
aparece como máculas onduladas pruriginosas en la parte media superior del
dorso ( Figura 17 ). La biopsia de piel con tinción amiloide ayudará a
diferenciar el liquen o la amiloidosis macular de la CARP.
Figura 16: Liquen amiloide.
Placas hiperpigmentadas en las superficies
extensoras de las piernas en un paciente con amiloidosis liquen. Las placas,
que resultan de pápulas coalescentes, son persistentes e intensamente
pruriginosas.
Figura 17: Amiloidosis macular.
Un patrón ondulado característico de pigmentación en
un paciente con amiloidosis macular.
TRATAMIENTO
CARP es una afección cutánea benigna y a menudo
asintomática; por lo tanto, el tratamiento no es obligatorio. Sin embargo, los
pacientes a menudo desean tratamiento debido a problemas estéticos o prurito
asociado.
Ningún ensayo aleatorizado ha evaluado el
tratamiento de CARP. Las recomendaciones de tratamiento se basan en datos de
análisis retrospectivos, series de casos e informes de casos. La
antibioticoterapia oral con minociclina es un tratamiento de primera línea bien
aceptado. Los antibióticos macrólidos son intervenciones razonables de segunda
línea para pacientes que no pueden tolerar la minociclina o que no mejoran con
la terapia con minociclina. Los tratamientos menos utilizados que pueden
mejorar la CARP incluyen retinoides tópicos, análogos tópicos de vitamina D,
tacrolimus tópico y antibióticos orales alternativos. La isotretinoína oral es
un tratamiento adicional que se reserva principalmente para pacientes con
enfermedad refractaria.
Si es necesario un alivio inmediato del prurito
asociado, se pueden aplicar corticosteroides tópicos de potencia media a las
áreas afectadas en el tronco y las extremidades dos veces al día durante dos a
cuatro semanas. Para la afectación facial o intertriginosa, se debe usar un
corticosteroide tópico de baja potencia una o dos veces al día durante dos a
cuatro semanas. El uso a largo plazo de los corticosteroides tópicos puede
causar atrofia o dispigmentación de la piel y debe controlarse cuidadosamente.
Alternativamente, se puede usar tacrolimus o pimecrolimus tópico para el
prurito si se necesita una terapia de mantenimiento a largo plazo. Estos agentes
no causan atrofia ni depigmentación de la piel.
TERAPIA DE PRIMERA LÍNEA
El tratamiento antibiótico oral se usan típicamente
en el tratamiento inicial de CARP. Las propiedades antiinflamatorias de los
antibióticos, como la inhibición de la migración de neutrófilos y la liberación
reactiva de oxígeno, pueden ser responsables de la eficacia clínica, ya que no
se aíslan bacterias de los pacientes con CARP [ 3,23-25 ]. La minociclina es el
antibiótico más utilizado para CARP.
Minociclina:
el tratamiento con minociclina está
respaldado por múltiples informes de casos y series de casos [ 3,15,17,26-35 ].
Como ejemplo, en un estudio no controlado de nueve pacientes con CARP tratados
con minociclina (50 mg dos veces al día durante seis semanas), siete pacientes
tuvieron una respuesta del 90 al 100 por ciento a la terapia y el resto tuvo
grados menores de mejoría [ 34 ]. No se informaron reacciones adversas, y los
pacientes fueron seguidos durante un promedio de 11 meses. Se observó
recurrencia en tres de nueve pacientes; todos respondieron al retratamiento con
minociclina.
Cuando se trata la CARP en adultos, generalmente se
prescribe minociclina a una dosis de 50 o 100 mg dos veces al día durante un
mínimo de seis semanas. La mejora suele ser evidente dentro de las primeras
semanas de tratamiento. Si no hay respuesta después de tres meses, discontinuamos
el tratamiento con minociclina.
Los posibles efectos secundarios de la minociclina
incluyen malestar gastrointestinal, decoloración de la piel, mareos, tinnitus,
un síndrome similar al lupus y reacción a medicamentos con eosinofilia y
síntomas sistémicos (DRESS). La minociclina puede decolorar el desarrollo de
dientes permanentes y está contraindicada en niños menores de nueve años y
mujeres embarazadas. Ver monografía de Lexicomp: Minociclina : información
sobre medicamentos, sección sobre reacciones adversas.
TERAPIA DE SEGUNDA LÍNEA
Los pacientes
que no pueden tolerar la minociclina o que no responden a la minociclina pueden
ser tratados con un antibiótico macrólido.
Antibióticos macrólidos: los informes de casos describen un tratamiento
exitoso con claritromicina (500 mg diarios durante cinco semanas) [ 26 ],
eritromicina (1000 mg diarios durante seis semanas) [ 26 ] y azitromicina (500
mg diarios durante tres a cuatro semanas) [ 26, 36,37 ]. La roxitromicina, un
macrólido no disponible en los Estados Unidos, también ha tratado con éxito la
CARP a una dosis de 300 mg por día en un paciente que no respondió a la
minociclina [ 38 ].
Los posibles efectos secundarios de los macrólidos
incluyen dificultad gastrointestinal (particularmente con eritromicina ),
interacciones farmacológicas y prolongación del intervalo QT. Los efectos
secundarios de estos medicamentos se revisan con mayor detalle por separado.
Otras terapias
Una variedad de otros tratamientos pueden ser
efectivos para la CARP en función de los informes de un pequeño número de
pacientes, incluidas las terapias tópicas, los antibióticos orales alternativos
y los retinoides orales. Debido a la preocupación por los efectos secundarios,
la terapia con retinoides orales generalmente se reserva para pacientes con
CARP refractaria.
Agentes tópicos
Los agentes tópicos que pueden ser beneficiosos para
CARP incluyen retinoides tópicos, análogos tópicos de la vitamina D, y tópica
tacrolimus . Se postula que la eficacia de la terapia tópica con retinoides y
análogos tópicos de vitamina D se relaciona con los efectos sobre la
queratinización desordenada en CARP.
Los retinoides tópicos - tretinoína tópica y
tazaroteno han aparecido eficaz para CARP en informes de casos [ 7,13,39 ].
Tres pacientes con CARP tratados con aplicaciones de tretinoína una vez al día
al 0.01% o 0.025% de gel mejoraron notablemente en seis a ocho semanas [ 7 ] y
la aplicación de tretinoína al 0.1% en áreas despejadas con crema en otro
paciente [ 39 ]. El tratamiento de una niña de 11 años con la aplicación dos
veces al día de tazaroteno al 0,1% en gel condujo a una mejora notable dentro
de una semana y la eliminación de la CARP dentro de los dos meses [ 13 ].
Posteriormente, se reanudó el tazaroteno según fuera necesario para las
recurrencias.
Análogos tópicos de vitamina D : los informes de
casos documentan el tratamiento exitoso de CARP con la aplicación dos veces al
día de ungüento tópico de calcipotriol o tacalcitol tópico [ 11,12,40,41 ].
Mejora marcada ha ocurrido dentro de varias semanas.
Tacrolimus tópico: el tratamiento con tacrolimus
ungüento al 0.1% dos veces al día durante tres meses condujo a una mejoría
clínica marcada en un paciente con CARP [ 42 ]. Una recurrencia de CARP dos
meses después de la interrupción de tacrolimus respondió al retratamiento.
Antibióticos orales alternativos
Además de los antibióticos minociclina y macrólidos,
los informes de casos dispersos sugieren que otros antibióticos pueden ser
efectivos. La doxiciclina ha dado buenas respuestas a una dosis de 200 mg por
día durante tres meses [ 18,43 ]. Otros antibióticos asociados con un
tratamiento exitoso incluyen amoxicilina (250 mg tres veces al día durante tres
meses) [ 3,16 ] y cefdinir (300 mg durante dos semanas) [ 27 ]. El ácido
fusídico , un antibiótico bacteriostático no disponible en los Estados Unidos,
administrado como 1000 mg al día durante cuatro semanas también ha resultado en
la eliminación de la enfermedad [ 26 ].
Retinoides orales
Los informes
de casos describen el tratamiento exitoso de CARP con isotretinoína oral
administrada en dosis que varían de 0.25 mg / kg por día a 2 mg / kg por día
durante dos a cinco meses [ 39,44-46 ]. En un informe, dos pacientes que no
respondieron a la minociclina tuvieron resolución de CARP después del tratamiento
con isotretinoína oral (1 mg / kg por día durante 14 a 18 semanas) y ácido
láctico tópico al 10%. Ambos pacientes permanecieron libres de lesiones a los
1,5 años de seguimiento [ 46 ].
El tratamiento con etretinato oral (0.25 a 0.35 mg /
kg por día o 50 mg por día) se ha asociado con la eliminación de CARP en los
informes de casos; sin embargo, la enfermedad recurrió después de suspender la
terapia [ 47,48 ]. Etretinate ya no está disponible en los Estados Unidos.
Los retinoides orales son teratogénicos y pueden
conducir a una variedad de efectos adversos, como queilitis, cambios visuales,
anormalidades lipídicas y seudotumor cerebral. Los riesgos y beneficios de los
retinoides orales deben considerarse cuidadosamente antes del tratamiento. Por
lo tanto, la terapia con retinoides orales generalmente se reserva para
pacientes con enfermedad refractaria.
Traducción: UpToDate 2020
Referencias
1 Scheinfeld N. Papilomatosis confluente y
reticulada: una revisión de la literatura. Am J Clin Dermatol 2006; 7: 305.
2 Tamraz H,
Raffoul M, Kurban M, et al. Papilomatosis confluente y
reticulada: estudio clínico e histopatológico de 10 casos del Líbano. J Eur
Acad Dermatol Venereol 2013; 27: e119.
3 Davis MD,
Weenig RH, Camilleri MJ. Papilomatosis confluente y reticulada
(síndrome de Gougerot-Carteaud): una dermatosis sensible a la minociclina sin
evidencia de levadura en la patogénesis. Un estudio de 39 pacientes y una
propuesta de criterios diagnósticos. Fr. J. Dermatol 2006; 154: 287.
4 Jimbow M, Talpash O, Jimbow K. Papilomatosis
confluente y reticulada: estudios clínicos, luz y microscopía electrónica. Int
J Dermatol 1992; 31: 480.
5 Griffiths CE. Gougerot-Carteaud sigue siendo un
enigma después de todos estos años. J Dermatolog Treat 2002; 13: 1.
6 Inalöz HS, Patel GK, Knight AG. Papilomatosis
familiar confluente y reticulada. Arch Dermatol 2002; 138: 276.
7 Schwartzberg JB, Schwartzberg HA. Respuesta de la
papilomatosis confluente y reticulada de Gougerot y Carteaud a la tretinoína
tópica. Cutis 2000; 66: 291.
8 Henning JP, de
Wit RF. Ocurrencia
familiar de papilomatosis confluente y reticulada. Arch Dermatol 1981; 117: 809.
9 Baden HP. Papilomatosis
cutánea familiar. Arch Dermatol 1965; 92: 394.
10 Stein JA,
Shin HT, Chang MW. Papilomatosis confluente y reticulada
asociada a tiña versicolor en tres hermanos. Pediatr Dermatol 2005; 22: 331.
11 Gülec AT, Seçkin D. Papilomatosis confluente y
reticulada: tratamiento con calcipotriol tópico. Br J Dermatol 1999; 141: 1150.
12 Ginarte M, Fabeiro JM, Toribio J. Papilomatosis
confluente y reticulada (Gougerot-Carteaud) tratada con éxito con tacalcitol. J
Dermatolog Treat 2002; 13:27.
13 Bowman PH, Davis LS. Papilomatosis confluente y
reticulada: respuesta al tazaroteno. J Am Acad Dermatol 2003; 48: S80.
14 Lee D, Cho
KJ, Hong SK, et al. Dos casos de papilomatosis confluente y
reticulada con una localización inusual. Acta Derm Venereol 2009; 89:84.
15 Kim BS, Lim
HJ, Kim HY, et al. Caso de papilomatosis confluente y
reticulada eficaz con minociclina con localización inusual en la frente. J
Dermatol 2009; 36: 251.
16 Davis RF, Harman KE. Papilomatosis confluente y
reticulada tratada con éxito con amoxicilina. Br J Dermatol 2007; 156: 583.
17 Kim MR, Kim SC. Papilomatosis confluente y
reticulada en el brazo tratado con éxito con minociclina. J Dermatol 2010; 37: 749.
18 Jo S, Park
HS, Cho S, Yoon HS. Criterios de diagnóstico actualizados
para papilomatosis confluente y reticulada: reporte de un caso. Ann Dermatol
2014; 26: 409.
19 Hallel-Halevy D, Grunwald MH, Halevy S.
Papilomatosis confluente y reticulada (Gougerot-Carteaud) de la región púbica.
Acta Derm Venereol 1993; 73: 155.
20 Sakiyama T, Amagai M, Ohyama M. Cronología de la papilomatosis
confluente y reticulada: la regresión espontánea en un caso después del
seguimiento a largo plazo puede implicar una naturaleza transitoria de la
afección. J Dermatol 2015; 42: 335.
21 Groh V, Schnyder UW, Sigg C. 'Papillomatose
papuleuse confluente et réticulée Gougerot-Carteaud': ¿otra forma de
amiloidosis cutánea? Dermatologica 1981; 162: 118.
22 Groh V, Sigg
C, Schnyder UW. Nuevos hallazgos histoquímicos y
ultraestructurales en tres casos de 'papillomatose papuleuse confluente et
réticulée (Gougerot-carteaud)'. Dermatologica 1982; 165: 145.
23 Zalewska-Kaszubska J, Górska D. Capacidades
antiinflamatorias de los macrólidos. Pharmacol Res 2001; 44: 451.
24 Sapadin AN, Fleischmajer R. Tetraciclinas:
propiedades no antibióticas y sus implicaciones clínicas. J Am Acad Dermatol
2006; 54: 258.
25 Monje E, Shalita A, Siegel DM. Aplicaciones
clínicas de las tetraciclinas no antimicrobianas en dermatología. Pharmacol Res 2011; 63: 130.
26 Jang HS, Oh
CK, Cha JH, et al. Seis casos de papilomatosis confluente y
reticulada aliviada por varios antibióticos. J Am Acad Dermatol 2001; 44: 652.
27 Yamamoto A, Okubo Y, Oshima H, et al. Dos casos
de papilomatosis confluente y reticulada: tratamientos exitosos de un caso con
cefdinir y otro con minociclina. J Dermatol 2000; 27: 598.
28 Sassolas B, Plantin P, Guillet G. Papilomatosis
confluente y reticulada: tratamiento con minociclina. J Am Acad Dermatol 1992;
26: 501.
29 Poskitt L, Wilkinson JD. Eliminación de
papilomatosis confluente y reticulada de Gougerot y Carteaud con minociclina.
Br J Dermatol 1993; 129: 351.
30 Katayama I, Yokozeki H, Nishioka K. La
minociclina oral mejoró la queratosis folicular escamosa (Dohi) y el trastorno
relacionado: los factores bacterianos posiblemente están involucrados en la
queratinización aberante. J Dermatol 1994; 21: 604.
31 Shimizu S, Han-Yaku H. Papilomatosis confluente y
reticulada sensible a la minociclina. Dermatología 1997; 194: 59.
32 Puig L, de Moragas JM. Papilomatosis confluente y
reticulada de Gougerot y Carteaud: la minociclina merece juicio antes del
etretinato. Arch Dermatol
1995; 131: 109.
33 Chang SN, Kim
SC, Lee SH, Lee WS. Tratamiento con minociclina para
papilomatosis confluente y reticulada. Cutis 1996; 57: 454.
34 AD Montemarano, Hengge M, Sau P, Welch M.
Papilomatosis confluente y reticulada: respuesta a la minociclina. J Am Acad
Dermatol 1996; 34: 253.
35 Fung MA,
Frieden IJ, LeBoit PE, et al. Papilomatosis confluente y
reticulada: tratamiento exitoso con minociclina. Arch Dermatol 1996; 132: 1400.
36 Atasoy M, Ozdemir S, Aktas A, y col. Tratamiento
de papilomatosis confluente y reticulada con azitromicina. J Dermatol 2004; 31:
682.
37 Gruber F, Zamolo G, Saftić M, y col. Tratamiento
de papilomatosis confluente y reticulada con azitromicina. Clin Exp Dermatol
1998; 23: 191.
38 Ito S, Hatamochi A, Yamazaki S. Un caso de
papilomatosis confluente y reticulada que respondió con éxito a la
roxitromicina. J Dermatol 2006; 33:71.
39 Lee MP,
Stiller MJ, McClain SA, et al. Papilomatosis confluente y
reticulada: respuesta al tratamiento con isotretinoína oral en dosis altas y
reevaluación de datos epidemiológicos. J Am Acad Dermatol 1994; 31: 327.
40 Carrozzo AM,
Gatti S, Ferranti G, y col. Tratamiento con calcipotriol de la
papilomatosis confluente y reticulada (síndrome de Gougerot-Carteaud). J Eur
Acad Dermatol Venereol 2000; 14: 131.
41 Lang EW,
Czosnyka M, Mehdorn HM. Reactividad de oxígeno tisular y
autorregulación cerebral después de una lesión cerebral traumática grave. Crit
Care Med 2003; 31: 267.
42 Tirado-Sánchez A, Ponce-Olivera RM. Tacrolimus en
papilomatosis confluente y reticulada de Gougerot Carteaud. Int J Dermatol 2013; 52: 513.
43 Angeli-Besson
C, Koeppel MC, Jacquet P, et al. Papilomatosis
confluente y reticulada (Gougerot-Carteaud) tratada con tetraciclinas. Int J
Dermatol 1995; 34: 567.
44 Erkek E, Ayva S, Atasoy P, Emeksiz MC.
Papilomatosis confluente y reticulada: respuesta favorable a dosis bajas de
isotretinoína. J Eur Acad Dermatol Venereol 2009; 23: 1342.
45 Hodge JA, Ray MC. Papilomatosis confluente y
reticulada: respuesta a la isotretinoína. J Am Acad Dermatol 1991; 24: 654.
46 Solomon BA, Laude TA. Dos pacientes con
papilomatosis confluente y reticulada: respuesta a isotretinoína oral y 10% de
loción de ácido láctico. J
Am Acad Dermatol 1996; 35: 645.
47 Bruynzeel-Koomen
CA, de Wit RF. Papilomatosis confluente y reticulada
tratada con éxito con el etretinato aromático. Arch Dermatol 1984; 120: 1236.
48 Baalbaki SA, Malak JA, al-Khars MA. Papilomatosis
confluente y reticulada. Tratamiento con etretinato. Arch Dermatol 1993; 129:
961.