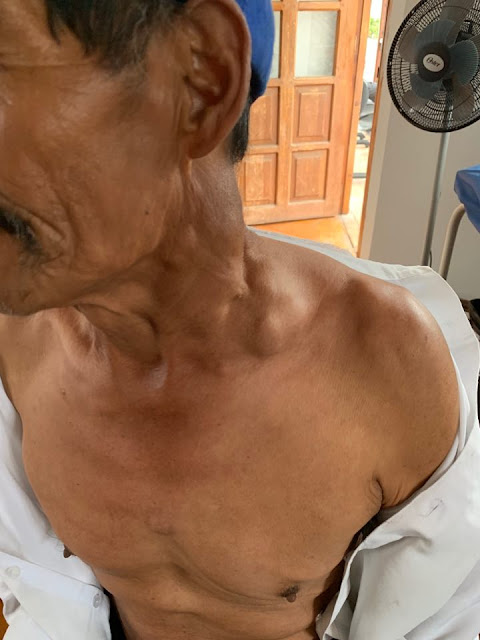
Paciente femenina 55 años diabética que refiere que
hace más o menos 2 semanas luego de comer pescado presentó una sensación de
cuerpo extraño a nivel de fauces que
luego fue progresando a disfagia y hace
ocho horas presentó fiebre por lo que acude a la consulta.
Se llevó a
cabo una TC de cuello y tórax
Se observa una imagen en el lado derecho de la orofaringe y el piso
de la boca heterogénea de aspecto mixto con contenido líquido y sólido además
de burbujas aéreas en su interior que se comportan como una masa que ocupa
espacio y altera la estructura de la orofaringe y del piso de la boca. Dicha
colección se proyecta hacia la región superior del tórax en el espacio
prevertebral desplazando el esófago y la vía aérea hacia adelante y
comprometiendo el mediastino produciendo infiltración de las estructuras de los
grandes vasos
Hay una gran colección líquida con burbujas aéreas
en el espacio orofaringeo del lado derecho y retrofaringeo, que llevó a una
mediastinitis con compromiso del espacio prevascular y prevertebral. Presenta
refuerzo periférico con el contraste como corresponde a todo absceso y
desplazamiento de estructuras vecinas.
INFECCIONES DEL ESPACIO RETROFARÍNGEO
PRESENTACIÓN DE LAS CARACTERÍSTICAS CLÍNICAS
Las características clínicas de una infección del
espacio retrofaríngeo dependen de la fuente primaria de la infección. El dolor
de garganta, la dificultad para tragar, o la dificultad para respirar pueden
ser características prominentes cuando la infección es causada por la diseminación
local, que generalmente es secundaria a un trauma penetrante (por ejemplo, de
huesos de pollo o después de una instrumentación del esófago o tráquea).
También puede haber fiebre y toxicidad sistémica. El examen de la orofaringe
puede mostrar hinchazón o abultamiento en la línea media o unilateral de la
pared faríngea posterior.
La infección del espacio retrofaríngeo también puede
propagarse a partir de la extensión local de una infección parafaríngea o de
infecciones más distantes (p. Ej., Infecciones odontogénicas) por la
participación de los ganglios linfáticos retrofaríngeos. En tales casos, puede
haber trismo e impide el examen directo
de la pared faríngea posterior.
COMPLICACIONES :
Los abscesos retrofaríngeos se encuentran entre las
infecciones más graves del espacio profundo, ya que la infección puede
extenderse directamente a las regiones anterior o posterior del mediastino
superior, o en toda la longitud del mediastino posterior a través del espacio
de peligro (“DANGER SPACE”)( figura 4 y figura 5).
Figura 4. Relación de varios espacios fasciales
cervicales con las capas superficiales y profundas de la fascia cervical
El espacio de "peligro" se encuentra
detrás del espacio anatómico retrofaríngeo. Es un espacio potencial que
proporciona un camino para que las infecciones retrofaríngeas se extiendan
hacia el mediastino.
A) Corte sagital del cuello.
(B) Corte coronal a nivel de C7.
Figura 5. Espacios profundos del cuello y capas
fasciales.
El espacio de "peligro" se encuentra
detrás del espacio anatómico retrofaríngeo. Es un espacio potencial que
proporciona un camino para que las infecciones retrofaríngeas se extiendan
hacia el mediastino.
La mediastinitis necrotizante aguda es la
complicación más temida de una infección del espacio retrofaríngeo. Una
infección en el espacio de "peligro" entre las fascias alar y
prevertebral puede drenar por gravedad hacia el mediastino posterior, lo que
produce mediastinitis y empiema. En el pasado, el 70 por ciento de los casos de
mediastinitis se debían a la propagación de la infección de esta manera. Sin
embargo, con la introducción de antibióticos, la extensión mediastínica se ha
vuelto poco frecuente, y la mayoría de los casos de mediastinitis aguda se
deben a la perforación esofágica .
Clínicamente, la aparición de mediastinitis
necrotizante aguda es rápida y se caracteriza por lo siguiente:
- Proceso necrotizante generalizado que se extiende a lo largo del mediastino posterior, ocasionalmente hacia el espacio retroperitoneal.
- Ruptura de absceso mediastínico en la cavidad pleural con empiema o desarrollo de loculaciones.
- Derrame pleural o pericárdico, frecuentemente con taponamiento
La mortalidad de la mediastinitis necrotizante aguda
en adultos es alta (25 por ciento), incluso cuando se administran los
antibióticos apropiados.
La neumonía por aspiración es otra complicación
potencial de la infección del espacio retrofaríngeo. La neumonía puede ser
consecuencia del deterioro de la deglución o la ruptura espontánea del absceso
en la vía aérea.
DIAGNÓSTICO
Se sospecha el diagnóstico de una infección del
espacio parafaríngeo o retrofaríngeo en función de la presentación clínica y se
establece por imagen (tomografía computarizada. Además de las imágenes, se
deben obtener hemocultivos en todos los pacientes con una infección del espacio
parafaríngeo o retrofaríngeo, independientemente de si hay fiebre para
identificar patógenos potenciales.
Los hallazgos generales en la TC de las infecciones
del espacio profundo del cuello incluyen la pérdida de definición entre los
espacios anatómicos en el cuello, infiltración de los tejidos subcutáneos (
figura 6 ), el realce del tejido y la formación de abscesos francos
Figura 6. Infección del espacio parafaríngeo.
Infección del espacio parafaríngeo.
Infiltración y estrechamiento del
espacio parafaríngeo izquierdo (flecha) secundario a una infección adyacente
que afecta a la glándula parótida izquierda. Tenga en cuenta la densidad de
grasa normal del espacio parafaríngeo derecho.
Figura 7 Tomografía computada que demuestra abscesos
retrofaríngeos y parafaríngeos
Esta tomografía computarizada con contraste del
cuello muestra los abscesos retrofaríngeos (A) y parafaríngeos (B), según lo
indicado por un núcleo de baja densidad, edema de tejidos blandos, planos de
grasa obliterados, efecto de masa y anillo de realce.
En ocasiones, los ganglios linfáticos necróticos (p.
Ej., de una enfermedad metastásica maligna) pueden ser similares en apariencia
a un absceso en la TC (realce periférico con atenuación central baja); en tales
casos, la resonancia magnética (RM) puede ser útil para diferenciar los dos.
Aunque se prefiere la TC o la RM en lugar de las
radiografías simples, ciertos hallazgos de una radiografía simple, si se
realizan, también pueden sugerir una infección del espacio retrofaríngeo. Estos
incluyen el aumento del grosor de los tejidos blandos prevertebrales, los
niveles de aire o aire y los cuerpos extraños. Puede haber lordosis cervical
con hinchazón y acumulación de gases en el espacio retrofaríngeo que causa el
desplazamiento anterior de la laringe y la tráquea ( figura 8 ). En presencia
de una infección del espacio retrofaríngeo, la faringe o la vía aérea superior
se desplazan anteriormente en más de la mitad del ancho del cuarto cuerpo
vertebral cervical (C4; normalmente, los tejidos blandos de la pared posterior
de la hipofaringe tienen aproximadamente 5 mm de profundidad, menos de un
tercio del diámetro de C4).
Figura 8
Demostración radiográfica de tejido blando lateral
de absceso retrofaríngeo.
Las radiografías laterales del cuello muestran: (A)
vista cervical lateral normal; (B) Expansión de los tejidos blandos
prevertebrales por un absceso retrofaríngeo. Las flechas en ambas imágenes
indican el borde anterior del espacio retrofaríngeo.
TRATAMIENTO
El drenaje quirúrgico abierto ha sido el enfoque
tradicional para el manejo de abscesos. Para los pacientes con infecciones del
espacio cervical profundo bien definidas sin compromiso de la vía aérea, la
aspiración con aguja guiada por ultrasonido es una alternativa eficaz y se
asocia con una menor estancia hospitalaria y un mejor ahorro de costos. En la
infección del espacio retrofaríngeo complicada por mediastinitis necrotizante
aguda, se requiere drenaje quirúrgico del mediastino y se puede realizar
mediante el abordaje cervico-mediastínico o transtorácico. Aunque el abordaje
cervical puede ser efectivo en la mediastinitis temprana, la toracotomía
generalmente está indicada una vez que el proceso de necrotización ha ingresado
en el espacio de "peligro".
El drenaje endoscópico está contraindicado debido a
la proximidad de los grandes vasos.
TERAPIA ANTIBIOTICA
La infección adquirida en la comunidad -
tratamiento antimicrobiano empírico inicial de infecciones del espacio
parafaríngeo o retrofaríngeos en pacientes inmunocompetentes con infecciones
adquiridas en la comunidad depende, en parte, en el sitio probable de origen de
la infección:
PARA LOS PACIENTES INMUNOCOMPETENTES CON UNA
PROBABLE FUENTE ORAL U ODONTOGÉNICA, sugerimos un régimen que tenga actividad
contra los estreptococos (incluidos los estreptococos viridans resistentes a la
clindamicina), H. influenzae y bacterias anaeróbicas. No incluimos de manera
rutinaria la cobertura contra S. aureus resistente a la meticilina (SARM) , pero sí si
existen factores de riesgo de infección o colonización por SARM, como se
muestra a continuación.
EJEMPLOS DE REGÍMENES EMPÍRICOS INCLUYEN:
Ampicilina-sulbactam (3 g por vía intravenosa [IV]
cada seis horas) o
Ceftriaxona
(1 a 2 g IV cada 24 horas) más metronidazol (500 mg IV cada ocho horas) o
Clindamicina (600 mg IV cada ocho horas) más
levofloxacina (500 mg IV u oral cada 24 horas)
PARA PACIENTES INMUNOCOMPETENTES CON UNA FUENTE
PROBABLE DE ORIGEN OTOGÉNICO (es decir, de oído o mastoides), sugerimos un
régimen que tenga actividad contra los estreptococos (incluidos los
estreptococos viridans resistentes a la clindamicina), H. influenzae y
bacterias anaerobias, así como el gramo facultativo cobertura negativa,
incluyendo P. aeruginosa . No incluimos habitualmente la cobertura contra el
SARM, pero sí lo hacemos si existen factores de riesgo de infección o
colonización por SARM, como se muestra a continuación.
EJEMPLOS DE REGÍMENES EMPÍRICOS INCLUYEN:
Cefepime (2 g IV cada 8 a 12 horas) más metronidazol
(500 mg IV cada ocho horas) o
Piperacilina-tazobactam (4.5 g cada seis horas)
Imipenem-cilastatina (500 mg IV cada seis horas) o
meropenem (1 g IV cada ocho horas)
PARA PACIENTES INMUNOCOMPETENTES CON UNA PROBABLE
FUENTE SINUSOGÉNICA (es decir, de los senos nasales), sugerimos un régimen que
tenga actividad contra S. pneumoniae , M. catarrhalis , S. aureus (incluido
SAMR) y bacterias anaerobias.
EJEMPLOS DE REGÍMENES EMPÍRICOS INCLUYEN:
Vancomicina más ampicilina-sulbactam (3 g IV cada
seis horas) o
Vancomicina más ceftriaxona (1 a 2 g IV cada 24
horas) más metronidazol (500 mg IV cada ocho horas) o
Clindamicina (600 mg IV cada ocho horas) más
levofloxacina (500 mg IV u oral cada 24 horas)
Como se mencionó anteriormente, incluimos la
cobertura contra SAMR para infecciones de origen oral / odontogénico u
otogénico cuando el paciente tiene factores de riesgo para infección o
colonización por SARM y para infecciones de origen sinusogénico. Esto
generalmente se logra con la adición de vancomicina (15 a 20 mg / kg IV cada 12
horas) o linezolid (600 mg por vía oral o IV cada 12 horas) al régimen. Los factores
de riesgo para SARM incluyen un historial de uso de drogas inyectables,
enfermedad comórbida (p. Ej., Diabetes mellitus, insuficiencia renal, úlceras
de decúbito, accidente cerebrovascular previo), residencia en un centro de
atención a largo plazo, alta hospitalaria dentro de los 12 meses anteriores y
hemodiálisis.
Las dosis de antibióticos están destinadas a
pacientes con función renal normal; la dosis de muchos de estos agentes debe
reducirse en pacientes con disfunción renal.
La terapia antibiótica empírica se puede ajustar una
vez que los resultados del cultivo estén disponibles.
INFECCIÓN ASOCIADA AL CUIDADO DE LA SALUD O HUÉSPED
INMUNOCOMPROMETIDO: para los pacientes
que están inmunocomprometidos o tienen una infección relacionada con el cuidado
de la salud (por ejemplo, residentes de centros de atención a largo plazo,
aquellos con hospitalización reciente), sugerimos un régimen de amplio espectro
que brinda cobertura contra SAMR y P. aeruginosa , además de otros aerobios y
anaerobios grampositivos y gramnegativos. Ejemplos incluyen:
Vancomicina (15 a 20 mg / kg IV cada 8 a 12 horas,
sin exceder los 2 g por dosis) o linezolid (600 mg IV cada 12 horas) más uno de
los siguientes:
Cefepime (2 g IV cada 8 a 12 horas) más metronidazol
(500 mg IV cada ocho horas) o
Imipenem (500 mg IV cada seis horas) o
Meropenem (1 g IV cada ocho horas) o
Piperacilina-tazobactam (4.5 g cada seis horas)
Las dosis de antibióticos están destinadas a
pacientes con función renal normal; la dosis de muchos de estos agentes debe
reducirse en pacientes con disfunción renal.
La terapia antibiótica empírica se puede ajustar una
vez que los resultados del cultivo estén disponibles.
TERAPIA DIRIGIDA Y DURACIÓN: la terapia con antibióticos se puede ajustar a
un régimen más estrecho si se dispone de resultados de cultivos informativos;
sin embargo, la cobertura anaeróbica generalmente se mantiene incluso si los
anaerobios no están aislados. En general, la terapia debe continuarse durante
dos o tres semanas hasta que la fiebre y la leucocitosis se hayan resuelto y la
sensibilidad y la hinchazón locales hayan disminuido. Los cursos más largos
pueden justificarse cuando hay complicaciones relacionadas con estructuras
óseas o vasculares.
En general, preferimos los antibióticos intravenosos
durante todo el tratamiento; sin embargo, los antibióticos que tienen una
excelente biodisponibilidad oral, como linezolid , ciprofloxacina y
metronidazol , pueden administrarse por vía oral una vez que el paciente está
mejorando, siempre que la absorción sea normal.
Otros problemas de manejo : en
los pacientes que se están recuperando, es importante restringir toda la
ingesta oral hasta que cualquier problema de deglución, que puede tener un
curso prolongado, se haya resuelto por completo.
INFECCIONES DEL ESPACIO PREVERTEBRAL
MICROBIOLOGÍA:
la microbiología de las infecciones del espacio prevertebral es bastante
diferente de la de otras infecciones profundas del cuello. Las infecciones del
espacio prevertebral generalmente se originan por la diseminación contigua de
una infección de la columna cervical (como discitis u osteomielitis vertebral),
por instrumentación local de la tráquea o el esófago, o por siembra hematógena.
Existe un predominio de organismos grampositivos, siendo el más común S. aureus
. Los organismos menos comunes incluyen varios bacilos gramnegativos
facultativos (incluyendo P. aeruginosa ), micobacterias y hongos.
Un estudio de osteomielitis cervical y absceso
prevertebral en 14 usuarios de drogas inyectables encontró que S. aureus causó
el 71 por ciento de los casos, mientras que los estafilococos coagulasa
negativos (14 por ciento), los estreptococos viridans (7 por ciento) y
Pseudomona causaron Los casos restantes. El S. aureus resistente a la
meticilina (SARM) es una causa cada vez más frecuente de osteomielitis
vertebral, especialmente en pacientes con factores de riesgo de colonización
por SARM. Los usuarios de drogas inyectables, por ejemplo, tienen una
incidencia 16 veces mayor de infecciones invasivas por MRSA de cualquier tipo
que los no usuarios.
Los factores de riesgo -
Factores de riesgo de infecciones del espacio prevertebral son
esencialmente los mismos que los de la osteomielitis vertebral.
Específicamente, el consumo de drogas por vía intravenosa, la inmunosupresión,
el trastorno por consumo de alcohol y la diabetes mellitus son factores de
riesgo conocidos.
PRESENTACIÓN CLÍNICA Y COMPLICACIONES: las manifestaciones clínicas de las
infecciones del espacio prevertebral varían según la ubicación de la fuente
primaria de infección (p. Ej., Espondilodiscitis cervical y osteomielitis) y si
existe absceso epidural espinal asociado o compresión de lamédulaespinal. En
una pequeña serie de 11 pacientes, los signos y síntomas de presentación más
comunes fueron dolor de cuello (100 por ciento), odinofagia (54 por ciento),
disfagia (36 por ciento), rigidez del cuello (36 por ciento), fiebre (27 por
ciento) y espalda dolor (9 por ciento).
El examen físico de la orofaringe puede revelar una
protuberancia en la pared posterior de la faringe en algunos pacientes. El
examen de la columna cervical también puede mostrar hinchazón o eritema.
Las complicaciones de las infecciones del espacio
prevertebral están relacionadas principalmente con las colecciones epidurales
espinales que causan la compresión de la médula espinal. Entre los pacientes
con absceso epidural espinal, aproximadamente un tercio tiene déficits
neurológicos que van desde el dolor de la raíz nerviosa hasta la parálisis.
Se ha informado que se produce parálisis
irreversible en 4 a 22 por ciento de los pacientes con absceso epidural
espinal. La propagación de la infección hacia o desde el disco o las vértebras
puede causar destrucción local con inestabilidad mecánica de la columna vertebral.
Como el espacio prevertebral se extiende desde la
base del cráneo hasta el cóccix y es contiguo a la vaina del músculo psoas, se
pueden formar abscesos distantes en el músculo psoas en un paciente que tiene
una infección del espacio prevertebral. También se ha informado una infección
cervical en el espacio prevertebral que se presume secundaria a la diseminación
ascendente de un pseudoquiste pancreático infectado.
DIAGNÓSTICO:
el diagnóstico de una infección del espacio prevertebral se realiza
mediante los hallazgos característicos de las imágenes en pacientes con
síntomas de infección del espacio del cuello profundo o sospecha de osteomielitis cervical. Además
de las imágenes, se deben obtener hemocultivos en todos los pacientes con una
infección del espacio paravertebral, independientemente de si existe o no
fiebre para identificar patógenos potenciales.
En las infecciones del espacio prevertebral, el
flemón o el absceso pueden verse en el espacio prevertebral . Las imágenes
también suelen mostrar espondilodiscitis u osteomielitis vertebral asociada.
MANEJO: el
tratamiento de las infecciones del espacio prevertebral consiste en un
drenaje rápido de cualquier absceso y antibióticos de amplio espectro.
DRENAJE: se
debe intentar el drenaje en todas las infecciones del espacio
prevertebral en las que hay un absceso claro o una colección de líquido
loculado. El drenaje percutáneo guiado por ultrasonido es una alternativa
eficaz y segura a la incisión y el drenaje quirúrgicos tradicionales para
algunos pacientes.
En el caso de la infección del espacio prevertebral
asociada con la osteomielitis cervical, también puede justificarse el
desbridamiento del hueso necrótico.
TERAPIA ANTIBIOTICA
SELECCIÓN DEL RÉGIMEN INICIAL: para pacientes con infecciones del espacio
prevertebral, sugerimos un régimen antibiótico inicial que tenga actividad
contra el S. aureus (incluido el SARM), los bacilos gramnegativos y los
anaerobios. Ejemplos incluyen:
Vancomicina (15 a 20 mg / kg por vía intravenosa
[IV] cada 8 a 12 horas, sin exceder los 2 g por dosis), más uno de los
siguientes :
Cefepime (2 g IV cada 8 a 12 horas) más metronidazol
(500 mg cada ocho horas) o
Piperacilina-tazobactam (4.5 g IV cada seis horas) o
Ciprofloxacina (400 mg IV cada 12 horas) más
metronidazol (500 mg IV cada ocho horas)
Linezolid (600 mg IV u oral cada 12 horas) o
daptomicina (6 mg / kg IV cada 24 horas) son otros agentes activos de MRSA que
pueden sustituirse por vancomicina en pacientes con intolerancia a la
vancomicina; Se prefiere linezolid IV sobre oral, inicialmente.
Para pacientes con infecciones asociadas a la
atención médica o con factores de riesgo de infección con un organismo
productor de betalactamasa de espectro extendido (BLEE), tratamiento empírico
con un agente activo de SARM (p. Ej., Vancomicina ) más un carbapenem (
imipenem 1 g IV cada seis horas o meropenem 2 g IV cada ocho horas es
apropiado.
Incluimos cobertura para anaerobios (p. Ej., Adición
de metronidazol a cefepima o ciprofloxacina ) durante la terapia empírica
temprana debido a la incertidumbre potencial de una infección prevertebral
versus retrofaríngea o la posibilidad de extensión de una infección del espacio
prevertebral desde un sitio retrofaríngeo. Una vez que se establece que una
infección del espacio prevertebral está relacionada con la osteomielitis
vertebral, la continuación de la cobertura anaeróbica específica no es
necesaria de forma rutinaria.
Las dosis de antibióticos a continuación están
destinadas a pacientes con función renal normal; la dosis de muchos de estos agentes
debe reducirse en pacientes con disfunción renal.
TERAPIA DIRIGIDA Y DURACIÓN: la terapia con antibióticos se puede ajustar a
un régimen más estrecho si se dispone de resultados de cultivos informativos.
Para las infecciones del espacio prevertebral no complicadas sin evidencia de
discitis u osteomielitis, es probable que dos a tres semanas de tratamiento
sean adecuadas. Sin embargo, la mayoría de las infecciones del espacio
prevertebral se deben a la propagación de la infección por discitis u osteomielitis
vertebral, en cuyo caso generalmente se recomienda una duración más prolongada
de la terapia.
En general, preferimos los antibióticos intravenosos
durante todo el tratamiento; sin embargo, los antibióticos que tienen una
excelente biodisponibilidad oral, como linezolid , ciprofloxacina y
metronidazol , pueden administrarse por vía oral una vez que el paciente está
mejorando, siempre que la absorción sea normal.
Fuente:
UpToDate 2019
Presentó
Dr. Hugo Cardenas Auz
La Paz, Carchi, Ecuador