Presentación del caso
Un hombre de 59 años fue atendido ambulatoriamente en este hospital debido a
fatiga, dolor abdominal, anemia, artralgias y alteraciones de la función
hepática.
El paciente había estado en su estado habitual de
salud hasta aproximadamente 3 días antes de la presentación, cuando se produjo
un malestar epigástrico y edema en el tobillo. También refirió aumento del estrés personal, dificultad para
dormir, disgeusia y náuseas. En la presentación en un consultorio externo de
este hospital, refirió dolor epigástrico
que calificó con 6 en una escala de 0 a 10 (donde 10 indica el dolor más grave)
y sin pérdida de peso. Tenía antecedentes de asma, dolor y derrame en la
rodilla derecha asociados con un quiste de Baker, hinchazón ocasional del
tobillo derecho y venas varicosas. Había tenido resultados normales en la
colonoscopia 3 años antes. Sus medicamentos eran pirbuterol por inhalación
según necesidad para el asma y sucralfato según necesidad para el malestar
estomacal; no refirió uso de
medicamentos antiinflamatorios no esteroideos. Vivía con su pareja y trabajaba
en una oficina. Consumía dos o tres copas de vino por noche y no fumaba ni
consumía drogas ilícitas.
En el examen, la temperatura era de 37,3 ° C, la
presión arterial 110/68 mm Hg, el peso de 81,8 kg y el índice de masa corporal
de 25,8. Había un edema con fóvea en los tobillos y varices superficiales en
ambas piernas; el resto del examen era normal. La hemoglobina corpuscular media
y la concentración de hemoglobina corpuscular media fueron normales, al igual
que los resultados de las pruebas de función renal y los niveles en sangre de
calcio, proteínas totales, albúmina, amilasa y fosfatasa alcalina. Otros
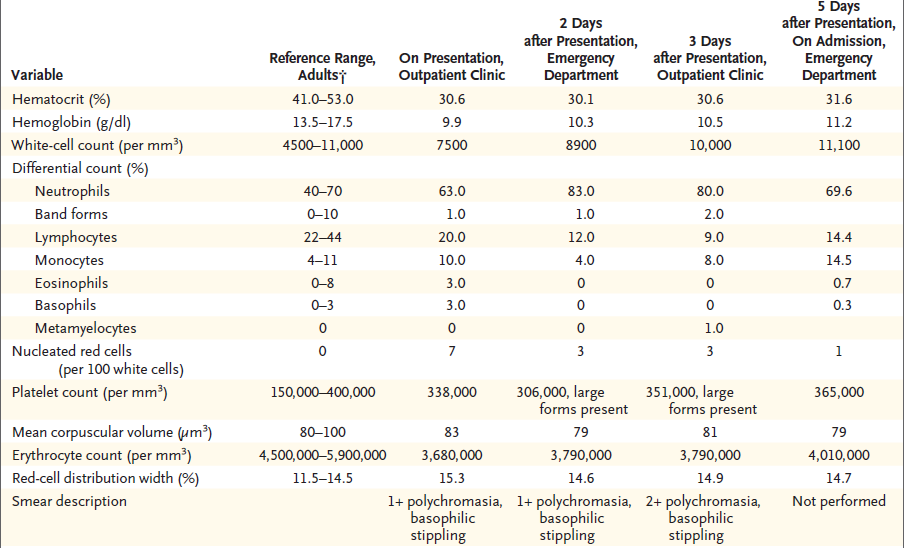
resultados de la prueba se muestran en la Tabla 1 y revelaron una anemia nueva
en comparación con los resultados de la prueba de 4 meses antes, que incluían
un hematocrito del 42% y un volumen corpuscular medio de 88 μm3.
TABLA 1
Datos de laboratorio.
La revisión de un frotis de sangre periférica reveló
1+ policromasia y punteado basófilo (Figura 1).
Figura 1
Frotis de sangre periférica (tinción de
Wright-Giemsa).
La revisión de un frotis de sangre periférica revela
varios eritrocitos con punteado basófilo grueso (Panel A, flechas), como lo
demuestran las inclusiones basófilas puntiformes que se distribuyen
uniformemente por todo el citoplasma. Algunos glóbulos rojos están agrandados,
con un tono violáceo (puntas de flecha); esta policromasia refleja un mayor
número de reticulocitos circulantes. También están presentes unos pocos
glóbulos rojos nucleados (Panel B, flecha).
Se realizó un diagnóstico de gastroenteritis, con
posible enfermedad ulcerosa péptica y una úlcera sangrante. Se administraron
omeprazol y sucralfato, se ordenaron pruebas de sangre en las heces y
anticuerpos contra Helicobacter pylori en la sangre, se programó una endoscopia
superior y se recomendó una dieta blanda. Se le indicó al paciente que
realizara un seguimiento en 3 días, o antes si su condición empeoraba.
Al día siguiente, el paciente llamó al consultorio
de su médico para informar de dolor en ambas piernas y aumento de la disgeusia.
Informó que sus deposiciones estaban más flojas de lo normal, sin hematoquezia
o melena. Al día siguiente, 2 días después de la presentación, fue atendido por
su médico de atención primaria en un consultorio externo de este hospital.
Informó de un aumento del dolor abdominal, dolor en la rodilla derecha y en
ambos hombros, y fatiga que había durado al menos 1 semana. En el examen, la
temperatura fue de 37.2 ° C, la presión arterial de 131/89 mm Hg, el pulso de
89 latidos por minuto, la altura de 177.8 cm, el peso de 80.3 kg y el IMC de
25.4. El abdomen era normal y la rodilla derecha estaba sensible a la
palpación, con un derrame leve y sin eritema; El resto del examen era normal.
Las heces obtenidas durante un examen rectal fueron negativas para sangre
oculta. El paciente programó una visita de seguimiento y regresó a casa.
Esa noche, el paciente acudió al servicio de
urgencias de este hospital debido a un dolor abdominal difuso que empeoraba al
comer y se irradiaba hacia el lado izquierdo del tórax, el cuello, el hombro y
la espalda. El dolor que inicialmente era intermitente se había vuelto
constante, y había tenido estreñimiento durante 2 días. En el examen, la
presión arterial era 187/90 mm Hg; Otros signos vitales, la saturación de
oxígeno y el resto del examen fueron normales. El nivel en sangre de ácido
láctico y los resultados de las pruebas de coagulación fueron normales, y las
pruebas de anticuerpos contra H. pylori en la sangre y la sangre en las heces
fueron negativas; otros resultados de la prueba se muestran en la Tabla 1. El
análisis de orina reveló trazas de cetonas y, por lo demás, era normal. La
ecografía abdominal fue normal. Se administraron oxicodona y ondansetrón. Se
aconsejó al paciente que evitara el acetaminofén y el alcohol, y se fue a casa
temprano en la mañana.
Más tarde esa mañana, el paciente regresó al
hospital para una visita ambulatoria y calificó el dolor en 4 de cada 10. Tuvo
ruidos intestinales hipoactivos y plenitud periumbilical, sin dolor epigástrico
en la palpación. El nivel en sangre de la proteína C reactiva fue normal, y las
pruebas de anticuerpos contra el virus de la hepatitis C, los anticuerpos
contra el virus de la inmunodeficiencia humana (VIH) y el antígeno del VIH
fueron negativos; otros resultados de la prueba se muestran en la Tabla 1. Al
día siguiente, el examen endoscópico superior reveló una hernia hiatal, un
anillo de Schatzki no obstructivo en la unión gastroesofágica y nodularidad en
el bulbo duodenal. Esa noche, el dolor abdominal aumentó notablemente.
Al día siguiente, 5 días después de la presentación
inicial del paciente, regresó a la clínica ambulatoria. Informó sobre dolor en
la parte inferior del abdomen (calificado en 8 de 10), estreñimiento que duró 4
días, náuseas con aliento seco, dificultad para respirar e insomnio debido al
dolor. En el examen, estaba lloroso y se retorcía de incomodidad. La
temperatura era de 37,5 ° C, la presión arterial de 129/80 mm Hg, el pulso de
103 latidos por minuto y la saturación de oxígeno al 100% mientras respiraba
aire ambiente. Los sonidos intestinales eran hipoactivos, y había dolor difuso
en ambos cuadrantes inferiores. El resto del examen se mantuvo sin cambios.
El paciente fue trasladado al servicio de urgencias
de este hospital en silla de ruedas. En el examen, parecía ansioso e incómodo.
El abdomen era blando y no distendido, y le incomodaba la palpación en los
cuadrantes inferiores. Los niveles en sangre de calcio, proteína total,
albúmina, amilasa, lipasa y ácido láctico fueron normales, y el examen
toxicológico de rutina de la sangre fue negativo; otros resultados de la prueba
se muestran en la Tabla 1. La radiografía del abdomen reveló un colon dilatado,
con hallazgos que sugieren heces en el colon derecho y transverso a un punto de
transición en el colon descendente proximal. La tomografía computarizada (TC)
del abdomen y la pelvis, realizada después de la administración de material de
contraste, reveló una gran cantidad de heces en el ciego y sin evidencia de
obstrucción. Fue ingresado en este hospital.
Se recibió un resultado de prueba diagnóstica.
DIAGNÓSTICO DIFERENCIAL
Este hombre de 59 años presentó una enfermedad aguda
caracterizada por dolor epigástrico, que fue seguida por un dolor abdominal más
difuso que empeoraba con la alimentación. También tenía una constelación
inusual de síntomas que plantea la posibilidad de una única enfermedad
subyacente, y los trastornos que no explican muchas de las características de
este caso se pueden descartar fácilmente.
CAUSAS INTRAABDOMINALES DE DOLOR ABDOMINAL AGUDO
El dolor abdominal agudo tiene un diagnóstico
diferencial amplio que incluye causas intraabdominales y extraabdominales.1 Las
catástrofes intraabdominales potencialmente mortales, como la perforación
gastrointestinal, el infarto intestinal y la rotura de un aneurisma aórtico
abdominal, causan la enfermedad en minutos u horas y pueden descartarse este
caso por la duración del curso de la enfermedad y la falta de hallazgos
característicos de laboratorio e imagen. La isquemia mesentérica sin infarto
puede desarrollarse durante un período de días, y el dolor abdominal
desproporcionado al nivel de sensibilidad abdominal (como en este caso) puede
sugerir isquemia mesentérica sin infarto, particularmente cuando la causa es la
vena mesentérica o trombosis arterial y cuando las características del infarto
(p. ej., acidosis, un nivel elevado de lactato deshidrogenasa e
hiperamilasemia) están ausentes. En este caso, el diagnóstico de isquemia
mesentérica es difícil de conciliar con los hallazgos de una nueva anemia sin
evidencia clara de hemorragia gastrointestinal, la hiponatremia en ausencia de
infarto intestinal y la ausencia de factores de riesgo para isquemia
mesentérica. Un diagnóstico de colitis isquémica en ausencia de hematoquezia
sería inusual, y los hallazgos son inconsistentes con vólvulo o una hernia
encarcelada. La obstrucción colónica, tal vez debido a una neoplasia, ha sido
descartada por los hallazgos de la TC; además, los resultados de una
colonoscopia habían sido normales 3 años antes.
Las causas y los hallazgos de laboratorio en este
caso pueden descartar las causas comunes de dolor abdominal agudo (apendicitis,
diverticulitis, colecistitis, pancreatitis y cólico renal), así como la
enfermedad inflamatoria intestinal. Se
consideró una úlcera péptica sangrante, pero no se confirmó en un examen
endoscópico superior; Además, la caída en el hematocrito no fue acompañada por
sangrado gastrointestinal. También se sospechó gastroenteritis, pero no fue
consistente con el curso clínico de este paciente.
Los niveles elevados de aminotransferasas en la
sangre aumentan la posibilidad de hepatitis, pero el dolor intenso y las
características extraintestinales y de laboratorio asociadas no son típicas de
los virus de la hepatitis comunes2 o de una hepatitis inducida por fármacos.
Otras infecciones que pueden afectar al hígado y tener manifestaciones
extrahepáticas proteiformes, como la larva migratoria visceral 3, son
improbables debido a la ausencia de eosinofilia, neumonitis y otros rasgos
característicos. Este paciente podría tener las complicaciones del uso
prolongado de alcohol y las anomalías de laboratorio asociadas con la hepatitis
alcohólica, pero en ese caso, el nivel sanguíneo de aspartato aminotransferasa
sería más alto que el nivel sanguíneo de alanina aminotransferasa; también, a
la luz de la severidad de los síntomas, se esperaría evidencia de disfunción
hepática. La edad del paciente hace improbable la enfermedad de Wilson y otros
trastornos metabólicos, como la tirosinemia hereditaria. Además, los síntomas
son inconsistentes con la enfermedad del hígado graso no alcohólico y el
síndrome de Budd-Chiari. Los niveles elevados de aminotransferasa pueden ser un
componente no específico de un proceso sistémico.
CAUSAS EXTRAABDOMINALES DEL DOLOR ABDOMINAL AGUDO
La constelación de hallazgos en este paciente
sugiere que una causa extraabdominal de dolor abdominal agudo es la más
probable. La mayoría de las entidades de esta categoría se pueden descartar
fácilmente, porque el diagnóstico debiera poder explicar la seudoobstrucción
colónica, la anemia aguda sin hemorragia gastrointestinal aparente y la
hiponatremia aguda, que parece deberse al síndrome de secreción inadecuada de
hormona antidiurética ( SIADH).
La porfiria aguda se debe considerar en un paciente
con dolor abdominal agudo, generalmente recurrente, que no tiene una
explicación clara.4 Las características de este caso que son compatibles con un
diagnóstico de porfiria aguda incluyen dolor abdominal neuropático severo,
náuseas, estrés o inquietud , dolor en los brazos y piernas, estreñimiento,
seudoobstrucción colónica, taquicardia, hipertensión episódica y SIADH; sin
embargo, la orina oscura característica no estaba presente. Las porfirias
generalmente se heredan y son causadas por una deficiencia en la actividad de
una de las enzimas requeridas para la síntesis normal de hemo. Se clasifican
según la presentación clínica, en neurovisceral o cutánea y según la fuente principal de
sobreproducción de porfirinas y precursores de porfirina (típicamente, la
médula ósea o el hígado) (Tabla 2) .5
TABLA 2. Porfirias.
Los pacientes con una porfiria neurovisceral
aguda, más comúnmente una porfiria intermitente aguda, pueden presentar dolor
abdominal con cólicos, a menudo en la parte inferior del abdomen. Los pacientes
con coproporfiria hereditaria y aquellos con porfiria variegata pueden
presentar características neuroviscerales o cutáneas. La porfiria puede ser
provocada por la inanición, un balance energético negativo, el uso de drogas o
alcohol, fumar, infecciones y otras formas de estrés. Este paciente tiene 59
años de edad y un primer ataque de porfiria a esta edad sería inusual. El
alcohol podría haber precipitado un ataque, pero el pirbuterol no está incluido
en la lista de medicamentos de la American Porphyria Foundation que provocan
ataques de porfiria aguda o en otras listas similares.
CAUSAS DE DISGEUSIA Y PUNTEADO BASÓFILO
Este paciente podría haber tenido porfiria aguda,
pero dos hallazgos que deben explicarse por el diagnóstico son disgeusia y el punteado
basófilo, y estas no son características
conocidas de la porfiria. Las causas comunes de la disgeusia son agentes
quimioterapéuticos, como ciclofosfamida y cisplatino, y otros medicamentos,
como albuterol, antagonistas del receptor H1 de histamina, penicilamina,
metronidazol y boceprevir; también se asocia con afecciones causadas por la
exposición a pesticidas y otras toxinas, como la intoxicación por plomo, así
como la deficiencia de zinc y la xerostomía.6 La disgeusia es un efecto
secundario conocido del pirbuterol.
El punteado basófilo es un rasgo distintivo de la
anemia sideroblástica y del envenenamiento por plomo, aunque no es un rasgo
constante de este último7. También se observa en pacientes con envenenamiento
por arsénico, algunas talasemias, una deficiencia de la erimitrita pirimidina
5'-nucleotidasa o trombótica Púrpura trombocitopénica.
La disgeusia y el punteado basófilo fueron
características distintas y prominentes en este caso, aunque es posible que las
náuseas se hayan percibido como un sabor alterado. La intoxicación por arsénico
causa un olor ajos en la respiración en lugar de verdadera disgeusia, y se
asocia de manera característica con diarrea grave y síntomas cardiovasculares,
hallazgos que no se observaron en este caso.
ENVENENAMIENTO POR PLOMO
Creo que el diagnóstico más probable en este caso es
la intoxicación por plomo, que explica todas las características clínicas, de
laboratorio y de imágenes, incluido el dolor abdominal ("cólico saturnino"),
náuseas, disgeusia, estreñimiento, seudoobstrucción colónica, dolor en
articulaciones y músculos, cambios conductuales y cognitivos, anemia aguda,
punteado basófilo, SIADH y disminución del nivel sanguíneo de fósforo (que
puede deberse a la pérdida de fosfato renal). 8 Las líneas de plomo, o la
pigmentación azulada en la línea de la encía (ribete de Burton), y dientes causada por una reacción del plomo
con la placa dental, no son un indicador confiable de envenenamiento agudo por
plomo y estuvieron ausentes en este paciente.9 El depósito de plomo en los
huesos se puede observar en la exposición a largo plazo de plomo, 10 así como
también puede ser la hipertensión11 y los efectos neuropsiquiátricos.12 El
diagnóstico de envenenamiento por plomo se confirma al medir el nivel de plomo
en la sangre; un nivel de 10 μg por decilitro o más se considera elevado en
adultos.13 El nivel puede ser superior a 100 μg por decilitro en pacientes con
intoxicación aguda por plomo, que es mucho menos común que la intoxicación
crónica por plomo. La síntesis de hemo se altera cuando la deshidratasa del
ácido 5-aminolevulínico (ALA) está inhibida en un 80 a 90%; esto ocurre a un
nivel de plomo en la sangre de aproximadamente 55 μg por decilitro. 14 Debido a
la inhibición de la ALA deshidratasa y la sobreproducción de ALA, los pacientes
con envenenamiento por plomo o con tirosinemia hereditaria tipo 1 presentan de
forma clásica características similares a las de los pacientes con porfiria
aguda.15 De hecho, la plumboporfiria, una porfiria causada por una deficiencia
de ALA deshidratasa, se llama así por "plumbum" (latín significa
"plomo") porque los síntomas de la afección imitan a los de la
intoxicación por plomo, pero la plumboporfiria es rara y generalmente se ve en
niños.16 Un nivel elevado en orina o sangre de ALA A menudo es útil para
establecer un diagnóstico de envenenamiento por plomo, aunque se espera que los
pacientes con envenenamiento por plomo y los que tienen un ataque de porfiria
aguda presenten esta anomalía de laboratorio. Sin embargo, solo los pacientes
con porfiria aguda también tendrían un nivel elevado de porfobilinógeno. 15 La
protoporfirina libre de eritrocitos y la protoporfirina de zinc, que muestran
el efecto del plomo en la síntesis de hemoglobina, también pueden usarse como
indicadores de la exposición al plomo durante el período de 3 meses anterior.14
¿Cuál fue la fuente de envenenamiento por plomo en
este caso? La gran mayoría de los casos de envenenamiento por plomo en los
Estados Unidos se debe a exposiciones en el lugar de trabajo.17 Me pareció
curioso que se proporcionara poca información sobre la historia laboral del
paciente o la situación del hogar. Varias posibilidades podrían explicar la
exposición en este caso, y el siguiente paso después de hacer el diagnóstico de
envenenamiento por plomo sería realizar una investigación rigurosa del lugar de
trabajo y el hogar del paciente para determinar las posibles fuentes de exposición
continua al plomo.
DIAGNOSTICO CLINICO PRESUNTIVO
ENVENENAMIENTO POR PLOMO.
DISCUSION PATOLOGICA
La revisión del frotis de sangre periférica reveló
una anemia microcítica, con punteado basófilo basto, policromasia y
ocasionalmente glóbulos rojos nucleados (Figura 1). La policromasia y los
glóbulos rojos nucleados circulantes sugieren hemólisis, que se confirmó con un
recuento elevado de reticulocitos del 4,2% (corregido por el grado de anemia).
El punteado basófilo básico resulta de una degradación incompleta del ARN y de
una estructura ribosómica anormal y refleja una síntesis de hemoglobina
alterada o una incorporación de hierro alterada en el hemo18. El plomo inhibe
muchas de las enzimas activas en la vía biosintética del hemo, incluida la ALA
deshidratasa, el coproporfirinógeno oxidasa y la ferroquelatasa, conduciendo
así a la incorporación de zinc en lugar
de hierro en la protoporfirina IX (el precursor inmediato del hemo) y a la
acumulación de protoporfirina quelada con zinc en eritrocitos, como se refleja
en el nivel elevado de protoporfirina de zinc. 19 Además, el plomo inhibe la
eritrita pirimidina 5'-nucleotidasa; la forma hereditaria de esta deficiencia
enzimática da lugar a una anemia hemolítica crónica, que se caracteriza por un
punteado basófilo grosero 7,19.
La electroforesis de hemoglobina no mostró evidencia
de hemoglobinopatía estructural o rasgo de β-talasemia, descartando la
hemoglobinopatía como la causa de la microcitosis, el punteado basófilo y la
hemólisis. La prueba de hemocromatosis hereditaria se realizó debido a la
función hepática anormal del paciente y la elevada saturación de transferrina.
El paciente no tenía la mutación C282Y de HFE, la mutación más claramente
asociada con la hemocromatosis hereditaria, pero era heterocigoto para la
mutación H63D de HFE, la mutación menos penetrante.20-22 El nivel de plomo en
sangre estaba notablemente elevado, a 91 μg por decilitro (rango de referencia,
0 a 9), y el nivel de protoporfirina de zinc también se elevó, a 425 μmol por mol
de hemoglobina (rango de referencia, menos de 70); Juntos, estos valores
confirman el diagnóstico de envenenamiento por plomo.
MANEJO
Cuando se encontró que el nivel de plomo en la
sangre era muy elevado, entrevisté al paciente sobre posibles exposiciones al
plomo en casa o en el trabajo. Trabajó desde una oficina en el hogar, por lo
que nuestra atención se dirigió a las exposiciones en el hogar. El nivel de
plomo en la sangre de su compañero era de 6 μg por decilitro. Fue muy útil
entrevistar al paciente sobre los hábitos que él tenía que su compañero no
tenía; esto llevó al descubrimiento de que había usado una antigua cuchara de
cloisonte rusa para agitar su café cada mañana durante el año anterior y que
bebía su café de una taza de cristal italiana (Figura 2). Su compañero no bebió
de ese juego de tazas ni usó la cuchara. En este punto, se indicó realizar una evaluación ocupacional y ambiental
y que ayudara en el tratamiento de este paciente.
FIGURA 2
La taza y la cuchara.
El paciente bebía café de esta taza glaseada pintada
a mano todas las mañanas (Panel A) y agitaba su café con esta cuchara (Panel
B).
Tuvimos la oportunidad de ver al paciente para una
evaluación inicial y una consulta de seguimiento. Para evitar la exposición
continua al plomo, realizamos una larga investigación para determinar su
fuente. En muchos casos, una historia ocupacional completa descubre posibles
exposiciones. En este caso, el paciente era diseñador de interiores y declaró
que nunca estuvo en un edificio durante el proceso de renovación, lo que hace
que la exposición al plomo del polvo de la pintura sea improbable. Vivía en un
edificio de gran altura, no estaba renovando su propia casa y no hacía ningún
trabajo de arte y artesanía. No había usado ninguna medicina alternativa o
complementaria, como las medicinas ayurvédicas, algunas de las cuales se ha
encontrado que contienen altos niveles de plomo.23-25 Bebía vino con
frecuencia, pero dijo que bebía de copas de vino estándar, no tenía lentes que
contuvieran plomo. Cocinaba con especias
importadas, que dieron negativo para el plomo. Él y su compañero comían el
mismo alimento, pero el nivel de plomo en sangre de su compañero estaba dentro
del rango aceptable, y por lo tanto el alimento compartido era una fuente poco
probable. Aunque no hemos identificado definitivamente la fuente del plomo,
desconfiamos mucho de las tazas importadas pintadas a mano y de la pequeña
cucharadita antigua. El paciente realizó una prueba de estos artículos en un
laboratorio externo, e informó que el análisis de la cuchara reveló que tenía
un 50% de plomo y que una de las tazas se trituró y consistía en aproximadamente
un 1% de plomo. Según se informó, el esmalte estaba intacto en la jarra
restante (y había estado intacto en la jarra que había sido aplastada), lo que
hace dudoso que el plomo se esté escapando de la jarra. Continuó usando la taza
para su café. No estaba claro que la cuchara fuera la fuente, ya que solo la
utilizó brevemente para remover su café.
Debido a que el paciente tenía síntomas severos de
envenenamiento por plomo, administramos tratamiento de quelación con EDTA de
calcio disódico durante 4 días, seguido de tratamiento con ácido
2,3-dimercaptosuccínico (succimer) durante 14 días adicionales. Su dolor
abdominal, estreñimiento y cambios en el estado mental se resolvieron por
completo en los 2 días posteriores al inicio del tratamiento de quelación.
Después de que el paciente completó el tratamiento,
se resolvieron las anormalidades de la enzima hepática y la anemia. Sin
embargo, seguimos perplejos por un nivel de plomo en la sangre persistentemente
elevado; el nivel ha disminuido constantemente pero aún no se ha normalizado, y
no estamos seguros de por qué.
Hay varias explicaciones posibles de por qué el
nivel de plomo en la sangre del paciente no ha vuelto a la normalidad. Estos
incluyen grandes reservas óseas en equilibrio con el compartimento de la
sangre, una posible reexposición al plomo de una fuente no identificada, o la
presencia de un polimorfismo genético, como un polimorfismo en el alelo ALA
dehydratase (ALAD), que en algunos casos se ha asociado con Alteraciones en la
respuesta del cuerpo a la exposición al plomo.
DIAGNÓSTICO ANATÓMICO
ANEMIA MICROCÍTICA Y PUNTEADO BASÓFILO BASTO QUE SON
COMPATIBLES CON LA INTOXICACIÓN POR PLOMO.
TRADUCCIÓN DE:
Case 12-2014 — A
59-Year-Old Man with Fatigue, Abdominal Pain, Anemia, and Abnormal Liver Function
Lawrence S.
Friedman, M.D., Leigh H. Simmons, M.D., Rose H. Goldman, M.D., M.P.H., and
Aliyah R. Sohani, M.D.
REFERENCES
1Millham FH.
Acute abdominal pain. In: Feldman M, Friedman LS, Brandt LJ, eds. Seisenger and
Fordtran's gastrointestinal and liver disease:
pathophysiology/diagnosis/management. 9th ed. Philadelphia: Saunders Elsevier,
2010:151-62.
2Kamar N, Bendall RP, Peron JM, et al. Hepatitis E virus and neurologic disorders. Emerg
Infect Dis 2011;17:173-179
CrossRef | Web
of Science | Medline
3Won KY,
Kruszon-Moran D, Schantz PM, Jones JL. National seroprevalence and risk factors
for zoonotic Toxocara spp. infection. Am J Trop Med Hyg 2008;79:552-557
Web of Science |
Medline
4Puy H, Gouya L,
Deybach JC. Porphyrias. Lancet 2010;375:924-937
CrossRef |
Medline
5Bonkovsky HL,
Guo JT, Hou W, Li T, Narang T, Thapar M. Porphyrin and heme metabolism and the
porphyrias. Compr Physiol 2013;3:365-401
6Schiffman SS.
Taste and smell in disease. N Engl J Med 1983;308:1275-1279
Full Text | Web
of Science | Medline
7Valentine WN,
Paglia DE, Fink K, Madokoro G. Lead poisoning: association with hemolytic
anemia, basophilic stippling, erythrocyte pyrimidine 5'-nucleotidase
deficiency, and intraerythrocytic accumulation of pyrimidines. J Clin Invest
1976;58:926-932
CrossRef | Web
of Science | Medline
8Flora G, Gupta
D, Tiwari A. Toxicity of lead: a review with recent updates. Interdiscip
Toxicol 2012;5:47-58
CrossRef
9Goldman RH, Hu
H. Adult lead poisoning. Waltham, MA: UpToDate, 2013.
10Patrick L.
Lead toxicity, a review of the literature. Part 1: exposure, evaluation, and
treatment. Altern Med Rev 2006;11:2-22
Web of Science |
Medline
11Martin D,
Glass TA, Bandeen-Roche K, Todd AC, Shi W, Schwartz BS. Association of blood
lead and tibia lead with blood pressure and hypertension in a community sample
of older adults. Am J Epidemiol 2006;163:467-478
CrossRef | Web
of Science | Medline
12Khalil N,
Morrow LA, Needleman H, Talbott EO, Wilson JW, Cauley JA. Association of
cumulative lead and neurocognitive function in an occupational cohort.
Neuropsychology 2009;23:10-19
CrossRef | Web
of Science | Medline
13Adult blood
lead epidemiology and surveillance -- United States, 2008-2009. MMWR Morb
Mortal Wkly Rep 2011;60:841-845
Medline
14Ahamed M,
Verma S, Kumar A, Siddiqui MK. Environmental exposure to lead and its
correlation with biochemical indices in children. Sci Total Environ
2005;346:48-55
CrossRef | Web
of Science | Medline
15Anderson KE,
Bloomer JR, Bonkovsky HL, et al. Recommendations for the diagnosis and
treatment of the acute porphyrias. Ann Intern Med 2005;142:439-450[Erratum, Ann
Intern Med 2005;143:316.]
CrossRef | Web
of Science | Medline
16Sassa S. ALAD
porphyria. Semin Liver Dis 1998;18:95-101
CrossRef | Web
of Science | Medline
17Fischbein A,
Hu H. Occupational and environmental exposure to lead. In: Rom WM, Markowitz
SB, eds. Environmental and occupational medicine. Philadelphia: Lippincott
Williams & Wilkins, 2007:954-90.
18Glassy EF, ed.
Color atlas of hematology: an illustrated field guide based on proficiency
testing. Northfield, IL: College of American Pathologists, 1998.
19Fuller SJ,
Wiley JS. Heme biosynthesis and its disorders. In: Hoffman R, Benz EJ,
Silberstein LE, Heslop HE, Weitz JI, Anastasi J, eds. Hematology: basic
principles and practice. 6th ed. Philadelphia: Elsevier, 2013:457-72.
20Adams PC,
Reboussin DM, Barton JC, et al. Hemochromatosis and iron-overload screening in
a racially diverse population. N Engl J Med 2005;352:1769-1778
Free Full Text |
Web of Science | Medline
21Lyon E, Frank
EL. Hereditary hemochromatosis since discovery of the HFE gene. Clin Chem
2001;47:1147-1156
Web of Science |
Medline
22Olynyk JK,
Cullen DJ, Aquilia S, Rossi E, Summerville L, Powell LW. A population-based
study of the clinical expression of the hemochromatosis gene. N Engl J Med
1999;341:718-724
Free Full Text |
Web of Science | Medline
23Lead poisoning
in pregnant women who used Ayurvedic medications from India -- New York City,
2011-2012. MMWR Morb Mortal Wkly Rep 2012;61:641-646
Medline
24Lead poisoning
associated with Ayurvedic medications -- five states, 2000-2003. MMWR Morb
Mortal Wkly Rep 2004;53:582-584
Medline
25Saper RB,
Phillips RS, Sehgal A, et al. Lead, mercury, and arsenic in US- and
Indian-manufactured Ayurvedic medicines sold via the Internet. JAMA
2008;300:915-923[Erratum, JAMA 2008;300:1652.]
CrossRef | Web
of Science | Medline