|
| Hospital Municipal de Azul "Dr. Ángel Pintos" |
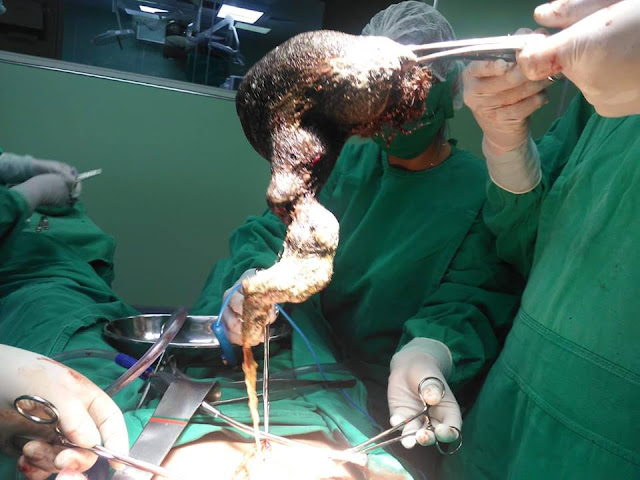
Se trata de un paciente que sufrió un accidente
mientras nadaba. Cayó en un desnivel leve, pero con mucho caudal, de un arroyo
de la zona. Sufrió algunos traumatismos menores y una lesión erosiva en la piel
de la rodilla. A los pocos días debuta con calor, eritema, tumefacción
progresiva y fiebre. Al examen, se palpaba la bursa pre rotuliana muy
distendida, con contenido líquido en el interior por lo que se punzó y se
obtuvo material purulento.
 |
| Bursitis prerrotuliana |
 |
| Aspecto purulento del líquido obtenido por punción |
DIAGNÓSTICO. BURSITIS SÉPTICA PRERROTULIANA.
No se rescató
ningún germen pero hay que tener en cuenta que los cultivos se obtuvieron 2
días después de comenzada la antibiooticoterapia EV.
Presentó
Dr. Gustavo Rabazzano
Médico Especialista en Reumatología
Hospital Municipal de Azul
BURSITIS SÉPTICA
La bursitis
es una inflamación o degeneración de las estructuras en forma de saco que
protegen los tejidos blandos de las prominencias óseas subyacentes [ 1 ]. La
bursitis séptica se refiere a la inflamación de la bolsa que se debe a una
infección, que suele resultar de una inoculación bacteriana directa (p. Ej.,herida
punzante), diseminada desde tejidos blandos cercanos (p. Ej., celulitis) o
hematógena (p. Ej., endocarditis bacteriana).
La bursitis no séptica debida a traumatismos
repetitivos, enfermedades por cristales y otros trastornos sistémicos no serán
tratatados aquí.
ETIOLOGÍA Y PATOGENIA
Hay más de 150 bolsas sinoviales en el cuerpo
humano. Las bolsas se pueden dividir por ubicación en aquellas que son
superficiales o profundas. Las bolsas superficiales son subcutáneas y separan
la piel de los tejidos más profundos, como el periostio o los ligamentos. Las
bolsas profundas sirven para reducir la fricción entre estructuras fibrosas,
como los tendones, del hueso adyacente. Las bolsas están recubiertas por
células sinoviales, que en circunstancias normales producen una pequeña
cantidad de líquido lubricante.
Los factores que aumentan el riesgo de bursitis
séptica incluyen la pérdida de integridad de la piel, la respuesta deficiente a
la infección (p. Ej., diabetes mellitus, abuso de alcohol) y factores del
huésped que conducen a una mayor cantidad de líquido o tejido bursal (como la
artritis reumatoide o la gota tofácea crónica). Un estudio de la bursitis séptica
del olecranon, encontró que un tercio de
los pacientes tenía al menos una enfermedad comórbida. No está claro si los
estados de inmunocompromiso como el VIH / SIDA aumentan el riesgo de bursitis
séptica.
BOLSAS SUPERFICIALES
Las bolsas superficiales o subcutáneas están
predispuestos a la infección como resultado de trauma de la piel; una serie
retrospectiva que incluyó 44 pacientes con bursitis séptica notó un traumatismo
anterior en el 36 por ciento de los casos. Los mecanismos más comunes involucrados
en la bursitis superficial séptica consisten en la inoculación directa debido a
la punción de la piel suprayacente o la diseminación contigua de una celulitis.
La mayoría de los casos notificados han sido en hombres. El traumatismo en la
piel y la bolsa puede ser ocupacional, debido a actividades recreativas o relacionados
con enfermedades concomitantes. Entre estos destacan los siguientes:
Bursitis séptica del olécranon: debido a traumas
repetitivos en fontaneros, carpinteros, mineros, soldados de combate, atletas,
pacientes con enfermedad pulmonar obstructiva crónica (posiblemente como
resultado de apoyarse en los codos) y pacientes que reciben hemodiálisis
crónica mediante acceso vascular en el brazo.
Bursitis séptica pre-patelar o infrapatelar: en
atletas y personas con ocupaciones arrodilladas como criadas, capas de
alfombras, clérigos y jardineros.
Bursitis séptica isquioglútea: en tejedores y
pacientes con lesión de la médula espinal.
Juanetes: se puede formar una bursa sobre la cara
interna de la primera articulación metatarsofalángica en pacientes con hallux
valgus donde la presión debida a los zapatos mal ajustados puede causar la
ruptura de la piel con infección bursal.
La infección iatrogénica de la bolsa del olécranon
se informó en 3 (12 por ciento) de 25
pacientes que recibieron inyección de triamcinolona intrabursal para tratar la
bursitis traumática del olécranon. Se ha observado una asociación entre la
bursitis séptica y el tratamiento con inhibidores de la proteasa de la
hepatitis C.
BOLSAS PROFUNDAS
La inoculación directa de la bursa profunda es poco
frecuente, pero en raras ocasiones se puede producir una infección iatrogénica
resultante de inyecciones de glucocorticoides (por ejemplo, subacromial,
iliopsoas o bursas trocánteras) [ 18 ]. Un historial de aspiración e inyección
conjunta reciente debe alertar al médico sobre una posible bursitis séptica
profunda. En ausencia de una inoculación conocida, se presume que la infección
de las bolsas profundas se debe a la siembra hematógena o la diseminación desde
un sitio séptico adyacente, como la artritis séptica contigua [ 10,14 ].
PRESENTACIÓN CLÍNICA
Los pacientes
con bursitis séptica suelen presentar dolor y eritema y calor peribursal, a
menudo en el contexto de diabetes, alcoholismo o inmunosupresión. La fiebre
está presente en 40 a 44 por ciento de los pacientes con bursitis séptica [
3,19 ]. El calor peribursal, el eritema, el edema y la sensibilidad al tacto
sugieren un diagnóstico de sepsis bursal [ 3,19,20 ]. La presencia de una
herida punzante o abrasión de la piel que recubre la bolsa involucrada sugiere
un trauma antecedente. Es más probable que los pacientes con bursitis séptica
aguda se presenten antes y tengan más dolor, eritema, calor y sensibilidad que
los pacientes con bursitis no infecciosa [ 11]]. La distinción de bursitis no
infecciosa puede ser más difícil en infecciones subagudas o crónicas.
Las características que distinguen la bursitis
séptica de la aséptica incluyen sensibilidad (88 por ciento bursitis séptica
versus 36 por ciento bursitis aséptica), eritema / celulitis (83 por ciento
bursitis séptica versus 27 por ciento bursitis aséptica), calidez (84 por
ciento bursitis séptica versus 56 por ciento bursitis aséptica), informe de
Trauma o evidencia de una lesión en la piel (50 por ciento de bursitis séptica
versus 25 por ciento de bursitis aséptica) y fiebre (38 por ciento de bursitis
séptica versus 0 por ciento de bursitis aséptica) [ 21 ].
Una bursa infectada suele ser sensible al tacto, y
hay una alta frecuencia de inflamación de los tejidos blandos peribursales y de
lesiones cutáneas subyacentes. Sin embargo, los recuentos de glóbulos blancos
sinoviales periféricos y bursales pueden no ser elevados y no difieren
significativamente entre los pacientes con bursitis séptica y aséptica [ 20 ].
Por lo tanto, estos valores de laboratorio no pueden utilizarse para distinguir
entre estas condiciones; La tinción de Gram y el cultivo del líquido sinovial bursal
deben realizarse si se sospecha bursitis séptica.
Los sitios comunes para la bursitis séptica son el
olécranon, el prepatelo y la bursa infrapatelar localizados superficialmente.
Para estas bolsas superficiales, el movimiento de la articulación adyacente
puede ser relativamente conservado; en contraste, la artritis séptica se asocia
con una marcada limitación del movimiento articular.
Se pueden observar leucocitosis, neutrofilia y una
mayor proporción de neutrófilos inmaduros (es decir, bandemia) [ 10 ]. La
velocidad de sedimentación del eritrocito y la proteína C reactiva son
generalmente elevadas. La bacteriemia es relativamente rara y es más a menudo
una característica de la bursitis séptica profunda que de la superficial [ 14
]. En una serie de 71 pacientes hospitalizados con bursitis, los hemocultivos
fueron positivos en el 4 por ciento de los casos [ 22 ]. En otra serie que
incluyó 62 pacientes, los hemocultivos fueron positivos en el 19 por ciento de
los casos [ 10 ].
MICROBIOLOGÍA
Staphylococcus aureus es el organismo causante en el
80 por ciento o más de los casos de bursitis séptica probada en cultivo [
5,6,8,11,14,21-23 ]. Los estreptococos de varias especies son la siguiente
causa más comúnmente informada [ 2,6,22 ]. Los organismos menos frecuentes que
causan bursitis séptica aguda son los estafilococos coagulasa negativos,
Enterococcus , Escherichia coli , Pseudomonas aeruginosa y anaerobios [ 6,9,24
]. Las infecciones polimicrobianas constituyen una proporción significativa de
la bursitis no relacionada con S. aureus , especialmente cuando el trauma fue
el evento incitante, que osciló entre el 10 y el 36 por ciento de los casos [
6,9,22].
La bursitis subaguda o crónica puede deberse a
Brucella abortus , Mycobacterias (tanto Mycobacterium tuberculosis como
micobacterias atípicas, como Mycobacterium kansasii [ 25 ]), hongos como la
Candida , hongos dematiaceos [ 26 ], mohos y algas incluyendo Prototheca [
14,27]. -41 ]. La infección sistémica debe considerarse en casos de bursitis
causada por Brucella o M. tuberculosis en regiones endémicas [ 14 ].
DIAGNÓSTICO
El diagnóstico de bursitis séptica se sugiere por la
presentación clínica y se confirma por el cultivo de líquido de la bursa
afectada. Se justifica la aspiración de líquido para distinguir la bursitis
séptica de la bursitis aséptica. Los estudios de imagen pueden ser útiles en
algunas circunstancias, como se explica a continuación.
ASPIRACIÓN DE LA BURSA
Aspiración del líquido de la bursa se indica cada
vez que hay un derrame, y bursitis séptica se sospecha en el contexto del
dolor, inflamación local, o fiebre. El líquido bursal se puede obtener por
aspiración con aguja en la cabecera de la cama en la mayoría de los casos de
bursitis prepatellar superficial ( imagen 1 ) y olecranon ( imagen 2 ).
Figura 3. Aspiración de la bursa prepatelar.
El paciente se coloca en posición supina. Cloruro de
etilo se pulveriza sobre la piel. Se inserta una aguja de calibre 16 de 1 1/2
pulgada en la base de la bolsa; la aguja se pasa al centro del saco a una
profundidad de 1/4 a 3/8 de pulgada y se aspira el líquido.
Figura 4. Aspiración de la bursa olecraneana.
El paciente está en posición supina con el codo
flexionado a 90 grados y el antebrazo sobre el tórax. Se aplica cloruro de
etilo o un agente similar en la piel para anestesia. Una aguja de calibre 16 de
1,5 pulgadas (3,75 cm) se inserta distalmente en la base de la bolsa, casi
paralela al cúbito. Se inyectan por vía subcutánea 0,5 ml de lidocaína antes de
la aspiración del líquido bursal.
El análisis de laboratorio del líquido bursal
consiste en la determinación del recuento de células nucleadas (recuento de
células blancas), tinción de Gram, cultivo y evaluación de cristales.
RECUENTO DE CÉLULAS: en la bursitis séptica, el
recuento de glóbulos blancos de la bolsa a menudo no es muy elevado. Un estudio de 13
pacientes con bursitis comprobada por cultivo observó que 8 pacientes tenían un
recuento de leucocitos en el líquido bursal inferior a 20,000 / mm 3 [ 4 ]. Uno
de los recuentos de glóbulos rojos más bajos en el líquido bursal en un caso de
bursitis séptica comprobado por cultivo fue de 1200 / mm 3 [ 4 ]. En otro
estudio que incluyó 36 pacientes con bursitis del olecranon o bursitis
prepatellar, se observó un umbral para la leucocitosis bursal de mayor de 2000 / mm 3 que tenía una sensibilidad y especificidad
para bursitis séptica de 94 y 79 por ciento, respectivamente [ 11]. Un resumen
de la literatura sobre la bursitis del olécranon encontró un promedio de
leucocitos bursal de 62,923 / mm 3 (rango 900 a 392,500 / mm 3 ), que fue
significativamente elevado en comparación con el promedio de leucocitos bursales
en bursitis aséptica de 2215 / mm 3 (rango 50 a 11.700 / mm 3 ) [ 21 ]. Los
huéspedes inmunocomprometidos pueden tener una respuesta inflamatoria embotada.
TINCIÓN DE GRAM: la sensibilidad de la tinción de
Gram para la detección de microorganismos varía de 15 a 100 por ciento [ 3,4,14
]. Cuando se ve un organismo, puede ser útil para guiar la terapia con
antibióticos. Se observa una tinción de Gram positiva en el contexto de la
bursitis del olécranon en la mitad a dos tercios de los casos [ 6,21 ].
CULTIVO: el fluido Bursa debe cultivarse para
bacterias aeróbicas. Las tinciones y cultivos de hongos y / o micobacterias
pueden ser apropiados en pacientes seleccionados (por ejemplo, jardineros con
riesgo de esporotricosis, pescadores con riesgo de Mycobacterium marinum o
pacientes inmunodeprimidos con riesgo de infecciones atípicas) y / o cuando el
cultivo bacteriano normal es negativo. En un estudio retrospectivo de pacientes
con infecciones profundas de la extremidad superior, incluida la bursitis
séptica, aquellos con síntomas que duraron más de siete días tenían más
probabilidades de tener cultivos positivos de hongos y / o micobacterias [
43]]. La infección anaeróbica debe considerarse cuando los cultivos son
inicialmente negativos, pero los signos y síntomas infecciosos persisten [ 24
].
Identificación De Cristales: la microscopía
polarizada compensada realizada por un médico o técnico con experiencia está
autorizada para evaluar la presencia de cristales y, si está presente,
clasificarlos en función de su forma y birrefringencia. La técnica es la misma
que la empleada para identificar cristales en el líquido articular.
La glucosa del líquido bursal no se evalúa de forma
rutinaria en la práctica clínica; La utilidad diagnóstica es incierta. En un
informe que incluyó a 30 pacientes con olecranon o bursitis prepatellar (10 de
los cuales tenían bursitis séptica), la concentración media de glucosa en el
líquido bursal fue significativamente menor en la fosa séptica que en la bursal
no séptica [ 19 ]. Se observó una proporción de glucosa en suero bursal:
glucosa en suero de más de 50 por ciento
casi exclusivamente en casos de bursitis séptica. Sin embargo, la concentración
de glucosa en el líquido bursal también puede ser baja en la bursitis no
séptica que se presenta en pacientes con artritis reumatoide [ 44 ]. Por lo
tanto, la glucosa del líquido bursal generalmente no se evalúa en la práctica
clínica.
ESTUDIOS DE IMÁGENES: en general, los estudios de imágenes no son
útiles en el contexto de la bursitis superficial aguda (olecranon o
prepatellar). En el contexto de la sospecha de penetración de cuerpo extraño,
puede justificarse la obtención de imágenes con película plana, ecografía o TC.
En el contexto de la sospecha de bursitis séptica profunda, se puede justificar
la obtención de imágenes con TC o resonancia magnética para evaluar la
presencia de un derrame bursal, abscesos asociados o estructuras adyacentes
afectadas [ 14,42,45,46 ]. Se puede utilizar la ecografía o la TC para guiar la
aspiración con aguja de la bolsa.
ESTUDIOS ADICIONALES: en casos de sospecha de brucelosis, la
serología sérica puede ser útil para el diagnóstico.
Si es necesaria la resección bursal, el examen
histológico del tejido extirpado (además de los cultivos amplios de tejido
[especialmente si los cultivos anteriores son negativos] para bacterias,
micobacterias, anaerobios y hongos) puede ser útil. Por ejemplo, la inflamación
granulomatosa sugiere enfermedad micobacteriana.
DIAGNÓSTICO DIFERENCIAL
El diagnóstico diferencial de la bursitis séptica
incluye:
CELULITIS: la celulitis puede preceder o acompañar a
la bursitis séptica [ 47 ]. La distinción de la celulitis con y sin bursitis
depende de la palpación experta. Si se sospecha una afectación superficial de
la bolsa, puede justificarse una ecografía; Si se sospecha una afectación
profunda de la bolsa, se puede justificar la tomografía computarizada (TC) o la
resonancia magnética.
BURSITIS INDUCIDA POR CRISTALES: la inflamación
periarticular puede ocurrir en pacientes con gota tofácea (o, con menos
frecuencia, seudogota). Un historial de episodios previos de inflamación
asociada a los cristales y / o el hallazgo de cristales en el líquido bursal es
sugestivo. La gota o la seudogota pueden ocurrir concomitantemente con bursitis
séptica; En una serie retrospectiva de 44 casos de bursitis séptica, se
detectaron cristales en el líquido bursal de tres pacientes [ 8 ].
MONOARTRITIS AGUDA: el dolor y la marcada limitación
de la movilidad articular son características de la monoartritis aguda. Un
derrame en una sola articulación, si está presente, también es indicativo de
monoartritis aguda. Sin embargo, los pacientes con bursitis séptica prepatellar
o infrapatelar pueden tener un derrame concomitante de rodilla, en respuesta a
la infección bursal suprayacente, que generalmente produce líquido sinovial con
un recuento de glóbulos blancos relativamente bajo. Si existe alguna duda con
respecto a la presencia de artritis séptica simultánea, la articulación debe
aspirarse (preferiblemente a través de la piel clínicamente no afectada) [ 6 ].
El diagnóstico diferencial de la monoartritis aguda incluye artritis inducida
por cristales (gota o seudogota), artritis reactiva, espondiloartritis
periférica, artritis psoriásica y artritis reumatoide.
HEMOBURSA: el sangrado agudo en una bolsa puede
causar hinchazón tensa, dolor y sensibilidad con los signos de inflamación. El
intento de aspiración puede no producir sangre o fluidos significativos, ya que
la sangre coagulada no se puede extraer a través de una aguja de gran calibre.
OSTEOMIELITIS PATELAR: esta condición rara debe
considerarse en los entornos de bursitis que parece recaer [ 48 ]. Las imágenes
con radiografías simples y la RMN pueden ser útiles para hacer este
diagnóstico.
TRATAMIENTO
El
tratamiento de la bursitis séptica requiere con antibióticos y drenaje
del líquido bursal infectado. La selección inicial de antibióticos está guiada
por patógenos comunes (la mayoría de las veces por estafilococos y por
estreptococos) y por los resultados de la tinción de Gram. La aspiración diaria
con aguja suele ser suficiente para el drenaje de las bolsas situadas
superficialmente. El drenaje quirúrgico o por catéter puede ser necesario para
la bursitis séptica complicada en sitios superficiales y para la infección
profunda de la bolsa. No hay datos publicados que apoyen la inyección de
corticosteroides de una bolsa infectada.
Las indicaciones para la hospitalización y / o la
terapia con antibióticos por vía intravenosa (IV) para la bursitis séptica
incluyen la presencia de infección local fulminante, evidencia de toxicidad
sistémica o infección en un paciente inmunocomprometido.
La profilaxis contra el tétanos puede estar indicada
en casos de bursitis debidos a traumas propensos al tétanos.
TRATAMIENTO ANTIBIÓTICO INICIAL: más del 80 por ciento de los casos de
bursitis séptica son causados por S. aureus y otros organismos grampositivos;
sin embargo, la tinción de Gram es positiva solo en la mitad a dos tercios de
los casos [ 6,21 ]. Si la tinción de Gram no revela organismos, uno de los
siguientes enfoques puede ser apropiado según la gravedad de la inflamación y
los factores del huésped (la terapia empírica inicial se modifica según los
resultados de las pruebas de sensibilidad a los antibióticos y el cultivo, una
vez que estén disponibles):
INFLAMACIÓN LEVE: si la inflamación es leve y el
paciente no está inmunodeprimido ni es diabético y puede contactarse una vez
que los resultados del cultivo estén disponibles, entonces la dicloxacilina
(500 mg por vía oral cuatro veces al día) o la clindamicina oral (si es
alérgica a la penicilina) pueden ser las primeras terapia de línea.
La clindamicina , la doxiciclina o el
trimetoprim-sulfametoxazol oral son apropiados en regiones con altas tasas de
infección de tejidos blandos debido a S. aureus resistente a la meticilina
(SARM). Las tasas in vitro de susceptibilidad a la clindamicina son más altas
entre los SARM adquiridos en la comunidad que entre los SAMR adquiridos en la
atención médica, aunque existe una variación por región geográfica [ 49 ].
INFLAMACIÓN SEVERA: si existe una inflamación severa
o el paciente está inmunocomprometido, se justifica un tratamiento antibiótico
intravenoso. La vancomicina (15 a 20 mg / kg / dosis cada 8 a 12 horas, que no
exceda los 2 g por dosis) puede iniciarse empíricamente.
La administración de antibióticos intravenosos
generalmente requiere hospitalización, al menos inicialmente. Un estudio de 118
pacientes con bursitis séptica con olécranon demostró un tratamiento exitoso
con terapia intravenosa secuencial administrada a través de un programa de
terapia parenteral domiciliaria seguida de terapia oral y drenaje bursal en
casos seleccionados [ 5 ]. El régimen antibiótico más común fue la
administración intravenosa secuencial de cefazolina (durante una mediana de
cuatro días) seguida de clindamicina por vía oral (durante una mediana de ocho
días); 60 pacientes (51 por ciento) requirieron un procedimiento de drenaje, y
solo un paciente requirió ingreso hospitalario.
ALTO RIESGO DE SARM: los pacientes con factores de
riesgo de infección por SARM ( tabla 1 ) deben recibir un tratamiento empírico
con un agente antimicrobiano que tenga actividad contra el SARM.
Tabla. Factores de riesgo para infección por SARM
En una serie de 12 casos de artritis séptica
adquirida en la comunidad, 6 tenían SARM (50 por ciento), 4 tenían S. aureus
susceptible a meticilina (SAMS; 33 por ciento), y 1 tenía Streptococcus
pneumoniae , Enterococcus faecalis y Pseudomonas aeruginosa [ 50 ]. Estos datos
sugieren que debe esperarse una mayor prevalencia de SARM adquirido en la
comunidad en la bursitis séptica. Otra serie retrospectiva de 44 casos de
bursitis séptica incluyó 28 casos de MSSA (64 por ciento) y 7 casos (16 por
ciento) de MRSA [ 8 ].
HUÉSPED INMUNOSUPRIMIDO: los pacientes
inmunosuprimidos deben tratarse con una cobertura de amplio espectro que incluya
tanto cobertura anti-SARM como anti-pseudomonal mientras se esperan datos de
cultivo. Un paciente inmunodeprimido puede requerir un tratamiento con
antibióticos de mayor duración que un huésped sano [ 10,51 ].
DURACIÓN DE LA TERAPIA: la duración de la terapia con antibióticos
debe ser determinada por la respuesta clínica, los resultados del cultivo y la
salud general del huésped. Muchos casos son tratados durante dos o tres
semanas. Un estudio prospectivo que incluyó a 25 pacientes demostró que el
tiempo necesario para lograr la esterilidad con la terapia con antibióticos (un
promedio de cuatro días) se correlacionó con la duración de los síntomas antes
del diagnóstico (es decir, una mayor duración de los síntomas se asoció con una
respuesta tardía) [ 52 ]. Cuando se continuó la terapia con antibióticos
durante cinco días adicionales después de la esterilidad del cultivo
documentada, todos los pacientes en el ensayo se curaron (duración promedio de
seguimiento de seis meses).
En un estudio retrospectivo posterior que incluyó
343 episodios de bursitis infecciosa grave (237 olécranon y 106 patelar) que
requirieron atención hospitalaria y bursectomía, S. aureus fue el organismo
predominante entre los 256 casos con un patógeno identificable (85 por ciento)
[ 22]. La cirugía se realizó en 312 casos (91 por ciento); 142 pacientes se
sometieron a una bursectomía de una etapa con cierre inmediato, y 146 pacientes
se sometieron a una bursectomía de dos etapas, con un retraso del cierre hasta
después de dos a cuatro días de tratamiento con antibióticos. Todos recibieron
antibióticos durante una duración media de 13 días (la duración media de los
antibióticos intravenosos fue de tres días); La curación se logró en el 85 por
ciento de los casos. No hubo asociación entre la curación y la duración total
de la terapia con antibióticos. Por lo tanto, los autores concluyen que la
terapia con antibióticos adyuvantes puede limitarse a siete días en pacientes
no inmunodeprimidos, aunque los pacientes que no se someten a un drenaje
temprano pueden necesitar tratamientos más prolongados de antibióticos. En
pacientes con bursitis por SAMS, un ensayo de cloxacilina IV(durante
aproximadamente siete días) seguido de cloxacilina oral (durante
aproximadamente 12 días) demostró una resolución completa en el 96 por ciento [
53 ], lo que sugiere que los antibióticos orales además de un ciclo más corto
de IV pueden ser suficientes.
DRENAJE: la
experiencia clínica sugiere que tratar la bursitis séptica con antibióticos
solos es a menudo inadecuado. Por lo general, se puede lograr un drenaje
adecuado sin intervención quirúrgica.
Las bolsas superficiales a menudo se pueden drenar
con una aspiración diaria con aguja. Los pacientes que no responden a los
antibióticos intravenosos y la aspiración percutánea de la bursa pueden
requerir drenaje quirúrgico o bursectomía.
Las bolsas profundas son más difíciles de drenar
mediante la aspiración con aguja repetida. Para estos sitios, la cirugía o la
colocación de un catéter permanente guiado por imágenes son enfoques
alternativos [ 42,46 ].
Se deben realizar aspiraciones repetidas hasta que
el líquido bursal sea estéril o ya no se acumule. Un catéter permanente puede
retirarse una vez que la cantidad de drenaje ha disminuido significativamente y
solo una pequeña cantidad (por ejemplo, <5 a="" d="" drenaje.="" ml="" no="" o:p="" o="" observa="" se="">
INDICACIONES PARA LA CIRUGÍA: las indicaciones para la intervención quirúrgica
para la bursitis séptica aguda incluyen la incapacidad de drenar la bolsa
adecuadamente mediante la aspiración con aguja o la colocación de un catéter,
la presencia de un cuerpo extraño o una infección adyacente en la piel o partes
blandas que requiera desbridamiento [ 6,14,54 ]. La escisión quirúrgica de una
bolsa infectada también puede estar indicada en pacientes inmunocomprometidos o
en estado crítico [ 54 ].
Por lo general, la bursectomía se realiza como un
procedimiento de una etapa con cierre inmediato cuando la herida está muy
limpia. De lo contrario, se puede realizar una bursectomía en dos etapas,
retrasando el cierre hasta después de dos a cuatro días de tratamiento con
antibióticos [ 22 ]. En un ensayo que incluyó a 164 pacientes con bursitis
séptica (130 con bursitis de olécranon y 34 con bursitis prepatellar)
aleatorizados para recibir una bursectomía de una o dos etapas (junto con una
semana de terapia con antibióticos), el fracaso del tratamiento ocurrió con
menos frecuencia entre los pacientes bursectomía en una etapa que bursectomía
en dos etapas (10 contra 16 por ciento); las tasas de infección recurrente
fueron similares (3 a 4 por ciento) [ 55 ].
Un estudio retrospectivo de pacientes adultos con
343 casos de olecranon infeccioso y bursitis patelar que se sometieron a
drenaje temprano observó que la duración de la terapia con antibióticos podría
acortarse; los pacientes que no se someten a un drenaje temprano pueden
necesitar antibióticos más prolongados [ 22 ].
El desbridamiento abierto puede complicarse por la
necrosis de la piel y la rotura de la herida, además de la sensibilidad de la
cicatriz y una recuperación prolongada [ 56 ]. En una serie de ocho pacientes
que se sometieron a una bursectomía endoscópica para el tratamiento de la
bursitis prepatellar séptica, no se observaron recidivas, informes de
sensibilidad o hipoestesia alrededor de la herida, complicaciones de la herida
o necrosis de la piel [ 57 ]. Una revisión de 29 estudios publicados que
incluyó 1278 pacientes con bursitis de olécranon sugirió que, en comparación
con la bursectomía abierta o endoscópica, el tratamiento no quirúrgico podría
producir tasas significativamente más altas de resolución clínica y menos
complicaciones generales, como el drenaje persistente y la infección de bursal
[ 23 ].
INFECCIÓN RECURRENTE: si la bursitis séptica se repite después de
la interrupción del tratamiento con antibióticos, generalmente se intenta otro
ciclo más prolongado de antibióticos antes de recurrir a la cirugía. Si no se
trata adecuadamente, la bursitis séptica puede provocar una infección crónica
de la bolsa; Las posibles complicaciones incluyen osteomielitis o formación de
fístulas cutáneas. Después de la primera recaída, si hay una recurrencia
subsiguiente de la infección o la persistencia de una sinovial bursal gruesa,
se debe considerar la escisión total de la bolsa durante una fase quiescente de
la enfermedad [ 6 ]. En una serie, la inmunosupresión aumentó
significativamente el riesgo de infección recurrente [ 22 ].
PREVENCIÓN DE LA RECURRENCIA: los pacientes cuyas ocupaciones o actividades de
ocio los ponen en mayor riesgo de bursitis superficial recurrente pueden
beneficiarse del uso de almohadillas de rodillas (durante actividades que
predisponen a la bursitis prepatellar o infrapatelar) o las almohadillas de
codo.
Fuente UpToDate
Referencias
1 Sheon RP,
Moskowitz RW, Goldberg VM. Dolor reumático de tejidos blandos:
reconocimiento, manejo, prevención, 3ª ed., Williams & Wilkins, Baltimore
1996.
2 Valeriano-Marcet J, Carter JD, Vasey FB.
Enfermedad de los tejidos blandos. Rheum Dis Clin North Am 2003; 29:77.
3 Ho G Jr, Tice
AD, Kaplan SR. Bursitis séptica en las bolsas
prepatellar y de olécranon: un análisis de 25 casos. Ann Intern Med 1978;
89:21.
4 Canoso JJ, Yood RA. Reacción de las bolsas
superficiales en respuesta a estímulos específicos de la enfermedad. Arthritis
Rheum 1979; 22: 1361.
5 Laupland KB, Davies HD, Grupo de estudio del
programa de terapia parenteral en el hogar de Calgary. Bursitis séptica del
olécranon en ambulatorio. El grupo de estudio del programa de terapia
parenteral domiciliaria de Calgary. Clin Invest Med 2001; 24: 171.
6 Zimmermann B
3rd, DJ Mikolich, Ho G Jr. Bursitis séptica. Semin Arthritis Rheum 1995; 24:
391.
7 Söderquist B, Hedström SA. Factores
predisponentes, bacteriología y antibioterapia en 35 casos de bursitis séptica.
Scand J Infect Dis 1986; 18:
305.
8 Lieber SB,
Fowler ML, Zhu C, et al. Características clínicas y resultados de
la bursitis séptica. Infección 2017; 45: 781.
9 Cea-Pereiro JC, Garcia-Meijide J, Mera-Varela A,
Gomez-Reino JJ. Una comparación entre la bursitis séptica causada por Staphylococcus
aureus y las causadas por otros organismos. Clin Rheumatol 2001; 20:10.
10 García-Porrúa C, González-Gay MA, Ibañez D,
García-País MJ. El espectro clínico de la bursitis séptica severa en el
noroeste de España: un estudio de 10 años. J Rheumatol 1999; 26: 663.
11 Stell IM, Gransden WR. Pruebas simples para
bursitis séptica: estudio comparativo. BMJ 1998; 316: 1877.
12 Enzenauer RJ, Pluss JL. Bursitis del olécranon
séptico en pacientes con enfermedad pulmonar obstructiva crónica. Am J Med
1996; 100: 479.
13 Rubayi S, Montgomerie JZ. Bursitis isquial
séptica en pacientes con lesión medular. Paraplejia 1992; 30: 200.
14 Pequeño LN, Ross JJ. Tenosinovitis supurativa y
bursitis séptica. Infect Dis
Clin North Am 2005; 19: 991.
15 Schermann H,
Karakis I, Dolkart O, et al. Bursitis del olécranon en una
población militar: epidemiología y evidencia de morbilidad prolongada en
reclutas de combate. Mil Med 2017; 182: e1976.
16 Weinstein PS, Canoso JJ, Wohlgethan JR.
Seguimiento a largo plazo de la inyección de corticosteroides para la bursitis
traumática del olécranon. Ann
Rheum Dis 1984; 43:44.
17 Burke CC,
Martel-Laferriere V, Dieterich DT. Bursitis séptica, una
posible complicación del uso de inhibidores de proteasa en el virus de la
hepatitis C. Clin Infect Dis 2013; 56: 1507.
18 Drezner JA, Sennett BJ. Bursitis séptica
subacromial / subdeltoidea asociada con terapia con isotretinoína e inyección
de corticosteroides. J
Am Board Fam Pract 2004; 17: 299.
19 Ho G Jr, Tice
AD. Comparación
de bursitis no séptica y séptica. Otras observaciones sobre el tratamiento de
la bursitis séptica. Arch Intern Med 1979; 139: 1269.
20 Smith DL, McAfee JH, Lucas LM, et al. Bursitis
del olécranon séptico y no séptico. Utilidad de la sonda de temperatura
superficial en la diferenciación temprana de casos sépticos y no sépticos. Arch Intern Med 1989; 149: 1581.
21 Reilly D,
bursitis Kamineni S. Olecranon. J Shoulder Elbow Surg 2016; 25: 158.
22 Pérez C, Huttner A, Assal M, et al. Olecranon
infeccioso y bursitis patelar: el tratamiento antibiótico adyuvante de corta
duración no es un factor de riesgo para la recurrencia en pacientes
hospitalizados adultos. J Antimicrob Chemother 2010; 65: 1008.
23 Sayegh ET, Strauch RJ. Tratamiento de la bursitis
del olécranon: una revisión sistemática. Arch Orthop Trauma Surg 2014; 134: 1517.
24 Fischer PA,
Kopp A, Massarotti EM. Bursitis séptica anaeróbica: reporte de
un caso y revisión. Clin Infect
Dis 1996; 22: 879.
25 Mathew SD,
Tully CC, Borra H, et al. Bursitis subacromial séptica
causada por Mycobacterium kansasii en un huésped inmunocomprometido. Mil Med
2012; 177: 617.
26 Gertner E. Bursitis séptica crónica causada por
hongos dematiaceos. Am J Orthop (Belle Mead NJ) 2007; 36: E10.
27 Ramírez I, Nieto-Ríos JF, Ocampo-Kohn C, et al. Bursitis
prototecal después de un trasplante simultáneo de riñón / hígado: reporte de un
caso y revisión. Transpl Infect Dis 2016; 18: 266.
28 Ramos-Pascua LR, Carro-Fernández JA,
Santos-Sánchez JA, et al. Bursectomy,
Curettage, and Chemotherapy in Tuberculous Trochanteric Bursitis. Clin
Orthop Surg 2016; 8:106.
29 Davis JM, Broughton SJ. Bursitis pre-patelar
causada por Brucella abortus. Med J Aust 1996; 165: 460.
30 Un informe de un caso es la bursitis de Guiral J,
Reverte D, Carrero P. Iliopsoas debido a una infección por Brucella melitensis.
Acta Orthop Scand 1999; 70:
523.
31 McDermott M,
O'Connell B, Mulvihill TE, Sweeney EC. Infección crónica por
Brucella de la bolsa supra-patelar con formación de seno. J Clin Pathol 1994;
47: 764.
32 Friedman ND, Sexton DJ. Bursitis debida a
Mycobacterium goodii, una micobacteria de rápido crecimiento recientemente
descrita. J Clin Microbiol 2001; 39: 404.
33 Crespo M, Pigrau C, Flores X, et al. Bursitis
trocantérica tuberculosa: reporte de 5 casos y revisión de la literatura. Scand
J Infect Dis 2004; 36: 552.
34 Ornvold K, Paepke J. Aspergillus terreus como
causa de la bursitis séptica del olécranon. Am J Clin Pathol 1992; 97: 114.
35 Wall BA,
Grape Leaf ME, Darnall JT, Must H. Candida tropicalis artritis y bursitis. JAMA
1982; 248: 1098a
36 Torres HA,
Bodey GP, Tarrand JJ, Kontoyiannis DP. Prototecosis en
pacientes con cáncer: series de casos y revisión de la literatura. Clin
Microbiol Infect 2003; 9: 786.
37 Samuel S, Boopalan PR, Alexander M, et al. Tuberculosis
de y alrededor del tobillo. J Foot Ankle Surg 2011; 50: 466.
38 Al-Qattan MM, Al-Namla A, Al-Thunayan A, Al-Omawi
M. Tuberculosis de la mano. J Hand Surg Am 2011; 36: 1413.
39 Garrigues GE, Aldridge JM tercero, Toth AP, Stout
JE. Bursitis por olécranon micobacteriana no tuberculosa: informes de casos y
revisión de la literatura. J Shoulder Elbow Surg 2009; 18: e1.
40 Leth S, Jensen-Fangel S. Bursitis infrapatelar
con Mycobacterium malmoense relacionada con el síndrome inflamatorio de
reconstitución inmune en un paciente VIH positivo. BMJ Case Rep 2012; 2012.
41 Ahbel DE,
Alexander AH, Kleine ML, Lichtman DM. Bursitis del olécranon
prototecal. Reporte de un caso y revisión de la literatura. J Bone Joint Surg Am 1980; 62: 835.
42 Ginesty E,
Dromer C, Galy-Fourcade D, et al. Las bursopatías
iliopsoas. Una revisión de doce casos. Rev Rhum Engl Ed 1998; 65: 181.
43 Kazmers NH,
Fryhofer GW, Gittings D, et al. Infecciones profundas
agudas de la extremidad superior: la utilidad de obtener cultivos atípicos en
presencia de purulencia. J
Hand Surg Am 2017; 42: 663.e1.
44 Goldin DS,
Stangler DA, Canoso JJ. Rheumatoid subcutaneous bursitis. J
Rheumatol 1981; 8:974.
45 Beltran J. Imágenes por RM de infección de
tejidos blandos. Magn Reson
Imaging Clin N Am 1995; 3: 743.
46 Manueddu CA, Hoogewoud HM, Balague F, Waldeburger
M. Bursitis infecciosa iliopsoas. Un reporte de caso. Int Orthop 1991; 15: 135.
47 Coste N,
Perceau G, Léone J, et al. Complicaciones osteoarticulares de la erisipela. J
Am Acad Dermatol 2004; 50: 203.
48 Choi HR. Osteomielitis patelar que se presenta
como bursitis prepatellar. Rodilla 2007; 14: 333.
49 Liu C, Bayer A, Cosgrove SE, et al. Guías de
práctica clínica de la Sociedad de Enfermedades Infecciosas de América para el
tratamiento de infecciones por Staphylococcus aureus resistentes a la meticilina
en adultos y niños. Clin Infect Dis 2011; 52: e18.
50 Frazee BW, Fee C, Lambert L. ¿Qué tan común es el
SARM en la artritis séptica en adultos? Ann Emerg Med 2009; 54: 695.
51 Roschmann RA, Bell CL. Bursitis séptica en
pacientes inmunocomprometidos. Am J Med 1987; 83: 661.
52 Ho G Jr, Su EY. Tratamiento antibiótico de la
bursitis séptica. Su implicación en el tratamiento de la artritis séptica.
Arthritis Rheum 1981; 24: 905.
53 Martínez-Taboada VM, Cabeza R, Cacho PM, et al.
Tratamiento basado en la cloxacilina en la bursitis séptica grave: estudio
retrospectivo de 82 casos. Joint
Bone Spine 2009; 76: 665.
54 Baumbach SF,
Lobo CM, Badyine I, et al. Bursitis prepatellar y de
olécranon: revisión de la literatura y desarrollo de un algoritmo de
tratamiento. Arch Orthop Trauma Surg 2014; 134: 359.
55 Uçkay I, von Dach E, Pérez C, et al. Bursectomía
de una etapa contra 2 etapas para el olécranon séptico y la bursitis
pre-patelar: un ensayo prospectivo aleatorizado. Mayo Clin Proc 2017; 92: 1061.
56 Gendernalik JD, Sechriest VF 2do. Bursitis
séptica pre-patelar: reporte de un caso de necrosis de la piel asociada con
bursectomía abierta. Mil Med 2009; 174: 666.
57 Dillon JP, Freedman I, Tan JS, et al. Bursectomía
endoscópica para el tratamiento de la bursitis pre-patelar séptica: una serie
de casos. Arch Orthop Trauma Surg 2012; 132: 921.