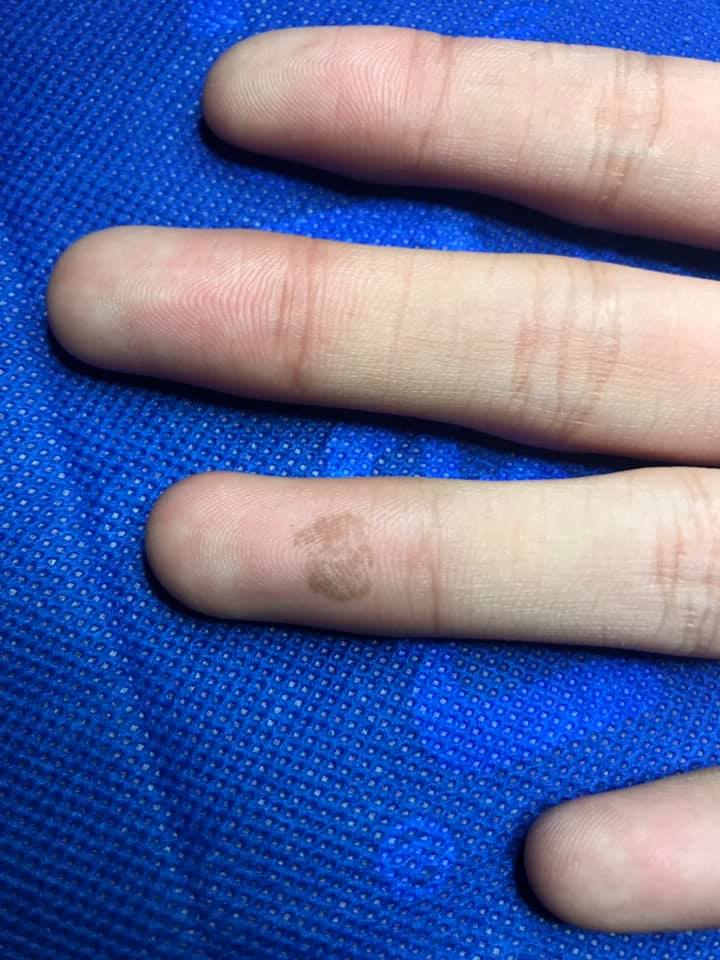
Paciente masculino de 17 años, con esta placa de 8 meses
de evolución, asintomático.
El diagnóstico es de tiña negra, se comprobó por examen
directo (ED) y respuesta al manejo.
Presentó
Dr. Roberto Miranda
Dermatólogo.
Docente de Postgrado de Medicina Familiar y Medicina Interna.
Hospital General Regional 6 del IMSS Tampico
Tamaulipas Mexico.
TIÑA NEGRA (Tinea nigra)
INTRODUCCIÓN
La tiña negra es una micosis superficial causada por
el hongo demaciaceo similar a una levadura Hortaea werneckii . La infección con
mayor frecuencia se presenta como una mácula o placa hiperpigmentada
asintomática en la palma ( imagen 3,4 y 5 ).
Figura 4: Parche hiperpigmentado en la palma.
Figura 5: Mácula
irregular, hiperpigmentada en la palma.
Con menos frecuencia, la tiña negra se presenta en
las plantas de los pies o en otros lugares (imagen 6,7 y 8). El curso de la
tinea nigra tiende a ser crónico; sin embargo, la infección se resuelve
rápidamente con el tratamiento adecuado.
Figura 6. Parche hiperpigmentado en la planta del
pie.
Figura 8. Parche hiperpigmentado en el dedo.
MICROBIOLOGÍA
La tiña negra se clasifica como una feohifomicosis
superficial, un grupo de infecciones fúngicas causadas por hongos dematiaceos
(pigmentados). El principal agente etiológico es H. werneckii , un hongo
previamente clasificado en los géneros Phaeoannellomyces y Exophiala (1,2) . H. werneckii es un hongo
pleoanamórfico que crece como una levadura negra y puede transformarse en un
moho.
H. werneckii es halotolerante y halofílico
(sobrevive y prospera en altas concentraciones de sal), osmotolerante y crece
en medios acuosos. El hongo se adapta fácilmente a condiciones de
hipersalinidad que varían de 3 a 30 por ciento de cloruro de sodio (1-6). H.
werneckii se ha aislado en varios entornos, incluidas las zonas costeras
(playas y arena), las plantas de manglar ( Aegiceras corniculatum ), las
plantas de desalinización y los charcos desecados [ 3,7-9 ].
Otros hongos que causan la tiña negra son
Cladosporium castellanii (también conocida como Stenella araguata ) (10,11), Phoma
hibernica (12) y Cladophialophora saturnica (spp nova) (13).
EPIDEMIOLOGÍA Y FACTORES DE RIESGO
La tiña negra es una condición poco común para la
cual los datos epidemiológicos son limitados. Se estima que la tiña negra representa
menos del 1 por ciento de las infecciones fúngicas superficiales. La tiña negra
puede aparecer a cualquier edad, pero con mayor frecuencia ocurre en niños y
adultos jóvenes. No parece haber una predilección sexual.
La tiña negra es más común en individuos que visitan
o residen en climas tropicales y subtropicales (1). La mayoría de las
infecciones notificadas se han producido en América Central y del Sur (México,
Panamá, Brasil, Colombia y Venezuela), Asia (Japón, India, Sri Lanka y
Birmania), Polinesia y las costas de África (2,14-18) . La tiña negra se
diagnostica raramente en Europa; Las infecciones notificadas generalmente se
adquieren fuera de Europa (19,20). En los Estados Unidos, se han producido
infecciones tanto nativas como no nativas. Florida, Carolina del Norte y
Carolina del Sur parecen ser los estados más comunes para las infecciones
nativas (21-23). Es probable que la mayoría de los pacientes se infecten en
ambientes acuosos (por ejemplo, ríos, lagos y áreas marinas).
La hiperhidrosis palmar o plantar es un importante
factor predisponente para la tiña negra. En una serie, 9 de 22 pacientes (41
por ciento) con tiña negra tenían hiperhidrosis (2). La asociación se debe
probablemente a la alta concentración salina del sudor, que produce condiciones
similares al nicho natural del hongo (1,22).
PATOGENIA
La tinea nigra se desarrolla después del contacto
directo con el hongo en el ambiente. Los traumatismos menores en la piel pueden
contribuir a la infección, lo que contribuye a la palma como un lugar común.
Las infecciones plantares tienden a ocurrir en individuos que han caminado
descalzos en áreas húmedas o arenosas (por ejemplo, playas). El período de
incubación no está bien definido; en una serie de 22 pacientes, el tiempo
estimado para el desarrollo de las lesiones visibles fue de aproximadamente dos
a cuatro semanas desde la inoculación, según lo recordó el paciente (2). No se
cree que la infección ocurra a través de la transmisión de humano a humano.
En la piel, H. werneckii crece en forma de hifas y
esporas marrones. La profundidad de la infección se limita a la capa
cornificada de la epidermis, que se hipertrofia como resultado de la infección.
CARACTERÍSTICAS CLÍNICAS
La presentación más común es una mácula o parche
unilateral, hiperpigmentado, de forma irregular pero bien circunscrito, con una
escala fina en la palma de la mano ( Figuras 3,4 y 5) (1,2,14,15,18,19, 24). El color varía
típicamente de marrón claro a oscuro. El eritema suele estar ausente. La
afectación bilateral es rara y puede resultar de la autoinoculación (2,25).
Aunque aproximadamente el 80 por ciento de los
pacientes tienen afectación de la palma de la mano, la tiña negra se presenta
ocasionalmente en los dedos o en los espacios interdigitales (imágenes 6 y 7 )
(2,17,18). La infección en el dorso de la mano es infrecuente. La segunda
ubicación más común es el pie, particularmente en las plantas de los pies y,
con poca frecuencia, en los espacios interdigitales ( Figuras 4 y 5) ). En una
serie de 22 pacientes, 3 pacientes (14 por ciento) tenían afectación de la
planta del pie, y el resto tenía afectación palmar (2). Las ubicaciones menos
frecuentes incluyen brazos, piernas, cuello y tronco (1,2,14,15,19,24,26).
La mayoría de los pacientes son asintomáticos. Los
pacientes ocasionales reportan prurito; en estos pacientes, se puede observar
un eritema leve en el sitio de la infección.
Sin tratamiento, la tinea nigra tiende a ser
crónica. Sin embargo, se ha informado una resolución espontánea en dos o tres
meses (2,27).
DIAGNÓSTICO
Un diagnóstico de tiña negra puede ser fuertemente
sospechoso basado en el hallazgo físico de una mácula o parche marrón de inicio
reciente, particularmente cuando se encuentra en la palma de la mano y ocurre
en una persona que reside o ha visitado una ubicación tropical o subtropical.
El examen dermatoscópico puede ayudar a distinguir clínicamente la tiña negra
de las lesiones melanocíticas. Para confirmar el diagnóstico, normalmente se
realiza una preparación de hidróxido de potasio (KOH). Un cultivo también puede
confirmar el diagnóstico e identificar el organismo causante.
DERMATOSCOPÍA: la
dermatoscopía es útil para diferenciar la tiña negra de las lesiones
melanocíticas, como los nevos acros y el melanoma. Los hallazgos
dermatoscópicos típicos son espículas marrones que no siguen las crestas o
surcos de los dermatoglifos acros (líneas de la piel) (Figura 9) (1,2,28-34).
Sin embargo, se ha informado la aparición de espículas siguiendo un patrón de
cresta paralelo (35,36).
Figura 9: Imagen dermatoscópica que muestra pigmento
en un patrón espicular que no sigue el patrón de los dermatoglifos (líneas de
la piel).
PREPARACIÓN DE HIDRÓXIDO DE POTASIO: una preparación de KOH puede confirmar la
infección por hongos. Las raspaduras de la piel afectada se colocan en un lado
de vidrio con KOH al 10% y se examinan con un microscopio. En la tiña negra, el
examen microscópico revela numerosos elementos fúngicos de color marrón claro
formados por hifas septadas, variegatas y ramificadas (Figura 10) ) (1,2,14,15).
También se pueden ver grupos de blastoconidia o clamidoconididios.
Figura 10: Preparación de hidróxido de potasio que
muestra hifas pigmentadas, de color ocre, gruesas e irregulares.
CULTIVO: un
raspado superficial de la piel afectada (similar al raspado realizado para una
preparación de KOH) generalmente proporciona una muestra suficiente para el
cultivo. Los cultivos para identificar H. werneckii se realizan en agar
Sabouraud dextrosa y agar Sabouraud dextrosa más antibióticos y se incuban a
una temperatura de 25 a 28 ° C. En promedio, el crecimiento de hongos es evidente
entre cinco y seis días (2).
En la fase inicial similar a la levadura, las
colonias de hongos son lisas, viscosas y de color verde oliva a negro ( Figura
11).
Figura 11. Cultivo de Hortaea werneckii que muestra
las fases de crecimiento tanto de levadura como filamentosa.
En la siguiente fase del molde, el hongo se
manifiesta como filamentos con un aspecto lanudo o aterciopelado (Figura 12).
En la fase similar a la levadura, son visibles con examen microscópico
abundantes células en ciernes con anélidos y septos característicos. El examen
microscópico de la fase de hongo filamentoso muestra hifas septadas gruesas con
conidióforos de los cuales brotan numerosos conidios arborescentes en
formaciones blastogénicas o acropetales (1,2,15,19). Si se desea, el hongo
cultivado puede identificarse definitivamente a través de la prueba de reacción
en cadena de la polimerasa (2,37).
Figura 12. Microscopía del cultivo de Hortaea
werneckii que muestra levaduras con septos y la fase filamentosa.
BIOPSIA: una
biopsia de piel no suele ser necesaria para el diagnóstico. Las biopsias de
piel generalmente se realizan si se sospecha un diagnóstico alternativo (p. Ej.,
Melanoma). Los hallazgos histológicos característicos de la tiña negra incluyen
(Figura 13) (1,2,28,38):
- Hiperqueratosis
- Leve acantosis
- Numerosas hifas y esporas pigmentadas dentro del estrato córneo.
Figura 13. Tiña negra. Esporas pigmentadas e hifas
en el estrato córneo
La inflamación suele estar ausente; En ocasiones, en
la dermis se presentan infiltrados de células mononucleares perivasculares.
La microscopía electrónica no es necesaria para el
diagnóstico, pero mostrará pequeñas colonias de hongos con hifas y blastoconidia
dentro de la epidermis (39).
DIAGNÓSTICO DIFERENCIAL
El diagnóstico diferencial para la tiña negra
incluye otras causas potenciales de pigmentación de la piel (particularmente la
piel acral), como nevos melanocíticos, lentigos, melanoma (40,41), dermatitis
neglecta (hiperpigmentación de la piel que resulta de una limpieza inadecuada
de la piel), decoloración de la piel de metales que entran en contacto con la
piel (p. ej., anillos metálicos), liquen plano palmar ( Figura 14) (42),
fitofotodermatitis (p. ej., dermatitis de Berloque ( Figura 15) y erupciones de
drogas fijas ( foto 10 ). Una preparación de hidróxido de potasio (KOH),
cultivo de hongos o biopsia de la piel distinguirá la tiña negra de estos
trastornos.
Figura 14. Liquen plano. Pápulas y placas
hiperpigmentadas en muñecas y palmas.
Figura 15. Erupción fija por drogas. Parche hiperpigmentado en la mano.
Los hallazgos clínicos atípicos y de preparación de
KOH deberían aumentar la posibilidad de una infección por hongos alternativa.
Las infecciones superficiales con otros hongos dematiaceos , como Exophiala
mansoni (43), Neoscytalidium dimidiatum
(anteriormente Scytalidium ) (44), o Aureobasidium melanogenum (45), pueden
presentarse con hiperpigmentación cutánea y una preparación de KOH positiva.
Como ejemplo, en un paciente con A . melanogenumLa infección, los parches
hiperpigmentados que afectaban a la cara, estaban menos definidos que la típica
tiña negra, estaban acompañadas por pápulas eritematosas y mostraban células
oscuras oval septadas con septos gruesos y hifas septadas en una preparación de
KOH. En tales pacientes, los cultivos de hongos son útiles para el diagnóstico
definitivo (2).
TRATAMIENTO
La terapia tópica es el modo preferido de
tratamiento para la tiña negra. Ningún ensayo aleatorizado ha evaluado
tratamientos para la tiña negra. La experiencia clínica apoya la eficacia de:
MEDICAMENTOS ANTIFÚNGICOS TÓPICOS: imidazoles tópicos
tales como bifonazol , clotrimazol, isoconazol , ketoconazol , miconazol , y
sertaconazol [ 51 ], así como terbinafina , butenafine, y ciclopirox.
QUERATOLÍTICOS TÓPICOS: 3% de ácido salicílico,
pomada de Whitfield (6% de ácido benzoico y 3% de ácido salicílico).
En nuestra experiencia, otros agentes tópicos, que
incluyen un 1% de tintura de yodo y un 3% de azufre, también pueden ser
efectivos.
La tiña negra generalmente responde rápidamente a
estas terapias. Un curso de tratamiento típico es la aplicación dos veces al
día durante dos o tres semanas. La resolución clínica debe ocurrir dentro de
este período. En nuestra experiencia, el tratamiento concomitante de la
hiperhidrosis (cuando está presente) puede ser necesario.
Si la tiña negra no responde al tratamiento tópico,
debe confirmarse el diagnóstico y la adherencia del paciente al régimen de
tratamiento.
La tiña negra generalmente no se repite después del
tratamiento. Sin embargo, el contacto continuo con condiciones ambientales favorables
para H. werneckii es un factor de riesgo para la reinfección.
La terapia sistémica no suele estar indicada y rara
vez es necesaria. En un informe de un caso, 200 mg de itraconazol por día
durante tres semanas condujeron a la resolución de la tiña negra [ 55 ]. En
nuestra experiencia, 100 mg de itraconazol por día durante 15 a 30 días pueden
ser suficientes para adultos con tiña nigra recurrente.
REFERENCIAS
1 Bonifaz A, Gómez-Daza F, Paredes V, Ponce RM.
Tinea versicolor, tinea nigra, white piedra, and black piedra. Clin Dermatol
2010; 28:140.
2 Bonifaz A, Badali H, de Hoog GS, et al. Tinea nigra by Hortaea werneckii, a report of 22 cases
from Mexico. Stud Mycol 2008; 61:77.
3 Chen J, Xing
XK, Zhang LC, et al. Identification of Hortaea werneckii Isolated from mangrove
plant Aegiceras comiculatum based on morphology and rDNA sequences.
Mycopathologia 2012; 174:457.
4 de Hoog GS, Gerrits van den Ende AH. Nutritional pattern and eco-physiology of Hortaea
werneckii, agent of human tinea nigra. Antonie Van Leeuwenhoek 1992; 62:321.
5 Petrovic U.
Role of oxidative stress in the extremely salt-tolerant yeast Hortaea
werneckii. FEMS Yeast Res 2006; 6:816.
6 Kogej T, Stein
M, Volkmann M, et al. Osmotic adaptation of the halophilic fungus Hortaea
werneckii: role of osmolytes and melanization. Microbiology 2007; 153:4261.
7 Gunde-Cimermana
N, Zalarb P, de Hoogc S, Plemenitasd A. Hypersaline waters in salterns -
natural ecological niches for halophilic black yeasts. FEMS Microbiol Ecol
2000; 32:235.
8 Efstratiou MA,
Velegraki A. Recovery of melanized yeasts from Eastern Mediterranean beach sand
associated with the prevailing geochemical and marine flora patterns. Med Mycol
2010; 48:413.
9 Zalar P, de
Hoog S, Gunde-Cimerman N. Ecology of the halotolerant dothideaceous black
yeasts. Stud
Mycol 1999; 43:38.
10 Borelli D, Marcano C. Cladosporium castellani
nova species, agente de tinea nigra. Castellania 1973; 1:151.
11 Crous PW,
Braun U, Schubert K, Groenewald JZ. Delimiting Cladosporium from
morphologically similar genera. Stud Mycol 2007; 58:33.
12 Bakerspigel
A. The isolation of Phoma hibernica from a lesion on a leg. Sabouraudia 1970;
7:261.
13 Badali H, Carvalho VO, Vicente V, et al. Cladophialophora saturnica sp. nov., a new
opportunistic species of Chaetothyriales revealed using molecular data. Med
Mycol 2009; 47:51.
14 Severo LC,
Bassanesi MC, Londero AT. Tinea nigra: report of four cases observed in Rio
Grande do Sul (Brazil) and a review of Brazilian literature. Mycopathologia
1994; 126:157.
15 Perez C, Colella MT, Olaizola C, et al. Tinea nigra: report of twelve cases in Venezuela.
Mycopathologia 2005; 160:235.
16 Cabrera R,
Sabatin N, Urrutia M, Sepúlveda R. [Tinea nigra: a allochthonous case report in
Chile]. Rev
Chilena Infectol 2013; 30:90.
17 Pegas JR, Criado PR, Lucena SK, de Oliveira MA. Tinea nigra: report of two cases in infants. Pediatr
Dermatol 2003; 20:315.
18 Uezato H, Gushi M, Hagiwara K, et al. A case of tinea nigra palmaris in Okinawa, Japan. J
Dermatol 2006; 33:23.
19 Hughes JR,
Moore MK, Pembroke AC. Tinea nigra palmaris. Clin Exp Dermatol 1993; 18:481.
20 Cabañes FJ,
Bragulat MR, Castellá G. Hortaea werneckii isolated from silicone scuba diving
equipment in Spain. Med Mycol 2012; 50:852.
21 Khan A,
McIver FA. A case of tinea nigra palmaris from Charleston,, South Carolina. J S
C Med Assoc 1980; 76:464.
22 WATKINS DB.
TINEA NIGRA. REPORT OF A CASE IN FLORIDA. Dermatol Trop Ecol Geogr 1964;
30:173.
23 VANVELSOR H,
SINGLETARY H. TINEA NIGRA PALMARIS. A REPORT OF 15 CASES FROM COASTAL NORTH
CAROLINA. Arch Dermatol 1964; 90:59.
24 Gupta AK,
Chaudhry M, Elewski B. Tinea corporis, tinea cruris, tinea nigra, and piedra.
Dermatol Clin 2003; 21:395.
25 Sarangi G,
Dash D, Chayani N, et al. Bilateral Tinea Nigra of palm: a rare case report
from Eastern India. Indian J Med Microbiol 2014; 32:86.
26 Bonifaz A.
Tinea nigra. In: Handbook of Tropical Dermatology, Arenas R, Estrada R (Eds),
Landes Bioscience, Georgetown, Texas 2001. p.24.
27 Rossetto AL,
Cruz RC. Spontaneous cure in a case of Tinea nigra. An Bras Dermatol 2012;
87:160.
28 Smith SB,
Beals SL, Elston DM, Meffert JJ. Dermoscopy in the diagnosis of tinea nigra
plantaris. Cutis 2001; 68:377.
29 Paschoal FM, de Barros JA, de Barros DP, et al. Study of the dermatoscopic pattern of tinea nigra:
report of 6 cases. Skinmed 2010; 8:319.
30 Piliouras P,
Allison S, Rosendahl C, et al. Dermoscopy improves diagnosis of tinea nigra: a
study of 50 cases. Australas J Dermatol 2011; 52:191.
31 Criado PR, Delgado L, Pereira GA. Dermoscopy
revealing a case of Tinea Nigra. An Bras Dermatol 2013; 88:128.
32 Maia Abinader MV, Carvalho Maron SM, Araújo LO,
Silva Ado A. Tinea nigra dermoscopy: A useful assessment. J Am Acad Dermatol
2016; 74:e121.
33 Xavier MH, Ribeiro LH, Duarte H, et al. Dermatoscopy in the diagnosis of tinea nigra. Dermatol
Online J 2008; 14:15.
34 Thomas CL,
Samarasinghe V, Natkunarajah J, Fogo A. Entodermoscopy: a spotlight on tinea
nigra. Int
J Dermatol 2016; 55:e117.
35 Nazzaro G, Ponziani A, Cavicchini S. Tinea nigra:
A diagnostic pitfall. J Am Acad Dermatol 2016; 75:e219.
36 Noguchi H, Hiruma M, Inoue Y, et al. Tinea nigra showing a parallel ridge pattern on
dermoscopy. J Dermatol 2015; 42:518.
37 Abliz P,
Fukushima K, Takizawa K, et al. Specific oligonucleotide primers for
identification of Hortaea werneckii, a causative agent of tinea nigra. Diagn
Microbiol Infect Dis 2003; 46:89.
38 Hasegawa T, Matsukura T, Mizuno Y, et al. Clinical trial of a laser device called fractional
photothermolysis system for acne scars. J Dermatol 2006; 33:623.
39 Guarenti IM,
Almeida HL Jr, Leitão AH, et al. Scanning electron microscopy of tinea nigra.
An Bras Dermatol 2014; 89:334.
40 Tseng SS,
Whittier S, Miller SR, Zalar GL. Bilateral tinea nigra
plantaris and tinea nigra plantaris mimicking melanoma. Cutis 1999; 64:265.
41Hall J, Perry VE. Tinea nigra palmaris: differentiation from malignant
melanoma or junctional nevi. Cutis 1998; 62:45.
42 Madke B,
Doshi B, Wankhede P, Nayak C. Palmar lichen planus mimicking tinea nigra.
Indian J Dermatol 2013; 58:407.
43 Listemann H,
Sinner U, Meigel W. [Exophiala mansonii as the pathogen in superficial
phaeohyphomycosis]. Mykosen 1986; 29:480, 483.
44 Machouart M,
Menir P, Helenon R, et al. Scytalidium and scytalidiosis: what's new in 2012? J
Mycol Med 2013; 23:40.
45 Chen WT, Tu
ME, Sun PL. Superficial Phaeohyphomycosis Caused by Aureobasidium melanogenum
Mimicking Tinea Nigra in an Immunocompetent Patient and Review of Published
Reports. Mycopathologia 2016; 181:555.
46 Sayegh-Carreño
R, Abramovits-Ackerman W, Girón GP. Therapy of tinea nigra plantaris. Int J
Dermatol 1989; 28:46.
47 Rossetto AL,
Cruz RC, Haddad Junior V. Double-blind study with topical Isoconazole and
Terbinafine for the treatment of one patient with bilateral Tinea nigra
plantaris and suggestions for new differential diagnosis. Rev Inst Med Trop Sao
Paulo 2013; 55:125.
48 Falcão EM,
Trope BM, Martins NR, et al. Bilateral Tinea Nigra Plantaris with Good Response
to Isoconazole Cream: A Case Report. Case Rep Dermatol 2015; 7:306.
49 Burke WA.
Tinea nigra: treatment with topical ketoconazole. Cutis 1993; 52:209.
50 Marks JG Jr,
King RD, Davis BM. Treatment of tinea nigra palmaris with miconazole. Arch
Dermatol 1980; 116:321.
51 Fierro-Arias L, Echevarría-Keel J, Huesca A,
Bonifaz A. Tiña negra palmar tratada con sertaconazol crema (2%). Dermatol Rev Mex 2016; 60:361.
52 Shannon PL,
Ramos-Caro FA, Cosgrove BF, Flowers FP. Treatment of tinea nigra with
terbinafine. Cutis 1999; 64:199.
53 Rossetto AL,
Cruz RC. Tinea nigra: successful treatment with topical butenafine. An Bras
Dermatol 2012; 87:939.
54 Rosen T,
Lingappan A. Rapid treatment of tinea nigra palmaris with ciclopirox olamine
gel, 0.77%. Skinmed 2006; 5:201.
55 Gupta G,
Burden AD, Shankland GS, et al. Tinea nigra secondary to Exophiala werneckii
responding to itraconazole. Br J Dermatol 1997; 137:483.
FUENTE UPTODATE 2019