En este ejercicio clínico se presenta un caso que es discutido por un médico internista al que se le van proporcionando datos de la historia clínica en forma secuencial, y este analiza el cuadro a la luz de los nuevos elementos, de una manera análoga al proceso diagnóstico en la práctica real de la medicina
Un hombre de 70 años se presentó en un departamento de emergencias (ED) en California a mediados de Enero con un historial de 2 días de fiebre subjetiva, tos no productiva y presión en el tórax. La presión en el pecho era constante y se agravaba con la inspiración profunda y la posición supina. Informó disminución de la tolerancia al ejercicio. Él normalmente había sido capaz de caminar cinco cuadras, pero ahora se volvió disneico cuando caminaba unos pocos metros. También informó un antecedente de 7 días de diarrea acuosa que se había resuelto un día antes de la enfermedad actual. El historial médico del paciente incluía diabetes tipo 2, miocardiopatía hipertensiva, insuficiencia cardíaca (fracción de eyección más reciente, 50 a 55%), hiperlipidemia y gota. Había sido hospitalizado 5 años antes de esta presentación por un episodio de insuficiencia cardíaca sistólica, con una fracción de eyección del 20%. El paciente había emigrado de Tailandia 10 años antes y hablaba idioma Mien con su familia. Él rechazó un intérprete y proporcionó un historial médico a través de su hija de habla inglesa No bebía alcohol ni fumaba tabaco. Sus medicaciones incluían amlodipina, carvedilol, simvastatina, aspirina, furosemida, metformina, y glipizida. A su llegada al servicio de urgencias, su presión arterial era de 133/88 mm Hg, frecuencia cardíaca 109 latidos por minuto, frecuencia respiratoria 18 respiraciones por minuto, temperatura de 38.5 ° C, y una saturación de oxígeno del 98% mientras respiraba aire ambiente. Estaba diaforético y disneico, y usaba los músculos accesorios durante la inspiración. No había distensión venosa yugular, y no tenía soplo o frote cardíaco. Se auscultaban rales bibasales. Había edema leve en ambas piernas y pies. El resto del examen físico era normal.
Un hombre de 70 años se presentó en un departamento de emergencias (ED) en California a mediados de Enero con un historial de 2 días de fiebre subjetiva, tos no productiva y presión en el tórax. La presión en el pecho era constante y se agravaba con la inspiración profunda y la posición supina. Informó disminución de la tolerancia al ejercicio. Él normalmente había sido capaz de caminar cinco cuadras, pero ahora se volvió disneico cuando caminaba unos pocos metros. También informó un antecedente de 7 días de diarrea acuosa que se había resuelto un día antes de la enfermedad actual. El historial médico del paciente incluía diabetes tipo 2, miocardiopatía hipertensiva, insuficiencia cardíaca (fracción de eyección más reciente, 50 a 55%), hiperlipidemia y gota. Había sido hospitalizado 5 años antes de esta presentación por un episodio de insuficiencia cardíaca sistólica, con una fracción de eyección del 20%. El paciente había emigrado de Tailandia 10 años antes y hablaba idioma Mien con su familia. Él rechazó un intérprete y proporcionó un historial médico a través de su hija de habla inglesa No bebía alcohol ni fumaba tabaco. Sus medicaciones incluían amlodipina, carvedilol, simvastatina, aspirina, furosemida, metformina, y glipizida. A su llegada al servicio de urgencias, su presión arterial era de 133/88 mm Hg, frecuencia cardíaca 109 latidos por minuto, frecuencia respiratoria 18 respiraciones por minuto, temperatura de 38.5 ° C, y una saturación de oxígeno del 98% mientras respiraba aire ambiente. Estaba diaforético y disneico, y usaba los músculos accesorios durante la inspiración. No había distensión venosa yugular, y no tenía soplo o frote cardíaco. Se auscultaban rales bibasales. Había edema leve en ambas piernas y pies. El resto del examen físico era normal.
PONENTE
La tos no productiva, la fiebre y la incomodidad
pleurítica del pecho en este hombre mayor generan sospecha de enfermedad pleural o pericárdica. En el examen
destacan como elementos importantes la fiebre, la taquicardia leve, la disnea y
los crepitantes bibasales. Neumonía es una de mis primeras consideraciones. Otras enfermedades potencialmente mortales que
merecen consideración incluyen sepsis, síndrome coronario agudo, insuficiencia
cardíaca congestiva y enfermedad del
pericardio.
EVOLUCIÓN
Un electrocardiograma mostró taquicardia sinusal y alteraciones
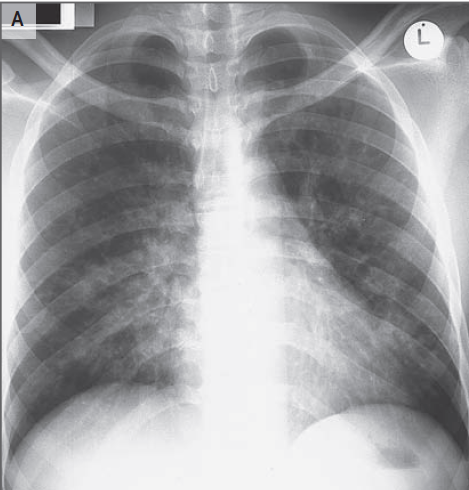
inespecíficas de la onda T. La radiografía de tórax era normal. Una
ultrasonografía en emergencias (point-of-care ultrasonography), mostró función ventricular izquierda normal, sin
derrame pericárdico, artefactos de línea B dispersos en el parénquima pulmonar
y colapso completo de la vena cava inferior durante la inspiración. El nivel de
ácido láctico fue de 1.4 mmol por litro (valor normal, menor a 2.1 mmol por
litro).
PONENTE
El nivel normal de ácido láctico hace que la sepsis
sea menos probable. Aunque la radiografía de tórax no muestra neumonía, un infiltrado
puede ser difícil de detectar en un paciente con hipovolemia. Los rales
bibasilares y líneas B en la ecografía sugiere edema intersticial, que podría
ser consistente con neumonitis o fallo cardíaco. Con un colapso de la vena cava
inferior en y una función cardíaca
normal, una insuficiencia cardíaca o una gran
grandes embolia pulmonar son menos probables. El colapso de la vena cava
inferior, en un paciente con dificultad para respirar, indica hipovolemia, lo que
puede ser una consecuencia de la diarrea previa del paciente.
EVOLUCIÓN
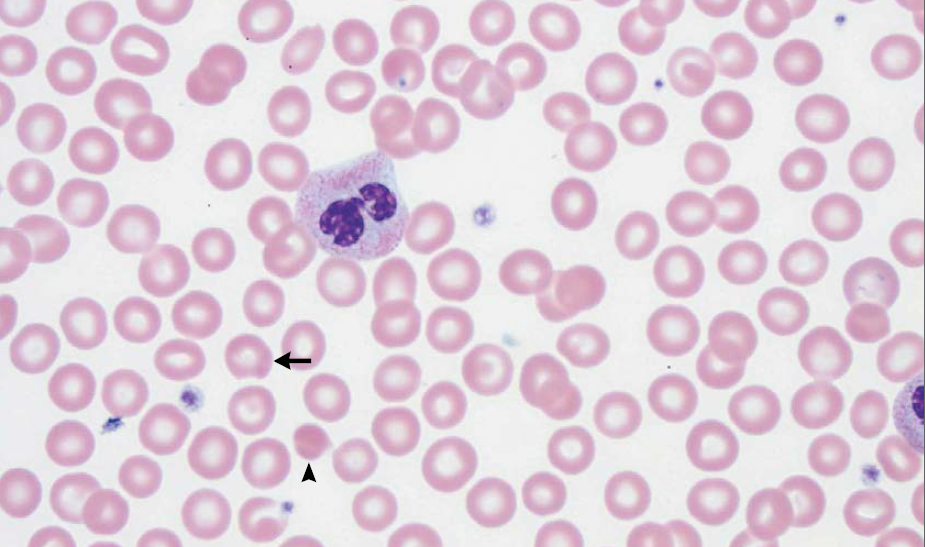
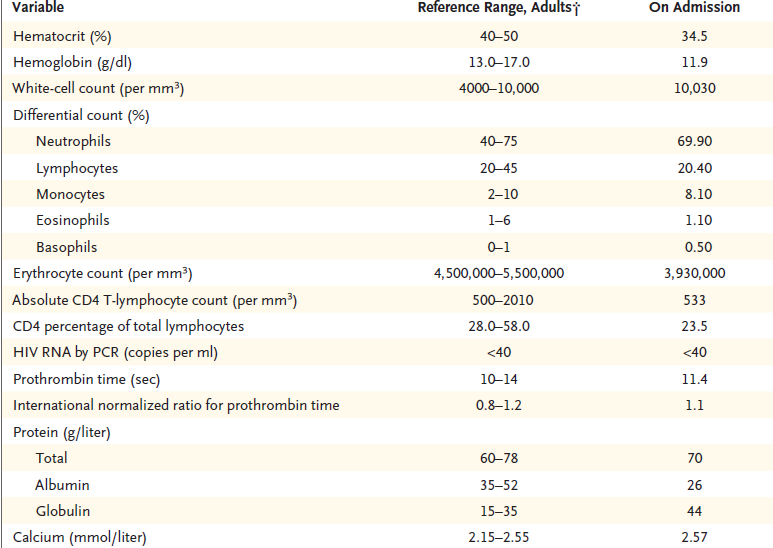
El nivel de hemoglobina era de 14.4 g por decilitro;
el recuento de glóbulos blancos fue de 9000 por milímetro cúbico, con 459
(5.1%) eosinófilos por milímetro cúbico (valor normal, menor de 450) pero el
recuento diferencial de glóbulos blancos era por otro lado normal. El nivel
sérico de sodio era de 133 mmol por litro, creatinina 1,3 mg por decilitro,
glucosa 281 mg por decilitro, aspartato aminotransferasa 49 U por litro (rango
normal, 5 a 34), y alanina aminotransferasa 78 U por litro (normal menor a 55). El resto de los datos del
panel metabólico era normal. El nivel de
troponina I fue de 2.02 ng. por mililitro (valor normal, menor a 0,10). La tirotrofina y los niveles
de tiroxina libre (T4) eran normales. El análisis de orina con tiras reactivas
mostró sangre moderada sin glóbulos
rojos en el microscopio. La creatina quinasa no se obtuvo su nivel. Los
resultados de los análisis de gases en sangre fueron normales. Un hisopado nasofaríngeo rápido para influenza
no fue realizado por no estar disponible
en el hospital. El paciente fue admitido en el servicio de medicina interna y
fue tratado con ceftriaxona, azitromicina y oseltamivir con diagnóstico
probable de neumonía adquirida en la comunidad asociada a la gripe, y con
heparina, atorvastatina y aspirina por sospecha de síndrome coronario agudo. La
tomografía computarizada pulmonar, y la angio-TC pulmonar fue negativa para
embolismo pulmonar pero mostró atelectasia subsegmentaria bibasal.
PONENTE
Un tratamiento empírico para gripe y neumonía adquirida en la comunidad
adquirida es razonable sobre la base de la presentación clínica. Sin embargo,
el elevado
Nivel de troponina I, los resultados del análisis de
orina que sugieren mioglobinuria o hemoglobinuria, y la TC que muestra solo
atelectasias no se explica fácilmente por estas condiciones. Es posible que una
infección viral pudiese conferir una predisposición a padecer un síndrome
coronario agudo en esta paciente de 70 años que tiene una enfermedad coronaria
subyacente, pero otras causas de lesión del miocardio también deben ser
consideradas. Un aumento de la demanda metabólica secundario a hipertiroidismo, anemia grave o sobrecarga de
presión del lado derecho del corazón por embolia pulmonar es poco probable dado
los resultados de las pruebas hasta el momento. La hipertensión pulmonar y la
sepsis también pueden causar isquemia por aumento de la demanda (es decir, isquemia
debido a un desequilibrioentre la oferta y la demanda de oxigeno). Yo también
consideraría miocarditis, que puede ser causada por infección (más comúnmente infección
por enterovirus, particularmente coxsackievirus), trastornos autoinmunes o
toxinas. El antecedente de una diarrea reciente de puede ser una pista. Me
gustaría preguntar sobre contactos enfermos, particularmente niños con diarrea o
erupción, como se ve con el coxsackievirus A, parvovirus B19, o infección por herpesvirus
humano 6. Las infecciones transmitidas por garrapatas, incluida la enfermedad
de Lyme, suelen ocurrir en verano y son raros durante la temporada de
gripe. La eosinofilia limítrofe podría
sugerir una reacción de hipersensibilidad o una infección helmíntica que puede
causar miocarditis, como la triquinosis o larva migrans visceral. El paciente es de Tailandia,
donde la melioidosis es endémica. A pesar de que la melioidosis puede tener un
período de incubación prolongado, entre
los pacientes en los Estados Unidos, normalmente se adquiere a través de viajes
recientes y es rara vez se asocia con miocarditis. Un paciente con infección
por legionella puede presentarse de manera similar a la forma en que se
presentó en esta paciente, y la infección por legionella, también puede causar
miocarditis. Sin embargo, la ausencia de evidencia de neumonía en las imágenes
hacen que la infección por legionella sea poco probable.
EVOLUCIÓN
Una prueba basada en la reacción en cadena de la
polimerasa (PCR) para gripe (que tiene un tiempo de procesamiento de 4 a 7
días) se ordenó, pero un hisopado
nasofaríngeo nunca se obtuvo del paciente. Un ecocardiograma
transtorácico, obtenido la mañana después de la admisión, no mostró ningún
cambio respecto de un ecocardiograma obtenido 2 años antes. Aunque la fiebre se
resolvió, el dolor de pecho y la marcada
disnea persistieron en los días 2 y 3 después de la admisión. El nivel de
troponina I disminuyó a 1,32 ng por mililitro. Los cultivos de sangre y orina
no mostraron crecimiento a las 48 horas. En el día 3 después del ingreso, el
paciente se sometió a cateterización cardíaca por síntomas persistentes. Los
resultados mostraron una enfermedad arterial coronaria mínima, una presión
pulmonar y en la aurícula derecha moderadamente elevados, función sistólica
ventricular izquierda normal, y mínima elevación de la presión diastólica
final. Un hemograma completo realizado en el día 4 después del ingreso mostró
un nivel de hemoglobina de 13.0 g por decilitro; un recuento de glóbulos
blancos de 8900 por milímetro cúbico, con 44% de neutrófilos (normal rango, 48
a 80), 21% bandas (rango normal, 0 a 14) y 1246 (14%) eosinófilos por milímetro
cúbico; y un recuento de plaquetas de 133.000 por milímetro cúbico. Los síntomas
del paciente disminuyeron, y fue dado de alta el día 5 después de la admisión con
un presunto diagnóstico de gripe complicada por neumonía adquirida en la
comunidad y síndrome coronario agudo.
PONENTE
La condición del paciente mejoró ya sea como resultado
de o a pesar del trato recibida la a
eosinofilia y el síndrome coronario agudo rara vez se asocia con gripe. Aunque una prueba rápida de antígeno
de influenza podrían haber sido útiles, estas pruebas son poco sensibles, y, según
El CDC el tratamiento empírico de la gripe sería
está recomendado incluso si el resultado
fuera negativo. Si se había realizado una prueba de influenza basada en PCR, un
resultado negativo habría descartado en gran medida gripe, pero el largo tiempo
que demoran sus resultados hacen que su utilidad clínica sea menor. Los resultados del cateterismo cardíaco
descarta enfermedad de arteria coronaria como causa del dolor torácico, disnea,
y elevación del nivel de troponina. La troponina elevada podría deberse a una
sobrecarga de presión en el lado derecho del corazón, sepsis, o miocarditis. La
sepsis puede causar un aumento en el nivel de troponina, y algunas infecciones como la meningococcemia, están
asociadas con miocarditis. Dados los resultados de los cultivos de sangre, una
grave infección bacteriana sistémica en este paciente es poco probable, a menos
que los cultivos hubiesen sido obtenidos después del inicio de la terapia con
antibióticos. El aumento en el recuento
de eosinófilos podría reflejar una reacción de hipersensibilidad a los
medicamentos; otras posibilidades incluyen enfermedades del tejido conectivo,
cáncer o una infección helmíntica. Una infeccion helmíntica involucrando la
migración de parásitos a través de la circulación pulmonar podría explicar las
elevadas presiones en la aurícula derecha y la arteria pulmonar pulmonar y
podrían aun explicar la disnea transitoria. Ascariasis, sarcocistosis,
esquistosomiasis, estrongiloidiasis, toxocariasis y triquinosis podría
manifestarse de manera similar. Debe obtenerse información sobre cualquier
viaje reciente o exposiciones inusuales.
EVOLUCIÓN
El paciente regresó al servicio de urgencias 1
semana después del alta. con una recurrencia de la presión torácica y disnea.
Refirió también escalofríos, mialgias y
sensación de fiebre aunque no se había controlado su temperatura.En el examen
físico, tenía una frecuencia respiratoria de 22 por minuto y el resto de los
signos vitales eran normales Tenía edema periorbitario y utilizaba los músculos accesorios durante la inspiración. Se
auscultaban rales bibasales y edema con signo de godet 1+ en tobillos sin
distensión venosa yugular. El resto del examen físico. era normal El recuento
de glóbulos blancos fue 14,200, con 5100 (36%) de eosinófilos, por milímetro cúbico.
El nivel de troponina I era menor que 0.10 ng por mililitro, y el nivel de
ácido láctico era 2,64 mmol por litro. Durante esta visita al departamento de
emergencia, dos otros hombres de la comunidad Mien, que habían presentado por separado, fueron
evaluados simultáneamente para síntomas similares. Se descubrió que los hombres
pertenecían a una familia extendida que había asistido a una celebración de
vísperas de Año Nuevo 2 semanas antes. En la celebración, fue servida ensalda de Laab, que se hizo de carne de un jabalí crudo
que había sido criado en una granja privada.
PONENTE
Síntomas similares entre los contactos que tuvieron
una Exposición similar (ingestión de carne cruda de jabalí), proporcionar la
clave epidemiológica para el diagnóstico
más probable, triquinosis aguda. El
antecedente de diarrea es consistente con la etapa más temprana de la
enfermedad que es la fase intestinal de la triquinosis. La aparición de fiebre,
síntomas cardiopulmonares, y eosinofilia, está
probablemente correlacionada con la migración larvaria. El paciente
regresó al servicio de urgencias con la constelación típica de fiebre, mialgias
y edema periorbitario visto clásicamente en la triquinosis. La disnea
prominente que presentó el paciente, podría
haber sido el resultado de la invasión por larvas de los músculos respiratorios o
miocardio (como se sugiere por el nivel elevado de troponina) o por neumonitis
causada por el tránsito de larvas a través de la circulación pulmonar. La terapia
antihelmíntica no debe demorarse hasta tener la serología diagnóstica
pendiente, debido a que el tratamiento puede no eliminar la infección, una vez
que esta ha progresado más allá de la fase entérica inicial. Tratamiento con
glucocorticoides debe ser iniciado para prevenir un cuadro similar a la
reacción de Jarisch– Herxheimer, que puede ocurrir después de la iniciación del
tratamiento con agentes antihelmínticos. En pacientes con enfermedad grave, la
triquinosis puede causar directamente sepsis grave e injuria pulmonar aguda, o
que podría explicar la elevación leve del ácido láctico del paciente. Infecciones
bacterianas fatales tienen también han estado asociadas con platos
tradicionales tailandeses, como laab dib, debido a la contaminación de las
materias primas de cerdo con Streptococcus Suis. Finalmente, el departamento
local de salud pública debe ser notificado de una sospecha de brote
EVOLUCIÓN
En vista de la exposición dietética a la carne cruda
de jabalí, muchos enfermos de la familia,
y marcada eosinofilia, el paciente fue ingresado en al hospital, y se
suministró tratamiento con albendazol y
prednisona se inició por presunta triquinosis aguda. Se obtuvo una muestra de
carne de jabalí congelada sin usar de los anfitriones del evento. En ella se
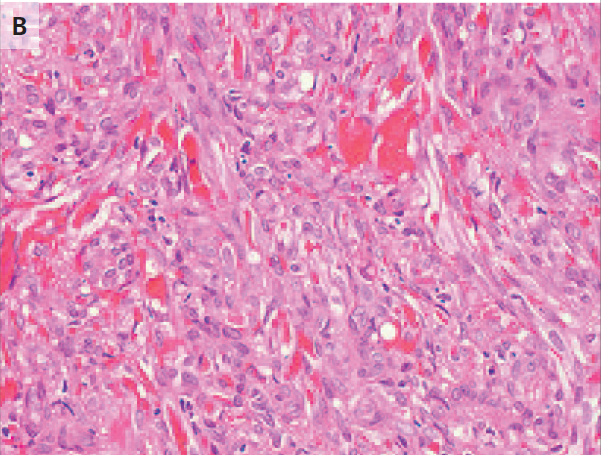
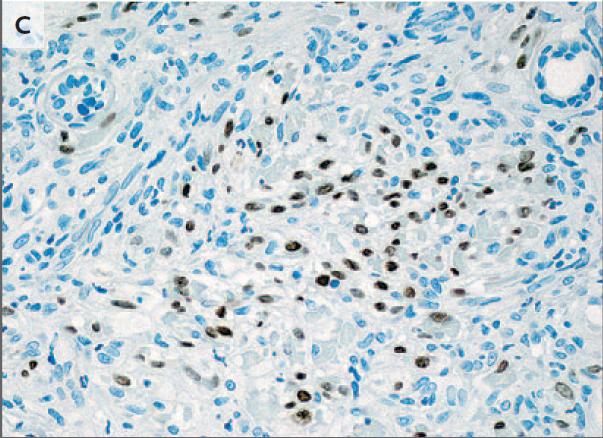
encontraron las larvas de Trichinella spiralis dentro del músculo (fig. 1). En
un estudio de ELISA para la triquina el anticuerpo IgG fue positivo.
Una investigación de salud pública por los departamentos
del estado y del condado reveló que este
brote de triquinosis afectó 12 personas, incluyendo nuestro paciente, que había estado en este evento o
consumido.Los pacientes se habían presentado a diferentes hospitales de sus
respectivas localidades en varias ocasiones consultando por síntomas de gripe
en plena temporada de gripe. Algunos
pacientes tenían diarrea y dolor abdominal predominantemente severos,
probablemente debido a la etapa entérica de la triquinosis, y recibieron todos
ellos elincorrecto diagnóstico de la
incorrecta gastroenteritis. Otros se presentaron con mialgias, dolor torácico y
dificultad respiratoria, que marcan la etapa parenteral de triquinosis;
diagnósticos erróneos incluidos infección aguda del tracto respiratorio,
influenza, síndrome coronario agudo, e insuficiencia cardíaca congestiva.
Nuestro paciente completó el curso de albendazol, y
sus síntomas disminuyeron. Tres meses después, él refirió que podía caminar durante horas sin disnea o
dolor torácico.
COMENTARIO
La triquinosis es una infección parasitaria
transmitida por los alimentos, causada por gusanos redondos del género
trichinella. Se asocia con el consumo de carne inadecuadamente cocida forma
inadecuada que contiene larvas infecciosas.
La triquinosis es una enfermedad rara en los Estados
Unidos, típicamente con menos de 50 casos diagnosticados cada año.1 Prácticas
mejoradas de cría de animales han llevado a una disminución dramática en la
incidencia de triquinosis a partir de carne de cerdo criada comercialmente. Consumo
de caza silvestre o carne cruda y viajar a zonas endémicas es ahora el factor
de riesgo más importante siendo el
consumo de carne de oso no comercial una
forma común. Los cerdos criados son las
fuentes de infección más comunes en los Estados Unidos.1 Un desproporcionado número
de casos observados en pacientes de ascendencia asiática.1.2 Cultural y
regional.
Las preferencias dietéticas culturales y
regionales en los que se consume carne
cruda puede provocar brotes de triquinosis.2 Laab (o larb) es un plato
tradicional del norte de Tailandia y Laos que a menudo se hace con carne de
cerdo cruda y ha sido asociado a brotes de triquinosis.2-4 entre viajeros,
consumo de delicias regionales como la carne cruda de caballo en Francia e
Italia, 5 jabalíes salvajes en el sudeste asiático, y carne de perro en China y
Corea ha producido casos triquinosis.
La triquinosis es un diagnóstico desafiante en un entorno
en el que la infección no es endémica. y no se ha reportado ningún brote; se
puede manifestar con signos y síntomas inespecíficos que pueden simular
gastroenteritis aguda, influenza, grave, infección bacteriana, insuficiencia
cardíaca y síndrome coronario agudo. 4,6,7 Rangos de gravedad clínica van desde
casos asintomáticos a mortales, dependiendo de la especie trichinella, la dosis
infecciosa de larvas, y respuesta del hospedador. 4,6
La triquinosis es una enfermedad bifásica, con una fase
enteral seguida de una fase parenteral. En la fase enteral, las larvas invaden la
mucosa del intestino delgado, maduran a gusanos adultos, y producen larvas
después de un período de incubación de 1 a 2 días.
Figura 1. Muestras de carne de jabalí.
Preparación táctil (Panel A) y fijados en parafina
fijados con formalina. Corte de tejido con hematoxilina y eosina.
La tinción (Panel B) muestra larvas de Trichinella
spiralis en músculo de jabalí.
Los pacientes suelen presentar síntomas de náuseas,
vómitos, diarrea acuosa y dolor
abdominal, que puede durar hasta 3 a 4 semanas.4,6,7 Laos síntomas clásicos y
más graves de la triquinosis se ven durante la fase parenteral, cuando las
larvas recién nacidas entran al sistema
linfático y los vasos sanguíneos, diseminándose al músculo esquelético y otros
órganos Esta fase suele comenzar 2 semanas después de la ingestión y puede
durar hasta 8 semanas a medida que los gusanos adultos en el intestino delgado
siguen produciendo más
larvas.4,6,7 Las larvas migratorias causan efectos
físicos directos, daño a los tejidos y desencadena una respuesta inmune. 4,6,7
Los síntomas y signos típicos incluyen fiebre, mialgia, debilidad, dolor de
cabeza, edema periorbitario, erupción, eosinofilia y niveles elevados de enzimas
musculares. Aunque la trichinella no migra a través del tejido pulmonar, los
síntomas respiratorios son comunes. En una serie de 102 casos de triquinosis
aguda, se notificó que el 50% de los pacientes tenían tos o auscultación
pulmonar anormal o ambos.8 Los síntomas torácicos
o respiratorios pueden estar relacionados con la invasión larvaria del tórax y músculo del miocardio o una reacción pulmonar
a las larvas que pasan por la circulación pulmonar. La muerte ocurre raramente
y es usualmente resultado de complicaciones de miocarditis, encefalitis, o
enfermedad tromboembólica 6,9,10 El daño
vascular y el efecto protrombótico local de los eosinófilos activados se cree son
los responsables de estas complicaciones severas.10,11 Los síntomas disminuyen
a medida que las larvas completan su migración al músculo estriado.4,6 El dolor muscular puede continuar porque las
larvas pueden permanecer latentes en el músculo estriado durante meses o incluso años .12 Los dos hallazgos
de laboratorio más comunes son la leucocitosis y la eosinofilia.13,14 La eosinofilia
ocurre temprano en el curso de la enfermedad, se ve en prácticamente todos los
casos de triquinosis, y es una medida de la severidad de la enfermedad.13,14 El
nivel de creatina quinasa es elevado en la mayoría de los casos. 12,13 La
confirmación de laboratorio del diagnóstico depende de la detección del
anticuerpo trichinella en suero. Evidencia de larvas de trichinella en la
biopsia muscular rara vez se necesita porque la historia clínica y los datos de
laboratorio, incluyendo resultados de pruebas serológicas, suelen ser adecuadas
para establecer el diagnóstico. El tratamiento elimina los gusanos adultos del intestino,
evitan la producción de larvas nuevas, y elimina las larvas en el sistema
linfático y los vasos sanguíneos. El diagnóstico y el tratamiento temprano pueden reducir la carga de invasión muscular
y severidad de la enfermedad. El retraso diagnóstico y el tratamiento son problemáticos
porque los medicamentos antihelmínticos pueden ser menos efectivos una vez que
las larvas entran en el músculo estriado.
El diagnóstico tardío en este caso parece haber reflejado sesgo de anclaje (anchoring bias)
(aceptación prematura de un diagnóstico común y la falta de incorporación
datos nuevos o conflictivos). A pesar de las imágenes
negativas del tórax, y cateterismo
cardiaco sin complicaciones, y la falta de pruebas de influenza, los
clínicos continuaron atribuyendo la presentación a influenza, neumonía y síndrome
coronario agudo. Una vez que la condición del paciente mejoró, hubo menos de un ímpetu para obtener
un detallado historial dietético y de viaje. Además, el paciente rechazó un
intérprete, que podría haber afectado la
naturaleza de la información disponible para los clínicos. En definitiva, fue
la simultánea llegada al servicio de urgencias de múltiples pacientes
relacionados, con síntomas similares, junto con una historia dietética, que
llevó al reconocimiento del correcto diagnóstico y tratamiento.
Traducción de
A Tricky Diagnosis
Amarinder Singh, M.D., M.P.H., Brad Frazee, M.D.,
David A. Talan, M.D.,
Valerie Ng,
M.D., Ph.D., and Berenice Perez, M.D.
NEJM
References
1. Wilson NO,
Hall RL, Montgomery SP,
Jones JL.
Trichinellosis surveillance —
United States,
2008–2012. MMWR Surveill
Summ 2015; 64:
1-8.
2. Heaton D,
Huang S, Shiau R, et al.
Trichinellosis
outbreak linked to consumption
of privately
raised raw boar meat
— California,
2017. MMWR Morb Mortal
Wkly Rep 2018;
67: 247-9.
3. Khamboonruang
C. The present status
of
trichinellosis in Thailand. Southeast
Asian J Trop Med
Public Health 1991;
22: Suppl:
312-5.
4. Gottstein B,
Pozio E, Nöckler K. Epidemiology,
diagnosis,
treatment, and control
of
trichinellosis. Clin Microbiol Rev
2009; 22:
127-45.
5. Ancelle T,
Dupouy-Camet J, Bougnoux
ME, et al. Two
outbreaks of trichinosis
caused by horsemeat
in France in 1985.
Am J Epidemiol
1988; 127: 1302-11.
6. Dupouy-Camet
J, Murrell KD, eds.
FAO/WHO/OIE
guidelines for the surveillance,
management,
prevention and control
of
trichinellosis. Paris: Food and Agriculture
Organization of
the United Nations,
World Health
Organization, World Organization
for Animal
Health, 2007.
7.
Trichinellosis: resources for health
professionals.
Atlanta: Centers for Disease
Control and
Prevention, 2018 (https://
www .cdc .gov/
parasites/ trichinellosis/
health_professionals/
index .html).
8. Minot GR,
Rackemann FM. Respiratory
signs and
symptoms in trichinosis.
Am J Med Sci
1915; 150: 571.
9. Fourestie V,
Douceron H, Brugieres P,
Ancelle T,
Lejonc JL, Gherardi RK. Neurotrichinosis:
a
cerebrovascular disease associated
with myocardial
injury and hypereosinophilia.
Brain 1993; 116:
603-16.
10. Murrell KD,
Pozio E. Worldwide oc-
trichinellosis,
1986-2009. Emerg
Infect Dis 2011;
17: 2194-202.
11. Paolocci N,
Sironi M, Bettini M, et al.
Immunopathological
mechanisms underlying
the time-course
of Trichinella spiralis
cardiomyopathy
in rats. Virchows Arch
1998; 432:
261-6.
12. Fröscher W,
Gullotta F, Saathoff M,
Tackmann W.
Chronic trichinosis: clinical,
bioptic,
serological and electromyographic
observations.
Eur Neurol 1988;
28: 221-6.
13. Dupouy-Camet
J, Kociecka W, Bruschi
F,
Bolas-Fernandez F, Pozio E. Opinion on
the diagnosis
and treatment of human
trichinellosis.
Expert Opin Pharmacother
2002; 3:
1117-30.
14. Ferraccioli
GF, Mercadanti M, Salaffi
F, Bruschi F,
Melissari M, Pozio E. Prospective
rheumatological
study of muscle and
joint symptoms
during Trichinella nelsoni
infection. Q J Med 1988; 69: 973-84.
15. Pozio E, Sacchini D, Sacchi L, Tamburrini
A, Alberici F.
Failure of mebendazole
in the treatment
of humans with
Trichinella
spiralis infection at the stage
of encapsulating
larvae. Clin Infect Dis
2001; 32:
638-42.