Un hombre de 71 años fue internado por deterioro de la función renal y
hematuria.
Tres semanas antes, la esposa del paciente se
enfermó con un cuadro de escalofríos, fatiga y mialgias, y ella pensó que tenía
gripe. Unos días más tarde, el paciente presentó fiebre subjetiva, con escalofríos
intermitentes, fatiga, malestar general, anorexia y mialgias difusas leves.
Notó que había reducido la ingesta de líquidos y que su orina se había vuelto
más oscura. Sus síntomas fueron temporalmente aliviados con la administración
de acetaminofén. Aproximadamente 10 días antes de la internación actual, el
paciente fue evaluado por su médico de atención primaria, que pensó que el
paciente estaba deshidratado. Le realizó pruebas de laboratorio, y los
resultados ese mismo día, mostraron una creatinina sérica de 4.9 mg por decilitro;
el nivel de creatinina había sido de 0,8 mg por decilitro 2 meses antes. Fue
referido a la emergencia del hospital donde refirió persistencia de los
síntomas constitucionales, calambres intermitentes en la parte inferior del
abdomen y mayor oscurecimiento de la orina,
que se había convertido en el color de la coca cola. La temperatura era 36.9 °
C, la frecuencia cardíaca de 87 latidos por minuto, la presión arterial 153/82
mm Hg y la saturación de oxígeno de 98% mientras respiraba aire ambiente. El
peso era de 103.2 kg, y el las membranas mucosas estaban húmedas. El resto del
examen era normal. La prueba de un hisopo nasofaríngeo para virus de influenza
A y B fue negativa, y se obtuvo un cultivo de orina; otros resultados de
pruebas de laboratorio eran como sigue: .
Hemoglobina 10.8 (g/dl) Hematocrito
33%.Glóbulos blancos 11600/mm3.Fórmula N 76%. L 13%. M 9%.
E 0,6%. B0.3%.Plaquetas 300.000/mm3.
Na 143. K 3,4. Cl 107. Urea 70 mg/dl. Creatinina 3,9
mg/dl. Glucemia 99 mg/dl. Calcemia 8,8mg/dl.
Proteínas totales 6,4 g/dl. Albúmina 3 g/dl. ESD 82 mm/h.
FAN (-). ANCA c y ANCA p negativos. Anti PR3 (-) Anti mieloperoxidasa (-).
C3 153 mg/d
(normal 75-175)
C4 30 mg/dl
(normal 12-39)
Anti-DNA de doble cadena negativo. FR (-)
Serología para virus B y C negativa. VDRL (-). PSA
normal.
Ferremia 25 ug/dl (45-160). Transferrina 121 mg/dl
(200-360 ug/dl). Ferritina plasmática 603
ug/l (normal 200-300).
Orina: color rosado, levemente turbia, pH 6.0.
Densidad 1008. Proteínas 2+. Glucosa (-). Cetonas (-). Sangre 3+. Bilirrubina (-). Leucocito
esterasa (-). Nitritos (-). GR a gran aumento : más de 100 (normal 0-2).
Leucocitos a gran aumento 10 a 20 (normal 0-2). Na 43 meq/l.Creatinina 57 mg/dl (39-259).
Proteínas totales en orina 325 mg/dl. Microalbuminuria 194 mg/dl (0-20).
Relación proteínas (mg)/creatinina(mg): 5,71 (menos de
0.15)
Relación microalbuminuria (mg)/creatinina (grs):
3412 (menos de 30).
Se obtuvieron estudios de imágenes: una radiografía de tórax era normal. Una tomografía
computarizada (TC) de la abdomen y pelvis, realizados sin administración
intravenosa de material de contraste, revelaron quistes renales bilaterales sin
evidencia de hidronefrosis, diverticulosis sin evidencia de diverticulitis,
colelitiasis sin evidencia de colecistitis y calcificaciones vasculares de aorta
abdominal, con un aneurisma aórtico abdominal de 3.9 cm de diámetro.
Los
medicamentos que elpaciente recibía en forma ambulatoria eran: aspirina, atorvastatina, amlodipina con
benazepril, metformina, colecalciferol y ácidos grasos n-3, así como ibuprofeno
cada dos días para el dolor de rodilla. Ibuprofeno, aspirina, benazepril y metformina
se suspendieron inmediatamente después de internarse.
La ecografía renal reveló riñones de tamaño normal
(13.3 cm el derecho y 11.8 cm el izquierdo, con quistes bilaterales ( de menos 5.5
cm de diámetro), incluyendo uno con una tabicación delgada, y sin evidencia de
hidronefrosis.
En el día 4 del hospital, el nivel de creatinina
disminuyó a 3,2 mg por decilitro, pero en los siguientes 2 días, apareció hematuria
y el nivel de creatinina aumentó a 3.9 mg por decilitro. El examen del
sedimento urinario reveló glóbulos rojos, cilindros de glóbulos rojos y cilindros
de glóbulos blancos. Como consecuencia de ello se le indicó un tratamiento
empírico con metilprednisolona intravenosa, y se programó la biopsia de riñón.
Dado que el paciente tenía temperaturas de hasta 37.7
° C y leucocitosis persistente, dos muestras de
hemocultivos fueron obtenidos. Dos días después, bacilos gramnegativos
desarrollaron en los dos frascos para anaerobios por lo que se inició tratamiento
con ceftriaxona intravenosa se inició y se suspendió la metilprednisolona. Se
repitieron los cultivos de sangre y
orina, se suspendió la ceftriaxona, y se comenzó tratamiento con cefepima y aztreonam.
Se repitió una TC del abdomen y la pelvis, sin la
administración intravenosa de material de contraste, la cual reveló una mayor
cantidad de líquido perirrenal sin
evidencia de absceso. También se vio un
quiste renal de 0.9 cm de
diámetro, hiperintenso en elpolo superior derecho, evidencias de infiltración
de la grasa presacra nueva, y pequeños derrames pleurales bilaterales. Un
ecocardiograma mostró una función ventricular normal y sin calcificaciones
valvulares. En el hospital el día 11, el nivel de creatinina fue de 3.0 mg por
decilitro.
En la evolución, el paciente presentaba hematuria macroscópica con orina
de color marrón, fatiga, fiebre de bajo grado, anorexia y tos intermitente El
paciente refirió dolor abdominal difuso de tipo calambre que calificó de intensidad 3 en una
escala de 0 a 10. Informó que no tenía disuria, aumento en la frecuencia
urinaria, dolor en el flanco, náuseas, vómitos, faringitis, disnea, rash, dolor
de cabeza, o síntomas neurológicos.
El paciente tenía un historial tolerancia a la
glucosa alterada, hipertensión, hiperlipidemia, aneurisma aórtico abdominal,
eccema, pólipos colónicos benignos, diverticulosis y osteoartritis de rodillas,
hombros y columna lumbar. Él había sufrido reparación de una hernia inguinal
derecha, así como prostatectomía radical para el tratamiento de cáncer de
próstata 16 años antes. No tuvo nunca reacciones a los medicamentos. Varios de
sus cinco nietos jóvenes habían estado enfermos durante el mes antes de esta
internación. Se había retirado 1 año antes de un trabajo en ventas, trabajo por
el cual había viajado a Europa y más recientemente a México. Él había bebido 3 o 4 cervezas diariamente desde
que se había retirado. Había fumado medio paquete de cigarrillos diariamente
durante 50 años, pero había fumado más recientemente algunos pocos cigarrillos
por día. Su padre había tenido cáncer de pulmón y su madre habían tenido
diabetes, pero no había antecedentes familiares de autoinmunidad o enfermedad
renal.
En el examen físico, la temperatura era 37.4 ° C, la
frecuencia cardíaca 84 latidos por minuto, la presión arterial 159/90 mm Hg, la
frecencia respiratoria 18 respiraciones por minuto y la saturación de oxígeno 94%
mientras el paciente respiraba aire ambiente. El peso era 103.6 kg, la altura 175
cm, y el índice de masa corporal de 33.8. El paciente parecía cómodo.
La dentición era pobre, pero no había lesiones
orofaríngeas. La auscultación del tórax revelaba un soplo
sistólico de pico temprano (grado 2/6) en la base izquierda y crepitantes
bibasilares. El abdomen era blando, indiferente y no distendido, y no había
dolor en el ángulo costovertebral. Había
una hernia inguinal izquierda. No había lesiones sépticas en las uñas y tampoco
erupciones. La orina era rosa, sin
coágulos. El resto del examen era normal. Se extrajeron muestras para cultivos
de orina y sangre. Los niveles en sangre de magnesio, fósforo, alanina aminotransferasa, aspartato
aminotransferasa, fosfatasa alcalina y bilirrubina eran normales. Se muestran
otros resultados de pruebas de laboratorio. El examen del sedimento urinario
mostró glóbulos rojos no dismórficos que eran "demasiado numerosos para
contar, "algunos cilindros granulares, y sin cilindros celulares. El resultados de la electroforesis de
proteínas séricas eran normales, y una prueba de orina para proteína de Bence
Jones fue negativa.
Se realizó una TC del abdomen y pelvis sin la administración intravenosa de material
de contraste (Fig. 1) que mostró infiltración de la grasa perinefrica bilateral leve sin hidronefrosis.
Los riñones contenían múltiples, quistes corticales renales simples bilaterales.
Había diverticulosis colónica, predominantemente en el colon sigmoide, con
infiltración grasa y múltiples ganglios
linfáticos prominentes en el mesenterio sigmoides. Estos hallazgos fueron
compatibles con diverticulitis sigmoidea aguda El peritoneo contenía una
pequeña cantidad de líquido libre sin aire libre. Había calcificaciones
vasculares que involucraban la aorta abdominal y sus ramas principales, con un
aneurisma aórtico abdominal infrarrenal (3.9 cm de diámetro). Las bases de los
pulmones estaban limpias. Había escaso
derrame pleural bilateral. Se administró ceftazidima intravenosa y metronidazol. A la
mañana siguiente apareció un dolor abdominal y suprapúbico intenso y la orina impresionaba
como más oscura roja.
Se llevó a cabo una prueba diagnóstica
Figura 1. Tomografía computarizada del abdomen y la
pelvis sin administración intravenosa de sustancia de contraste. Las imágenes
coronales muestran una infiltración perinéfrica bilateral leve (Panel A,
flechas) sin evidencia de hidronefrosis, múltiples divertículos en el colon
sigmoide (Panel B, puntas de flecha), e infiltración de la grasa mesentérica
del sigmoide. (Panel B, flechas).
DIAGNÓSTICO DIFERENCIAL
Este hombre de 71 años se presentó con una función
renal rápidamente decreciente y hematuria.
Su nivel de creatinina aumentó durante un período de 2 meses, de 0,8 a 4,9 mg
por decilitro. En el contexto de construir un diagnóstico diferencial, el primero paso es
determinar si la disminución de la función renal se debe a una uropatía
obstructiva, una condición prerrenal o una enfermedad intrínseca del
riñón. El paciente tenía pocos síntomas relacionados con el tracto urinario
y no había evidencia de hidronefrosis en la ecografía renal, haciendo poco
probable el diagnóstico de uropatía obstructiva. Un
insulto prerrenal tal como depleción de volumen
intravascular sería poco probable
como causa de la injuria aguda que este
paciente presentó sin una enfermedad reñal preexistente . Además, la administración de solución salina
intravenosa no dio lugar a una mejoría notable en la función renal, lo que
también hace muy improbable que la pérdida
de volumen intravascular sea una explicación para este caso.
Medicamentos que podría alterar la tasa de filtración glomerular, incluidos
antiinflamatorios no esteroideos (AINES), o inhibidores de la enzima
convertidora de angiotensina, discontinuaron. Por lo tanto, el proceso de
la enfermedad es muy probable que sea intrínseco al riñón.
EXAMEN DEL SEDIMENTO URINARIO
Mucho se puede deducir de las descripciones del sedimento
urinario. En la presentación inicial, la orina se describe como el color de la
cola y el examen del sedimento urinario reveló células rojas, cilindros de
glóbulos rojos y cilindros de células blancas, hallazgos sugestivos de glomerulonefritis.1 Los resultados de los análisis
de orina y el deterioro de la función renal hicieron que hubiese preocupación
sobre el pronóstico por lo que se inició
tratamiento con metilprednisolona
endovenosa. La presencia de cilindros de células blancas plantea posibilidad
de nefritis intersticial. Aunque la nefritis intersticial puede ser causada
por gramnegativos anaerobios
facultativos (p. ej., yersinia) que pueden ser adquiridos en un viaje al
extranjero, rara vez causa hematuria macroscópica.
Dado el grado de hematuria visto en este paciente, una nefritis intersticial sería poco probable y por lo
tanto deben considerarse otras causas de hematuria.
Un examen repetido posterior del sedimento urinario
mostró que los glóbulos rojos no eran
dismórficos y que no había cilindros celulares, hallazgos que sugieren una fuente
de sangrado en el tracto urinario. Una ecografía renal y una TC sin contraste mostraron quistes renales
simples y una masa quística mínimamente compleja (clasificación Bosniak 2) de poca
importancia clínica, junto con una vejiga contraída. Aunque no se puede
descartar una fuente de sangrado en el tracto urinario, sería una causa poco
probable ya que no explicaría una declinación tan rápida de lafunción renal en
este paciente.
GLOMERULONEFRITIS RÁPIDAMENTE PROGRESIVA
La glomerulonefritis rápidamente progresiva es el diagnóstico
más probable en este paciente, y el plan de diagnóstico y terapéutico tendría que proceder rápidamente para evitar cicatrización
glomerular e intersticial. La evaluación de los niveles del complemento sérico
(C3 y C4) es muy útil para reducir el diagnóstico diferencial. La activación de
la vía clásica del complemento, que
reduce tanto el nivel de C4 como el nivel de C3, sugiere enfermedad glomerular
debido a un proceso como el lupus eritematoso sistémico o la crioglobulinemia.
La activación de la vía alternativa del complemento, que da como
resultado un bajo nivel de C3 y un nivel normal de C4, aumenta la posibilidad de
una variedad de enfermedades infecciosas y de la glomerulonefritis membranoproliferativa.
En este caso, los niveles de C3 y C4 están normales, lo que sugiere que la
disminución de la función renal se debió a un proceso como la nefropatía IgA,
enfermedad por anticuerpos anti citoplasma de neutrófilos (ANCA), o enfermedad
por anticuerpos anti-membrana basal glomerular (Síndrome de Goodpasture).
Este paciente tenía varios test serológicos negativos, incluidas pruebas
específicas para la hepatitis B y C, hallazgos
que disminuyen la probabilidad de glomerulonefritis
viral. Un anticuerpo anti-DNA de doble cadena negativo hace el diagnóstico que
el diagnóstico de lupus eritematoso sistémico sea poco probable y los test para anticuerpos anti-antiproteinasa
3 y antimieloperoxidasas, en dos ocasiones separadas, disminuyen la probabilidad de que los ANCA
estuviesen involucrados en la patogenia de la enfermedad No hay mención de pruebas
serológicas para anticuerpos anti-MBG.
Ante cualquier diagnóstico de glomerulonefritis, se
deben formular dos preguntas: primero, ¿ la condición inflamatoria está limitada al riñón?, ¿o es parte de un proceso
sistémico? La presencia de manifestaciones extrarenales ayuda a reducir la
lista de diagnósticos diferenciales. Por ejemplo, un paciente podría tener un
síndrome pulmón-riñón (por ejemplo GNF ANCA-positivo o enfermedad por anticuerpos
anti-MBG), o dolor abdominal de tipo
calambres asociado con vasculitis del intestino por IgA. En este caso, el
dolor abdominal es la única pista
extrarrenal. Segundo, las manifestaciones extrarenales ¿proporcionan pistas
sobre la patogenia de la enfermedad? En este caso, la intersección de infección
y enfermedad renal agudiza el enfoque.
INFECCIÓN Y ENFERMEDAD RENAL
Algunas infecciones (por ejemplo, infección por el
virus de la hepatitis B o C, infección por el virus de la inmunodeficiencia
humana, sífilis e infección por estafilococos), causan enfermedad renal, y
algunos pueden agravar afecciones renales existentes, como la nefropatía por
IgA o enfermedad anti-MBG, o puede conducir la causa de la enfermedad renal. Este caso contiene muchas pistas.
¿Podría el paciente haberse contagiado una infección
de su esposa o nietos o durante su reciente viaje a México? La lista de posibles
transmisiones es larga. Dado que el paciente tenía enfermedad diverticular, su
dolor abdominal bajo de tipo calambre y el malestar, muy probablemente se deba
a colitis o a diverticulitis . Se comenzó un tratamiento antibiótico cuyo
espectro fue posteriormente ampliado para tener cobertura para anaerobios gramnegativos que fue lo que desarrolló en el
hemocultivo. Hay más de dos docenas de géneros de bacilos anaerobios
gramnegativos, y Bacteroides fragilis y
Fusobacterium nucleatum lideran la lista de posibilidades en este caso.
Una infección endovascular del aneurisma aórtico o de
una válvula cardíaca son posibles pero poco probable, dado la ausencia de
vegetaciones en la ecocardiografía y la región periaórtica relativamente normal
en la TC.
BACTERIEMIA GRAM-NEGATIVA Y GLOMERULONEFRITIS
Podría la bacteremia gramnegativa haber contribuido a la inmunopatogenia de la glomerulonefritis
de este paciente? La nefropatía IgA es causada por defectos de la inmunidad de
la mucosa, y la interacción entre esta
enfermedad glomerular y los trastornos intestinales están bien documentados3.
Brotes de de la nefropatía IgA pueden ocurrir de forma sincrónica con infecciones
gastrointestinales. Pacientes con vasculitis IgA (Púrpura de Henoch-Schönlein)
puede presentarse con dolor abdominal de tipo calambres. Dicho esto, una nefropatía rápidamente evolutiva por IgA
sería un diagnóstico inusual en un paciente de 71 años sin episodios previos de
hematuria macroscópica. Es posible que este paciente tuviera una glomerulonefritis
necrotizante con formación de semilunas ANCA negativo que imitaba una
glomerulonefritis ANCA-positiva.
4 Tanto la nefropatía
por IgA como la glomerulonefritis ANCA-negativa deben permanecer en el diagnóstico diferencial. En este caso.
El diagnóstico más probable en este paciente es
enfermedad anti-MBG: una causa de glomerulonefritis rápidamente evolutiva tanto en
jóvenes como en ancianos. La
enfermedad anti-MBG puede causar sangrado pulmonar pero este paciente no tenía
evidencia de hemorragia a dicho nivel. La enfermedad anti-GBM no afecta los
órganos abdominales. ¿ El dolor
abdominal tipo calambre y la bacteriemia
por gram-negativos anaerobios proporcionan información sobre el proceso de la
enfermedad en este paciente?
Las enfermedades autoinmunes ocurren como
consecuencia de múltiples factores y no de un solo factor. El paciente debe
perder tolerancia inmunológica a algún autoantígeno; específicamente, los pacientes
con enfermedad por anti-GBM, se pierde tolerancia inmunológica a un epitope
notablemente restringido al dominio no colágeno de la cadena alfa-3 del colágeno tipo IV, conocido como
alfa-3 (IV) NC1 o antígeno de Goodpasture. 5,6 Este antígeno normalmente está
oculto de la vigilancia inmune y debe someterse a un cambio estructural,o
“conformopatía autoantigénica”, para permitir su interacción con los anticuerpos anti-MBG circulantes.7
La predisposición genética y factores ambientales desempeñan
un papel en la formación de autoanticuerpos y en la disponibilidad de autoantígenos.
La enfermedad anti-MBG está marcada por
"agrupamiento espacial y temporal", 8 indicando la importancia de los
factores genéticos y del medio ambiente. La predisposición genética se basa en una asociación HLA muy fuerte.9 Los riesgos ambientales son numerosos e
incluyen el hábito de fumar cigarrillos y la infección. El caso original de Ernest
Goodpasture's (que en realidad puede haber sido un caso de glomerulonefritis
ANCA-positiva) estuvo asociado con el
brote de gripe de 1918.10 La aparición de variaciones estacionales de la
enfermedad en primavera y principios de verano sugiere desencadenantes infecciosos. En un estudio reciente, 11 67% de los
pacientes con la enfermedad anti-MBG tenían
pródromos febriles e infecciones y bacterianas debido a una variedad de bacterias
gramnegativas.
El potencial inmunopatogénico de los microbios en la
enfermedad anti-MBG ha sido probado en varios formas. Un importante epItope de
células B humanas de alpha-3 (IV) NC1 se solapa con un epítope de células T de enfermedad
murina anti-MBG, lo que sugiere que un aminoácidos es responsable crítico de la
autoinmunidad en la enfermedad anti-MBG. Cuando este aminoácido se enfrentó contra una base de datos de proteínas
microbianas, siete péptidos derivados de microbios basados en este fueron
encontrados. Anticuerpos circulantes contra estas bacterias fueron descubiertas
en circulación de pacientes con enfermedad anti-MBG.12 Tres de estos péptidos
microbianos eran de especies de
bacteroides.
La enfermedad anti-MBG de este paciente puede ser un
ejemplo de mimetismo molecular inducido por un gramnegativo anaerobio como
bacteroides u otras bacterias gramnegativas que contribuyeron a la
diverticulitis. Hay otros dos mecanismos por los qué una infección puede haber
exacerbado la enfermedad. Primero, se pueden encontrar anticuerpos anti-MBG en la
circulación durante meses o años antes de la manifestación de la enfermedad, 13
y es posible que una infección por bacteroides acelerara la producción de anticuerpos
anti-MBG. Segundo, el crítico epítope
alfa-3 (IV) NC1 debe someterse a conformopatía autoantigénica, 14 y es posible
que un medio infeccioso expusiese el antígeno oculto.
Hay otra consideración de diagnóstico en este caso.
Este paciente tenía una proteinuria mucho más marcada de lo que se esperaría en
un paciente con enfermedad anti-MBG. Una relación proteína: creatinina de 5,71
sería muy probablemente el resultado de la perturbación de los podocitos
inducidos por otra enfermedad glomerular. Por ejemplo, el paciente podría haber
tenido nefropatía membranosa concurrente asociada con cáncer causado por años
de fumar cigarrillos.
Sin embargo, este hombre, que tenía obesidad e intolerancia
a la glucosa y estaba recibiendo metformina, probablemente tuvo una nefropatía
diabética concurrente leve.
En América del Norte, hay una epidemia de diabetes y
nefropatía diabética que pueden coexistir con cualquier enfermedad
glomerular.15 Para establecer el diagnóstico
de enfermedad anti-MBG en este paciente, habría que realizar una biopsia de
riñón.
Diagnósticos presuntivo: Enfermedad anti membrana basal glomerular causando una
glomerulonefritis con semilunas.
Diverticulitis debida a Bacteroides fragilis y otras
bacterias anaerobias gramnegativas.
Podocitopatía, posiblemente debido a nefropatía
diabética leve.
DISCUSIÓN PATOLÓGICA
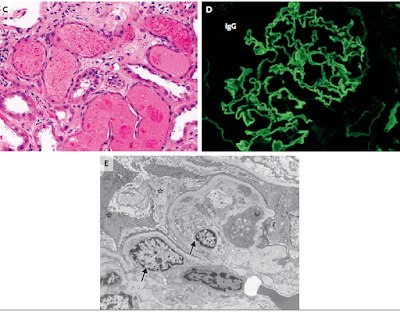
Los procedimientos de diagnóstico en este caso fue
una biopsia con aguja gruesa del riñón, un ensayo inmunosorbente ligado a
enzimas en suero (ELISA) y análisis de transferencia Western. EL examen de la
muestra de biopsia reveló 21 glomérulos, de los cuales el 19% estaban globalmente esclerosados y el 38% eran
semilunas celulares (Fig. 2A y 2B). Había necrosis segmentaria en algunos glomérulos. Cilindros de glóbulos
rojos (figura 2C), gotitas de reabsorción, y lesiones tubulares de diversos
grados de gravedad. Aproximadamente el 30% de
la corteza mostró fibrosis intersticial y atrofia tubular. Los vasos
sanguíneos mostraron leve fibrosis intimal en arterias e hialinosis arteriolar.
En conjunto, estos hallazgos muestran evidencia de una glomerulonefritis
necrotizante y con formación de semilunas.
En la microscopía de inmunofluorescencia de los
glomérulos, la membrana basal glomerular mostró brillo, global, lineal (4+)
tinción para IgG (Fig. 2D) y un patrón similar e intensidad de tinción para
kappa y lambda. Las semilunas fueron positivas para fibrina. La MBG mostró
tinción 3+ a 4+ para IgG4, 2+ a 3+ tinción para IgG1 y 1+ tinción para IgG2. La
tinción para IgG3 fue negativa. En la microscopía electrónica, el endotelio era
reactivo Había borramiento global de los procesos del pie podocitario, lo que que explica la proteinuria del
paciente. No había depósitos electrón densos (Fig. 2E). No había evidencias de
nefropatía diabética.
Figura 2 Biopsia renal.
Tinción con de ácido periódico-Schiff y hematoxilina
y eosina (paneles A y B,
respectivamente) muestran glomérulos hipercelulares con semilunas celulares
(flechas) y segmentos de necrosis (punta de flecha). Hematoxilina adicional y
la tinción con eosina (Panel C) muestra cilindros de glóbulos rojos y lesión
tubular. La microscopía de inmunofluorescencia directa (Panel D) muestra
tinción lineal brillante (4+) para IgG a lo largo de la pared capilar
glomerular. Microscopía electrónica (Panel E) muestra podocitos reactivos
(asteriscos), con borramiento de los procesos del pie y células endoteliales
reactivas (flechas). No hay depósitos electrón
densos.
Las pruebas de ELISA en suero para la detección y
cuantificación de anticuerpos contra alfa-3 (IV) NC1 fueron negativas a menos
de 2 unidades de referencia por mililitro (resultado positivo, más de 20). El análisis de Western blot para la
detección de anticuerpos contra alfa-3 (IV) NC1 fue positivo.
Los hallazgos son diagnósticos de enfermedad
anti-MBG pero con varias características inusuales. Primero, las semilunas y la
necrosis no fueron tan prominentes como estarían en un caso clásico de
enfermedad anti-MBG, en el que las semilunas son difusas, globales, y
circunferenciales, involucrando típicamente aproximadamente 75% de
glomérulos.16,17 En este caso, las semilunas involucraron menos de la mitad de
los glomérulos y eran pequeñas, lo que sugiere enfermedad transitoria o
subaguda.
En segundo lugar, el ELISA sérico fue negativo para
Anticuerpos anti-MBG, mientras que eltest má sensible, el análisis de Western blot fue positivo.
Pruebas falsas negativas ocurren en 2 a 3% de los casos de enfermedad
anti-MBG.18 En este caso, el ELISA negativo sugiere que el título del anticuerpo
era demasiado bajo para la detección por esa metodolgía.
Finalmente, este caso mostró una distribución
dominante de lasubclase IgG4. La IgG4 se considera inerte y tiene una capacidad
limitada para fijar el complemento y receptores de Fc. El dominio de IgG4 puede
haber explicado la menor gravedad y alcance de las lesiones glomerulares. A su
vez, los anticuerpos IgG4 contra alfa-3 (IV) NC1 pueden causar un ELISA falso
negativo. 19,20
En la enfermedad anti-MBG, la distribución de
subclases de IgG pueden estar asociadas
con la gravedad de la enfermedad.21
En resumen, glomerulonefritis necrotizante con
formación de semilunas asociado con un Western blot para anticuerpos
contra alfa-3 (IV)NC1 positivos es diagnóstico de enfermedad anti-MBG. La
relativamente modesta extensión y
severidad de las lesiones glomerulares y
el ELISA sérico negativo para anticuerpos anti-MBG son características que se
han descrito en presentaciones inusuales de enfermedad anti-MBG. 18,22
DISCUSIÓN DEL MANEJO
Una vez establecido el diagnóstico de la enfermedad
anti-MBG, este paciente fue tratado con
metilprednisolona intravenosa durante 3 días
consecutivos y ciclofosfamida oral por día durante 5 días, seguido de un descenso de ladosis. No hubo
evidencia de hemorragia pulmonar, pero esta posibilidad impulsó a continuar con
cinco sesiones de plasmaféresis durante los 10 días posteriores la biopsia
renal.
En los hemocultivos anaeróbicos crecieron tres
organismos: B. fragilis, Fusobacterium. necropho- ron y Peptoniphilus indolicus.
Las infecciones bacterianas fueron tratadas con éxito por vía intravenosa con ceftazidima
y metronidazol. Los hemocultivos subsiguientes
fueron negativos.
Cinco días después de la biopsia renal, el paciente
desarrolló severo dolor, junto con un recuento de leucocitos de más de 40,000 por milímetro
cúbico. La TC del abdomen reveló evidencia de diverticulitis con una pequeña perforación colónica. El
paciente inicialmente recibió un tratamiento conservador pero finalmente se
sometió a una colectomía sigmoidea y colostomía. Sus medicamentos
inmunosupresores fueron interrumpidos durante 3 días durante el período perioperatorio.
Desarrolló trombosis venosa profunda
bilateral en el postoperatorio y fue
tratado con heparina intravenosa. Durante las 2 semanas posteriores a la
biopsia renal, el paciente tenía función renal fluctuante, con un nivel de
creatinina sérica que variaba de 2.3 a 3.2 mg por decilitro. Nunca requirió
diálisis. La hospitalización del paciente duró más de 6 semanas Durante ese tiempo,
tuvo dos episodios de dehiscencia de la suturaprobablemente agravado por la
terapia con glucocorticoides, y eventualmente
curaron por segunda intención.
Nunca hubo evidencia de hemorragia pulmonar, una característica potencial
temida de la enfermedad anti-MBG que puede conducir a complicaciones graves y
ocasionalmente hasta la muerte. Hacia final de su curso hospitalario, el
paciente recibió rituximab intravenoso Su nivel de creatinina sérica
en el momento del alta fue de 2,0 mg por decilitro.
Tres meses después del alta, el paciente recibió una
segunda dosis de rituximab intravenoso.
La ciclofosfamida se detuvo después de 3 meses, y la
prednisona se redujo gradualmente durante un período de 5 meses y luego fue
descontinuada. Alpaciente se lo sometió
a una reversión exitosa de la colostomía 1 año después.
Ahora, 16 meses después de que recibió el
diagnóstico de la enfermedad anti-MBG, él está bien, con un nivel de creatinina
sérica de 1.5 mg por decilitro, y no está recibiendo actualmente medicamentos inmunosupresores
DIAGNÓSTICO ANATÓMICO
ENFERMEDAD POR ANTICUERPOS ANTIMEMBRANA BASAL
GLOMERULAR.
Case 24-2018: A
71-Year-Old Man with Acute Renal Failure and Hematuria
Ronald J. Falk,
M.D., Jad S. Husseini, M.D., Andrew Z. Fenves, M.D.,
and Ivy A.
Rosales, M.D.
NEJM
References
1. Charles
Jennette J, Falk RJ. Glomerular
clinicopathologic
syndromes. In: Gilbert SJ,
Weiner DE, eds.
Primer on kidney diseases.
7th ed.
Philadelphia: Elsevier, 2018: 162-
74.
2. Raghavan R,
Eknoyan G. Acute interstitial
nephritis: a
reappraisal and update.
Clin Nephrol
2014; 82: 149-62.
3. Coppo R. The
intestine-renal connection
in IgA
nephropathy. Nephrol Dial
Transplant 2015;
30: 360-6.
4. Falk RJ,
Jennette JC. ANCA disease:
where is this
field heading? J Am Soc
Nephrol 2010;
21: 745-52.
5. Butkowski RJ,
Langeveld JP, Wieslander
J, Hamilton J,
Hudson BG. Localization of
the Goodpasture
epitope to a novel chain
of basement
membrane collagen. J Biol
Chem 1987; 262:
7874-7.
6. Wieslander J,
Kataja M, Hudson BG.
Characterization
of the human Goodpasture
antigen. Clin
Exp Immunol 1987; 69:
332-40.
7. Hudson BG,
Tryggvason K, Sundaramoorthy
M, Neilson EG.
Alport’s syndrome,
Goodpasture’s syndrome,
and type IV collagen.
N Engl J Med
2003; 348: 2543-56.
8. Canney M,
O’Hara PV, McEvoy CM,
et al. Spatial
and temporal clustering of
anti-glomerular
basement membrane disease.
Clin J Am Soc
Nephrol 2016; 11:
1392-9.
9. Fisher M,
Pusey CD, Vaughan RW,
Rees AJ.
Susceptibility to anti-glomerular
basement
membrane disease is strongly
associated with
HLA-DRB1 genes. Kidney
Int 1997; 51:
222-9.
10. Wilson CB,
Smith RC. Goodpasture’s
syndrome
associated with influenza A2
virus infection.
Ann Intern Med 1972; 76:
91-4.
11. Gu QH, Xie LJ, Jia XY, et al. Fever and
prodromal
infections in anti-glomerular
basement
membrane disease. Nephrology
(Carlton) 2018;
23: 476-82.
12. Li JN, Jia X, Wang Y, et al. Plasma
from patients
with anti-glomerular basement
membrane disease
could recognize
microbial
peptides. PLoS One 2017; 12(4):
e0174553.
13. Olson SW,
Arbogast CB, Baker TP, et al.
Asymptomatic
autoantibodies associate
with future
anti-glomerular basement
membrane
disease. J Am Soc Nephrol
2011; 22: 1946-52.
14. Pedchenko V, Bondar O, Fogo AB, et al.
Molecular
architecture of the Goodpasture
autoantigen in
anti-GBM nephritis.
N Engl J Med
2010; 363: 343-54.
15.
O’Shaughnessy MM, Hogan SL, Poulton
CJ, et al.
Temporal and demographic trends
in glomerular
disease epidemiology in the
southeastern
United States, 1986-2015.
Clin J Am Soc
Nephrol 2017; 12: 614-23.
16. Jennette JC.
Rapidly progressive crescentic
glomerulonephritis.
Kidney Int 2003;
63: 1164-77.
17. McAdoo SP,
Pusey CD. Anti-glomerular
basement
membrane disease. Clin J Am
Soc Nephrol
2017; 12: 1162-72.
18. Ohlsson S,
Herlitz H, Lundberg S, et
al. Circulating
anti-glomerular basement
membrane
antibodies with predominance
of subclass IgG4
and false-negative immunoassay
test results in
anti-glomerular
basement
membrane disease. Am J Kidney
Dis 2014; 63:
289-93.
19. Rosales IA,
Colvin RB. Glomerular
disease with
idiopathic linear immunoglobulin
deposition: a
rose by any other
name would be
atypical. Kidney Int 2016;
89: 750-2.
20. Nasr SH,
Collins AB, Alexander MP,
et al. The
clinicopathologic characteristics
and outcome of
atypical anti-glomerular
basement
membrane nephritis. Kidney Int
2016; 89:
897-908.
21. Zhao J, Yan Y, Cui Z, Yang R, Zhao
MH. The
immunoglobulin G subclass
distribution of
anti-GBM autoantibodies
against
rHalpha3(IV)NC1 is associated with
disease
severity. Hum Immunol 2009; 70:
425-9.
22. Salama AD,
Dougan T, Levy JB, et al.
Goodpasture’s
disease in the absence of
circulating
anti-glomerular basement membrane
antibodies as
detected by standard
techniques. Am J
Kidney Dis 2002; 39: 1162-7.