Una mujer de 30 años presentó shock y necrosis de la pared abdominal después de una cesárea.
La mujer, primigávida previamente sana se
había sometido a cesárea a las 36,4 semanas de gestación después de las 34
horas de trabajo de parto, debido a la sospecha de corioamnionitis (dolor abdominal
y un recuento elevado de glóbulos blancos), taquicardia fetal y una
desaceleración prolongada en el rastreo de la frecuencia cardíaca fetal durante
el trabajo de parto aumentado por oxitocina.
La paciente había recibido atención prenatal
de rutina. En un cultivo de orina 6,5 meses antes de la admisión había
crecido estreptococos del grupo B. Una semana antes del ingreso, se produjo una
congestión sinusal transitoria, sin fiebre, náuseas, vómitos, diarrea o
disuria. Los medicamentos al ingreso incluían vitaminas prenatales, hierro y
paracetamol. La paciente no tenía alergias conocidas. Vivía con su esposo y
trabajaba en el cuidado de la salud. Ella tenía un perro y un gato; su marido
había cambiado de cama. No bebía alcohol, no fumaba, ni usaba drogas ilícitas.
Había viajado a Europa y México. Su padre había muerto de una enfermedad
cardíaca a los 59 años de edad, y una hermana había tenido dos abortos
espontáneos.
Los resultados de las pruebas de laboratorio
se muestran en la Tabla 1.
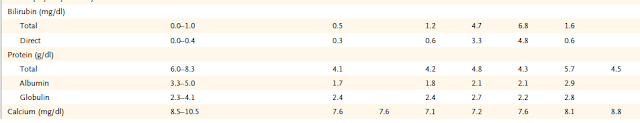
Tabla 1. Datos de laboratorio .
El análisis de orina fue normal.
Se administró
ampicilina y gentamicina antes y
durante el parto. Dio a luz un bebé varón que pesaba 3230 g; los puntajes de
Apgar de 1 y 5 minutos fueron 8 y 9, respectivamente. La placenta pesaba 480 g
(percentil 60 para la edad gestacional) y el examen patológico no reveló
anomalías graves; hubo una marcada inflamación aguda de la decidua basal
(tejido materno), con neutrófilos, eosinófilos, formación de abscesos y
necrosis, pero no hubo corioamnionitis aguda ni microorganismos.
Aproximadamente 10 horas después del parto, la
temperatura subió a 38,4 ° C y el recuento de glóbulos blancos se elevó. Se
inició la administración de clindamicina. En el cuarto día de hospitalización,
37 horas después del parto, desarrolló
disnea; la presión arterial fue de 90/50 mm Hg y el pulso 130 a 139 latidos por
minuto. Durante las siguientes 13 horas, la presión arterial sistólica
disminuyó a 70 a 79 mm Hg y se mantuvo baja a pesar de la reanimación con
líquidos; La temperatura fue de 38.1 ° C y la frecuencia respiratoria 22
respiraciones por minuto. En el examen, la paciente impresionaba enferma. Se
escuchaban rales en ambas bases pulmonares y un soplo sistólico (grado 2/6). El
abdomen estaba distendido y blando, con pocos ruidos intestinales y
sensibilidad sobre la incisión quirúrgica, que parecía limpia y seca, sin
eritema. Las extremidades estaban frías, con más de 2 + de edema. Los niveles
de glucosa en sangre, fósforo y ácido láctico eran normales, al igual que las
pruebas de coagulación; otros resultados de la prueba se muestran en la Tabla
1. Un electrocardiograma mostró un ritmo sinusal a 129 latidos por minuto, con
ondas QRS de bajo voltaje y anomalías no específicas del segmento ST. El
paciente fue trasladado a la unidad de cuidados intensivos quirúrgicos.
La tomografía computarizada (TC) del tórax y las
piernas, realizada de acuerdo con un protocolo para la evaluación de la embolia
pulmonar, no reveló evidencia de embolia pulmonar o trombosis venosa profunda.
La ecocardiografía transtorácica reveló hipocinesia difusa de ambos
ventrículos, una fracción de eyección del ventrículo izquierdo del 38%,
insuficiencia mitral y pulmonar leve, insuficiencia tricuspídea moderada y
ausencia de trombo o vegetaciones valvulares. La ecografía del abdomen mostró
una pequeña cantidad de ascitis y un derrame pleural derecho. La tomografía
computarizada del abdomen sin la administración de material de contraste mostró
un pequeño volumen de ascitis, enfisema subcutáneo, un útero de posparto, íleo
leve sin obstrucción y escasos derrames pleurales bilaterales, sin evidencia de
absceso. Los cultivos de sangre, orina y placenta obtenidos durante los
primeros 2 días fueron estériles; Los repetidos cultivos de sangre y orina
permanecieron estériles. La prueba de un hisopo nasal para detectar
Staphylococcus aureus resistente a la meticilina (SARM) fue negativa. Se inició
la administración de imipenem-cilastatina, vancomicina y dalteparina, se
continuó con la clindamicina y se suspendieron los otros antibióticos.
Durante los siguientes días, la paciente estuvo
afebril y la fracción de eyección del ventrículo izquierdo aumentó a 57%. Se
notó el drenaje de la incisión, que fue desbridada dejada abierta al quinto
día; el tejido subyacente parecía bien perfundido y viable, y la fascia estaba
intacta. En el octavo día, desarrolló
una erupción. Imipenem-cilastatina y clindamicina se suspendieron, y se inició
la administración de aztreonam y metronidazol.
En el día 12 del hospital, la temperatura subió a
39.6 ° C; La presión arterial fue de 122/52 mm Hg, el pulso 138 latidos por
minuto y la frecuencia respiratoria normal. Había una leve sensibilidad en la
incisión abdominal y un edema de 3+ en los muslos. Se drenó líquido serosanguínolento
de la incisión, pero el tejido subyacente parecía viable, sin drenaje purulento.
Los cultivos permanecieron estériles. Se interrumpió la administración de
vancomicina, aztreonam y metronidazol. En el día 13, la fiebre persistió; Había
induración de la pared abdominal, sin eritema. Los resultados de las pruebas de
laboratorio se muestran en la Tabla 1. Se transfundieron glóbulos rojos
sedimentados. La TC del abdomen y la pelvis después de la administración de
material de contraste reveló material de baja densidad en la cavidad
endometrial, tejido de realce irregular en el margen del canal endometrial,
líquido en la bolsa rectovaginal con realce en peritoneo, enfisema subcutáneo
persistente y cambios tisulares nivel de los músculos abdominales inferiores del
recto, y un colon sin haustraciones.
Se realizaron histerectomía abdominal total,
salpingooforectomía bilateral y desbridamiento de la pared abdominal;
clindamicina y doxiciclina se administraron antes de la operación. El examen
patológico de los tejidos mostró endomiometritis, con neutrófilos y
eosinófilos, necrosis y abscesos; serositis que afectaba la superficie
peritoneal uterina anterior y ambas trompas de Falopio; e inflamación aguda y
crónica, con abscesos y necrosis, de la piel y el músculo esquelético. No se
observaron organismos, y los cultivos fueron estériles. Se inició un ciclo de
10 días de clindamicina, vancomicina e imipenem-cilastatina. El desbridamiento
de la herida se realizó de forma intermitente.
En el día 18, la prueba de la mutación 1849G → T
(V617F) en JAK2 (el gen de la Janus quinasa) fue negativa. Se realizó
reconstrucción de la herida abdominal y cierre parcial. El día 25, se inició la
administración de metronidazol, doxiciclina y una combinación de piperacilina y
tazobactam, y se suspendieron otros antibióticos. Las pruebas de detección de
anticuerpos antineutrófilos citoplasmáticos (ANCA) y anticuerpos contra la
proteinasa 3 y la mieloperoxidasa fueron negativas. Los niveles sanguíneos de
lipasa y amilasa eran normales; otros resultados de la prueba se muestran en la
Tabla 1. Se administró inmunoglobulina intravenosa (dos dosis, con 7 días de
diferencia). El recuento de glóbulos blancos disminuyó gradualmente (Tabla 1).
Durante las siguientes 4 semanas, la herida fue irrigada y desbridada, se
retiró la malla biológica (utilizada en la reconstrucción de la herida
abdominal) y se aplicaron injertos de piel de los muslos de espesor parcial de tejido que cubrían el intestino.
Dos meses después del ingreso, cuando se estaba planificando
el alta hospitalaria de la paciente, comenzó un drenaje purulento en los bordes
del injerto de piel, con eritema en los márgenes y recurrencia de leucocitosis
(Tabla 1). La exploración de la herida reveló mionecrosis focal y necrosis de
los bordes del injerto de piel, que fueron desbridados.
Se obtuvieron consultas con los servicios de
inmunología y dermatología. La paciente refirió presentar sinusitis recurrente
y otitis media aguda antes de los 5 años. No había tenido erupciones o
dificultades con la curación de heridas. No había antecedentes de alergia o
inmunodeficiencia en familiares de primer grado. En el examen, los bordes de la
herida abdominal estaban rojos e indurados. Había varias pústulas superficiales
(de 3 a 4 mm de diámetro) con una base edematosa y eritematosa sobre el sitio
del injerto de piel del muslo anterior derecho y múltiples costras hemorrágicas
dispersas en ambos sitios donadores de injerto de piel. El resto del examen se
mantuvo sin cambios. Los resultados de las pruebas se muestran en la Tabla 1.
Se realizó un procedimiento diagnóstico.
DIAGNÓSTICO DIFERENCIAL
Esta paciente tenía lo que parecía ser una infección
necrotizante de tejidos blandos después
de una cesárea. Los cuatro principios de atención para las infecciones
necrotizantes son la detección temprana, el desbridamiento agresivo, la terapia
antibiótica adecuada y el apoyo fisiológico. La TC puede ser útil al evaluar
una infección necrotizante de tejidos blandos, con sensibilidad y un valor
predictivo negativo de casi el 100% .1 ¿Podemos revisar los estudios de imagen?
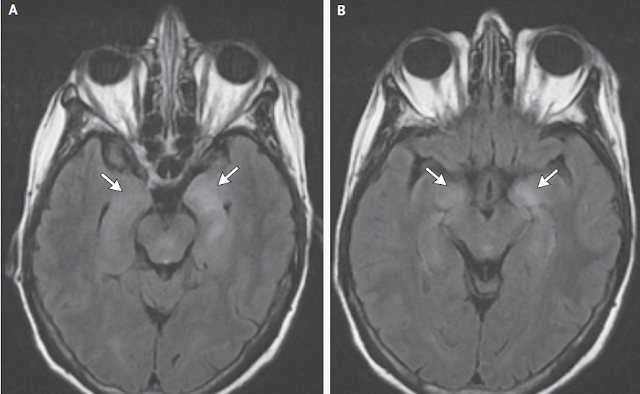
En el día 13 del hospital, la tomografía
computarizada del abdomen y la pelvis después de la administración de material
de contraste intravenoso reveló un útero posparto agrandado con una cavidad
endometrial que estaba distendida con líquido (Figura 1A). La unión
endomiometrial anterior era irregular, con realce heterogéneo (Figura 1B). Se
observaron ascitis y un realce del revestimiento peritoneal. Estos hallazgos
son compatibles con endometritis, piometra o ambos.
Figura 1.TC del Abdomen y Pelvis con la
administración de contraste.
El panel A muestra un útero posparto agrandado con
una cavidad endometrial que está distendida con líquido (flecha). El panel B
muestra una unión endometrial irregular y de realce heterogéneo (punta de
flecha).
El manejo de infecciones necrotizantes de tejidos
blandos solamente con antibióticos se
asocia con tasas de mortalidad que se acercan a casi el 100%. La exploración
quirúrgica temprana se asocia con tasas de mortalidad más bajas (20 a 50%). 3,4
Sin embargo, la mortalidad en casos severos como éste se acerca al 60%, y la
enfermedad puede dejar a los pacientes severamente debilitados. Los
procedimientos intraoperatorios de "segunda mirada" deben realizarse
dentro de las 12 a 24 horas posteriores al desbridamiento, para garantizar el
control quirúrgico de la infección.
Ésta paciente fue llevada al quirófano con urgencia
y se descubrió que tenía un útero no viable y mionecrosis con purulencia en la
vaina del recto. El tercio inferior del músculo recto y la vaina fueron
removidos. La herida se exploró y se dejó abierta, y se aplicó un vendaje
temporal asistido por vacío; Había planes para exploraciones en serie y
desbridamientos. Resultó inusual no encontrar evidencia de bacterias en una
paciente con un proceso necrotizante tan severo.
Se realizaron desbridamientos en serie a medida que
la mionecrosis continuaba progresando. La mionecrosis eventualmente se
desaceleró y se detuvo. Durante este proceso, nos preguntamos si la paciente
tenía una deficiencia inmunológica; se obtuvieron consultas de hematología e inmunología,
y se encontró que la paciente tenía un nivel bajo de IgG en sangre. Recibió dos
dosis de inmunoglobulina intravenosa, con una disminución en el grado de
leucocitosis a 8900 células por milímetro cúbico.
Una vez que se detuvo la necrosis, realizamos una
reconstrucción parcial de la pared abdominal con el uso de una malla biológica
para evitar una mayor retracción fascial lateral, seguida de un injerto de piel
de grosor dividido con un excelente crecimiento del injerto durante la semana
siguiente. Sin embargo, a medida que se acercaba el día de su alta
hospitalaria, la leucocitosis volvió y el injerto comenzó a aparecer necrótico.
Consultamos los servicios de enfermedades infecciosas, inmunología y
dermatología.
El diagnóstico diferencial inicial del servicio de
enfermedades infecciosas incluyó la recurrencia de una infección necrotizante
de tejidos blandos, una infección local de la herida en un huésped con
deterioro inmunológico y un absceso pélvico.
INFECCIÓN NECROTIZANTE DE TEJIDOS BLANDOS
Las infecciones necrotizantes de tejidos
blandos (también conocida como fascitis necrotizantes) 5 son una complicación
postparto rara pero bien conocida que se ha analizado previamente.6 La mayoría
de estas infecciones son polimicrobianas (tipo I), típicamente en pacientes
inmunocomprometidos y postquirúrgicos, o son debidas a un solo patógeno
bacteriano (tipo II). La infección necrotizante de tejidos blandos de tipo II
generalmente involucran a los estreptococos del grupo A, pero cada vez más,
los SAMR, los estreptococos del grupo B,
la klebsiella u otras bacterias están involucradas, probablemente debido a la
aparición de nuevos factores de virulencia.7 Las infecciones necrotizantes de tejidos blandos que involucran especies de
clostridios (tipo III) también ocurre, al igual que otros tipos de infección no
clasificados, como los que involucran a Vibrio vulnificus. Las características
patológicas incluyen necrosis de la fascia y otros tejidos blandos, trombosis,
numerosas bacterias y una escasez de células inflamatorias.
Los signos y síntomas de infección necrotizante de
tejidos blandos, muchos de los cuales tuvo este paciente, incluyen fiebre,
taquicardia, hipotensión, eritema con induración que se extiende más allá del
área afectada, dolor desproporcionado a la lesión visible, ampollas, crepitación,
gas en eltejido subcutáneo, equimosis, cambio de coloración de la piel y
necrosis. Un diagnóstico que se realiza sobre la base de características
clínicas tiene baja sensibilidad. Los hallazgos de laboratorio son
inespecíficos, pero comúnmente incluyen un recuento elevado de glóbulos blancos
y un bajo nivel de sodio en suero. Se han propuesto reglas de predicción
basadas en los hallazgos de laboratorio, pero se han sometido a una validación
prospectiva limitada y no se utilizaron en este caso. 5,8
Este caso tenía varias características atípicas. La
presentación inicial fue inusual, ya que la infección necrotizante postparto se
produce típicamente en los primeros días después del parto (4,9), mientras que
en este paciente ocurrió 12 días después del parto; no se identificaron
organismos por examen patológico, tinciones o cultivos (aunque esto podría
haber sido un reflejo de la terapia antibiótica temprana); y se observó una
inflamación aguda marcada en el examen anatomopatológico. Además, la mayoría de
los pacientes mejoran dramáticamente dentro de las 24 a 48 horas posteriores al
desbridamiento, pero esta paciente tenía leucocitosis y fiebre persistente.
Finalmente, la mayoría de las recaídas de las infecciones necrotizantes de
tejidos blandos ocurren horas o días después del desbridamiento, y las recaídas
tardías, como se ve en este caso, son extremadamente raras.
No obstante, en vista de los indicadores claros para
la infección necrotizante de tejidos blandos, un aumento de la temperatura, un
alto recuento de glóbulos blancos, aumento del flujo, eritema, expansión de la
induración y dolor fuera de proporción con el examen, coincidimos con los
planes para la exploración quirúrgica de emergencia y se recomienda el aporte
adicional de los servicios de dermatología e inmunología.
Se consultó al servicio de inmunología para tratar
la mala cicatrización de la herida en esta paciente. Un diagnóstico unificador
debe explicar la extensa necrosis e inflamación en el contexto clínico del
embarazo y un síndrome viral reciente, las altas temperaturas intermitentes y
los hallazgos de laboratorio de leucocitosis e hipogammaglobulinemia. Como un
intento de la explicación del cuadro de esta paciente se consideraron la
insuficiencia vascular localizada, las dermatosis neutrofílicas y otros
procesos autoinmunes o inmunodeficiencia.
COMPROMISO VASCULAR
El compromiso vascular puede deberse a
trombosis, vasculitis u otro daño a los vasos sanguíneos que se desencadena por
infección, trauma, aterosclerosis o inflamación mediada por el sistema
inmunitario. El examen patológico del útero confirmó la presencia de
tromboembolia en los vasos uterinos y hemorragia en la pared, con marcada
eosinofilia. Entre las vasculitis, la patergia (necrosis de los tejidos en los
sitios de cirugía o traumatismo menor) y la afectación extracutánea son características
de la enfermedad de Behçet. Sin embargo, la ausencia de lesiones típicas
mucocutáneas y la ausencia de vasculitis en los tejidos necróticos no apoyan
este diagnóstico. Las vasculitis asociadas a ANCA se pueden descartar por el
análisis ANCA negativo y la ausencia de vasculitis.
HIPOGAMMAGLOBULINEMIA
Al inicio de la admisión de este paciente, los
niveles totales de IgG e IgM eran bajos, con un componente IgG kappa M y un
nivel bajo de IgA normal. El bajo nivel de albúmina aumentó la posibilidad de
que las inmunoglobulinas pudieran haberse perdido, quizás en los tejidos
necróticos. Otra explicación es la disminución de la síntesis de
inmunoglobulina debido a una mala nutrición y una enfermedad grave.
Alternativamente, la hipogammaglobulinemia podría deberse a una
inmunodeficiencia primaria, como la inmunodeficiencia común variable (CVID). La paciente tenía
antecedentes de sinusitis y otitis media en la infancia, pero no tenía
antecedentes de infecciones recurrentes que sugirieran una CVID. El diagnóstico
de CVID en pacientes con niveles reducidos de inmunoglobulinas se realiza solo
después de que se hayan descartado otras causas de hipogammaglobulinemia (por
ejemplo, timoma, linfoma, enteropatía con pérdida de proteínas, proteinuria,
desnutrición y uso de medicamentos inmunosupresores). Este paciente no tenía
evidencia de timoma o linfoma en la TC. Otras inmunodeficiencias primarias que
afectan la función de los neutrófilos, como la enfermedad granulomatosa
crónica, parecían improbables en vista de la ausencia de antecedentes de piel y
otras infecciones y su presentación en adultos. Recibió dos infusiones de
inmunoglobulina intravenosa, con una disminución en el recuento de glóbulos
blancos, lo que sugiere que puede haber proporcionado algún beneficio.
DERMATOSIS NEUTROFILICAS
Patergia asociada con una dermatosis
neutrofílica podría explicar la necrosis masiva en esta paciente, porque los
órganos y tejidos afectados habían sido traumatizados ya sea por cesárea o por
embarazo. La patergia podría explicar la participación de tejidos y órganos
anatómicamente adyacentes pero con desarrollo diferente con diferentes
suministros vasculares. Entre las dermatosis neutrofílicas, este caso se ajusta
mejor al síndrome de Sweet, que puede estar asociado con una infección
respiratoria superior precedente o con el embarazo, así como con infiltrados
eosinofílicos. En las dermatosis neutrofílicas, la infiltración de las diversas
células inflamatorias y sus citoquinas liberadas pueden afectar la función del
suministro vascular, con trombosis y hemorragia a menudo descritas, como lo
fueron en este caso. Una búsqueda en la literatura reveló algunos informes de
casos de síndrome de Sweet en pacientes con trastornos de inmunodeficiencia
tales como CVID.10-12
RESUMEN
Recomendamos la revisión de las muestras
patológicas anteriores del paciente en busca de evidencia de infiltrados
neutrofílicos o insuficiencia vascular localizada. También recomendamos la
evaluación inmunológica, incluida la evaluación de los subconjuntos de células
T y las pruebas repetidas para determinar los niveles de inmunoglobulina
después de que la paciente se haya recuperado de la enfermedad aguda, así como
el tratamiento con glucocorticoides sistémicos si los cultivos siguieron siendo
negativos y su condición no mejorara.
dermatológico se limitó al síndrome
necrotizante (mionecrótico) de Sweet.13
SÍNDROME DE SWEET
El síndrome de Sweet (dermatosis neutrofílica febril
aguda) se caracteriza por la presencia de dos hallazgos principales, ambos de los
cuales se observaron en este paciente: la aparición abrupta de lesiones
cutáneas edematosas eritematoso-violáceas, y el hallazgo histopatológico de
edema dérmico superficial y un denso infiltrado neutrofílico dérmico. Al menos
dos de los cuatro criterios menores también deben estar presentes para el
diagnóstico. Estos incluyen fiebre alta y leucocitosis, ambos de los cuales
esta paciente tenía; los otros dos criterios son una respuesta rápida a los
glucocorticoides y una condición o exposición subyacente asociada. 14 Las
afecciones asociadas incluyen el cáncer, especialmente los cánceres
hematológicos, que son las afecciones más comunes asociadas con el síndrome de
Sweet en adultos; infecciones, particularmente infecciones respiratorias
superiores y gastrointestinales, pero también infecciones con el virus de la
inmunodeficiencia humana; medicamentos, especialmente el factor estimulante de
colonias de granulocitos y el ácido retinoico all trans, aunque se han
informado muchos otros; enfermedades inflamatorias del intestino; y el
embarazo. 15,16 Esta paciente tenía dos posibles desencadenantes para el
síndrome de Sweet: una infección de las vías respiratorias superiores y el
embarazo.
En el examen de este paciente, observamos placas
y edematosas y eritematosas distintivas con purulencia muy superficial
(Figura 2A en sus muslos sobre los sitios donantes de injerto. El síndrome de
Sweet se distingue de otras dermatosis neutrofílicas (enfermedad de Behçet,
pioderma gangrenoso y el síndrome de
artritis dermatosis asociada con el intestino) por la aparición de lesiones
cutáneas y la presencia de síntomas sistémicos, así como la afectación
extracutánea, que incluye artritis, artralgias, mialgias. Meningitis aséptica,
afectación ocular y, en raras ocasiones, infiltración neutrofílica de los
pulmones, huesos, riñones, músculos o páncreas. 17,18 Las lesiones en este
paciente fueron consistentes con las lesiones en pacientes con síndrome de
Sweet y, junto con la enfermedad sistémica. Los síntomas y la afectación
extracutánea, apoyan fuertemente este diagnóstico.
Figura 2 Fotografías clínicas del paciente.
Dos meses después del ingreso, el sitio donante de
injerto de piel en la pierna derecha (Panel A) tenía placas edematosas,
eritematosas con purulencia superficial, hallazgos típicos del síndrome de
Sweet. Después de que se inició la administración de prednisona en dosis altas,
el injerto abdominal se volvió necrótico (Panel B). Cinco meses después de que
la paciente fue dada de alta del hospital, la piel quedó completamente curada
(Panel C).
Hay muchos informes de síndrome de Sweet en el
embarazo, todos en pacientes en el primer o segundo trimestre, en contraste con
la presentación de nuestra paciente, y la mayoría en pacientes primigrávidas15,16.
El parto generalmente resulta en la resolución. Unos pocos pacientes tuvieron
brotes posparto o síndrome de Sweet recurrente junto con embarazos posteriores.
La afectación de los pulmones, los riñones y las superficies mucocutáneas se
desarrolló en una paciente, que mejoró después del parto y el tratamiento con
prednisona.19 El proceso inflamatorio que conduce a la necrosis de la piel y
los tejidos blandos adyacentes a la herida quirúrgica de este paciente, sin una
fuente microbiana y sin respuesta al tratamiento con antibióticos sin respuesta
a la expansión del desbridamiento, es característico de la patergia, que es un
hallazgo clínico importante en las dermatosis neutrofílicas. La patergia puede
ocurrir en los sitios de punción vascular y limita el diagnóstico diferencial a
la categoría de dermatosis neutrofílicas. Evitar el desbridamiento adicional es
crítico si esta paciente realmente tiene el síndrome de Sweet, ya que el trauma
repetido exacerba la condición.
En resumen, la aparición de las lesiones en los
muslos, las altas temperaturas, la leucocitosis con neutrofilia, la patología
quirúrgica y los sitios de injerto y los infiltrados inflamatorios neutrófilos
en el examen patológico de los tejidos sugieren el síndrome de Sweet en este
caso. El proceso se extiende a los tejidos profundos, causando necrosis de
tejidos blandos y músculos e imitando una infección necrotizante de los tejidos
blandos, una condición que hemos denominado síndrome de Sweet necrotizante.13
Es importante descartar una afección asociada, como un cáncer hematológico.
Para descartar infecciones atípicas, obtuvimos una
muestra de biopsia de una lesión de muslo para el examen histológico y el
cultivo. También les pedimos a nuestros colegas en dermatopatología que
revisaran las muestras quirúrgicas anteriores para ver si existían
características compatibles con el síndrome de Sweet.
DIAGNOSTICO CLÍNICO PRESUNTIVO:
INFECCIÓN NECROTIZANTE DE TEJIDOS BLANDOS
VERSUS SÍNDROME DE SWEET CON AFECTACIÓN EXTRACUTÁNEA Y NECROSIS DE
TEJIDOS BLANDOS Y MÚSCULOS.
DISCUSION PATOLOGICA
La placenta se examinó inicialmente debido a
un recuento elevado de glóbulos blancos durante el parto. No hubo
corioamnionitis ni reacción inflamatoria fetal. En cambio, se observó una
inflamación aguda llamativa, con neutrófilos, eosinófilos y formación de
abscesos, en la decidua basal, con zonas adyacentes de necrosis (Figura 3).
Figura 3 Características patológicas de la placenta
(hematoxilina y eosina).
Un corte representativo de la placenta muestra
inflamación aguda, con formación de abscesos en la decidua basal (Panel A,
asterisco y Panel B) y zonas adyacentes de necrosis (Panel A, flecha; y Panel
C).
La inflamación era inusual ya que se limitaba a la
superficie materna de la placenta y no afectaba al parénquima placentario. La
tinción para organismos (bacterias, hongos y bacilos ácido-alcohol resistentes)
fue negativa.
El útero y el músculo recto se examinaron
inicialmente debido a la preocupación por la infección. El examen general
reveló necrosis que afectó a casi toda la mitad anterior del útero. Examen microscópico
(Figura 4A, 4B y 4C), revelaron grandes áreas de formación de abscesos con
neutrófilos y eosinófilos intactos y fragmentados. El músculo liso miometrial y
el músculo esquelético del recto mostraron una inflamación aguda extensa con
múltiples focos de mionecrosis. La tinción para bacterias y hongos fue
negativa.
La revisión de la muestra de biopsia de piel (Figura
4D y 4E) mostró una epidermis intacta. Había edema dérmico papilar y un
infiltrado inflamatorio superficial y medio dérmico compuesto predominantemente
de neutrófilos maduros y eosinófilos. Las tinciones y cultivos para los
organismos fueron negativos.
Figura 4 Características patológicas del útero,
tejidos blandos y piel (hematoxilina y eosina).
En el Panel A, grandes áreas de formación de
abscesos (asterisco) y vasos sanguíneos trombosados adyacentes (flecha)
afectan al útero anterior. El músculo liso miometrial (Panel B) y el músculo
esquelético del recto (Panel C) muestran una inflamación aguda extensa, con
múltiples focos de mionecrosis. En el Panel D, un espécimen de biopsia por
punción de la piel muestra una epidermis intacta sin ulceración, con edema
dérmico papilar y con un infiltrado inflamatorio superficial y medio dérmico.
El infiltrado inflamatorio dérmico está compuesto predominantemente por
neutrófilos maduros (Panel E).
Las características histológicas comunes a todas las
muestras incluían un infiltrado inflamatorio denso compuesto de neutrófilos y eosinófilos,
formación de abscesos y necrosis tisular en las muestras extracutáneas. Aunque
la primera consideración fue un proceso infeccioso, particularmente bacterias
piógenas, el tejido estéril enviado desde el quirófano siempre fue negativo
para el cultivo y no se observaron organismos en las secciones histológicas.
Las dermatosis neutrofílicas se caracterizan
histológicamente por un infiltrado neutrofílico estéril, que puede ser muy
denso y puede asociarse con daño tisular extenso.20 Aunque las dermatosis
neutrofílicas suelen estar limitadas a la piel, se ha informado de compromiso
extracutáneo en casi todos los órganos del cuerpo. , 18
La ausencia de ulceración epidérmica y vasculitis,
así como el aspecto clínico de las lesiones cutáneas de este paciente,
argumentan contra el pioderma gangrenoso y son características compatibles con
el síndrome de Sweet. Los hallazgos en la placenta, el útero y el músculo recto
fueron compatibles con el síndrome de Sweet con afectación extracutánea.
DISCUSIÓN DEL MANEJO
El síndrome de Sweet tiende a resolverse
espontáneamente durante un período de semanas a meses, especialmente si el
desencadenante subyacente se trata o se elimina. Las recurrencias ocurren en
aproximadamente el 30% de los casos y en hasta el 50% de los casos asociados
con un cáncer hematológico.21 Los antibióticos no son efectivos a menos que el
desencadenante sea una infección bacteriana. La administración de prednisona en
dosis altas (generalmente de 1 a 2 mg por kilogramo de peso corporal por día)
es el tratamiento de primera línea y también es una prueba de diagnóstico;
conduce a una mejora en las características clínicas y las anomalías de
laboratorio dentro de las 24 a 48 horas. Una vez que el paciente se ha
estabilizado, la dosis se reduce gradualmente durante un período de varias
semanas. Otros agentes que son efectivos incluyen dapsona, ciclosporina, yoduro
de potasio, colchicina, alopurinol y talidomida. La inmunoglobulina intravenosa
se ha utilizado principalmente en casos pediátricos asociados con
inmunodeficiencia y puede haber sido transitoriamente efectiva en este
paciente.
El tratamiento con dosis altas de glucocorticoides
puede causar una cicatrización tardía de la herida e infecciones, especialmente
cuando los pacientes tienen inmunosupresión subyacente o heridas que han sido
desbridadas. La administración de ciclosporina se puede agregar en pacientes
que tienen heridas que requieren injertos, para prevenir la pérdida del
injerto.13 La ciclosporina produce una respuesta rápida, tiene pocos efectos
secundarios en los ciclos cortos y en estudios en animales produce menos
deterioro de la cicatrización que los glucocorticoides. .22 En este paciente,
con grandes injertos de piel e hipogammaglobulinemia, recomendé un tratamiento
inicial con ciclosporina y prednisona.
El paciente fue tratado con 120 mg de prednisona
diariamente, disminuyendo rápidamente a 60 mg. La fiebre y la leucocitosis
mejoraron, pero persistió la patología en los sitios de la herida, con falla
del injerto (Figura 2B). La administración de ciclosporina se inició después de
10 días de tratamiento con prednisona y la prednisona se redujo gradualmente.
SERVICIO DE CIRUGÍA: se realizó una repetición del
injerto de piel. La mitad inferior del músculo recto y la vaina se volvieron a
escindir debido a la mionecrosis recurrente. El injerto fue exitoso y la
paciente fue dada de alta a su casa después de 12 semanas de hospitalización.
Ella requerirá cirugía plástica reconstructiva de la pared abdominal (Figura
2C).
SERVICIO DE ALERGIA E INMUNOLOGÍA: La administración
de agentes inmunosupresores se redujo y se suspendió 6 semanas después del
alta, sin recurrencia de las lesiones cutáneas. Un mes después, el paciente fue
atendido en la clínica de alergia e inmunología para la evaluación de la
hipogammaglobulinemia. Hubo niveles bajos continuos de IgG, IgA e IgM; tetanos
protectores, difteria y títulos de anticuerpos neumocócicos; y un nuevo
componente IgG lambda M de 0.03 g por decilitro. La citometría de flujo de la
sangre reveló subconjuntos de células T normales, con 5% de células B CD19 +.
Pensamos que la hipogammaglobulinemia persistente en
este paciente con inmunosupresión reciente era muy probablemente secundaria a
su enfermedad y medicamentos inmunosupresores; los diagnósticos diferenciales
incluyeron gammapatía monoclonal y CVID, aunque los títulos de anticuerpos
específicos suelen ser bajos en los casos de CVID. Como no hubo evidencia de
infecciones graves recurrentes o infecciones con organismos inusuales,
decidimos repetir la evaluación más adelante. Un año después de la admisión de la
paciente, los niveles de todas las inmunoglobulinas son normales y no existe un
componente M. Por lo tanto, no hay evidencia de un trastorno de
inmunodeficiencia. La paciente se siente bien, está completamente activa y es
capaz de cuidar a su hijo, y está a la espera de una reconstrucción quirúrgica
plástica de la pared abdominal.
SERVICIO DE PATOLOGÍA: Como patóloga, me pregunto si
hubiera sido posible hacer este diagnóstico antes o considerarlo en el futuro
cuando veamos lesiones necrotizantes de tejidos blandos sin evidencia de
infección.
Esta placenta era muy inusual. Nunca antes había
visto un absceso en el lado materno de la placenta. Discutimos el caso con los
cuidadores del paciente, y la sospecha clínica de infección fue tan alta que no
consideramos seriamente diagnósticos alternativos. Dado que los hallazgos no
eran consistentes con una infección ascendente típica de la placenta, y como
había numerosos eosinófilos, me pregunté acerca de una infección parasitaria.
Para los dermatopatólogos, el síndrome de
Sweet siempre se considera cuando hay un infiltrado cutáneo neutrofílico denso
en un paciente febril con cultivos estériles. Para patólogos generales, este
diagnóstico rara vez se consideraría, por dos razones. Primero, el síndrome de
Sweet rara vez se presenta con manifestaciones extracutáneas tan extensas, y
que yo sepa, no ha habido informes de afectación placentaria. En segundo lugar,
las manifestaciones cutáneas en este paciente aparecieron después de la
afectación de otro órgano, lo cual es inusual. Creo que la lección para los
patólogos es tener en cuenta que el síndrome de Sweet, aunque es principalmente
un trastorno de la piel, puede afectar a otros órganos, por lo que en un caso
con un infiltrado neutrofílico denso y sin evidencia de infección, considere
este diagnóstico.
DIAGNOSTICO ANATOMICO
SÍNDROME DE SWEET, CON AFECTACIÓN EXTRACUTÁNEA
NECROTIZANTE EXTENSA (TEJIDOS BLANDOS, MÚSCULO ESQUELÉTICO, ÚTERO Y PLACENTA).
Traducción de:
“A 30-Year-Old
Woman with Shock and Abdominal-Wall Necrosis after Cesarean Section”
Marc A. de Moya,
M.D., Johnson T. Wong, M.D., Daniela Kroshinsky, M.D., M.P.H., Gregory K.
Robbins, M.D., M.P.H., Anuradha S. Shenoy-Bhangle, M.D., and Devon C. Gimbel,
M.D.
N Engl J Med
2012; 367:1046-1057September 13, 2012
References
1) Zacharias
N, Velmahos GC, Salama A, et al. Diagnosis
of necrotizing soft tissue infections by computed tomography. Arch Surg
2010;145:452-455
CrossRef | Web
of Science
.
2) Menias CO, Elsayes KM, Peterson CM,
Huete A, Gratz BI, Bhalla S. CT of pregnancy-related complications. Emerg
Radiol 2007;13:299-306
CrossRef
.
3) McHenry CR, Piotrowski JJ, Petrinic D,
Malangoni MA. Determinants of mortality for necrotizing soft-tissue infections.
Ann Surg 1995;221:558-565
CrossRef | Web
of Science | Medline
.
4) Anteby EY, Yagel S, Hanoch J, Shapiro
M, Moses AE. Puerperal and intrapartum group A streptococcal infection. Infect
Dis Obstet Gynecol 1999;7:276-282
CrossRef |
Medline
.
5) Anaya DA, Dellinger EP. Necrotizing
soft-tissue infection: diagnosis and management. Clin Infect Dis
2007;44:705-710
CrossRef | Web
of Science | Medline
.
6) Case Records of the Massachusetts
General Hospital (Case 33-2009). N Engl J Med 2009;361:1689-1697
Full Text | Web
of Science | Medline
.
7) Wong CH, Chang HC, Pasupathy S, Khin
LW, Tan JL, Low CO. Necrotizing fasciitis: clinical presentation, microbiology,
and determinants of mortality. J Bone Joint Surg Am 2003;85:1454-1460
Web of Science |
Medline
.
8) Wong CH, Khin LW, Heng KS, Tan KC, Low
CO. The LRINEC (Laboratory Risk Indicator for Necrotizing Fasciitis) score: a
tool for distinguishing necrotizing fasciitis from other soft tissue
infections. Crit Care Med 2004;32:1535-1541
CrossRef | Web
of Science
.
9) Gonzalez
Castro A, Rodriguez-Borregan JC, Obeso T, Castellanos A, Perez-Ceballos A,
Sesmero JR. Necrotizing
fasciitis after cesarean section. Arch Gynecol Obstet 2008;277:579-581
CrossRef | Web
of Science
.
10) Haliasos E, Soder B, Rubenstein DS,
Henderson W, Morrell DS. Pediatric Sweet syndrome and immunodeficiency
successfully treated with intravenous immunoglobulin. Pediatr Dermatol
2005;22:530-535
CrossRef | Web
of Science
.
11) Lipp KE, Shenefelt PD, Nelson RP Jr,
Messina JL, Fenske NA. Persistent Sweet's syndrome occurring in a child with a
primary immunodeficiency. J Am Acad Dermatol 1999;40:838-841
CrossRef | Web
of Science
.
12) O'Regan GM, Ho WL, Limaye S, Keogan MT,
Murphy GM. Sweet's syndrome in association with common variable
immunodeficiency. Clin Exp Dermatol 2009;34:192-194
CrossRef | Web
of Science
.
13) Kroshinsky D, Alloo A, Rothschild B, et
al. Necrotizing Sweet syndrome: a new variant of neutrophilic dermatosis
mimicking necrotizing fasciitis. J Am Acad Dermatol 2012 March 23 (Epub ahead
of print).
.
14) Sweet RD. An acute febrile neutrophilic
dermatosis. Br J Dermatol 1964;76:349-356
CrossRef | Web
of Science | Medline
.
15) Cohen PR. Pregnancy-associated Sweet's
syndrome: world literature review. Obstet Gynecol Surv 1993;48:584-587
CrossRef
.
16) Cohen PR. Sweet's syndrome -- a
comprehensive review of an acute febrile neutrophilic dermatosis. Orphanet J
Rare Dis 2007;2:34-34
CrossRef | Web
of Science
.
17) Marie I, Levesque H, Joly P, et al.
Neutrophilic myositis as an extracutaneous manifestation of neutrophilic
dermatosis. J Am Acad Dermatol 2001;44:137-139
CrossRef | Web
of Science
.
18) Vignon-Pennamen MD. The extracutaneous
involvement in the neutrophilic dermatoses. Clin Dermatol 2000;18:339-347
CrossRef | Web
of Science
.
19) Lopez-Sanchez
M, Garcia-Sanchez Y, Marin AP. An
unusual evolution of a pregnancy-associated Sweet's Syndrome. Eur J Obstet
Gynecol Reprod Biol 2008;140:283-285
CrossRef | Web
of Science
.
20) Lear JT, Atherton MT, Byrne JP.
Neutrophilic dermatoses: pyoderma gangrenosum and Sweet's syndrome. Postgrad
Med J 1997;73:65-68
CrossRef | Web of Science | Medline
.
21) Wallach D, Vignon-Pennamen MD. From acute
febrile neutrophilic dermatosis to neutrophilic disease: forty years of
clinical research. J Am Acad Dermatol 2006;55:1066-1071
CrossRef | Web
of Science
.
22) Nemlander
A, Ahonen J, Wiktorowicz K, et al. Effect of cyclosporine on wound healing. Transplantation
1983;36:1-6
CrossRef | Web of Science