Un hombre de 39 años con un diagnóstico reciente de
infección por el virus de la inmunodeficiencia humana (VIH) fue trasladado al hospital desde otro hospital debido a fiebre,
sudores y psicosis.
El paciente había estado bien hasta 4 meses antes de
la admisión, cuando comenzó con fiebre con temperaturas de hasta 40.6 °C,
sudores nocturnos y escalofríos. Durante los siguientes 3 meses, se presentaron
anorexia, tos no productiva y pérdida de peso involuntaria (7 a 14 kg),
asociada a saciedad precoz, ardor epigástrico que mejoraba con la ingesta y
dolor abdominal intermitente, leve y con cólicos. Se administraron dos ciclos
de antibióticos, sin mejoría.
Seis días antes de la admisión, el paciente fue
visto en el departamento de emergencias de un hospital. La evaluación fue
negativa; se le realizó una prueba cutánea para tuberculosis y se le dio el
alta. Al día siguiente, vio a su internista. La tomografía computarizada (TC)
de abdomen, después de la administración de material de contraste, reveló una
masa de paredes gruesas cerca del duodeno (7 cm por 2,2 cm, con aire en el
centro), ganglios linfáticos diseminados cerca de la porta hepática, vesícula
biliar con pared engrosada y esplenomegalia leve (13.5 cm). El paciente fue
admitido en un hospital.
En el examen, el paciente estaba alerta, orientado,
cooperativo y delgado, con escalofríos. La temperatura era de 38.5 °C, la
presión sanguínea 135/76 mm Hg, el pulso 106 latidos por minuto, la frecuencia
respiratoria de 20 respiraciones por minuto y la saturación de oxígeno 93%
mientras respiraba aire ambiente. Había dolor leve en el epigastrio y el
cuadrante superior derecho, sin induración en el sitio de la prueba cutánea
para la tuberculosis. El hematocrito era 31.9%, el recuento de leucocitos 4600
por milímetro cúbico (con 75% de neutrófilos y 14% de linfocitos), el nivel de
fosfatasa alcalina en sangre 233 U por litro y el nivel de aspartato
aminotransferasa 47 U por litro. Se administraron antibióticos de amplio
espectro y pantoprazol intravenoso.
Durante los siguientes 2 días, la temperatura
aumentó a 39.4 ° C y las heces se volvieron negras y alquitranadas; el hematocrito
descendió a 28.3%. Una resonancia
magnética (RMN) de abdomen, después de la administración de contraste, reveló
una lesión de paredes gruesas contigua a la pared posteromedial del duodeno,
distensión leve de la vesícula biliar y una pequeña cantidad de líquido adyacente
a la vesícula biliar. Se transfundió una unidad de glóbulos rojos. El cuarto
día, la esofagogastroduodenoscopia reveló una úlcera duodenal y gastritis. La
prueba de anticuerpos contra el VIH fue positiva. Esa noche, el paciente presentó
un estado de agitación. Cuando se lo interrogó sobre qué había sentido dijo
haber presentado una pesadilla en la que se estaba muriendo. El quinto día de
internación impresionaba tenso, hablaba con los dientes y los puños apretados y
los ojos fijos mirando hacia adelante; a partir de allí desarrolló delirios
religiosos. Se realizó una consulta psiquiátrica y se recetó olanzapina. El
paciente fue transferido a otro hospital de mayor complejidad.
El paciente había tenido herpes zoster del dermatoma
torácico 4 años antes del ingreso y nuevamente 3 meses antes del ingreso. Él no
tenía alergias conocidas. Había inmigrado a los Estados Unidos desde un país
caribeño más de una década antes. Según los informes, las pruebas de VIH y
sífilis habían sido negativas 11 años antes de la admisión. Tenía antecedentes
de abuso de alcohol y no fumaba ni usaba drogas intravenosas. Vivía con su
pareja y sus hijos. Tenía niños biológicos que vivían en su país natal. Como
mascotas tenía un pájaro y una tortuga en su hogar. Sus padres y hermanos
estaban sanos, sin antecedentes familiares de enfermedad psiquiátrica.
Al ingreso, el paciente estaba despierto pero
inicialmente no respondía. La temperatura era 37,6 ° C y la presión sanguínea
148/81 mm Hg; otros signos vitales y el resto del examen físico fueron
normales. Presentaba agitación y continuó teniendo delirios extraños. Se le
administró olanzapina y haloperidol. En un examen psiquiátrico más tarde ese mismo
día, la agitación se había resuelto. No estaba orientado en la fecha y se
determinó que no tenía la capacidad de firmar un alta voluntaria que solicitó
en contra de los consejos médicos. Se comenzó un acompañamiento de veinticuatro
horas. Los niveles sanguíneos de plaquetas, bilirrubina, amilasa, lipasa,
calcio, fósforo, magnesio, vitamina B12, ácido fólico, tirotropina y amoníaco
fueron normales, al igual que los resultados de las pruebas de función renal y
análisis de orina; las pruebas para drogas tóxicas y los virus de la hepatitis
B y C fueron negativos. Otros resultados de prueba se muestran en la Tabla 1
Tabla 1 Datos de laboratorio.
En el examen psiquiátrico formal en el segundo día,
el paciente tenía un comportamiento desorganizado y reservado, afectividad
plana, bloqueo de pensamiento y delirios nihilistas extraños, incluyendo
declaraciones de que había muerto y estaba muerto. Aunque el examen cognitivo
fue de alcance limitado debido a la falta de cooperación del paciente, reveló
déficits en la atención (incapacidad para nombrar meses del año hacia atrás),
memoria anterógrada (incapacidad para recordar oralmente tres objetos) y la
realización de tareas visuoespaciales en ausencia de fluctuaciones en el nivel
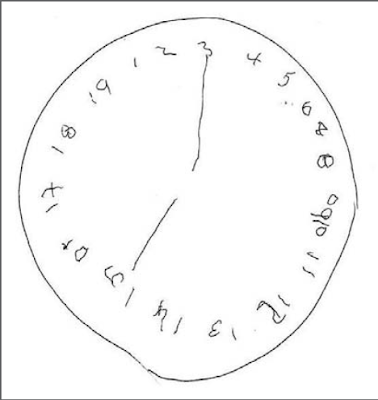
de conciencia. (Figura 1).
Figura 1. Clock Drawing.
En el segundo día de hospital, las habilidades
visuoespaciales se evaluaron haciendo que el paciente dibujara un reloj.
Mediante esta prueba se demostró una desorganización visuoespacial severa por
el escaso espacio entre los números, la omisión y la repetición de números, los
números escritos incorrectamente y que continúan más allá del
número 12. Además, aunque hay dos agujas distinguibles, el tiempo no se
identifica correctamente, evidenciando déficits en el pensamiento abstracto y
la capacidad de traducir el concepto de tiempo en un dibujo.
El tercer día de internación, el paciente parecía
lúcido y sombrío y tenía un contenido de su discurso apropiado. La temperatura
máxima fue de 40.3 ° C. Había placas blancas en la lengua, cicatrices de zoster
en el hemitórax derecho y una linfadenopatía pequeña y de consistencia gomosa en la axila izquierda.
Los análisis de sangre para anticuerpos IgG contra toxoplasma y citomegalovirus
(CMV) fueron positivos, y las pruebas para sífilis, antígeno de CMV, anticuerpo
contra estrongiloides, antígeno criptocócico y antígeno de histoplasma urinario
fueron negativos. El nivel de aspartato aminotransferasa aumentó a 155 U por
litro. Se suspendieron los antibióticos de amplio espectro y se inició
nistatina por vía oral. Se instituyeron medidas de aislamiento respiratorio.
Una radiografía de tórax con portátil fue normal; La TC de abdomen y pelvis
obtenida después de la administración de material de contraste mostró
linfadenopatía abdominal superior, retroperitoneal y pélvica; esplenomegalia;
un divertículo duodenal; y engrosamiento de la pared de la vesícula biliar.
Durante los siguientes 9 días, los síntomas
psiquiátricos persistieron. Continuó presentando fiebre diariamente, con temperaturas de hasta 40.1 °
C, y se desarrolló efectos secundarios extrapiramidales. La TC del cerebro no
mostró ninguna anomalía clínicamente significativa. La TC del tórax sin
material de contraste reveló algunos nódulos inespecíficos y múltiples ganglios
linfáticos supraclaviculares, mediastínicos y del abdomen superior, de hasta 12
mm de diámetro. Las imágenes de RMN del cerebro obtenidas antes y después de la
administración de material de contraste mostraron focos de realce múltiples
punteados, de hasta 4 mm de diámetro, en los hemisferios cerebrales derecho e
izquierdo, con hiperintensidad circundante leve en las imágenes de recuperación
de inversión atenuada por líquido (FLAIR) . La distribución de las lesiones fue
predominantemente intraaxial e involucraban la sustancia blanca y la unión de
la sustancia gris y blanca, aunque una lesión parecía extraaxial y otra lesión
parecía involucrar la sustancia gris cortical. Los resultados de la
electroencefalografía portátil fueron normales, con actividad beta suprayacente
y sin evidencia de actividad epileptiforme. Tres muestras de esputo inducido
mostraron hifas en la preparación húmeda para hongos y fueron negativos para
bacilos ácido-alcohol resistentes. En los cultivos de esputo crecieron Candida
albicans y flora respiratoria normal. Los cultivos de esputo, orina y sangre
para micobacterias y hongos se mantuvieron negativos. Se realizó punción lumbar
y el análisis del líquido cefalorraquídeo (LCR) fue normal. El nivel de ARN del
VIH fue de 3010 copias por mililitro de LCR, sin células malignas en el examen
citológico.
En el noveno día, una aspiración con aguja fina de
un ganglio linfático peripancreático no mostró células malignas, y la
citometría de flujo reveló linfocitos T con una relación invertida de células T
CD4 a células T CD8 y sin células B monoclonales. El examen oftalmológico
mostró lesiones retinianas, que incluían infiltrados blancos superficiales
esponjosos, hallazgos compatibles con retinopatía por CMV o VIH. La
ecocardiografía transtorácica fue normal.
Se suspendió el haloperidol y se administró
olanzapina y lorazepam según fuera necesario para la agitación. Se comenzó el
tratamiento con medicamentos antirretrovirales (emtricitabina, tenofovir,
atazanavir y ritonavir) y profilaxis con trimetoprim-sulfametoxazol.
La TC abdominal muestra una estructura posterior a
la segunda porción del duodeno que es típica en apariencia para un divertículo
duodenal, aunque inicialmente planteó la preocupación por una masa, ya sea
inflamatoria o maligna. Hay ganglios linfáticos agrandados de baja densidad,
incluidos los ganglios aortocavas y periaórticos (Figura 2B), algunos de los
cuales eran originalmente preocupantes para una masa parapancreática. La pared
de la vesícula biliar se engrosa con una pequeña cantidad de líquido pericolecístico.
Figura 2. Tomografía computarizada abdominal (Figura
2)
Una estructura posterior a la segunda porción del
duodeno (2A) tiene una apariencia típica de un divertículo duodenal (flecha).
Hay ganglios linfáticos agrandados de baja densidad, incluidos los ganglios
aortocavas y periaórticos (2B, flecha).
La tomografía computarizada del cerebro no reveló
ninguna anomalía clínicamente significativa. Una pequeña calcificación punteada
intraaxial fue un hallazgo inespecífico y no agudo. La RMN de cerebro (Figura
3) reveló múltiples focos hiperintensos predominantemente punteados en las
imágenes potenciadas en T2, incluyendo un foco en el lóbulo temporal medial
derecho y otro en el lóbulo frontal izquierdo inferior, sin evidencia de efecto
de masa. Aunque las imágenes están alteradas por un artefacto de movimiento, no
hay evidencia evidente de hemorragia o absceso.
Figura 3. RMN de cerebro.
Se muestran imágenes axiales: potenciadas en T1
(3A), T1 después de la administración de
material de contraste (3B) y ponderadas en T2 (3C). Hay focos dispersos,
hiperintensos y dispersos en todo el cerebro en imágenes potenciadas en T2. Las
flechas identifican lesiones en el lóbulo frontal inferior izquierdo y en la
unión del lóbulo temporal derecho y la ínsula.
El día 12, se realizó un procedimiento de
diagnóstico.
DIAGNÓSTICO DIFERENCIAL
Este paciente tiene una psicosis de nueva aparición.
También presentó un cuadro donde en el que realizó declaraciones repetidas sobre haber muerto y
estar muerto que son consistentes con delirios nihilistas (denominado síndrome
de Cotard), que ocurren cuando el ser propio se vuelve desconocido, lo que
lleva a la ilusión de estar muerto1,2. La psicosis es un síntoma, no un diagnóstico,
y puede clasificarse en psicosis primaria y secundaria (orgánica).
Desafortunadamente, no existe una manera fácil de diferenciar de manera
confiable las psicosis primarias de las secundarias sobre la base de las
características de la propia psicosis 3,4, y la evaluación de la situación
clínica general es muy importante para reducir el diagnóstico diferencial y
determinar el grado de urgencia.
DELIRIUM
La primera pregunta que debemos hacernos es si la
psicosis de nuevo inicio de este paciente es causada por una condición médica
subyacente y potencialmente mortal, como el delirium. La psicosis es común en
pacientes con delirium.5 El diagnóstico clínico de delirium depende de la
presencia de dos características cardinales: alteraciones o disrupción de la
atención y alteraciones o disrupción del ciclo sueño-vigilia, que conduce a la
fluctuación de los síntomas en el transcurso de un día.5 Un delirium se puede
pasar por alto fácilmente si las características secundarias, como la psicosis,
eclipsan el problema central de la falta de atención. Un electroencefalograma
(EEG) que muestra una ralentización difusa sugiere un delirium, pero como en
este paciente, un EEG normal no es lo suficientemente sensible como para descartar
con fiabilidad un delirium.
El inicio repentino de psicosis en un paciente con variabilidad
del estado mental y fiebre es un
delirium hasta que se demuestre lo contrario. En este paciente, nuestro
diagnóstico y evaluación diferencial debe centrarse en su infección avanzada
por VIH. Por lo tanto, se justifica una evaluación exhaustiva que incluya el
análisis de LCR y una RMN para descartar una infección o una afección maligna
del sistema nervioso central.
DEMENCIA ASOCIADA AL VIH
El delirium a menudo ocurre en pacientes con
deterioro cognitivo y demencia. Como este paciente tiene una infección avanzada
por VIH, corre el riesgo de padecer demencia asociada al VIH, que era un
problema común antes de la introducción de la terapia antirretroviral de gran
actividad (TARGA) .7 La presentación típica es una demencia progresiva con
características subcorticales (apatía, falta de atención, y pérdida de la
memoria retentiva) y anormalidades de la función motora, como la desaceleración
psicomotora. Cuando la psicosis ocurre en pacientes con demencia asociada al
VIH, se caracteriza por agitación, irritabilidad e ideas delirantes
prominentes8 (todas ellas presentes en este paciente) y a menudo es parte de un
síndrome maníaco que se ha denominado "manía del SIDA".
La demencia asociada al VIH es un diagnóstico de
exclusión, respaldado por los hallazgos en el análisis del LCR y la RMN. Es
casi seguro que este paciente tenga algún grado de afectación cerebral por
infección por VIH, como lo sugiere la inmunosupresión grave y la presencia de
ARN del VIH en el LCR. El alcance de su deterioro cognitivo requerirá un nuevo
examen con una batería completa de pruebas neuropsicológicas después de que se
haya resuelto su enfermedad aguda. Lo más probable es que se encuentre en una
etapa temprana de demencia asociada al VIH, ya que no tuvo hallazgos focales y
su historial no mostró deterioro cognitivo.
PSICOSIS DEBIDO A CONDICIONES MÉDICAS GENERALES
La psicosis puede ocurrir en pacientes con delirium
y en aquellos con demencia. También puede ocurrir como una manifestación
directa de una afección médica subyacente, como la infección por VIH. Las
características clínicas comunes de la psicosis asociada al VIH incluyen inicio
repentino sin pródromo, delirios (87% de los pacientes), alucinaciones (61%) y
síntomas afectivos (81%) 9. En la psicosis asociada al VIH, los hallazgos neurológicos
son generalmente limitados y los hallazgos de TC son inespecíficos; sin
embargo, los EEG son anormales en el 50% de los casos. 9 El deterioro cognitivo
se ha descrito consistentemente como una característica de la psicosis asociada
al VIH, 9,10 aunque no se puede distinguir de un primer episodio de
esquizofrenia.11,12 Dado que el abuso de sustancias es un trastorno coexistente
común en pacientes infectados por VIH y puede afectar la cognición, es
importante descartar el uso de alcohol u otras drogas como una causa
contribuyente13. No diagnosticaría la psicosis asociada al VIH en un paciente
con delirium, que algunos de los pacientes citados en la literatura podrían
haber tenido.
TRASTORNOS PSIQUIÁTRICOS PRIMARIOS
En algunos pacientes que han establecido la
infección por VIH, se desarrolla un trastorno psiquiátrico primario, como la
esquizofrenia, sin VIH como factor causal. En este paciente, es poco probable
un primer episodio de esquizofrenia, ya que el inicio de la esquizofrenia no
suele ser repentino, sino que involucra un período prodrómico de varios años,
con pérdida gradual de función y competencia social.14 Este paciente estaba
casado, tenía hijos y a la edad de 39 años sería inusualmente viejo tener un primer
episodio de esquizofrenia, ya que los hombres suelen enfermarse a los 20 años.
Sin embargo, la psicosis es una característica de otros trastornos
psiquiátricos además de la esquizofrenia. Por ejemplo, el inicio súbito de la
psicosis en el transcurso de un día se ha denominado "psicosis
reactiva" en respuesta a factores estresantes y puede ocurrir en pacientes
con infección por VIH.15 El delirium de este paciente es una explicación
suficiente para su psicosis, y la causalidad psiquiátrica no necesita ser
invocada.
En resumen, la historia clínica (aparición repentina
de psicosis en un paciente con síntomas constitucionales y fiebre) y los
resultados del examen del estado mental seriado (caracterizado por delirio,
problemas de atención y desorientación en ocasiones) sugieren un delirium en
este paciente con SIDA y supresión inmune severa. Los hallazgos inespecíficos en la RMN y la
punción lumbar que mostró la replicación viral del VIH pero ninguna otra
infección, sugieren que uno de los trastornos neurocognitivos asociados con el
VIH es un factor de vulnerabilidad para el delirium. Las pequeñas lesiones
observadas en la resonancia magnética no son suficientes para explicar la
psicosis de este paciente, especialmente teniendo en cuenta la clara evidencia
de que tenía un delirium, muy probablemente por una infección sistémica.
DIAGNÓSTICO TARDÍO DE INFECCIÓN POR VIH
En cualquier paciente con fiebre y cambios
repentinos en el estado mental, se debe considerar la infección o una afección
maligna del sistema nervioso central. En este paciente con infección por VIH y
bajo recuento de células T CD4, el diagnóstico diferencial debe incluir
procesos que causan enfermedad del sistema nervioso central en huéspedes
inmunosuprimidos. La toxoplasmosis cerebral es posible, ya que el paciente
tiene evidencia serológica de infección pasada. Sin embargo, no se identificó
ningún absceso cerebral en la RMN, por lo que este diagnóstico es poco
probable. La meningitis criptocócica es otra posibilidad. Los resultados del
análisis de LCR son a menudo anodinos en la meningitis criptocócica, ya que el
organismo puede no provocar una respuesta inflamatoria robusta. La ausencia de
antígeno criptocócico en el LCR de este paciente hace que este diagnóstico sea
poco probable. La infección por Mycobacterium tuberculosis puede causar
enfermedad crónica del sistema nervioso central. Este paciente no tiene
evidencia de meningitis tuberculosa o de un tuberculoma. Aunque la RMN puede
revelar una enfermedad grave, no es particularmente sensible para la detección
de invasión del sistema nervioso central; por lo tanto, la tuberculosis afectando
el sistema nervioso central no puede descartarse. También se debe considerar la
infección por CMV, especialmente teniendo en cuenta las anomalías observadas en
el examen de la retina. Las pruebas de CMV en sangre y LCR fueron negativas, y
esto hace que la encefalitis por CMV sea poco probable aunque no imposible.
Este paciente también está en riesgo de leucoencefalopatía multifocal
progresiva o linfoma asociado con el virus de Epstein-Barr, pero no hay pruebas
de imagen que respalden estos diagnósticos.
En este paciente profundamente inmunodeprimido,
pueden estar implicadas infecciones oportunistas múltiples, ya que las leyes de
parsimonia médica no se aplican a pacientes con bajos recuentos de células T
CD4. El rango de posibles infecciones oportunistas es vasto, pero la mayoría de
las enfermedades son causadas por un número relativamente pequeño de
organismos. Los dos factores predictivos más importantes en este caso son el
recuento de células T CD4 de 30 por milímetro cúbico y el hecho de que el
paciente proviene de una isla en el Caribe donde la tuberculosis es endémica.
Su fiebre, escalofríos, sudores, tos y linfadenopatía son consistentes con tuberculosis
diseminada. A pesar de que tenía una prueba cutánea (PPD) negativa para tuberculosis, esta prueba carece de
sensibilidad en huéspedes normales y por lo tanto es probable que sea poco
informativa en este paciente con un bajo recuento de células T CD4. También
debemos considerar las infecciones por hongos que se comportan como la
tuberculosis, incluida la histoplasmosis.
Durante el curso hospitalario del paciente, tenía un
nivel de aspartato aminotransferasa persistentemente alto. Dado que la revisión
inicial del aspirado de ganglio linfático no mostró bacilos u hongos
acidorresistentes, el siguiente paso fue una biopsia hepática.
DIAGNÓSTICOS PRESUNTIVOS:
PSICOSIS AGUDA CON DELIRIO DE COTARD, MUY
PROBABLEMENTE SUPERPUESTA A UN LEVE TRASTORNO NEUROCOGNITIVO ASOCIADO AL VIH.
DELIRIUM DEBIDO A LOS EFECTOS SISTÉMICOS DE UNA
INFECCIÓN OPORTUNISTA O MALIGNIDAD, MUY PROBABLEMENTE POR M. TUBERCULOSIS.
DISCUSIÓN PATOLÓGICA
El examen de la muestra de biopsia hepática reveló
varios granulomas epitelioides, algunos de ellos necrotizantes (Figura 4A y
4BFigura 4). La tinción histoquímica para organismos ácido-resistentes reveló
numerosos bacilos ácido-resistentes (Figura 4C).
Figura 4. Muestra de Biopsia de Hígado.
El panel A (hematoxilina y eosina) muestra un
granuloma epitelioide con un manguito de linfocitos. Algunos de los granulomas
muestran restos necróticos amorfos centrales (Panel B, área entre las flechas,
hematoxilina y eosina). Numerosos bacilos acidorresistentes están presentes
(Panel C, flechas, tinción de Ziehl-Neelsen).
El diagnóstico fue infección micobacteriana del
hígado con inflamación granulomatosa necrotizante. Poco después de que se hizo
el diagnóstico, se informaron varios cultivos como positivos para el complejo
M. tuberculosis, incluida la biopsia hepática, el aspirado de ganglio linfático
peripancreático, el esputo, la sangre y la orina. Por lo tanto, el diagnóstico
anatómico final es una infección diseminada de M. tuberculosis. La gran
cantidad de bacilos y la disposición algo más suelta de los histiocitos son
características consistentes con el estado inmunodeficiente del paciente.
Después de confirmar el diagnóstico de M.
tuberculosis, volvimos a analizar el aspirado de nódulo linfático
peripancreático para ver si podíamos encontrar bacilos ácido-alcohol
resistentes. La revisión del aspirado reveló linfocitos y pequeñas cantidades
de restos granulares amorfos en los que se identificaron bacilos ácido-alcohol
resistentes. Este caso subraya el hecho de que la identificación de bacilos
ácido-alcohol resistentes es un desafío y los organismos pueden pasarse por
alto. Por lo tanto, cuando hay una alta sospecha clínica de enfermedad
micobacteriana, es importante notificar al patólogo para que se pueda dedicar
más tiempo a revisar los extendidos teñidos para bacilos ácido-alcohol
resistentes.
DISCUSIÓN DEL MANEJO
MANEJO DE LA PSICOSIS ASOCIADA AL VIH
La reversión de la psicosis orgánica implica el
tratamiento del trastorno subyacente y el tratamiento sintomático con agentes
antipsicóticos. Este paciente tuvo marcadamente menos agitado después de 2 días
de tratamiento con olanzapina, un agente antipsicótico. Este fármaco se eligió
inicialmente debido a su eficacia comprobada y al riesgo relativamente bajo de
causar síntomas extrapiramidales y discinesia tardía, que son altamente
prevalentes entre los pacientes con VIH.16-19- Se piensa que esta sensibilidad
está relacionada con el daño asociado con el VIH al sistema dopaminérgico de
los ganglios basales y al aumento de los niveles plasmáticos de los agentes
antipsicóticos debido a las interacciones con los medicamentos
antirretrovirales. 20,21 La disfunción de los ganglios basales también aumenta
el riesgo de síndrome neuroléptico maligno, que ha sido bien documentado en
pacientes con VIH22.
El día 5, se desarrollaron síntomas extrapiramidales
que requirieron la administración de lorazepam y una reducción en la dosis de
olanzapina. Debido al desarrollo de síntomas extrapiramidales, fiebre alta
persistente y cambios en el estado mental, existió preocupación por la
posibilidad de síndrome neuroléptico maligno. Se siguieron de cerca los niveles
de creatina quinasa, que se mantuvo normal. Al momento del alta, la mayoría de
los síntomas psicóticos del paciente se habían resuelto, excepto por una
afectividad persistentemente plana y un discurso levemente monótono.
MANEJO DE TUBERCULOSIS E INFECCIÓN POR VIH
Este paciente tiene al menos dos infecciones que
ponen en peligro la vida, el VIH y la tuberculosis, y ambos requieren regímenes
de tratamiento complejos. Su curso clínico posterior resalta una pregunta
clínica no resuelta con respecto al momento del inicio de la terapia
antirretroviral en pacientes con un bajo recuento de células T CD4 e infección
oportunista concurrente. 23-29
Inicialmente, este paciente comenzó con un régimen
antirretroviral estándar de cuatro medicamentos, y aproximadamente 1 semana
después, se inició el tratamiento dirigido contra la tuberculosis. Dentro de
los 6 días posteriores al inicio de la terapia antituberculosa, se
desarrollaron altas temperaturas, tos y taquipnea, con un empeoramiento del
malestar general. Apareció asimismo dolor escrotal severo, con hinchazón,
sensibilidad e induración. La exploración ecográfica del escroto mostró una
masa testicular compleja con un agrandamiento del epidídimo que se consideró
compatible con la afectación por tuberculosis diseminada. Durante este tiempo,
también hubo un aumento en el nivel de fosfatasa alcalina, de 185 U por litro a
722 U por litro, lo que sugiere un empeoramiento de la enfermedad hepática del
paciente. Esta constelación de hallazgos es consistente con el síndrome
inflamatorio de reconstitución inmune (SRI), un empeoramiento paradójico de la
inflamación causada por la reconstitución de la función inmune durante el
tratamiento antirretroviral. A medida que su función inmune comenzó a
recuperarse, el paciente montó una respuesta inflamatoria exuberante,
probablemente dirigida contra antígenos liberados de micobacterias muertas o en
curso de hacerlo.
Para el tratamiento del SRI, se agregó prednisona al
régimen del paciente con lo cual tuvo una respuesta clínica rápida, con una
disminución en los niveles de fosfatasa alcalina y una mejoría en la fiebre.
Sin embargo, tuvo reactivación de una infección por CMV latente y requirió
tratamiento con ganciclovir. A medida que se disminuyó la dosis de prednisona,
la fiebre reapareció, pero el patrón de fiebre fue relativamente constante, sin
la variación diurna normal típica de los cuadros infecciosos. El paciente se veía y se sentía
bien, lo que sugería que la fiebre podría estar relacionada con la medicación.
Se discontinuó la rifabutina, que era parte de su régimen antimicobacteriano, y
se resolvió la fiebre.
Después de la interrupción de la prednisona, desarrolló
hipercalcemia asintomática, con niveles de calcio medidos tan altos como 13.5
mg por decilitro. Se sospechó que la misma era causada por un mecanismo no dependiente
de la hormona paratiroidea sino más bien relacionado con la producción de
1,25-dihidroxivitamina D por los macrófagos en reacción a la infección por
tuberculosis. La hipercalcemia se observa con mayor frecuencia en otras
enfermedades granulomatosas, como la sarcoidosis, que en la tuberculosis.
Debido a este cuadro se recomenzó la prednisona a dosis bajas y la
hipercalcemia se resolvió rápidamente con ketoconazol, que inhibe un paso en la
producción de 1,25-dihidroxivitamina D. El paciente fue dado de alta después de
4 semanas en el hospital, momento en el cual estaba médicamente estable y tenía
un estado mental notablemente mejorado. Continuó la terapia contra la
tuberculosis y el VIH.
En el examen realizado por el servicio de
oftalmología, se observó que el paciente tenía retinopatía bilateral, que se
consideró debida a CMV o VIH. Sin embargo, había un área focal de coriorretinitis
en el ojo izquierdo que no se consideraba típica de la retinitis por CMV y se
pensó que posiblemente era una lesión granulomatosa por tuberculosis.
Aproximadamente 14 meses después del alta, en el momento de su último examen
ocular, las lesiones oculares estaban inactivas y no había evidencia de
retinitis activa.
Treinta meses después del alta, el paciente se
encuentra excepcionalmente bien médicamente, se siente fuerte y realiza
ejercicios con frecuencia. Su último recuento de células T CD4 fue de 231 por
milímetro cúbico, y no se detectó el ARN del VIH en plasma.
PSIQUIATRÍA
El paciente fue visto en psiquiatría ambulatoria
para el seguimiento 6 meses después de que se resolvieran sus enfermedades
agudas. Se había recuperado notablemente pero tenía problemas cognitivos
residuales, particularmente en la velocidad de procesamiento, la memoria de
recuerdo y las funciones del lóbulo frontal, todas las cuales podían tener
ramificaciones funcionales. Su dibujo del reloj estaba intacto. Cabe destacar
que obtuvo 7 de 16 en la escala de demencia del VIH (con puntajes de 10 o menos
que indican demencia asociada al VIH) .30
Este caso ejemplifica el efecto que la infección por
VIH puede tener en el cerebro, particularmente al final de la infección. El
diagnóstico temprano y el tratamiento de la infección por VIH pueden ayudar a
limitar la enfermedad cerebral. Por lo tanto, hay que realizar las pruebas de
VIH en cualquier paciente que presente psicosis14 o con problemas cognitivos31.
A la luz de la creencia episódica del paciente de
que él estaba muerto, ¿deberíamos considerar la posibilidad de que este
pensamiento o sentimiento se derivara de una convulsión parcial compleja en el
lóbulo temporal? El tema de la muerte en crisis parciales complejas ha sido
descrito en la literatura32.
Se obtuvo un EEG para descartar convulsiones y fue normal
en este paciente. No creemos que sea posible establecer la causalidad entre la
lesión de este paciente en el lóbulo temporal y su psicosis.
DIAGNÓSTICOS FINALES
INFECCIÓN DISEMINADA CON MYCOBACTERIUM TUBERCULOSIS,
QUE INVOLUCRA HÍGADO, GANGLIOS LINFÁTICOS PERIPANCREÁTICOS, ESPUTO, SANGRE Y
ORINA, CON DELIRIO Y PSICOSIS AGUDA CON DELIRIO DE COTARD.
TRASTORNO NEUROCOGNITIVO LEVE ASOCIADO AL VIH.
Traducción de:
"A 39-Year-Old Man with a Recent Diagnosis of HIV Infection and Acute Psychosis
Oliver Freudenreich, M.D., Nesli Basgoz, M.D., Carlos Fernandez-Robles, M.D., Mykol Larvie, M.D., Ph.D., and Joseph Misdraji, M.D."
N Engl J Med 2012; 366:648-657February 16, 2012
References
1 Debruyne H,
Portzky M, Van den Eynde F, Audenaert K. Cotard's syndrome: a review. Curr
Psychiatry Rep 2009;11:197-202
CrossRef |
Medline
2 Berrios GE,
Luque R. Cotard's delusion or syndrome? A conceptual history. Compr Psychiatry
1995;36:218-223
CrossRef | Web
of Science | Medline
3 De Ronchi D, Bellini F, Cremante G, et al. Psychopathology of first-episode psychosis in
HIV-positive persons in comparison to first-episode schizophrenia: a neglected
issue. AIDS Care 2006;18:872-878
CrossRef | Web
of Science | Medline
4 Johnstone EC,
Cooling NJ, Frith CD, Crow TJ, Owens DG. Phenomenology of organic and
functional psychoses and the overlap between them. Br J Psychiatry
1988;153:770-776
CrossRef | Web
of Science | Medline
5 Meagher DJ,
Moran M, Raju B, et al. Phenomenology of delirium: assessment of 100 adult
cases using standardised measures. Br J Psychiatry 2007;190:135-141
CrossRef | Web
of Science | Medline
6 Brenner RP.
Utility of EEG in delirium: past views and current practice. Int Psychogeriatr
1991;3:211-229
CrossRef |
Medline
7 McArthur JC,
Hoover DR, Bacellar H, et al. Dementia in AIDS patients: incidence and risk
factors. Neurology 1993;43:2245-2252
Web of Science |
Medline
8
Nakimuli-Mpungu E, Musisi S, Mpungu SK, Katabira E. Primary mania versus
HIV-related secondary mania in Uganda. Am J Psychiatry 2006;163:1349-1354
CrossRef | Web
of Science | Medline
9 Harris MJ,
Jeste DV, Gleghorn A, Sewell DD. New-onset psychosis in HIV-infected patients.
J Clin Psychiatry 1991;52:369-376
Web of Science |
Medline
10 Sewell DD,
Jeste DV, Atkinson JH, et al. HIV-associated psychosis: a study of 20 cases. Am
J Psychiatry 1994;151:237-242
Web of Science |
Medline
11 Keefe RS, Fenton
WS. How should DSM-V criteria for schizophrenia include cognitive impairment?
Schizophr Bull 2007;33:912-920
CrossRef | Web
of Science | Medline
12
Mesholam-Gately RI, Giuliano AJ, Goff KP, Faraone SV, Seidman LJ.
Neurocognition in first-episode schizophrenia: a meta-analytic review.
Neuropsychology 2009;23:315-336
CrossRef | Web
of Science | Medline
13 Norman LR,
Basso M, Kumar A, Malow R. Neuropsychological consequences of HIV and substance
abuse: a literature review and implications for treatment and future research.
Curr Drug Abuse Rev 2009;2:143-156
CrossRef
14 Freudenreich
O, Schulz SC, Goff DC. Initial medical work-up of first-episode psychosis: a
conceptual review. Early Interv Psychiatry 2009;3:10-18
CrossRef | Web
of Science
15 Boast N, Coid
J. Homosexual erotomania and HIV infection. Br J Psychiatry 1994;164:842-846
CrossRef | Web
of Science | Medline
16 Meyer JM,
Marsh J, Simpson G. Differential sensitivities to risperidone and olanzapine in
a human immunodeficiency virus patient. Biol Psychiatry 1998;44:791-794
CrossRef | Web
of Science | Medline
17 Mirsattari
SM, Power C, Nath A. Parkinsonism with HIV infection. Mov Disord
1998;13:684-689
CrossRef | Web
of Science | Medline
18 Hriso E, Kuhn
T, Masdeu JC, Grundman M. Extrapyramidal symptoms due to dopamine-blocking
agents in patients with AIDS encephalopathy. Am J Psychiatry 1991;148:1558-1561
Web of Science |
Medline
19 Shedlack KJ,
Soldato-Couture C, Swanson CL Jr. Rapidly progressive tardive dyskinesia in
AIDS. Biol Psychiatry 1994;35:147-148
CrossRef | Web
of Science | Medline
20 Cardoso F.
HIV-related movement disorders: epidemiology, pathogenesis and management. CNS
Drugs 2002;16:663-668
CrossRef | Web
of Science | Medline
21 Kelly DV,
Beique LC, Bowmer MI. Extrapyramidal symptoms with ritonavir/indinavir plus
risperidone. Ann Pharmacother 2002;36:827-830
CrossRef | Web
of Science | Medline
22 Hernandez JL, Palacios-Araus L, Echevarria S,
Herran A, Campo JF, Riancho JA. Neuroleptic
malignant syndrome in the acquired immunodeficiency syndrome. Postgrad Med J
1997;73:779-784
CrossRef | Web
of Science | Medline
23 Piggott DA,
Karakousis PC. Timing of antiretroviral therapy for HIV in the setting of TB
treatment. Clin Dev Immunol 2011;2011:103917-103917
CrossRef | Web
of Science | Medline
24 Meintjes G,
Wilkinson RJ. Optimum timing of antiretroviral therapy for HIV-infected
patients with concurrent serious opportunistic infections. Clin Infect Dis
2010;50:1539-1541
CrossRef | Web
of Science | Medline
25 Cohen K,
Meintjes G. Management of individuals requiring antiretroviral therapy and TB
treatment. Curr Opin HIV AIDS 2010;5:61-69
CrossRef | Web
of Science
26 Thompson MA, Aberg JA, Cahn P, et al. Antiretroviral treatment of adult HIV infection: 2010
recommendations of the International AIDS Society-USA panel. JAMA
2010;304:321-333
CrossRef | Web
of Science | Medline
27 Abdool Karim
SS, Naidoo K, Grobler A, et al. Integration of antiretroviral therapy with
tuberculosis treatment. N Engl J Med 2011;365:1492-1501
Full Text | Web
of Science | Medline
28 Blanc FX, Sok
T, Laureillard D, et al. Earlier versus later start of antiretroviral therapy
in HIV-infected adults with tuberculosis. N Engl J Med 2011;365:1471-1481
Full Text | Web
of Science | Medline
29 Havlir DV,
Kendall MA, Ive P, et al. Timing of antiretroviral therapy for HIV-1 infection
and tuberculosis. N Engl J Med 2011;365:1482-1491
Full Text | Web
of Science | Medline
30 Power C,
Selnes OA, Grim JA, McArthur JC. HIV Dementia Scale: a rapid screening test. J
Acquir Immune Defic Syndr Hum Retrovirol 1995;8:273-278
CrossRef |
Medline
31 Costello D,
Davis J, Venna N. HIV infection with immunodeficiency presenting with subacute
cognitive decline: recent illustrative cases. CNS Spectr 2007;12:842-850
Web of Science |
Medline
32 Greenberg DB,
Hochberg FH, Murray GB. The theme of death in complex partial seizures. Am J
Psychiatry 1984;141:1587-1589
Web of Science |
Medline