Paciente masculino de 42 años, VIH (+), último
recuento de CD4: 7/mm3.
 |
| Hospital Municipal "Dr. Ángel Pintos" de Azul |
Comienza hace una semana a presentar dolor en región
de la inserción maseterina en maxilar inferior que crece rápidamente en 24
horas. En las últimas 24 horas se exacerba el dolor haciéndose más intenso. Afebril.
Refiere el paciente que comenzó como un punto
doloroso en la región lateral de la cara a nivel del ángulo de la mandíbula y
aumentó de tamaño rápidamente con dolor creciente y como se ve, signos
flogóticos a ese nivel. No se palpaba adenomegalia en el sitio inicial. Tanto
clínicamente como en la TC se ve un absceso o una zona necrótica abscedada
sobre todo en la serie con contraste. Esta colección parece corresponder a los
planos musculares, y menos probablemente a un adenoflemón, parotiditis etc.
Se indicó punción de la formación abscedada
obteniéndose pus de aspecto
achocolatado. En el cultivo desarrolló S aureus meticilino sensible.
La Dra Anastasia Schiaffino Jefa de Laboratorio de Bacteriología
nos hizo llegar esta imagen donde se ven los cocos gram positivos en racimos
que desarrollaron en este paciente el cual
evolucionó bien con tratamiento ATB.
PAROTIDITIS SUPURADA EN ADULTOS
INTRODUCCIÓN
La infección aguda de la
glándula parótida puede ser causada por una variedad de bacterias y virus. La
parotiditis supurativa bacteriana aguda es causada con mayor frecuencia por
Staphylococcus aureus y flora mixta aeróbicos y / o anaerobios orales. A menudo
ocurre en el contexto de debilitamiento, deshidratación e higiene bucal
deficiente, particularmente en pacientes posoperatorios de edad avanzada.
ANATOMÍA Y PATOGÉNESIS:
Las glándulas parótidas se
ubican a los lados de la cara anterior al canal auditivo externo, superior al
ángulo de la mandíbula, e inferior al arco cigomático. La mayor parte de la
glándula parótida es superficial al músculo masetero. La glándula salival
consiste en 20 a 30 nódulos linfáticos intraparotídeos y periparotídeos con
drenaje linfático desde el lado ipsilateral de la cara y la frente, incluida la
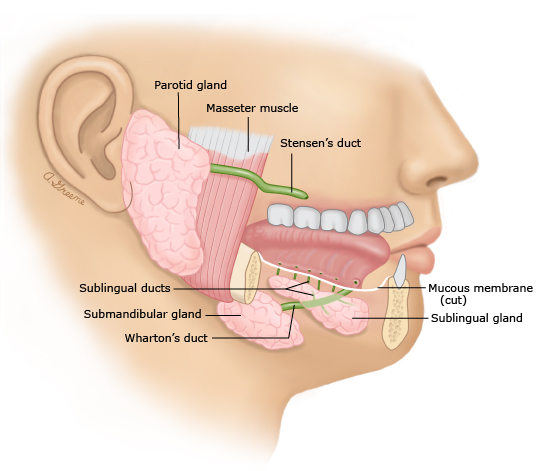
región auricular y el conducto auditivo externo [ 1 ]. El conducto de Stensen
se origina en el borde anterior de la glándula parótida y mide de 4 a 7 cm de
largo, se estrecha a 1,2 mm en un istmo y el orificio mide 0,5 mm y está
opuesto al segundo molar superior ( figura 1 ).
Figura 1
Las tres principales glándulas salivales son las
glándulas parótida, submandibular y sublingual. El conducto de Stensen drena la
glándula parótida opuesta al segundo molar superior. El conducto de Wharton
drena las glándulas submandibulares y algunas glándulas sublinguales en el piso
de la boca cerca del frenillo de la lengua.
La parotiditis supurativa bacteriana aguda puede ocurrir
cuando la estasis salival permite la siembra retrógrada del conducto de Stensen
por una flora oral mixta [ 2 ]. La obstrucción ductal por cálculos o tumores
puede predisponer a la supuración. La formación de abscesos también puede
surgir por infección contigua o por siembra hematógena en los ganglios
linfáticos intraparótidos o periparotídeos [ 1 ].
EPIDEMIOLOGÍA Y FACTORES DE RIESGO
La
parotiditis supurativa ocurre típicamente en pacientes posoperatorios de
edad avanzada que están deshidratados o intubados, aunque también se puede
observar en pacientes ambulatorios [ 2-4 ]. Otros factores predisponentes
incluyen la limpieza intensiva reciente de los dientes, el uso de fármacos
anticolinérgicos y otras drogas que reducen el flujo salival, la malnutrición,
los cálculos salivales con obstrucción y la neoplasia de la cavidad oral [ 4 ].
La infección de quistes embriogénicos, como la primera hendidura branquial,
puede dar lugar a una supuración frecuente de la glándula parótida [ 5 ].
MANIFESTACIONES CLÍNICAS
La
parotiditis supurativa se caracteriza por la aparición repentina de
hinchazón firme y eritematosa de las áreas pre y postauriculares que se
extiende hasta el ángulo de la mandíbula. Esto se asocia con dolor local
exquisito y sensibilidad con quejas de trismus y disfagia. Los hallazgos
sistémicos de fiebre alta, escalofríos y toxicidad marcada generalmente están
presentes.
En el examen, generalmente no se aprecia una zona
fluctuante debido a la fascia parotídea densa que cubre la glándula. El
material purulento puede expresarse desde el orificio del conducto de Stensen
en más de la mitad de los casos ( figura 1 ). El drenaje se puede lograr
mediante una suave compresión alrededor de la abertura del conducto de Stensen.
MICROBIOLOGÍA
La microbiología de la
parotiditis supurativa aguda es bastante variable y a menudo polimicrobiana. S.
aureus es con mucho el patógeno aislado con más frecuencia, pero los anaerobios
también son comunes [ 4,6 ]. Los organismos gramnegativos (Enterobacteriaceae,
Eikenella corrodens y otros bacilos gramnegativos) a menudo se observan en
pacientes hospitalizados [ 3,7 ]. Por razones inexplicables, Klebsiella spp es
particularmente frecuente entre los pacientes con diabetes mellitus del sudeste
asiático [ 8,9 ]
La naturaleza polimicrobiana de las infecciones del
espacio parotídeo se ilustra en un estudio de 32 pacientes con parotiditis
supurativa aguda [ 4 ]. Las bacterias aeróbicas se aislaron en un 34 por
ciento, las bacterias anaerobias en un 41 por ciento y las bacterias aeróbicas
y anaeróbicas mezcladas en un 25 por ciento. S. aureus fue el aerobio
predominante (en 10 pacientes), seguido de estreptococos viridans y Haemophilus
influenzae (en cuatro pacientes cada uno). Pigmented Prevotella y Porphyromonas
spp, Fusobacterium spp. Y Peptostreptococcus spp fueron los anaerobios
predominantes.
Las causas raras de parotiditis supurativa incluyen
Streptococcus pneumoniae , Streptococcus pyogenes , Moraxella catarrhalis ,
Enterobacteriaceae spp, Pseudomonas aeruginosa , Mycobacterium tuberculosis y
Actinomyces spp [ 10 ].
IMÁGENES
Los estudios de imágenes son útiles para
evaluar la inflamación o la obstrucción del conducto por un cálculo, y para
diferenciar entre la parotiditis supurativa aguda y la recolección franca del
absceso o un tumor sólido.
Las opciones de imagen incluyen ultrasonido,
tomografía computarizada (TC) y sialografía por resonancia magnética [ 10,11]
La ecografía es nuestra modalidad de imagen inicial preferida para la sospecha
de parotiditis supurativa u obstructiva, ya que es particularmente útil para
detectar cálculos en el conducto o el parénquima y para diferenciar entre la sialoadenitis
obstructiva y la no obstructiva. Una colección de abscesos puede verse como una
lesión hipoecogénica rodeada por un borde ecogénico irregular dentro del
parénquima de la glándula. La TC es la herramienta más sensible para
diferenciar la celulitis supurada del absceso franco con mejora del borde, y es
un complemento útil si los hallazgos ecográficos no son definitivos. La
sialografía por resonancia magnética proporciona el mejor detalle de las
anomalías ductales dentro de la glándula parótida y es superior a la
sialografía convencional; a menudo se utiliza junto con la resonancia magnética
para evaluar las enfermedades ductales y parenquimatosas de la glándula
parótida [12 ]. La sialografía de rayos X no se puede utilizar durante la
infección aguda y requiere la inyección de material de contraste [ 10 ].
DIAGNÓSTICO
El diagnóstico generalmente se
realiza cuando los hallazgos clínicos característicos están presentes, como se
discutió anteriormente.
Una amilasa sérica elevada en ausencia de
pancreatitis respalda la sospecha clínica de afectación de la parótida. Cuando
el drenaje purulento está presente en la abertura del conducto de Stensen, debe
recogerse para tinción de Gram y cultivo. La tinción de Gram es particularmente
útil para detectar estafilococos y Candida. Sin embargo, el cultivo obtenido
intraoralmente debe interpretarse con precaución ya que los resultados pueden
representar contaminación por la flora oral.
Se recomienda la aspiración con aguja guiada por
ultrasonido de la glándula parótida inflamada por vía extraoral para obtener
muestras para la evaluación microbiológica antes de la terapia antimicrobiana
empírica. Las muestras deben cultivarse tanto para aerobios como para
anaerobios, así como para hongos y micobacterias. La principal utilidad de los
datos del cultivo es obtener pruebas de susceptibilidad de un organismo
dominante para garantizar una cobertura antibacteriana adecuada.
TRATAMIENTO
El tratamiento de la parotiditis
supurativa incluye hidratación y antibióticos por vía intravenosa. Dado que la
parotiditis supurativa puede extenderse potencialmente a los espacios faciales
profundos de la cabeza y el cuello y puede ser potencialmente mortal, no se
recomienda el tratamiento ambulatorio con antibióticos orales. La incisión
quirúrgica y el drenaje deben implementarse si no hay respuesta clínica después
de 48 horas de tratamiento con antibióticos intravenosos empíricos.
REGÍMENES ANTIBIÓTICOS INICIALES
Regímenes antimicrobianos empíricos iniciales se basan en los factores
de microbiología y de acogida esperados y deben dirigirse a S. aureus (incluyendo
S. aureus resistente a la meticilina [SAMR]) y aerobios y
anaerobios orales mixtas. Agregamos cobertura para Enterobacteriaceae y
Pseudomonas aeruginosa en pacientes con hospitalización reciente o que están
inmunocomprometidos. El espectro del régimen antimicrobiano debe reducirse una
vez que los datos microbiológicos estén disponibles.
Las dosis de antibióticos recomendadas a
continuación están destinadas a pacientes con función renal normal; la
dosificación de algunos de estos agentes debe reducirse en pacientes con
disfunción renal.
HUÉSPEDES INMUNOCOMPETENTES
- Nafcilina (1.5 g IV cada cuatro horas) u otra penicilina antiestafilocócica o una cefalosporina de primera generación, además de
- Metronidazol (500 mg IV cada seis u ocho horas) o clindamicina (600 mg IV cada seis u ocho horas)
La vancomicina (15 a 20 mg / kg IV cada 12 horas) o
linezolid (600 mg por vía oral o IV cada 12 horas) debe sustituirse por
nafcilina en el huésped inmunocompetente con factores de riesgo de infección
por S. aureus resistente a la meticilina (SAMR). Los factores de riesgo para
SAMR incluyen antecedentes de uso de drogas intravenosas, enfermedades
comórbidas (p. Ej., Diabetes mellitus) o residir en una comunidad u hospital
donde hay una incidencia importante de SAMR.
HUÉSPEDES INMUNOCOMPROMETIDOS
- Vancomicina (15 a 20 mg / kg IV cada 8 a 12 horas, sin exceder 2 g por dosis) o linezolid (600 mg por vía oral o IV cada 12 horas) más uno de los siguientes regímenes:
- Cefepime (2 g IV cada 12 horas) más metronidazol (500 mg IV cada seis u ocho horas) o
- Imipenem (500 mg IV cada seis horas) o
- Meropenem (1 g IV cada ocho horas) o
- Piperacilina-tazobactam (4.5 g IV cada seis horas)
REGÍMENES DE ROTACIÓN A LA VÍA ORAL
La terapia en descenso a un régimen oral pueden ser
consideradas una vez que el paciente ha mejorado y manejo quirúrgico se considera
innecesario. La elección de un régimen antimicrobiano oral para la terapia de
reducción debería idealmente guiarse por los datos de cultivo y
susceptibilidad. Una combinación de clindamicina (450 mg por vía oral tres
veces al día) más ciprofloxacina (500 o 750 mg por vía oral dos veces al día)
se puede usar para cubrir aerobios orales (incluidas Enterobacteriaceae spp),
P. aeruginosa , muchas cepas de S. aureus y anaerobios; la dosis más alta de
ciprofloxacina se debe usar cuando se sospecha P. aeruginosa . Un régimen
alternativo que nono tener actividad anti-Pseudomonas es
amoxicilina-clavulánico (875 mg por vía oral dos veces al día) con o sin
linezolid (600 mg por vía oral dos veces al día); linezolid debe incluirse si
se sospecha SAMR. Otro régimen posible es linezolid más moxifloxacino (400 mg
por vía oral una vez al día), que proporciona actividad contra aerobios orales
(incluidas Enterobacteriaceae spp), S. aureus y anaerobios, pero no tiene buena
actividad contra P. aeruginosa . La elección del régimen en función del estado
inmunitario del paciente se describe en la tabla.
DURACIÓN
La duración de la terapia depende del
estado inmunológico del huésped, la gravedad y el grado de infección y la
respuesta a la terapia. Para pacientes con parotiditis supurativa no
complicada, es razonable una duración total de 10 a 14 días.
COMPLICACIONES
La progresión
de la infección puede provocar hinchazón masiva del cuello, obstrucción
respiratoria, septicemia y osteomielitis del hueso facial adyacente. Dado que
el espacio parotídeo colinda con el espacio parafaríngeo, la parotiditis
supurativa es una fuente importante de infección del espacio parafaríngeo con
potencial evolución a la tromboflebitis séptica yugular (síndrome de Lemierre)
[ 2 ]. Otra posible complicación es la parálisis del nervio facial, que es
relativamente poco frecuente [ 1 ] ( figura 2 ).
Figura 2
En raras ocasiones, una fístula puede ocurrir como
una complicación de la parotiditis supurativa aguda [ 13].] La sialografía de
TC y la fistulografía se pueden realizar para evaluar la extensión de la
fístula y excluir la posibilidad de una malignidad subyacente. Una
fistulectomía puede ser necesaria para el tratamiento definitivo. (Consulte
"Descripción general de la osteomielitis en adultos" y
"Infecciones profundas en el espacio del cuello", sección sobre
"Infecciones espaciales parafaríngeas" ).
La exploración y el drenaje quirúrgicos pueden ser
necesarios tanto para el diagnóstico como para el tratamiento. Si no se
encuentra un proceso infeccioso, debe realizarse una búsqueda de causas no
infecciosas de hinchazón de la parótida (p. Ej., Malignidad o enfermedades
vasculares de colágeno). En raras ocasiones, puede producirse una infección
recurrente de la glándula parótida, especialmente en pacientes con enfermedades
comórbidas, como la diabetes mellitus. En tales pacientes, se puede considerar
una parotidectomía.
CAUSAS NO SUPURADAS:
Una variedad de organismos puede causar parotiditis.
Las paperas son el virus clásico que causa parotiditis, pero otros virus que se
han asociado con la parotiditis incluyen virus de la influenza, virus
Coxsackie, virus de Epstein-Barr, virus de la coriomeningitis linfocítica,
virus parainfluenza, virus del herpes simple y citomegalovirus [ 10 ]. En
pacientes infectados por VIH, se ha observado hinchazón bilateral de la
parótida con lesiones quísticas y puede deberse a una sialoadenitis asociada al
VIH o un síndrome inflamatorio de reconstitución inmune tras el inicio de la
terapia antirretroviral [ 14,15 ]. La infección crónica por el virus de la
hepatitis C (VHC) también se ha asociado con anomalías de la parótida, como la
sialoadenitis linfocítica y el síndrome de Sjogren [ 16].].
La parotiditis viral se puede distinguir de la
parotiditis supurativa por un período prodrómico, seguido de una inflamación
aguda de la glándula afectada, que puede durar de 5 a 10 días y con frecuencia
es bilateral. La parotiditis viral no causa una secreción purulenta del
conducto de Stensen [ 10 ]. La evaluación serológica puede establecer el
diagnóstico.
Mycobacterium tuberculosis y micobacterias no
tuberculosas, como M. avium intracellulare , rara vez se han asociado con
parotiditis [ 17 ].
Las causas no infecciosas de la inflamación
parotídea incluyen enfermedades vasculares del colágeno, fibrosis quística,
alcoholismo, diabetes mellitus, gota, uremia, sarcoidosis, síndromes de
displasia ectodérmica, disautonomía familiar, sialolitiasis, tumores benignos y
malignos y trastornos relacionados con los medicamentos [ 10 ]. La hinchazón
parótida bilateral tiene un amplio diagnóstico diferencial e incluye afecciones
asociadas con sialadenosis, causas infecciosas y neoplasia [ 18 ].
REFERENCIAS
Tan VE, Goh BS. Absceso parotídeo: una revisión de
cinco años: presentación clínica, diagnóstico y tratamiento. J Laryngol Otol
2007; 121: 872.
Cohen MA, Docktor JW. Parotitis supurativa aguda con
extensión a los espacios profundos del cuello. Am J Emerg Med 1999; 17:46.
Brook I. El cuello hinchado. Linfadenitis cervical,
parotiditis, tiroiditis y quistes infectados. Infect Dis Clin North Am 1988; 2: 221.
Brook I.
Parotiditis supurativa bacteriana aguda: microbiología y manejo. J Craniofac
Surg 2003; 14:37.
Triglia JM, Nicollas R, Ducroz V, y col. Primeras
anomalías de la hendidura branquial: un estudio de 39 casos y una revisión de
la literatura. Arch
Otolaryngol Head Neck Surg 1998; 124: 291.
Raad II, Sabbagh
MF, Caranasos GJ. Sialadenitis bacteriana aguda: un
estudio de 29 casos y revisión. Rev
Infect Dis 1990; 12: 591.
Sherman JA.
Pseudomonas absceso parotídeo. J Oral Maxillofac Surg 2001; 59: 833.
Huang TT, Tseng
FY, Yeh TH, y col. Factores que afectan la bacteriología de
la infección profunda del cuello: un estudio retrospectivo de 128 pacientes. Acta Otolaryngol 2006; 126: 396.
Chi TH, Yuan CH,
Chen HS. Absceso parotídeo: un estudio retrospectivo de 14
casos en un hospital regional de Taiwán. B-ENT 2014; 10: 315.
Al-Dajani N,
Wootton SH. Linfadenitis cervical, parotiditis supurativa,
tiroiditis y quistes infectados. Infect
Dis Clin North Am 2007; 21: 523.
Varghese JC, Thornton F, Lucey BC, y col. Un estudio
prospectivo comparativo de la sialografía MR y la sialografía convencional de
la enfermedad del conducto salival. AJR Am J Roentgenol 1999; 173: 1497.
Abu-Taleb NSM,
Abdel-Waheb N, Amer MS. El Papel de la Resonancia Magnética y la
Sialografía por Resonancia Magnética en el Diagnóstico de Distintos Trastornos
de las Glándulas Salivales: Un Acuerdo Interobservador. J Med Imaging Radiation Sciences 2014; 45: 299.
Naragund AI, Halli VB, Mudhol RS, Sonoli SS. Fístula
parótida secundaria a parotiditis supurativa en una niña de 13 años: informe de
un caso. J Med Case Rep
2010; 4: 249.
Mandel L, Surattanont F. Hinchazón parotídea
bilateral: una revisión. Oral
Surg Oral Med Oral Pathol Oral Radiol Endod 2002; 93: 221.
Ogasawara N, Takano KI, Kobayashi H, y col. Lesiones
quísticas asociadas con el VIH de la glándula parótida. Auris Nasus Larynx 2017; 44: 126.
Cacopardo B, Pinzone MR, Gussio M, Nunnari G. Alta
prevalencia de anomalías parotídeas entre pacientes infectados por el VHC. Infez Med 2014; 22:31.
O'Connell JE,
George MK, Speculand B, Pahor AL. Infección
micobacteriana de la glándula parótida: una causa inusual de inflamación de la
parótida. J Laryngol Otol
1993; 107: 561.
Chen S, Paul BC, Myssiorek D. Un enfoque algorítmico
para el diagnóstico de la ampliación de la parótida bilateral. Otolaryngol Head Neck Surg 2013; 148: 732.