|
| Hospital "Dr Ángel Pintos" de Azul |
Paciente masculino de 26 años.
MOTIVO DE INTERNACIÓN 21/12/2014: vómitos, diarrea y síndrome febril.
ENFERMEDAD ACTUAL:
Paciente que comineza hace 4 días con cefalea frontal
agregando a las 24 horas anorexia y vómitos. Hace 24 horas presentó dos
deposiciones diarreicas y comienza con fiebre.
Refiere mialgias en pantorrillas y artralgias.Al examen se observa un
paciente en regular estado general que impresiona ictérico.
Se hace laboratorio por guardia donde se
constata alteración de las pruebas hepáticas, renales, además de plaquetopenia,
leucocitosis y anemia. Se interroga sobre exposición a roedores a lo que
responde haber estado trabajando hace 14 días en un silo en relación a cosecha
de soja. Por otro lado el paciente estuvo hace 20 días en una excursión de
pesca donde refiere contacto con barro en los alrededores de una laguna donde pasó la noche.
SE INTERNA.
Se realiza Rx de tórax:
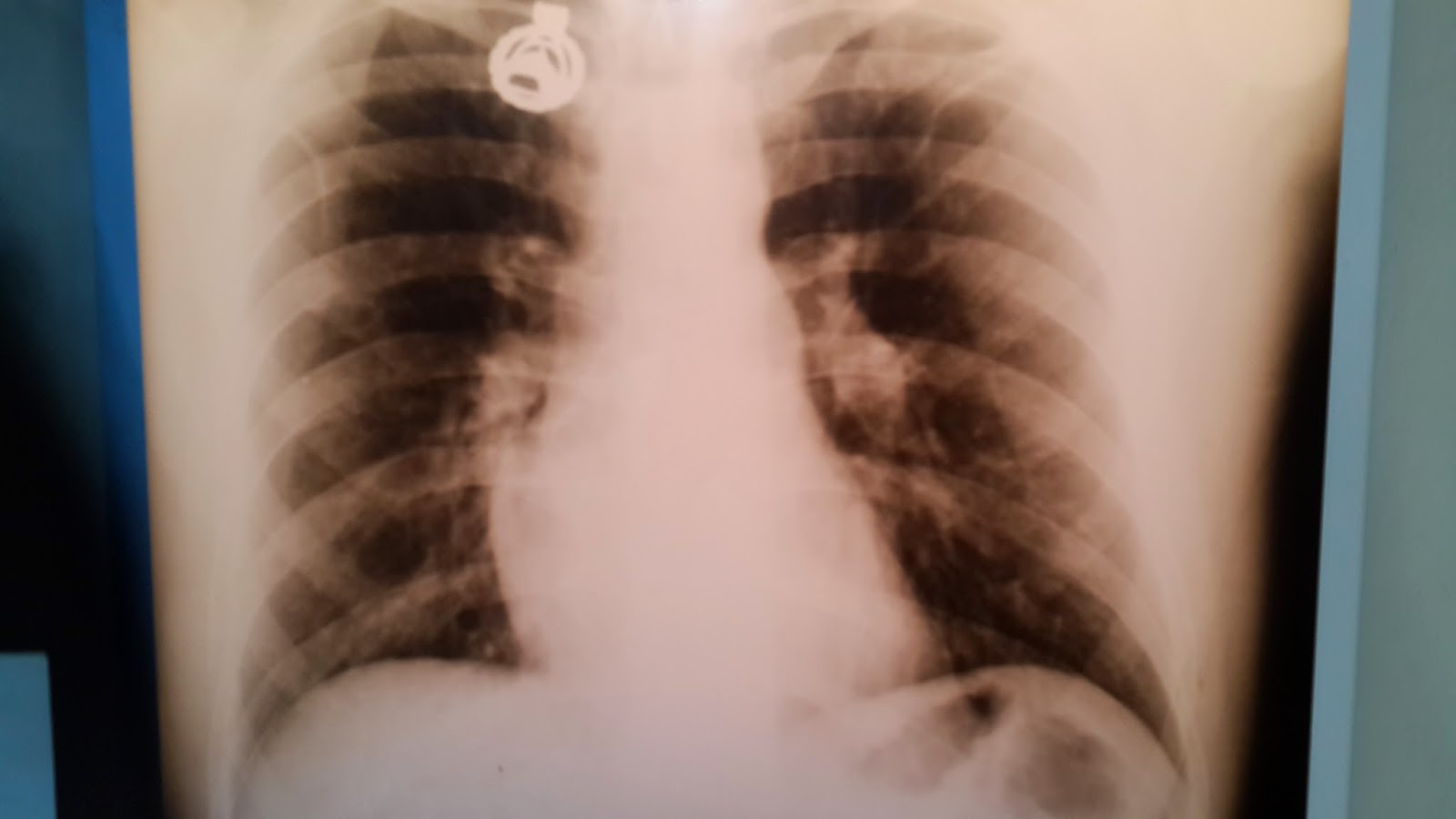 |
| Rx de tórax del ingreso por guardia |
ANTECEDENTES: tabaquismo (20 cigarrillospor día). Niega alergias. No
cirugías.Niega medicación de base. Traumatismo encefalocraneano con pérdida de
conocimiento en 2009.
INTERNACIÓN:
Paciente en regular estado general, lúcido,ubicado temporoespacialmente,
Febril 38°C.
TA: 80/40 mmHg. Frecuencia cardíaca 100 por minuto. Frecuencia
respiratoria 22 por minuto. Ictericia franca de piel y mucosas.
R1, y R2 normales, silencios libres.
Aparato respiratorio buena entrada de aire bilateral
Mialgias a predominio de pantorrillas. Artralgias a predominio de
rodillas.
Pupilas isocóricas, reactivas. Conjuntivas ictéricas, ligera inyección
conjuntival.
Enantema petequial en paladar blando y fauces.
Abdomen blando depresible indolro. No se palpan vísceromegalias.
LABORATORIO: Hb 10,9 g/dl. Hto 33%. GB 10800 (88% granulocitos, 7%
linfocitos, 5%monocitos). Plaquetas 60.000/mm3. TGO 79 UI/L. TGP 49 UI/L. Bilirrubina total 9,8 mg/dl.
Bilirrubina indirecta 9,46 mg/dl. FAL 154 UI/L. Urea 122 mg/dl. Creatinina 3,11
mg/dl.
Na 139 meq/l. K 2,72. Cl 100 meq/l. CPK 747 UI/L. T y C de protrombina
100% 13”. Ph 7,4. PCO2 41,5 mmHg PO2 87,6 mm Hg. HCO3, 30,E. EB +6,8. Sat 98%.
Se comenzó tratamiento empírico con ceftriaxona 1 gr/12 horas.
Diuresis 1800 ml/24 horas.
22/12/2014: Empeoramiento brusco de su estado general, taquipnea,
taquicardia frecuencia 110 por minuto, hipotensión arterial TA 80/60 mmHg,
taquipnea 35 por minuto con mala dinámica respiratoria por lo que se decide
ARM. Al colocar el tubo endotraqueal
vino sangre por el tubo endotraqueal que es aspirada
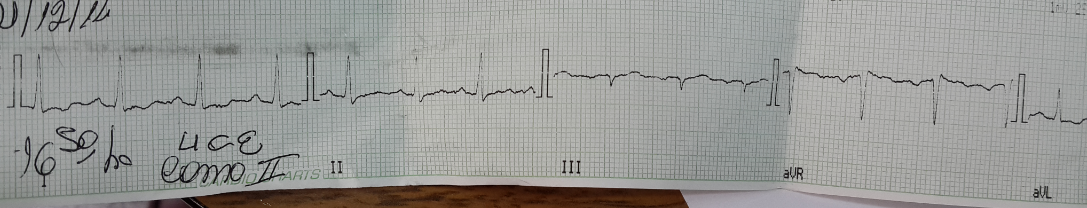
Electrocardiograma: alteraciones difusas inespecíficas de la
repolarización.
Se realiza nueva Rx de tórax que muestra infiltados bilaterales nuevos. Diagnóstico diferencial entre distress respiratorio del adulto, hemorragia pulmonar, insuficiencia cardíaca, bronconeumonía.
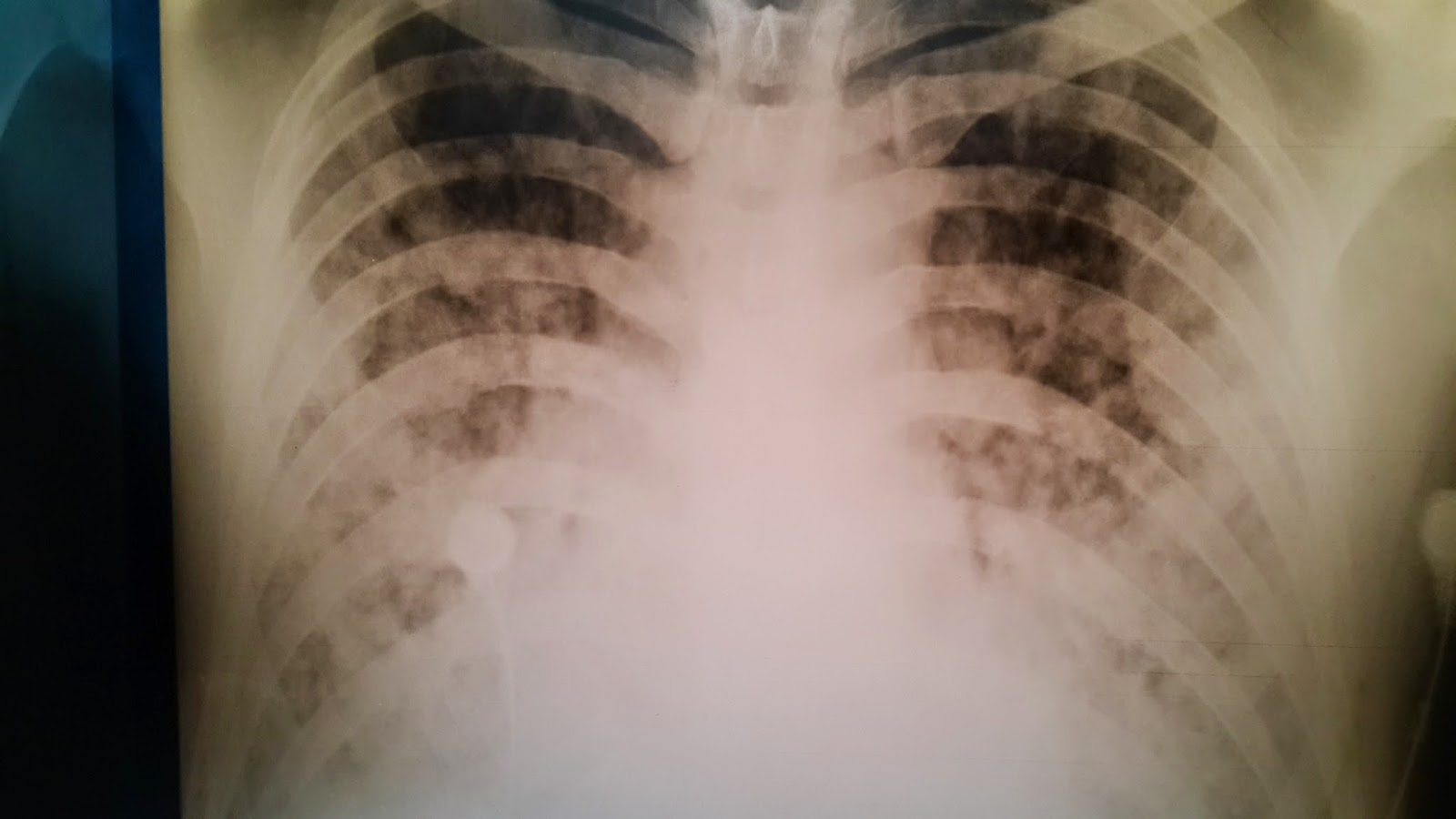 |
| Infiltrados algodonosos bilaterales a las 24 horas del ingreso |
Se plantearon tres diagnósticos diferenciales:
- Fiebre hemorrágica Argentina.
- Infección por hantavirus
- Leptospirosis
23/12/2014
Mal estado general, sigue con ARM. Requerimiento de inotrópicos. Aumento
notable de los parámetros nitrogenados y de la bilirrubina. Caída importante
del hematocrito lo que hace sospechar, asociado a lasangre que viene por el tubo
endotraqueal, hemorragia pulmonar. Quemosis conjuntival. (creatinina 6,1 mg/dl).
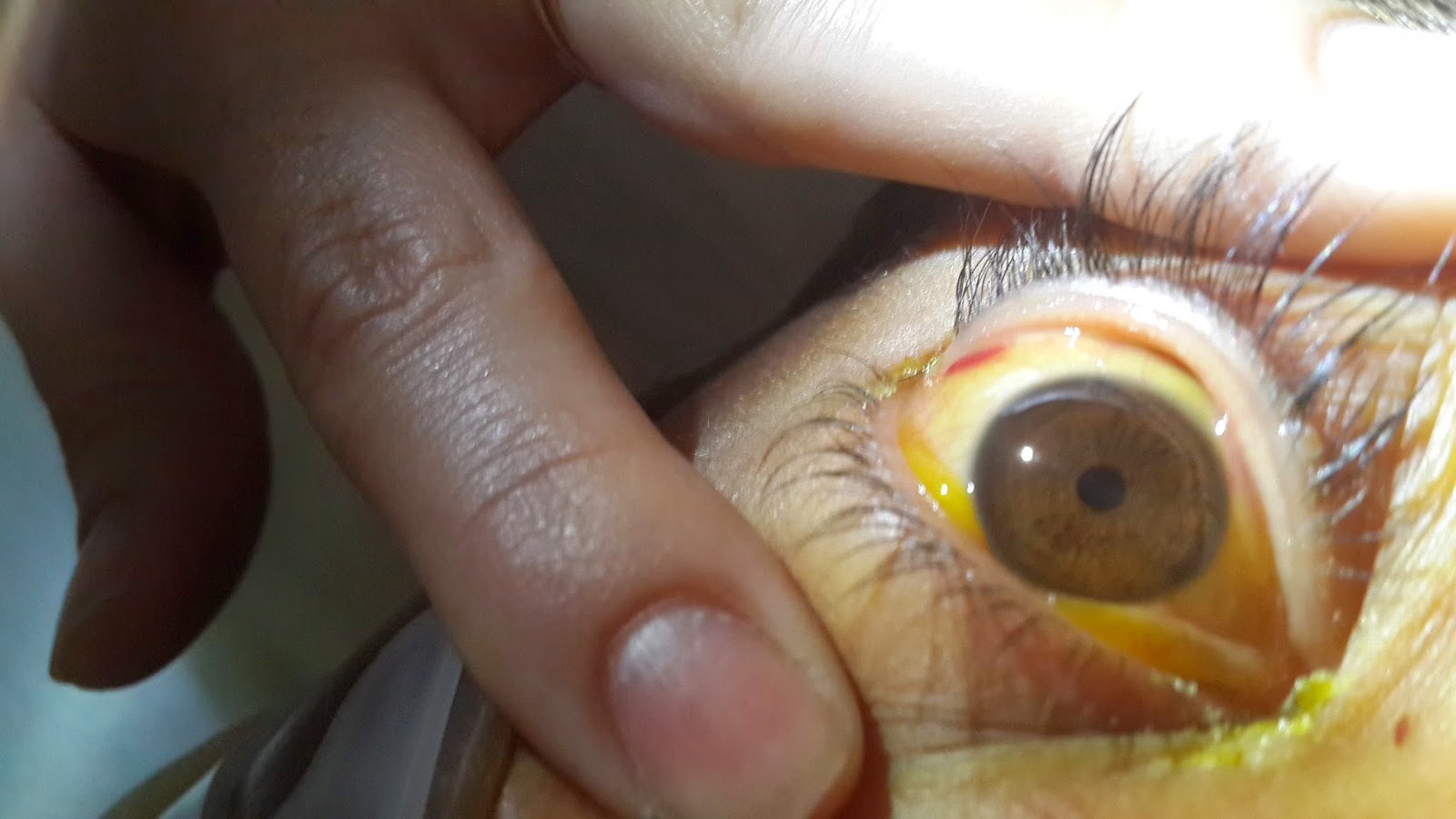 |
| Quemosis e ictericia conjuntival |
Se recibió serología para leptospirosis positiva en títulos bajos.
GR 2940000. Hb 8,9. Hto 27%. GB 11100 (granulocitos 92% linfocitos 5%
monocitos 3%). CPK 680 UI/L.
TGO 71UI/L. TGP 58 UI/L . FAL 129 UI/L. Bilirrubina total 14 mg/dl.
Bilirrubina directa 7 mg/dl.
Urea 179 mg/dl. Creatinina 6,2 mg/dl. Na 137 meq/l. K 3,22 meq/l. Cl 101
meq/l.
Calcemia 8,9 mg/dl. Proteínas totales 5,2 g/dl. Albúmina 2,7 g/dl
Orina: ligeramente turbia, sedimento escasa cantidad, células redondas,
piocitos escasa cantidad, hematíes regular cantidad, se observan cilindros. Coluria franca
24/12/2014: Paciente con cuadro de sepsis y fallo multiorgánico en ARM,
franca ictericia, insuficiencia renal no oligúrica. Normotenso con inotrópicos
(dopamina y noradrenalina), distress respiratorio. Se realiza acocardiograma
que muestra buena función sistólica delVI. Mejora la saturación en posición
prona.
Laboratorio:GR: 3240000. Hb 10. Hto 30%. GB: 17600 (G 79%, L 11%, M 10%).
Plaquetas 38.000/mm3. Urea 192 mg/dl. Creatinina 5,9 mg/dl. TGO 66 UI/L TGP 74
UI/L. FAL 183 UI/L Bilirrubina total 15,68 mg/dl. Directa 9,12 mg/dl. Calcemia
8,7 mg/dl. Albúmina 2,9 g/dl. VSG 140 mm/h
25/12/2014: Paciente levemente mejorado, cuando se intenta bajar la dosis
de medicación miorrelajante el paciente se desadapta al respirador por lo que
se debe aumentar nuevamente la misma. TA 110/60 mm Hg con muy bajas dosis de
inotrópicos. Impresiona más ictérico. Diuresis 1500 ml, balance 300 ml negativo.
Rx de tórax es muy penetrada pero se nota franca mejoría. Por el tubo
endotraqueal viene sangre escasa. Mejoría de la función renal
Laboratorio: GR 3.080000. Hb: 9,5 Hto: 27,9. GB 13600 (granulocitos: 74%
linfocitos: 16%monocitos: 10%). Bilirrubina total 19,8. Bilirrubina directa
10,8. Urea 133 mg/dl. Creatinina 2,93 mg/dl. TGO 57 UI/L. TGP 66 UI/L. FAL: 203
UI/L. Calcemia 8,86. EAB: PH: 7,33. PCO2 65,5 PO2 235,8 mm Hg. HCO3 32,2. EB
+7,7. Sat 99,5%.
Na 148 K 3,18. Cl 102. Ty C de protrombina 18” 80%.
26/12/2014: Mejorado, requerimiento mínimo de inotrópicos pero se
hipotensa al sacárselos completamente. Impresiona más ictérico. Diuresis
conservada, coluria.Me joría notable de la función renal. GR 2700000. Hb:
8,2Hto: 24,4. GB 12800 (Granulocitos 74% L 17% M 9%).
Bilirrubina total 19 mg/dl. Bdirecta 10. FAL: 199UI/LTGO: 53 TGP: 57.
Amilasa 113 mg/dl.
Urea 84. Creatinina 1,53 mg/dl. Proteínas totales 5,9. Na: 147 K: 3 Cl:
105.
EAB: PH: 7,46. PCO2: 47,6 PO2: 103,4. HCO3: 32,1. EB:+8,3. Sat 98%. RX de
tórax: normal
27/12/2014: Paciente estable, normotenso con dosis mínimas de inotrópicos
(110/60 mmHg) Frecuencia cardíaca 86 por minuto, regular. Febril, 38,7°C.
Semiología respiratoria sin cambios.No hay evidencias claras de foco
infeccioso. Mejora la función renal pero aumento de la bilirrubina total.
Laboratorio: GR 2470000 Hto: 22,3 Hb: 7,5. GB: 14000 (granulocitos 77 L:17
M: 6)
Bilirrubina 21 mg/dl. B directa 10,7. Glucemia 102. Urea 114. Creatinina
1,15. TGO: 75 UI/L TGP: 62 UI/L. FAL:
232.
28/12/2014: sin cambios continúa febril
29/12/2014: Sigue febril, sin foco evidente. Rx de tórax normal.
Hemodinámicamente bien, TA 110/75 mmHg.
Francamente ictérico. Coluria.
 |
| Coluria |
Laboratorio: GR 2700000 GB 22600 (granulocitos 86%) Plaquetas 160000.
EAB: Ph 7,39. Pco2 51 mm Hg Po2 90,1. HCO3 30. Eb: +3,9. Saturación 97%
30/12/2014: Igual estado general, presenta picos febriles 2 o 3 por día de
hasta 39°C. Infiltrado dudoso base izquierda en la Rx. Por el tubo endotraqueal
viene abundante sangre. Se realiza BAL para intentar rescatar agente etiológico
del cuadro febril.
01/01/2015: Paciente mejorado, no requiere inotrópicos pero persiste
febril. Hace 2 picos de 38,7°C. Se aisló
acinetobacter del BAL. Gr 2560000 Hto23% Hb 8 g/dl. Gb 20800 (segmentados
88%), Plaquetas 515000. Bilirrubina 33mg/dl indirecta 21. TGO 85 TGP 94
FAL 257.
Actualmente tratado con Tigeciclina 50/12 hs, vancomicina 1 gr/12
meropenem 1 gr/8hs
02/01/2015: Paciente mejorado, no requiere inotrópicos.
Gr 2570000 Hb 7,8 Hto 23%. Gb 12600
(84% segmentados) Plaquetas 510000.
Bilirrubina total 24 B indirecta 13,25. Urea 48. Creatinina 0,71
mg/dl
03/01/2015: Paciente en buen estado general,se extuba con buena
tolerancia. Sigue febril, haciendo dos picos diarios de 38,5 °C. Leve
infiltrado basal izquierdo.
GB 17400 Granulocitos 72%. GR 2920000 Hto 26% Hb 8,8g/dl. Bilirrrubina
total 17,11 B directa 8,03. TGO 97 TGP 155. Urea 40 creatinina 0,8
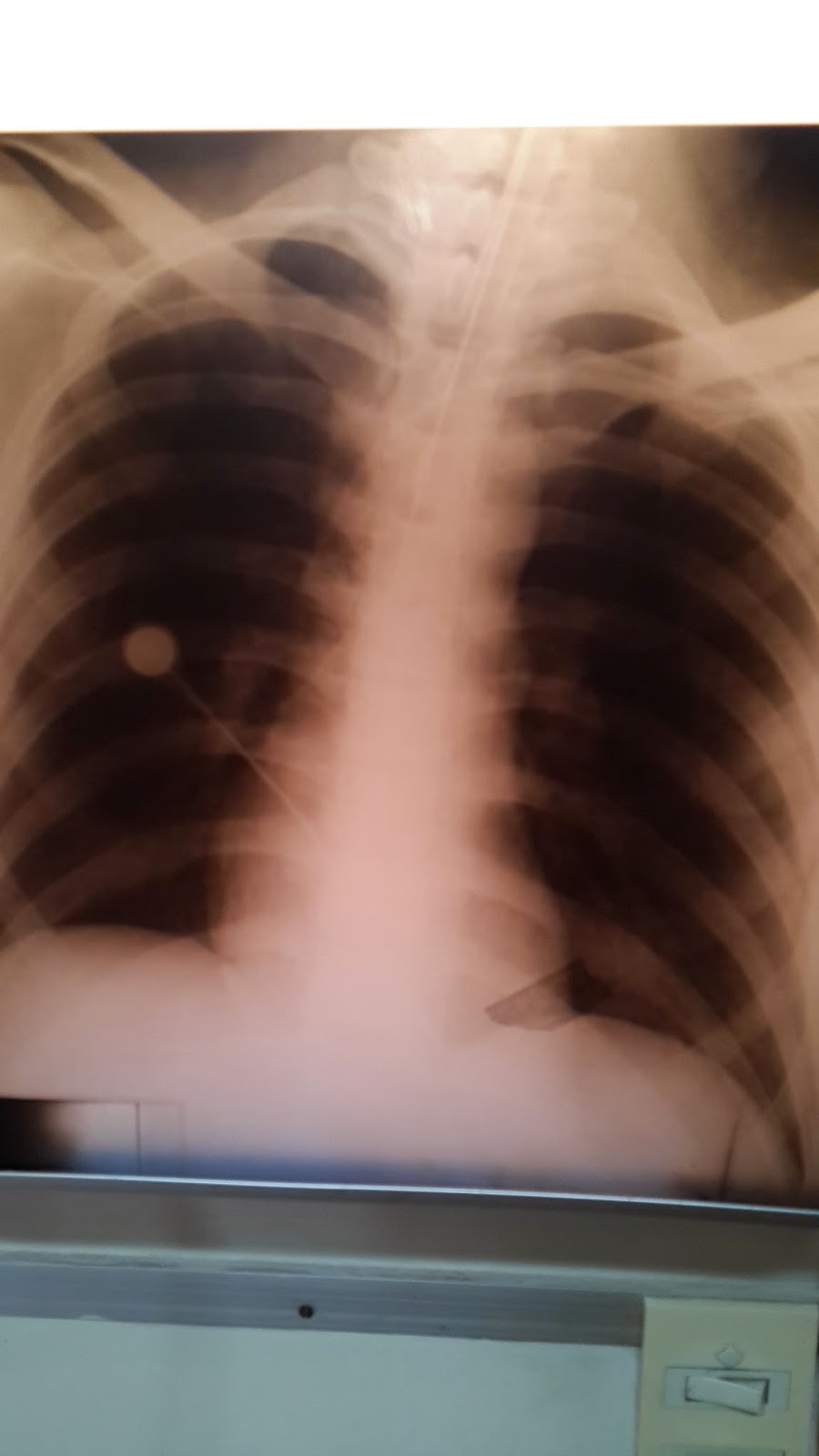 |
| Rx de control completamente normal |
04/01/2014: Buen estado general, afebril. GR 2850000 GB 16600 Hto 26% Hb 9. Bilirrubina total 13,7. Directa
7. TGO 72.TGP 118. FAL 313.
 |
| Paciente completamente recuperado previo al alta |
Se recibe nueva serología para leptospirosis positiva franca con
cuadruplicación de los títulos respecto del valor inicial. Serología para hanta
virus y fiebre hemorrágica Argentina negativos.
05/01/2015 Buen estado general, afebril
06/01/2015 Alta médica.
Diagnóstico: Leptospirosis. Enfermedad de Weil.
CONCLUSIONES DEL CASO
Presentamos un paciente de 26 años con una forma clínica grave de leptospirosis, la llamada
enfermedad de Weil . El paciente presentaba antecedentes epidemiológicos que lo
hacían especialmente vulnerable a la adquisición de la enfermedad como es el
contacto con directo de la piel de miembros inferiores con aguas estancadas y
barro alrededor de 3 semanas antes en una excursión de pesca.
Desgraciadamente
anualmente en nuestro servicio vemos una veintena de casos de leptospirosis, la
mayoría de ellos se presentan con formas leves en formas de síndromes febriles
o seudogripales autolimitados pero en ocasiones somos testigos de este tipo de
presentaciones graves que ponen en riesgo la vida del paciente, y de hecho, a
veces terminan con su deceso ( http://www.elrincondelamedicinainterna.com/2012/04/ateneo-hospital-pintos-04042012-varon.html
). Esta forma clínica de leptospirosis, la forma de Weil se presenta afortunadamente en una minoría de
los casos y la hemorragia pulmonar, como presentó este paciente es una complicación prevalente. A veces se superpone
al síndrome de hemorragia pulmonar, un
síndrome de distress respiratorio agudo que empeora el manejo de estos
pacientes especialmente cuando se agrega insuficiencia renal, la cual la
mayoría de las veces es no oligúrica como sucedió en este caso.
Nuestro paciente presentó dos elementos de laboratorio que son bastante
prevalentes en las formas graves de leptospirosis como son la hipopotasemia
(potasio inicial de 2,7 meq/l), y un aumento importante de la bilirrubina de
hasta 20 mg/dl con aumento leve de transaminasas.
Las alteraciones electrocardIográficas consistentes en alteraciones
inespecíficas de la repolarización se consideraron parte del cuadro de
afectación grave por parte de la enfermedad, probablemente un componente miocardítico tóxico en el contexto de la sepsis, aunque sin expresión ecocardiográfica significativa en cuanto a que no hubo fallo cardíaco lo que nos permitió descartar el edema agudo de pulmón cardiogénico en el cambio entre la primera y la segunda radiografía.
Afortunadamente se comenzó un tratamiento empírico antibacteriano
inmediato apenas internado el paciente lo que seguramente fue el motivo de la
buena evolución final del cuadro