Un año antes, él notó una pequeña masa no dolorosa en la región posterior del testículo derecho, que un clínico a quien consultó, rotuló de epididimitis; la masa pareció desaparecer , o al menos el paciente no la notó nuevamente. Un mes antes de la consulta, los resultados de un examen físico anual de rutina fueron informados como normales; no se describen alteraciones en los testículos.
Diez días antes de la consulta, el testículo derecho comenzó a doler y a crecer rápidamente. El paciente no tuvo fiebre ni síntomas generales. Su clínico de atención primaria comenzó tratamiento con levofloxacina. Los resultados de los estudios de laboratorio, incluyendo análisis de orina, recuento de glóbulos rojos y blancos con fórmula, recuento de plaquetas, eritrosedimentación, y tests de función hepática, renal, y tiroideos fueron normales.
El dolor testicular disminuyó, pero persistió la inflamación. Una semana más tarde, un examen ecográfico llevado a cabo en otro hospital mostró una masa testicular compleja considerada altamente sugestiva de cáncer. El clínico del paciente recomendó una biopsia del testículo, pero el paciente decidió venir a este hospital para una segunda opinión.
Él se sentía bien, y no tenía síntomas constitucionales, gastrointestinales o urinarios. Había estado en excelente estado de salud, no refería alergias, y no tomaba medicaciones. Nunca había tenido infecciones urinarias o epididimitis, y no había antecedentes de hernia inguinal o enfermedades de transmisión sexual. Él nunca había fumado; ocasionalmente tomaba alcohol. Se había casado 4 meses antes y no tenía hijos. Un abuelo había muerto de cáncer de páncreas, y una abuela tenía cáncer, pero el paciente desconocía la localización. No había historia familiar de cáncer testicular ni genitourinario.
En el examen físico, el paciente estaba bien, aunque ansioso. Sus signos vitales y el resultado del examen físico fueron normales; no tenía dolor en mamas ni ginecomastia. EL testículo izquierdo era normal; el testículo derecho contenía una masa firme, de 4 cm de diámetro. Los epidídimos eran normales. Una muestra de sangre fue enviada para realizar marcadores tumorales.
Ese mismo día, más tarde se llevó a cabo un procedimiento diagnóstico.
Diagnóstico Diferencial.
Dr. Donald S. Kaufman: Dr. Saksena, podría comentar los estudios por ultrasonido llevados a cabo en otro hospital?
Dr. Mansi A. Saksena: El estudio por ultrasonido testicular llevado a cabo en otro hospital mostró una masa intratesticular compleja, de 3,1 por 2,9 cm, con componentes quísticos y sólidos, en un testículo derecho agrandado (Figura 1). Un estudio con Doppler mostró mínima vascularización dentro de los componentes sólidos de la masa. El epidídimo derecho y el testículo y el epidídimo izquierdos eran normales.

Figura 1. Imagen Ultrasonográfica del Testículo Derecho.
Un corte transversal a través del testículo derecho (Panel A) muestra una masa intratesticular compleja, con un componente quístico (cabeza de flecha) y un componente sólido(flecha). El tejido testicular normal es visto a lo largo de la región anterior a la masa. Un estudio Doppler (Panel B) revela mínima vascularización en el componente sólido(flecha).
Cuál es el Diagnóstico?
Dado que la masa era intratesticular, se puede descartar el diagnóstico de hernia, varicocele, o hematoma escrotal. Dado que la lesión estaba bien definida, con parénquima testicular adyacente normal, la torsión testicular es improbable. La edad del paciente y la apriencia ultrasonográfica de la masa sugiere que es una neoplasia testicular. (1)
Dr. Kaufman: Dr. Tabatabaei, podría discutir el diagnóstico diferencial de una masa testicular presentándose como esta lo hizo, en un individuo joven?
Dr. Shahin Tabatabaei: El paciente consultó a su clínico de atención primaria por un relativamente abrupto inicio de dolor testicular e inflamación, y una masa en el escroto. Importantes factores a tener en cuenta al formular un diagnóstico diferencial, incluyen la edad del paciente, la rapidez de inicio de sus síntomas, la presencia o ausencia de dolor, fiebre e inflamación local, y los resultados del examen físico. Las masas escrotales pueden ser debidas a neoplasias, inflamación, o defectos anatómicos. El diagnóstico diferencial de una masa escrotal en un adulto joven tal como este, incluyen: cáncer testicular, hidrocele, espermatocele, hernia inguinal, orquiepididimitis, trauma, y quiste epidermoide. Aunque las masas escrotales benignas son más comunes que las malignas, es crucial descartar la posibilidad de causas malignas antes de considerar un manejo conservador.
La mayoría de las masas escrotales estan asociadas con dolor escrotal, mientras que las condiciones no inflamatorias, incluyendo el cáncer testicular, son más a menudo indoloras. Sin embargo, un dolor agudo ocurre en alrededor de 10% de los pacientes con tumores testiculares, usualmente debido a hemorragia intratumoral o epididimitis asociada que puede causar inflamación aguda y dolor. Por lo tanto, una presentación aguda con inflamación y dolor, como en este paciente, no descarta el diagnóstico de cáncer testicular.
La causa inflamatoria más común de una masa escrotal es la epididimitis o la epididimo-orquitis. Este paciente había notado una masa un año antes que fue considerada como una epididimitis. Considerando el relativamente rápido crecimiento del tumor de células germinales testicular (con un tiempo de duplicación de 10 a 30 días), es improbable que esa masa fuese la manifestación inicial de un cáncer testicular. La epidídimo-orquitis está a menudo asociada con síntomas sistémicos tales como fiebre y fatiga, así como síntomas urinarios, que no estaban presentes en este paciente. En raros casos, la sarcoidosis se manifiesta como una masa escrotal, pero el proceso es usualmente bilateral.
La historia clínica es importante, ya que condiciones tales como hidrocele y hernia a menudo desarrollan gradualmente y son crónicas, mientras que un inicio agudo es más específico de infección o torsión. También importante es una historia de trauma, que no está presente en este caso.
En el examen físico, un hidrocele, un espermatocele, o hernia, son blandos más que duros a la palpación. La transiluminación puede ayudar a diferenciar entre una hernia de un espermatocele y de un hidrocele. Los quistes epidermoides estan fijos a la piel. La presencia de inflamación localizada del epidídimo, con o sin inflamación testicular difusa y dolor, son sugestivos de epididimitis o epidídimo-orquitis. El cáncer testicular usualmente es una masa discreta, dura, indolora dentro del testículo; sin embargo, todo el testículo puede estar agrandado, como en este caso, y doloroso. Una masa firme, o dura, no dolorosa en un paciente de entre 18 a 45 años debe sospecharse maligna hasta que no se demuestre lo contrario. En casos tales como este, que se presentó inicialmente con dolor testicular difuso e inflamación, la distinción entre cáncer e infección es dificultosa de hacer. En tal caso, estoy convencido que un estudio por ultrasonido del testículo es el próximo paso. Aunque este examen puede no ser requerido en casos en que la historia y los hallazgos del examen físico son típicos, esto puede confirmar el diagnóstico en casos dificultosos, y permite realizar el tratamiento correcto. Un ensayo con antibióticos, a los que estos pacientes son sometidos, como en este paciente, puede conducir a una inaceptable pérdida de tiempo y al retraso diagnóstico, especialmente si el paciente no es confiable para el seguimiento. Un retraso en el diagnóstico de cáncer testicular puede estar asociado con estadios más avanzados de enfermedad, y puede afectar la chance de curación. (2,3) Una reevaluación por el clínico 1 semana después mostró una masa persistente indolora. En este punto, un examen ultrasónico fue llevada a cabo.
Dr. Kaufman: El clínico del paciente aconsejó una biopsia testicular diagnóstica. El paciente me vino a ver 2 días más tarde para una segunda opinión. Dado que un cáncer testicular fue mi diagnóstico presuntivo, yo recomendé una orquiectomía radical inmediata, que es el procedimiento de elección cuando se sospecha cáncer testicular. Se extrajo sangre para medida de marcadores tumorales, la subunidad beta de gonadotrofina coriónica humana, y alfa fetoproteína, y vió al Dr. Tabatabaei más tarde ese mismo día.
Dr. Tabatabaei: El diagnóstico de cáncer testicular es usualmente un diagnóstico clínico. El uso de ultrasonografía escrotal es meramente confirmatorio. La presentación de este paciente fue característica de un proceso neoplásico, así que el Dr Kaufman y yo, no vimos la necesidad de esperar una TAC o los resultados de los marcadores tumorales. Más tarde, ese mismo día, llevé a cabo una orquiectomía derecha radical.
Discusión Patológica.
Dr. Robert H. Young: La pieza fue recibida para consulta preoperatoria. El testículo contenía una masa que era obvia a la palpación; los cortes revelaron una masa de 4 cm de diámetro con una apariencia multicolor, que incluía áreas sólidas de color amarillo a blancas, hemorragias focales, y áreas quísticas menores. (Figura 2A). El diagnóstico más probable de una masa de ese aspecto, particularmente a la edad de este paciente es, ya sea, un carcinoma embrionario puro, o un tumor de células germinales mixto, que a menudo tiene un componente de carcinoma embrionario. El seminoma es usualmente una neoplasia más uniforme, color blanco crema, aunque puede exhibir hemorragia o necrosis. (4)
Figura 2. Hallazgos Macroscópicos y Microscópicos del Tumor Testicular.
La superficie de corte del tumor testicular muestra principalmente un tejido sólido amarillo blanquecino, con hemorragia focal y unos pocos quistes (Panel A). El tumor tiene el patrón típicamente papilar y glandular (Panel B, hematoxilina y eosina) del carcinoma embrionario. Una visión a gran aumento (Panel C, hematoxilina y eosina) muestra los núcleos pleomórficos y citoplasma oscuro que son característicos del carcinoma embrionario. Un componente teratomatoso (Panel D, hematoxilina y eosina) tiene epitelio escamoso con producción de queratina (izquierda) y glándulas teratomatosas (derecha).
En el examen microscópico, el tumor era principalmente carcinoma embrionario, que es un adenocarcinoma primitivo del testículo con patrón papilar, glandular, y sólido. Las células tumorales son de aspecto altamente malignas, con pleomorfismo, y nucléolos prominentes (Figura 2 C). El patrón papilar y glandular descarta seminoma. Había focos menores de tumor del saco de yolk con un patrón microquístico y focos teratomatosos (Figura 2D). Los seminomas pueden ocasionalmente formar espacios, (5) pero la apariencia es diferente de los carcinomas embrionarios. Una distinción entre seminoma y carcinoma embrionario puede usualmente ser hecha con tinciones con hematoxilina y eosina, pero, si está indicada, la inmunohistoquímica puede ayudar a distinguir, ya que los carcinomas embrionarios son negativos para c-kit (CD117) y positivos para CD30 , a diferencia del seminoma. (6)
El tumor también tenía células gigantes sincitiotrofoblásticas, que son comunes en el carcinoma embrionario, y que a veces conducen a diagnósticos erróneos de coriocarcinoma. Muchos tumores testiculares con un componente de carcinoma embrionario tienen al menos un componente teratomatoso menor. Esta muy común mezcla de carcinoma embrionario y teratomas era llamado teratocarcinoma en la literatura antigua.
En el examen microscópico, el tumor, 60% del cual era carcinoma embrionario, se mostraba confinado al testículo, sin penetración de la túnica albugínea. Había invasión vascular focal.
Discusión del Manejo.
La superficie de corte del tumor testicular muestra principalmente un tejido sólido amarillo blanquecino, con hemorragia focal y unos pocos quistes (Panel A). El tumor tiene el patrón típicamente papilar y glandular (Panel B, hematoxilina y eosina) del carcinoma embrionario. Una visión a gran aumento (Panel C, hematoxilina y eosina) muestra los núcleos pleomórficos y citoplasma oscuro que son característicos del carcinoma embrionario. Un componente teratomatoso (Panel D, hematoxilina y eosina) tiene epitelio escamoso con producción de queratina (izquierda) y glándulas teratomatosas (derecha).
En el examen microscópico, el tumor era principalmente carcinoma embrionario, que es un adenocarcinoma primitivo del testículo con patrón papilar, glandular, y sólido. Las células tumorales son de aspecto altamente malignas, con pleomorfismo, y nucléolos prominentes (Figura 2 C). El patrón papilar y glandular descarta seminoma. Había focos menores de tumor del saco de yolk con un patrón microquístico y focos teratomatosos (Figura 2D). Los seminomas pueden ocasionalmente formar espacios, (5) pero la apariencia es diferente de los carcinomas embrionarios. Una distinción entre seminoma y carcinoma embrionario puede usualmente ser hecha con tinciones con hematoxilina y eosina, pero, si está indicada, la inmunohistoquímica puede ayudar a distinguir, ya que los carcinomas embrionarios son negativos para c-kit (CD117) y positivos para CD30 , a diferencia del seminoma. (6)
El tumor también tenía células gigantes sincitiotrofoblásticas, que son comunes en el carcinoma embrionario, y que a veces conducen a diagnósticos erróneos de coriocarcinoma. Muchos tumores testiculares con un componente de carcinoma embrionario tienen al menos un componente teratomatoso menor. Esta muy común mezcla de carcinoma embrionario y teratomas era llamado teratocarcinoma en la literatura antigua.
En el examen microscópico, el tumor, 60% del cual era carcinoma embrionario, se mostraba confinado al testículo, sin penetración de la túnica albugínea. Había invasión vascular focal.
Discusión del Manejo.
Dr. Kaufman: En este caso, el procedimiento esencial y los tests para el diagnóstico clínico, patológico y estadificación del tumor de células germinales del testículo, incluyó la orquiectomía radical, tests para marcadores tumorales, y TAC. Dr. Saksena, podría describirnos los hallazgos de la TAC tóraco-abdómino-pélvica posoperatoria?
Dr. Saksena: La TAC de tórx, abdomen y pelvis fue llevada a cabo el día después de la cirugía. No había nódulos pulmonares ni linfadenopatías en el mediastino, retroperitoneo o pelvis.
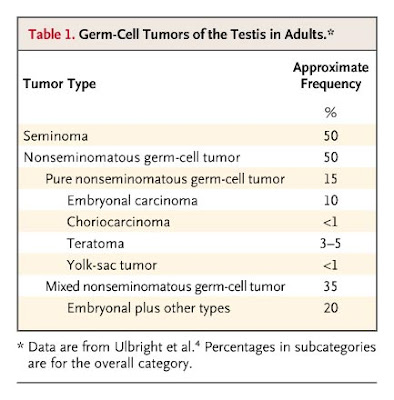
Dr. Kaufman: El tumor de células germinales de testículo es infrecuente pero no raro. La edad usual en el momento del diagnóstico es 18 a 40 años, y esos tumores son las neoplasias sólidas más comunes en hombres entre los 20 y los 34 años. Hay varios tipos histológicos y la combinación de todos ellos. (Tabla 1)
El Grupo Colaborativo de Cáncer de Células Germinales (7) tiene tres categorías de pronóstico, bueno, intermedio, y malo (Tabla 2) basado en la combinación de elementos histológicos, localización en la presentación, estadio, y marcadores tumorales.
Tabla 1. Tumores Testiculares de Células Germinales en Adultos.
Tabla 2. Factores Pronósticos y Sobrevida entre Pacientes con Tumores Testiculares de Células Germinales No-Seminomatosos
Estadificación del Cáncer Testicular.
Además del sistema de estadificación TNM (tumor-nódulo-metástasis) para las neoplasias testiculares, el actual sistema incluye una categoría para marcadores tumorales (Tabla 3). (8) En este paciente, el nivel sérico de la sub unidad beta de la gonadotrofina coriónica humana fue de 16 mUI/ml (normal menos de 5), y la alfa-fetoproteína fue de 10,5 ng/ml (normal menos de 6,1). La LDH era normal. En base al tamaño del tumor, y el nivel de marcadores tumorales, el tumor es un estadío IA, cayendo en el grupo de buen pronóstico.

Tabla 3. Sistema de Estadificación para Estadios Tempranos de los Tumores Testiculares de Células Germinales.
Tratamiento de Estadios Tempranos de Tumores Testiculares de Células Germinales No-Seminomatosos.
Actualmente hay controversia en relación al tratamiento óptimo de los estadios IA, IB, y IIA en los cánceres testiculares. Hay acuerdo general en que los tumores estadio IIB deben ser manejados, al menos inicialmente, con quimioterapia. La radioterapia, el tratamiento de elección para los pacientes con seminoma estadio I, no se usa en el manejo inicial de los estadios tempranos de los tumores testiculares germinales no-seminomatosos. Así, las tres opciones adyuvantes de tratamiento son: la vigilancia activa, la disección primaria de los ganglios linfáticos retroperitoneales, y la quimioterapia. Todas las opciones resultan en curas de 99% de los casos tales como este, pero dos tercios de los pacientes están ya curados después de la orquiectomía. Ya que todos los tratamientos adyuvantes están asociados a efectos colaterales, el objetivo es proveer una tratamiento adyuvante a la medida de cada paciente en riesgo de recidiva y evitar el tratamiento adyuvante para aquellos de menor riesgo de recidiva.
Vigilancia Activa.
Dado que los pacientes con estadio I de los tumores de células germinales tienen una tasa de sobrevida a los 5 años cercana al 100%, algunos investigadores han tratado de reducir la toxicidad de la terapia a largo plazo, incluyendo la eliminación de la disección de los ganglios linfáticos retroperitoneales de rutina para pacientes seleccionados. La vigilancia (por ejemplo la observación sola después de la orquiectomía) es segura si se realizan periódicamente los tests de laboratorio, los estudios radiológicos, y los controles clínicos. Aunque la tasa de recidiva es 20 a 30% en pacientes con estadio I de los tumores germinales no-seminomatosos, más del 98% de esos cánceres se curarán eventualmente. (9) La ventaja de la vigilancia es que al menos 70% de los pacientes no necesitan tratamiento después de la orquiectomía. Una desventaja es que hasta el 30% de los pacientes deben someterse eventualmente a 4 o más ciclos de quimioterapia, con los efectos colaterales asociados. Más aún, el estricto seguimiento puede inducir stress y alienta a la no adherencia.
Los protocolos de vigilancia activa varían entre las distintas instituciones, (10,11) pero típicamente incluyen medidas mensuales de los marcadores tumorales, e imágenes regularmente por 2 años; Yo recomiendo TAC de tórax y abdomen cada 3 meses. Ya que las principales recidivas en pacientes con tumores de células germinales no-seminomatosos ocurren dentro de los primeros 2 años y son raros después de los 5 años.
El paciente bajo discusión es un excelente candidato para la vigilancia activa. Sus marcadores tumorales cayeron a niveles indetectables después de la orquiectomía, su TAC fue normal, y la compliance no fue claramente un problema, en cuanto a obtener los tests sanguíneos necesarios para marcadores tumorales, radiografías de tórax, y TAC abdominales durante la duración de la vigilanacia. (9)
Disección Primaria de Ganglios Retroperitoneales.
Entre los pacientes con estadio I, los tumores de células germinales no-seminomatosos quienes no tienen evidencias de compromiso retroperitoneal en las imágenes, la disección de los ganglios retroperitoneales muestra compromiso de los mismos en 30%. Este procedimiento es una atractiva alternativa para pacientes de los cuales no se puede tener una seguridad de su compliance con la vigilancia activa, o aquellos a los que saber que que 30% de los pacientes recidivan y existe la probabilidad en este caso de ser sometidos a quimioterapia, los hace una alternativa inaceptable. Una comparación retrospectiva de la disección de ganglios retroperitoneales y la vigilancia activa para pacientes con estadio I de enfermedad, la tasa de sobrevida fue superior al 98% en ambas opciones. (12)
Un más avanzado estadio y la presencia de marcadores tumorales persistentemente elevados después de la orquiectomía son predictores independientes de progresión. En un estudio de pacientes con estadio I a IIA de enfermedad y niveles normales de marcadores después de la orquierctomía, la tasa de sobrevida libre de progresión a los 4 años después de la disección de ganglios retroperitoneales fue de 96%. (13) Este procedimiento representa una opción aceptable para la intervención primaria en estadios I y IIA de los tumores testiculares de células germinales. Esto no está indicado si los marcadores tumorales permanecen elevados después de la orquiectomía o si el estadio clínico es IIB o mayor.
La disección de los ganglios retroperitoneales conlleva un pequeño riesgo de complicaciones que pueden ocurrir con cualquier cirugía mayor del abdomen. En particular, este procedimiento confiere riesgo de eyaculación retrógrada y subsecuente infertilidad (riesgo que puede reducirse con el reparo y disección cuidadosa de los nervios), y obstrucción del intestino delgado debido a adherencias operatorias.
Quimioterapia.
Una tercera alternativa para pacientes con estadio temprano de enfermedad es un curso corto (uno a tres ciclos) de quimioterapia sistémica primaria como un medio alternativo tanto de la disección de ganglios retroperitoneales como de la vigilancia activa. Para pacientes con estadio IIB o mayores y para aquellos con marcadores tumorales elevados después de la orquiectomía, la quimioterapia es el tratamiento de elección.
La quimioterapia basada en cisplatino, la piedra angular en el tratamiento de las neoplasias de células germinales de los testículos, está asociada a complicaciones que incluyen el fenómeno de Raynaud, (14) neuropatía periférica, (15) nefropatía, y leucemia secundaria. (16) Lo más importante, un número de estudios han mostrado riesgo aumentado de enfermedad cardiovascular entre los sobrevivientes de los tumores testiculares de células germinales tratados con cisplatino. (17,18,19,20,21,22). Los pacientes con cáncer testicular son típicamente pacientes jóvenes en ese momento y usualmente sobreviven muchos años. Así, la potencialidad de enfermedad cardiovascular debe ser considerada cuando se decide si usar quimioterapia, y es un antecedente a tener en cuenta en pacientes que han recibido quimioterapia en el pasado. (23)
Dado que el tumor de este paciente cae en la categoría de buen pronóstico y debido al riesgo asociado a la quimioterapia, yo no recomendé quimioterapia como una opción.
Actualmente hay controversia en relación al tratamiento óptimo de los estadios IA, IB, y IIA en los cánceres testiculares. Hay acuerdo general en que los tumores estadio IIB deben ser manejados, al menos inicialmente, con quimioterapia. La radioterapia, el tratamiento de elección para los pacientes con seminoma estadio I, no se usa en el manejo inicial de los estadios tempranos de los tumores testiculares germinales no-seminomatosos. Así, las tres opciones adyuvantes de tratamiento son: la vigilancia activa, la disección primaria de los ganglios linfáticos retroperitoneales, y la quimioterapia. Todas las opciones resultan en curas de 99% de los casos tales como este, pero dos tercios de los pacientes están ya curados después de la orquiectomía. Ya que todos los tratamientos adyuvantes están asociados a efectos colaterales, el objetivo es proveer una tratamiento adyuvante a la medida de cada paciente en riesgo de recidiva y evitar el tratamiento adyuvante para aquellos de menor riesgo de recidiva.
Vigilancia Activa.
Dado que los pacientes con estadio I de los tumores de células germinales tienen una tasa de sobrevida a los 5 años cercana al 100%, algunos investigadores han tratado de reducir la toxicidad de la terapia a largo plazo, incluyendo la eliminación de la disección de los ganglios linfáticos retroperitoneales de rutina para pacientes seleccionados. La vigilancia (por ejemplo la observación sola después de la orquiectomía) es segura si se realizan periódicamente los tests de laboratorio, los estudios radiológicos, y los controles clínicos. Aunque la tasa de recidiva es 20 a 30% en pacientes con estadio I de los tumores germinales no-seminomatosos, más del 98% de esos cánceres se curarán eventualmente. (9) La ventaja de la vigilancia es que al menos 70% de los pacientes no necesitan tratamiento después de la orquiectomía. Una desventaja es que hasta el 30% de los pacientes deben someterse eventualmente a 4 o más ciclos de quimioterapia, con los efectos colaterales asociados. Más aún, el estricto seguimiento puede inducir stress y alienta a la no adherencia.
Los protocolos de vigilancia activa varían entre las distintas instituciones, (10,11) pero típicamente incluyen medidas mensuales de los marcadores tumorales, e imágenes regularmente por 2 años; Yo recomiendo TAC de tórax y abdomen cada 3 meses. Ya que las principales recidivas en pacientes con tumores de células germinales no-seminomatosos ocurren dentro de los primeros 2 años y son raros después de los 5 años.
El paciente bajo discusión es un excelente candidato para la vigilancia activa. Sus marcadores tumorales cayeron a niveles indetectables después de la orquiectomía, su TAC fue normal, y la compliance no fue claramente un problema, en cuanto a obtener los tests sanguíneos necesarios para marcadores tumorales, radiografías de tórax, y TAC abdominales durante la duración de la vigilanacia. (9)
Disección Primaria de Ganglios Retroperitoneales.
Entre los pacientes con estadio I, los tumores de células germinales no-seminomatosos quienes no tienen evidencias de compromiso retroperitoneal en las imágenes, la disección de los ganglios retroperitoneales muestra compromiso de los mismos en 30%. Este procedimiento es una atractiva alternativa para pacientes de los cuales no se puede tener una seguridad de su compliance con la vigilancia activa, o aquellos a los que saber que que 30% de los pacientes recidivan y existe la probabilidad en este caso de ser sometidos a quimioterapia, los hace una alternativa inaceptable. Una comparación retrospectiva de la disección de ganglios retroperitoneales y la vigilancia activa para pacientes con estadio I de enfermedad, la tasa de sobrevida fue superior al 98% en ambas opciones. (12)
Un más avanzado estadio y la presencia de marcadores tumorales persistentemente elevados después de la orquiectomía son predictores independientes de progresión. En un estudio de pacientes con estadio I a IIA de enfermedad y niveles normales de marcadores después de la orquierctomía, la tasa de sobrevida libre de progresión a los 4 años después de la disección de ganglios retroperitoneales fue de 96%. (13) Este procedimiento representa una opción aceptable para la intervención primaria en estadios I y IIA de los tumores testiculares de células germinales. Esto no está indicado si los marcadores tumorales permanecen elevados después de la orquiectomía o si el estadio clínico es IIB o mayor.
La disección de los ganglios retroperitoneales conlleva un pequeño riesgo de complicaciones que pueden ocurrir con cualquier cirugía mayor del abdomen. En particular, este procedimiento confiere riesgo de eyaculación retrógrada y subsecuente infertilidad (riesgo que puede reducirse con el reparo y disección cuidadosa de los nervios), y obstrucción del intestino delgado debido a adherencias operatorias.
Quimioterapia.
Una tercera alternativa para pacientes con estadio temprano de enfermedad es un curso corto (uno a tres ciclos) de quimioterapia sistémica primaria como un medio alternativo tanto de la disección de ganglios retroperitoneales como de la vigilancia activa. Para pacientes con estadio IIB o mayores y para aquellos con marcadores tumorales elevados después de la orquiectomía, la quimioterapia es el tratamiento de elección.
La quimioterapia basada en cisplatino, la piedra angular en el tratamiento de las neoplasias de células germinales de los testículos, está asociada a complicaciones que incluyen el fenómeno de Raynaud, (14) neuropatía periférica, (15) nefropatía, y leucemia secundaria. (16) Lo más importante, un número de estudios han mostrado riesgo aumentado de enfermedad cardiovascular entre los sobrevivientes de los tumores testiculares de células germinales tratados con cisplatino. (17,18,19,20,21,22). Los pacientes con cáncer testicular son típicamente pacientes jóvenes en ese momento y usualmente sobreviven muchos años. Así, la potencialidad de enfermedad cardiovascular debe ser considerada cuando se decide si usar quimioterapia, y es un antecedente a tener en cuenta en pacientes que han recibido quimioterapia en el pasado. (23)
Dado que el tumor de este paciente cae en la categoría de buen pronóstico y debido al riesgo asociado a la quimioterapia, yo no recomendé quimioterapia como una opción.
Dr. Tabatabaei, aconsejaría la disección de ganglios retroperitoneales en este caso
Dr. Tabatabaei: El paciente tiene estadio I de enfermedad. Aproximadamente 60% de su tumor es carcinoma embrionario, y la invasión linfovascular estaba presente sólo focalmente. Aunque el estadio I de los tumores testiculares de células germinales no-seminomatosos que tienen más de 50% de carcinoma embrionario, y aquellos con invasión linfovascular, se han visto asociados a riesgo de recidiva, (10) en este caso, la invasión vascular era mínima, y los niveles de marcadores tumorales era indetectable 2 semanas después de la orquiectomía. Este paciente es un buen candidato para la vigilancia activa; la quimioterapia puede ser usada si él tiene recidiva. Yo recomendaría disección de ganglios retroperitoneales sólo si el tumor recidiva y si hay masas tumorales residuales después de la quimioterapia para enfermedad recidivada.
Dr. Kaufman: Nosotros discutimos ventajas y desventajas de la disección de ganglios retroperitoneales con el paciente, pero para un tumor estadio I, nosotros preferimos vigilancia activa como se hizo en este paciente. Él se opuso enfáticamente a la disección de ganglios retroperitoneales, y estuvo de acuerdo al seguimiento estricto. Él está siendo seguido por el servicio de Oncología en su localidad, con medida mensual de marcadore stumorales y Rx de tórax mensuales. Dieciocho meses después de la operación, él se siente bien, sin evidencias de recurrencia.
Diagnóstico Anatómico.
Tumor Testicular de Células Germinales Mixto (carcinoma embrionario, teratoma, y tumor del saco de yolk).
Traducción de:
Case 6-2007 — A 28-Year-Old Man with a Mass in the Testis
Donald S. Kaufman, M.D., Mansi A. Saksena, M.D., Robert H. Young, M.D., and Shahin Tabatabaei, M.D.
Volume 356:842-849 February 22, 2007 Number 8.
CASE RECORDS OF THE MASSACHUSETTS GENERAL HOSPITAL
The New England Journal of Medicine.
Conclusiones del Caso.
Este joven paciente consultó por una masa testicular dolorosa que presentaba crecimiento rápido, de diez días de evolución. Llamativamente, el paciente había visitado a su médico un mes antes, por un examen físico anual de rutina, en el cual no se constataron alteraciones en el examen testicular.
Si bien la probabilidad de que un mes antes, el testículo fuera normal es cierta, dado el crecimiento rápido de este tipo de tumores, también es probable que el examen testicular no haya sido realizado.
En una visita anual de rutina, cuántos de los médicos clínicos llevamos a cabo un examen sistemático del aparato genital masculino?
Una visita anual de rutina, es una oportunidad única de detectar en el consultorio, una innumerable cantidad de patologías, antes de que estas sean el motivo de consulta.
También es una excelente oportunidad de sentirnos gratificados en nuestra práctica médica, interrumpiendo la evolución natural de una enfermedad que puede ser de otro modo mortal.
Lamentablemente muchas veces cuando nos enfrentamos a un paciente que nos consulta por un “chequeo”, automáticamente bajamos nuestro nivel de atención en el interrogatorio, en el examen físico, y conducimos la consulta en “piloto automático”.
Para contrarrestar esos “vicios”, debemos estar atentos, y debemos ser sistemáticos en nuestro examen, que debe ser realizado exhaustivamente, de la misma forma que lo haríamos frente a un paciente portador de una patología que motiva la consulta.
Dentro de este examen sistemático, el examen testicular, así como el resto del aparato genital masculino es insoslayable.
Este examen, debiera ser el último que se realiza después de haber completado el resto de los sistemas.
Es de buena práctica explicar al paciente el motivo del examen, ya que tanto el paciente como el propio médico pueden sentirse algo incómodos durante el mismo.
Es conveniente comenzar con el paciente parado, frente al médico sentado de frente, provisto de guantes. De esta manera se puede apreciar más fácilmente la ubicación de los testículos, así como la presencia de hernias. Hay que observar la región inguinal, la piel, el pene y escroto. Retirar hacia atrás el prepucio en pacientes no circuncidados, y observar cuidadosamente el glande y el surco balanoprepucial, en busca de úlceras genitales, chancros, candidiasis etc. Observar el orificio uretral. La implantación, densidad y el ensortijamiento del vello pubiano, que son expresión de la condición hormonal del paciente. Muchas veces la presencia de pediculosis o escabiosis es un hallazgo del examen de rutina. Se debe palpar el pene en busca de induraciones fibrosis, o alteraciones de su curvatura (De Quervain).
En el examen testicular es habitual que el testículo izquierdo esté ligeramente más bajo que el derecho en el escroto. La palpación debe ser suave, entre el pulgar y los dedos índice y medio. Asegurarse de la presencia de ambos, y si solo se palpa uno, palpar cuidadosamente el trayecto inguinal en busca de un testículo no descendido. Aprovechar esta parte del examen para buscar hernias en el trayecto inguinal. Siempre la palpación debe ser comparativa.
La presencia de un nódulo en un testículo es siempre motivo de preocupación. Ocasionalmente el testículo o la región escrotal pueden estar agrandados, y en esos casos es frecuente la presencia de hidrocele que podemos diagnosticar fácilmente con transiluminación, que en este caso es positiva, a diferencia de las orquiepididimitis, o los tumores, en que la transiluminación es negativa.
Finalmente digamos que el tiempo es un factor fuertemente condicionante de la consulta médica por razones que todos conocemos y que no se discutirán aquí. Por ello, tenemos que confeccionar un interrogatorio y sobre todo un examen físico sistemático a nuestra medida, para pacientes que nos consultan por un examen médico de rutina. Un examen sistemático que evite cometer errores por omisión. Ese examen sistemático debe incluir el examen genital masculino.
Source Information
From the Departments of Hematology–Oncology (D.S.K.), Radiology (M.A.S.), Pathology (R.H.Y.), and Urology (S.T.), Massachusetts General Hospital; and the Departments of Medicine (D.S.K.), Radiology (M.A.S.), Pathology (R.H.Y.), and Urology (S.T.), Harvard Medical School.
1) Harisinghani MG, Saksena M, Ross RW, et al. A pilot study of lymphotroph-ic nanoparticle-enhanced magnetic resonance imaging technique in early stage testicular cancer: a new method for noninvasive lymph node evaluation. Urology 2005;66:1066-1071. [CrossRef][ISI][Medline]
2) Prout GR Jr, Griffin PP. Testicular tumors: delay in diagnosis and influence on survival. Am Fam Physician 1984;29:205-209. [ISI][Medline]
3) Bosl GJ, Vogelzang NJ, Goldman A, et al. Impact of delay in diagnosis on clinical stage of testicular cancer. Lancet 1981;2:970-973. [CrossRef][ISI][Medline]
4) Ulbright TM, Amin MB, Young RH. Tumors of the testis, adnexa, spermatic cord, and scrotum. Atlas of tumor pathology. 3rd series. Fascicle 25. Washington, DC: Armed Forces Institute of Pathology, 1999.
5) Ulbright TM, Young RH. Seminoma with tubular, microcystic, and related patterns: a study of 28 cases of unusual morphologic variants that often cause confusion with yolk sac tumor. Am J Surg Pathol 2005;29:500-505. [CrossRef][ISI][Medline]
6) Emerson RE, Ulbright TM. The use of immunohistochemistry in the differential diagnosis of tumors of the testis and paratestis. Semin Diagn Pathol 2005;22:33-50. [CrossRef][ISI][Medline]
7) International Germ Cell Cancer Collaborative Group. International germ cell consensus classification: a prognostic factor-based staging system for metastatic germ cell cancers. J Clin Oncol 1997;15:594-603. [Free Full Text]
8) Testis. In: Greene FL, Page DL, Fleming ID, et al., eds. AJCC cancer staging manual. 6th ed. New York: Springer, 2002:317-22.
9) Albers P, Siener R, Kliesch S, et al. Risk factors for relapse in clinical stage I nonseminomatous testicular germ cell tumors: results of the German Testicular Cancer Study Group Trial. J Clin Oncol 2003;21:1505-1512. [Free Full Text]
10) Divrik RT, Akdogan B, Ozen H, Zorlu F. Outcomes of surveillance protocol of clinical stage I nonseminomatous germ cell tumors -- is shift to risk adapted policy justified? J Urol 2006;176:1424-1429. [CrossRef][ISI][Medline]
11) Ernst DS, Brasher P, Venner PM, et al. Compliance and outcome of patients with stage 1 non-seminomatous germ cell tumors (NSGCT) managed with surveillance programs in seven Canadian centres. Can J Urol 2005;12:2575-2580. [Medline]
12) Spermon JR, Roeleveld TA, van der Poel HG, et al. Comparision of surveillance and retroperitoneal lymph node dissection in Stage I nonseminomatous germ cell tumors. Urology 2002;59:923-929. [CrossRef][ISI][Medline]
13) Stephenson AJ, Bosl GJ, Motzer RJ, et al. Retroperitoneal lymph node dissection for nonseminomatous germ cell testicular cancer: impact of patient selection factors on outcome. J Clin Oncol 2005;23:2781-2788. [Free Full Text]
14) Bokemeyer C, Berger CC, Kuczyk MA, Schmoll HJ. Evaluation of long-term toxicity after chemotherapy for testicular cancer. J Clin Oncol 1996;14:2923-2932. [Abstract]
15) Vogelzang NJ, Bosl GJ, Johnson K, Kennedy BJ. Raynaud's phenomenon: a common toxicity after combination chemotherapy for testicular cancer. Ann Intern Med 1981;95:288-292. [Free Full Text]
16) Travis LB, Curtis RE, Storm H, et al. Risk of second malignant neoplasms among long-term survivors of testicular cancer. J Natl Cancer Inst 1997;89:1429-1439. [Free Full Text]
17) Bosl GJ, Leitner SP, Atlas SA, Sealey JE, Preibisz JJ, Scheiner E. Increased plasma renin and aldosterone in patients treated with cisplatin-based chemotherapy for metastatic germ-cell tumors. J Clin Oncol 1986;4:1684-1689. [Free Full Text]
18) Meinardi MT, Gietema JA, van der Graaf WTA, et al. Cardiovascular morbidity in long-term survivors of metastatic testicular cancer. J Clin Oncol 2000;18:1725-1732. [Free Full Text]
19) Huddart RA, Norman A, Shahidi M, et al. Cardiovascular disease as a long-term complication of treatment for testicular cancer. J Clin Oncol 2003;21:1513-1523. [Free Full Text]
20) Studer UE, Burkhard FC, Sonntag RW. Risk adapted management with adjuvant chemotherapy in patients with high risk clinical stage I nonseminomatous germ cell tumor. J Urol 2000;163:1785-1787. [CrossRef][ISI][Medline]
21) Nuver J, Smit AJ, van der Meer J, et al. Acute chemotherapy-induced cardiovascular changes in patients with testicular cancer. J Clin Oncol 2005;23:9130-9137. [Free Full Text]
22) Weijl NI, Rutten MF, Zwinderman AH, et al. Thromboembolic events during chemotherapy for germ cell cancer: a cohort study and review of the literature. J Clin Oncol 2000;18:2169-2178. [Free Full Text]
23) Steingart R. Mechanisms of late cardiovascular toxicity from cancer chemotherapy. J Clin Oncol 2005;23:9051-9052. [Free Full Text]
Diagnóstico Anatómico.
Tumor Testicular de Células Germinales Mixto (carcinoma embrionario, teratoma, y tumor del saco de yolk).
Traducción de:
Case 6-2007 — A 28-Year-Old Man with a Mass in the Testis
Donald S. Kaufman, M.D., Mansi A. Saksena, M.D., Robert H. Young, M.D., and Shahin Tabatabaei, M.D.
Volume 356:842-849 February 22, 2007 Number 8.
CASE RECORDS OF THE MASSACHUSETTS GENERAL HOSPITAL
The New England Journal of Medicine.
Conclusiones del Caso.
Este joven paciente consultó por una masa testicular dolorosa que presentaba crecimiento rápido, de diez días de evolución. Llamativamente, el paciente había visitado a su médico un mes antes, por un examen físico anual de rutina, en el cual no se constataron alteraciones en el examen testicular.
Si bien la probabilidad de que un mes antes, el testículo fuera normal es cierta, dado el crecimiento rápido de este tipo de tumores, también es probable que el examen testicular no haya sido realizado.
En una visita anual de rutina, cuántos de los médicos clínicos llevamos a cabo un examen sistemático del aparato genital masculino?
Una visita anual de rutina, es una oportunidad única de detectar en el consultorio, una innumerable cantidad de patologías, antes de que estas sean el motivo de consulta.
También es una excelente oportunidad de sentirnos gratificados en nuestra práctica médica, interrumpiendo la evolución natural de una enfermedad que puede ser de otro modo mortal.
Lamentablemente muchas veces cuando nos enfrentamos a un paciente que nos consulta por un “chequeo”, automáticamente bajamos nuestro nivel de atención en el interrogatorio, en el examen físico, y conducimos la consulta en “piloto automático”.
Para contrarrestar esos “vicios”, debemos estar atentos, y debemos ser sistemáticos en nuestro examen, que debe ser realizado exhaustivamente, de la misma forma que lo haríamos frente a un paciente portador de una patología que motiva la consulta.
Dentro de este examen sistemático, el examen testicular, así como el resto del aparato genital masculino es insoslayable.
Este examen, debiera ser el último que se realiza después de haber completado el resto de los sistemas.
Es de buena práctica explicar al paciente el motivo del examen, ya que tanto el paciente como el propio médico pueden sentirse algo incómodos durante el mismo.
Es conveniente comenzar con el paciente parado, frente al médico sentado de frente, provisto de guantes. De esta manera se puede apreciar más fácilmente la ubicación de los testículos, así como la presencia de hernias. Hay que observar la región inguinal, la piel, el pene y escroto. Retirar hacia atrás el prepucio en pacientes no circuncidados, y observar cuidadosamente el glande y el surco balanoprepucial, en busca de úlceras genitales, chancros, candidiasis etc. Observar el orificio uretral. La implantación, densidad y el ensortijamiento del vello pubiano, que son expresión de la condición hormonal del paciente. Muchas veces la presencia de pediculosis o escabiosis es un hallazgo del examen de rutina. Se debe palpar el pene en busca de induraciones fibrosis, o alteraciones de su curvatura (De Quervain).
En el examen testicular es habitual que el testículo izquierdo esté ligeramente más bajo que el derecho en el escroto. La palpación debe ser suave, entre el pulgar y los dedos índice y medio. Asegurarse de la presencia de ambos, y si solo se palpa uno, palpar cuidadosamente el trayecto inguinal en busca de un testículo no descendido. Aprovechar esta parte del examen para buscar hernias en el trayecto inguinal. Siempre la palpación debe ser comparativa.
La presencia de un nódulo en un testículo es siempre motivo de preocupación. Ocasionalmente el testículo o la región escrotal pueden estar agrandados, y en esos casos es frecuente la presencia de hidrocele que podemos diagnosticar fácilmente con transiluminación, que en este caso es positiva, a diferencia de las orquiepididimitis, o los tumores, en que la transiluminación es negativa.
Finalmente digamos que el tiempo es un factor fuertemente condicionante de la consulta médica por razones que todos conocemos y que no se discutirán aquí. Por ello, tenemos que confeccionar un interrogatorio y sobre todo un examen físico sistemático a nuestra medida, para pacientes que nos consultan por un examen médico de rutina. Un examen sistemático que evite cometer errores por omisión. Ese examen sistemático debe incluir el examen genital masculino.
Source Information
From the Departments of Hematology–Oncology (D.S.K.), Radiology (M.A.S.), Pathology (R.H.Y.), and Urology (S.T.), Massachusetts General Hospital; and the Departments of Medicine (D.S.K.), Radiology (M.A.S.), Pathology (R.H.Y.), and Urology (S.T.), Harvard Medical School.
1) Harisinghani MG, Saksena M, Ross RW, et al. A pilot study of lymphotroph-ic nanoparticle-enhanced magnetic resonance imaging technique in early stage testicular cancer: a new method for noninvasive lymph node evaluation. Urology 2005;66:1066-1071. [CrossRef][ISI][Medline]
2) Prout GR Jr, Griffin PP. Testicular tumors: delay in diagnosis and influence on survival. Am Fam Physician 1984;29:205-209. [ISI][Medline]
3) Bosl GJ, Vogelzang NJ, Goldman A, et al. Impact of delay in diagnosis on clinical stage of testicular cancer. Lancet 1981;2:970-973. [CrossRef][ISI][Medline]
4) Ulbright TM, Amin MB, Young RH. Tumors of the testis, adnexa, spermatic cord, and scrotum. Atlas of tumor pathology. 3rd series. Fascicle 25. Washington, DC: Armed Forces Institute of Pathology, 1999.
5) Ulbright TM, Young RH. Seminoma with tubular, microcystic, and related patterns: a study of 28 cases of unusual morphologic variants that often cause confusion with yolk sac tumor. Am J Surg Pathol 2005;29:500-505. [CrossRef][ISI][Medline]
6) Emerson RE, Ulbright TM. The use of immunohistochemistry in the differential diagnosis of tumors of the testis and paratestis. Semin Diagn Pathol 2005;22:33-50. [CrossRef][ISI][Medline]
7) International Germ Cell Cancer Collaborative Group. International germ cell consensus classification: a prognostic factor-based staging system for metastatic germ cell cancers. J Clin Oncol 1997;15:594-603. [Free Full Text]
8) Testis. In: Greene FL, Page DL, Fleming ID, et al., eds. AJCC cancer staging manual. 6th ed. New York: Springer, 2002:317-22.
9) Albers P, Siener R, Kliesch S, et al. Risk factors for relapse in clinical stage I nonseminomatous testicular germ cell tumors: results of the German Testicular Cancer Study Group Trial. J Clin Oncol 2003;21:1505-1512. [Free Full Text]
10) Divrik RT, Akdogan B, Ozen H, Zorlu F. Outcomes of surveillance protocol of clinical stage I nonseminomatous germ cell tumors -- is shift to risk adapted policy justified? J Urol 2006;176:1424-1429. [CrossRef][ISI][Medline]
11) Ernst DS, Brasher P, Venner PM, et al. Compliance and outcome of patients with stage 1 non-seminomatous germ cell tumors (NSGCT) managed with surveillance programs in seven Canadian centres. Can J Urol 2005;12:2575-2580. [Medline]
12) Spermon JR, Roeleveld TA, van der Poel HG, et al. Comparision of surveillance and retroperitoneal lymph node dissection in Stage I nonseminomatous germ cell tumors. Urology 2002;59:923-929. [CrossRef][ISI][Medline]
13) Stephenson AJ, Bosl GJ, Motzer RJ, et al. Retroperitoneal lymph node dissection for nonseminomatous germ cell testicular cancer: impact of patient selection factors on outcome. J Clin Oncol 2005;23:2781-2788. [Free Full Text]
14) Bokemeyer C, Berger CC, Kuczyk MA, Schmoll HJ. Evaluation of long-term toxicity after chemotherapy for testicular cancer. J Clin Oncol 1996;14:2923-2932. [Abstract]
15) Vogelzang NJ, Bosl GJ, Johnson K, Kennedy BJ. Raynaud's phenomenon: a common toxicity after combination chemotherapy for testicular cancer. Ann Intern Med 1981;95:288-292. [Free Full Text]
16) Travis LB, Curtis RE, Storm H, et al. Risk of second malignant neoplasms among long-term survivors of testicular cancer. J Natl Cancer Inst 1997;89:1429-1439. [Free Full Text]
17) Bosl GJ, Leitner SP, Atlas SA, Sealey JE, Preibisz JJ, Scheiner E. Increased plasma renin and aldosterone in patients treated with cisplatin-based chemotherapy for metastatic germ-cell tumors. J Clin Oncol 1986;4:1684-1689. [Free Full Text]
18) Meinardi MT, Gietema JA, van der Graaf WTA, et al. Cardiovascular morbidity in long-term survivors of metastatic testicular cancer. J Clin Oncol 2000;18:1725-1732. [Free Full Text]
19) Huddart RA, Norman A, Shahidi M, et al. Cardiovascular disease as a long-term complication of treatment for testicular cancer. J Clin Oncol 2003;21:1513-1523. [Free Full Text]
20) Studer UE, Burkhard FC, Sonntag RW. Risk adapted management with adjuvant chemotherapy in patients with high risk clinical stage I nonseminomatous germ cell tumor. J Urol 2000;163:1785-1787. [CrossRef][ISI][Medline]
21) Nuver J, Smit AJ, van der Meer J, et al. Acute chemotherapy-induced cardiovascular changes in patients with testicular cancer. J Clin Oncol 2005;23:9130-9137. [Free Full Text]
22) Weijl NI, Rutten MF, Zwinderman AH, et al. Thromboembolic events during chemotherapy for germ cell cancer: a cohort study and review of the literature. J Clin Oncol 2000;18:2169-2178. [Free Full Text]
23) Steingart R. Mechanisms of late cardiovascular toxicity from cancer chemotherapy. J Clin Oncol 2005;23:9051-9052. [Free Full Text]