La paciente había estado bien hasta hacía aproximedamente 10 semanas antes de la admisión, cuando comenzó a presentar mareos ocasionales y náuseas, seguido durante las siguientes semanas por incremento del vértigo posicional y vómitos severos. Se administraron agentes antieméticos, con lo cual se resolvieron los vómitos, y mejoraron los mareos. Posteriormente se instalan palabra arrastrada, ataxia rápidamente progresiva, y dificultad en la marcha.
Aproximadamente 6 semanas antes de la internación, la paciente vió a un clínico en otro hospital. Se le realizó una RMN de cráneo que mostró una señal aumentada en T2 en la suatancia blanca periventricular que se interpretó como isquemia o desmielinización. Una TAC de cerebro no mostró lesiones. Se inició terapia con warfarina que fue rápidamente suspendida debido a que los estudios de coagulación arrojaron resultados supraterapéuticos. Se le infundió plasma fresco congelado, y los resultados de los tests de coagulación volvieron a lo normal. Un test para anticoagulante lúpico fue negativo Un estudio completo de sangre, nivel de proteínas séricas, electrolitos, calcio, fósforo, y resultados de tests hepáticos y renales fueron todos normales. Una punción lumbar reveló una presión normal de apertura; los resultados de los análisis del líquido cefalorraquídeo se muestran en la Tabla 1. No se vieron microorganismos en las tinciones ni en los cultivos; un test de antígeno criptocóccico, y una PCR para virus del herpes simplex fueron ambos negativos. Tests para HIV 1 y 2, FAN, y VDRL fueron negativos.

Tabla 1. Resultados del test de Líquido Cefalorraquídeo.
Clickear sobre la Tabla para ampliarla.
Una semana más tarde, una segunda RMN mostró una nueva, y pequeña área linear de aumento de la señal en la región de la protuberancia en FLAIR (fluid-attenuated inversion recovery). Una angio RMN de las arterias carótidas reveló una variante anatómica de la arteria vertebral izquierda, leves irregularidades de la arteria basilar sin evidencias de oclusión, y menos de 15% de estenosis de las arterias carótidas. Un curso de tratamiento de 3 días con altas dosis de metilprednisolona fue administrado, seguido por un descenso lento de la dosis, sin obtener mejoría.
Aproximadamente 3 semanas antes de la internación, la paciente fue evaluada en un consultorio de neurología en otro hospital. En el examen ella estaba sentada en una silla de ruedas y tenía un temblor de cabeza y cuello, hipoafectividad, y una palabra severamente disártrica. Ella estaba alerta y orientada, con alguna dificultad en llevar a cabo órdenes en múltiples pasos. Los tests visuales revelaron seguimiento disminuído, y movimientos sacádicos. Los movimientos alternantes de las manos estaban severamente enlentecidos, había leve debilidad flexora en la cadera y paratonía; la fuerza y el tono muscular eran normales. El test dedo-nariz reveló severa dismetría bilateralmente, y el test talón rodilla no pudo ser llevado a cabo. La paciente era incapaz de caminar. Los reflejos eran normales.
Una semana antes de la internación, una TAC de tórax reveló un mínimo engrosamiento pleural en el pulmón derecho, bandas de atelectasias subsegmentarias o fibrosis en el seno costofrénico posterior derecho, y una cisura oblicua en el pulmón izquierdo. La mamografía y la TAC de abdomen y pelvis no mostraron anormalidades.
Una semana más tarde, la paciente vió a un neurólogo de este hospital. Sus síntomas neurológicos se habían mantenido estables las 2 semanas previas.
Ella tenía hipertensión e hipercolesterolemia. Sus antecedentes médicos incluían un antecedente de otitis media, 7 años antes, y ligadura de trompas bilateralmente. No tomaba alcohol, y había dejado de fumar 20 años antes. Estaba casada, y tnía una hija de 35 años en buen estado de salud. Su madre había tenido cáncer de mama en su octava década, y su padre tenía enfermedad de Parkinson. No había antecedentes familiares de esclerosis múltiple. Sus medicamentos incluían atorvastatin, aspirina, hidroclorotiazida, con prometazina según necesidad para los mareos.
Los signos vitales eran normales. La paciente estaba alerta y orientada, con temblores y tartamudeo en su discurso. El score del Mini-Mental State Examination fue de 27 (el score más alto posible es 30), con pérdida de puntos en cálculo y en recordar 2 de 3 objetos a los 5 minutos de habérselos nombrado. Había dificultad en la pronunciación de la letra K, y el reflejo deglutorio estaba disminuído. El primer nervio craneal (olfatorio) no fue testeado; los nervios craneales II a VII estaban intactos. El examen motor y de sensibilidad eran normales; los reflejos estaban 2+ a 3+ en forma generalizada. Había una marcada dismetría y disdiadococinesia en los brazos, y había dificultad con la amplitud y velocidad de los movimientos finos de los dedos y con el control de los movimientos durante el examen de la fuerza. El examen de las piernas reveló dismetría. La paciente era incapaz de mantenerse parada a menos que tuviese ayuda, y era incapaz de caminar. No había respuesta a la estimulación plantar. El resto del examen físico era normal.
La paciente fue admitida a este hospital ese día. Un análisis completo de sangre, tiempo de protrombina y tiempo parcial de tromboplastina, tests de función hepática y renales , y niveles séricos de electrolitos, inmunoglobulinas, CA 125, CA19-9, CEA, tiroxina, TSH fueron normales; quedaron pendientes otros resultados adicionales.
En el 2º día de internación, una RMN reveló una masa, de 12 mm de diámetro en la región inferior de la mama izquierda. Una TAC tóraco abdominal mostró cambios grasos focales en el hígado, y un nódulo de 11 mm de diámetro en la glándula adrenal izquierda que impresionaba como adenoma; no se vieron otras anormalidades.
Una ecografía de pelvis no mostró alteraciones.
El 4º día de internación, una RMN de cerebro mostró moderada pérdida de volumen en hemisferios cerebelosos sin evidencias de señales anormales en T2, o en la difusión. Había múltiples focos de hiperintensidad en T2 en la sustancia blanca, con un sutil realce con gadolinio en la corona radiata derecha. Dos días más tarde, un PET scan (positron-emission tomographic) mostró focos hipermetabólicos en ambas axilas, y en una vértebra dorsal baja, aproximadamente D10. Sin embargo, una revisión de la TAC de tórax obtenida antes en esta misma hospitalización, no mostró masas o adenopatías en las regiones axilares. La electroforesis proteica sérica reveló un patrón anormal, con una banda de muy baja concentración, identificada como un componente M (monoclonal) de IgG kappa. En el 7º día de hospital, una biopsia de una masa sólida hiperecoica de la mama izquierda, llevada a cabo bajo control ultrasonográfico, reveló tejido mamario atrófico sin células malignas. Al día siguiente, una biopsia escisional de la lesión de la mama izquierda reveló un fibroadenoma mixoide, sin evidencias de cáncer.
Ese mismo día se recibió el resultado de un test, que fue diagnóstico.
Diagnóstico Diferencial:
Dr. Josep Dalmau: Puedo ver los estudios de imágenes?
Dr. R. Gilberto Gonzalez: La RMN obtenida en la internación de la paciente en este hospital reveló evidencias de atrofia cerebelosa y del tronco cerebral, con señales anormales en la sustancia blanca. Una imagen sagital en la línea media en T1 del cerebro (Figura 1 A) muestra atrofia del vermis cerebeloso con cisuras prominentes. Imágenes en T2 a través de la fosa posterior mostró pérdida de tejido en el cerebelo, con expansión del líquido cefalorraquídeo a la fosa posterior, y agrandamiento del cuarto ventrículo. Los hemisferios cerebelosos, vermis, y protuberancia eran pequeños. En el cerebro, habían focos dispersos de hiperintensidad en T2 en la sustancia blanca subcortical. La anormalidad de señal más grande era un foco de 8 mm de diámetro en la corona radiata que mostraba un sutil realce de las imágenes obtenidas después de la administración de material de contraste.
 Figura 1. Estudio de Imágenes.
Figura 1. Estudio de Imágenes.Una RMN sagital en T1 (Panel A) muestra atrofia del vermis cerebeloso (flecha). Un PET obtenido después de la administración de 18F-fluorodeoxiglucosa (Panel B) muestra un pequeño foco de captación en axila izquierda y uno levemente más grande en axila derecha (flecha). Un PET de seguimiento obtenido 4 meses más tarde (Panel C) muestra una captación anormal del trazador en la región de la axila derecha y pared torácica (flecha).
Dr. Dalmau: En esta paciente adulta, sin antecedentes de inmunodeficiencia, el desarrollo subagudo de un síndrome predominantemente cerebeloso con alteraciones inflamatorias en el líquido cefalorraquídeo con focos hipermetabólicos en un PET scan corporal total estrecha la lista de diagnósticos diferenciales a unos pocos trastornos. Los diagnósticos que podrían haber sido considerados antes del PET se muestran en la Tabla 2. La ausencia de alcoholismo y deficiencias nutricionales, el curso rápido de la enfermedad, los hallazgos inflamatorios en el líquido cefalorraquídeo, los cambios atróficos en las regiones sintomáticas de la RMN, y los hallazgos del PET, solos o en combinación, descartan la mayoría de esos trastornos.

Tabla 2. Causas Posibles de Ataxia Cerebelosa Rápidamente Progresiva en Pacientes Inmunocompetentes.
El desarrollo rápido de disartria y ataxia y la presencia de factores de riesgo para enfermedad cerebrovascular, sugirieron inicialmente stroke en el sistema vértebro-basilar. Se comenzó un tratamiento con warfarina, pero se notó un efecto supraterapéutico por lo que se suspendió este tratamiento. Se descartó la presencia de un anticoagulante lúpico. Estos hallazgos no descartan la posibilidad de una tendencia subclínica a la fibrinolisis, que ocurre en algunas condiciones malignas. (1) En esta paciente, el resultado de la angio-RMN descartó oclusión vascular, y los hallazgos en el líquido cefalorraquídeo sugieren otras causas en lugar de stroke.
Enfermedades Desmielinizantes.
La paciente fue tratada con corticosteroides, probablemente debido a que se pensó en enfermedad desmielinizante. Los pacientes con esclerosis múltiple, tienen un promedio de edad al momento del diagnóstico, de 30 años. Esta mujer tiene 56 años, y no tiene antecedentes de déficits neurológicos, ni visuales. Los hallazgos en la RMN en T2 son más sugestivos de enfermedad isquémica de pequeños vasos. El nivel elevado de proteína básica de mielina en el líquido cefalorraquídeo, puede ocurrir en diversos trastornos además de la esclerosis múltiple (2), y puede ocurrir también en síndromes paraneoplásicos. Este hallazgo, asociado a la mala respuesta a los corticoides no sostiene el diagnóstico de esclerosis múltiple.
Sarcoidosis.
La sarcoidosis debe ser incluída en la lista de diagnósticos diferenciales. Sin embargo, los síntomas de sarcoidosis no son tan agudos como los de esta paciente, y los nervios craneales, las meninges basales, el hipotálamo, y la región pituitaria están comprometidos frecuentemente en la sarcoidosis, y no es el caso de esta paciente. Una TAC de tórax es anormal en 60 a 70% de los pacientes con sarcoidosis. En esta paciente, la ausencia de tales hallazgos, y el nivel normal de enzima convertidora de angiotensina en el líquido cefalorraquídeo, argumentan contra el diagnóstico de sarcoidosis. (3)
Síndromes Paraneoplásicos que afectan el Sistema Nervioso Central.
Yo sospecho que esta paciente tiene una complicación neurológica de un cáncer. El compromiso metastásico del sistema nervioso central es improbable, dada la ausencia de alteraciones que realcen con contraste en fosa posterior. Tumores raros tales como linfomas intravasculares (4), y las llamadas “encefalitis carcinomatosas” causadas por metástasis miliares (5) pueden no presentar realce con contraste en las imágenes ni efecto de masa, pero el síndrome predominantemente cerebeloso en esta paciente, asociado a las alteraciones del líquido cefalorraquídeo no sostienen estos diagnósticos.
Los trastornos paraneoplásicos pueden afectar cualquier parte del sistema nervioso central, y son considerados inmuno-mediados. (6) La probabilidad de que un trastorno sea paraneoplásico depende del síndrome clínico del paciente (por ejemplo degeneración cerebelosa, o encefalitis límbica), y de que se detecten anticuerpos, y por supuesto un tumor. (7) En el 60% de los pacientes con trastornos paraneoplásicos, los síntomas neurológicos preceden al diagnóstico de cáncer; la ausencia de cáncer conocido en esta paciente es por lo tanto, típica. Se ha postulado la hipótesis de que la respuesta inmune antitumoral pueda contribuir al escaso desarrollo del tumor original y a su pequeño tamaño, lo que dificulta su detección. (8)La combinación de TAC y PET facilitan la detección de esos tumores. (9)
Características Inmunológicas de los Síndromes Paraneoplásicos.
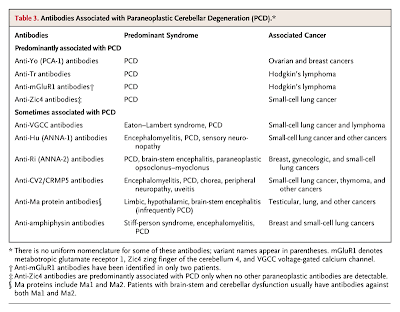
Las respuestas inmunes asociadas a los síndromes paraneoplásicos se muestran en la Tabla 3. Los anticuerpos parecen ser necesarios pero no suficientes para causar disfunción neurológica, y la respuesta de las células T está también involucrada. (10,11,12) En esta paciente, la identificación de cualquiera de los anticuerpos listados en la Tabla 3 confirmaría el diagnóstico de síndrome paraneoplásico; dependiendo del anticuerpo identificado, este hallazgo dirigiría la búsqueda del tumor. (6) En aproximadamente 40% de los pacientes, no se identifican anticuerpos. (13)
Tabla 3. Anticuerpos Asociados con Degeneración Cerebelosa Paraneoplásica
El desarrollo de degeneración cerebelosa paraneoplásica es usualmente rápida, llevando al paciente a una severa discapacidad en el término de días a semanas. (14) La presentación de esta paciente es típica, comenzando con mareos, vértigo, y náuseas que pueden sugerir un problema vestibular periférico. Esos síntomas son seguidos de ataxia de tronco y miembros, oscilopsia (sensación subjetiva de que los objetos se mueven) variable, visión borrosa, diplopia, nistagmo, disartria, temblor, y a veces disfagia. Las alteraciones oculomotoras pueden ser complejas debido a que siempre hay algún grado de compromiso del tronco cerebral en los estudios de autopsias. (15) Las características clínicas en esta paciente indican disfunción cerebelosa predominante; la alteración del reflejo faríngeo sin otras alteraciones de los nervios craneales sugiere compromiso leve del tronco cerebral. Leves déficits cognitivos y de la memorias, detectados durante el examen, ocurren en 20% de los pacientes con degeneración cerebelosa paraneoplásica. (14)
Las alteraciones en el líquido cefalorraquídeo son sugestivas de proceso inflamatorio o inmunomediado; alteraciones similares se encuentran en pacientes con degeneración cerebelosa paraneoplásica. Los anticuerpos paraneoplásicos antineuronales nucleares (anticuerpos anti-Hu y anti-Ri) no fueron detectados en el líquido cefalorraquídeo de esta paciente; no sabemos si se hicieron tests para otros anticuerpos en esta paciente.
Los dos anticuerpos que tienen mayor especificidad para disfunción cerebelosa son los anticuerpos anti Yo (16,17) y anti Tr. (18) El resto de los anticuerpos listados en la Tabla 3 están asociados con síndromes que frecuentemente afectan otras áreas del sistema nervioso además del cerebelo, o son raramente detectados en pacientes con síndromes paraneoplásicos (por ejemplo mGluR1).
En la mayoría de los pacientes con síndromes degeneración cerebelosa paraneoplásica, la RMN es normal en estadios tempranos, como ocurrió en este caso. (13,14,16,19) La alteración en el FLAIR en tronco cerebral puede estar relacionada con inflamación transitoria, que ocurre en el hipocampo en pacientes con encefalitis límbica. (20) EL realce sutil en la corona radiata sugiere telangiectasia, y las alteraciones en T2 son probablemente hallazgos inespecíficos de enfermedad isquémica de pequeños vasos.
Tumores Asociados a Síndromes Paraneoplásicos del Sistema Nervioso Central.
Que neoplasia es responsable de la enfermedad de esta paciente? A su edad, los tumores más frecuentemente asociados a degeneración cerebelosa son: el cáncer de ovario, mama, pulmón y linfoma. (13,14,16,19) La ausencia de síntomas abdominales, los resultados negativos de los marcadores tumorales, y la distribución de los hallazgos del PET scan, no son sugestivos de cáncer de ovario. La paciente tiene familiar de cáncer de mama, y existe una débil evidencia de que un fibroadenoma de mama sea un factor de riesgo para cáncer. (21) Sin embargo, el compromiso axilar bilateral y una metástasis en D10 serían una inusual presentación de un cáncer de mama. Un pequeño foco de captación de 18 F-fluorodeoxiglucosa en la axila en el lado de la inyección de dicho material radiactivo, puede ocasionar una infiltración radiactiva que puede ocasionar resultados falsos positivos. (22)
El cáncer de pulmón, particularmente el cáncer de pequeñas células, es el cáncer que más frecuentemente se asocia a síndromes paraneoplásicos del sistema nervioso central. Esos síndromes pueden manifestarse por disfunción cerebelosa, que puede mantenerse aisladamente o progresar al compromiso de otras partes del sistema nervioso central (encefalomielitis) y a menudo se asocia a anticuerpos anti-Hu. (23) Alrededor del 40% de los pacientes con cáncer de pulmón de células pequeñas y degeneración cerebelosa sin anticuerpos anti-Hu, tienen anticuerpos contra los canales de calcio disparados por voltaje, que también están presentes en el síndrome miasteniforme de Eaton-Lambert. (24) Excepto por leve debilidad proximal en las piernas, esta paciente no tuvo síntomas sugestivos de síndrome de Eaton-Lambert. El antecedente remoto de tabaquismo, la ausencia de alteraciones en el pulmón y en el mediastino en el PET scan, y la ausencia de anticuerpos anti-Hu hacen que el diagnóstico cáncer de pulmón sea muy improbable.
Los linfomas son los siguientes tumores más frecuentes asociados a degeneración cerebelosa paraneoplásica. La distribución de los hallazgos del PET y la presencia de un componente M IgG kappa puede sugerir linfoma no-Hodgkin, aunque este último hallazgo sucede en 1% de la población sana. Una gamapatía monoclonal IgG es típica de mieloma múltiple, pero este tumor, raramente está asociado a degeneración cerebelosa, y no afecta ganglios axilares. Los pacientes con degeneración cerebelosa y linfoma de Hodgkin tienen anticuerpos anti-Tr, (18)mientras que aquellos con linfomas no-Hodgkin raramente tienen algún anticuerpo de los que se conocen que producen degeneración cerebelosa paraneoplásica. (25) Además, de la degeneración cerebelosa, esta paciente puede haber tenido coagulopatía paraneoplásica que contribuyó al efecto supraterapéutico de la warfarina. La coagulopatía puede ocurrir en asociación con diversos tipos de cáncer o neoplasias de células-B. (1) El nivel sérico de LDH en esta paciente no está detallado, pero un nivel elevado apoyaría el diagnóstico de linfoma.
Resumen.
Creo que el diagnóstico en este caso es un síndrome paraneoplásico con degeneración cerebelosa predominante. El cáncer de mama asociado a anticuerpos anti-Yo sería mi primer diagnóstico. El procedimiento diagnóstico probablemente sea una biopsia de la lesión de la axila derecha o de la lesión del cuerpo vetebral de D10 detectado por PET scan.
Dr. Nancy Lee Harris (Patología): Dr. Batchelor, podría usted resumirnos su opinión, y decirnos que tests adicionales fueron realizados?
Diagnóstico Clínico.
Síndrome paraneoplásico con degeneración cerebelosa predominante.
Diagnóstico del Dr. Josep Dalmau.
Síndrome paraneoplásico con degeneración cerebelosa paraneoplásica, probablemente asociados a anticuerpos anti-Yo y cáncer de mama primario.
Discusión Patológica
Dr. Batchelor: Una batería de tests para anticuerpos MaTa, CV2/CRMP5, anticuerpos antineuronal nuclear (Hu, Ri), anticuerpos anti-CAR, y anticuerpos anti canales de calcio activados por voltaje (asociados al síndrome miasteniforme de Eaton-Lambert) se recibieron del laboratorio, siendo todos ellos negativos. Un test para anticuerpos anti células de Purkinje (Yo) fue positivo.
Un ensayo de 5 días de inmunoglobulinas intravenosas no condujo a mejoramiento en la condición neurológica de la paciente, y fue dada de alta a un centro de rehabilitación el día 12. Dada la preocupación por un cáncer de ovario oculto, se llevó a cabo una histerectomía laparoscópica con salpingo-ooforectomía fueron llevadas a cabo dos meses después del alta; no se encontró tumor maligno. Nosotros repetimos entonces la TAC y el PET scan.
Dr. Gonzalez: Un PET scan obtenido 4 meses después del PET inicial reveló anormalidades en la axila derecha y pared torácica. (Figura 1 C). Había todavía una anormalidad en la vértebra D10. La axila izquierda no mostraba alteraciones. La TAC mostró la presencia de un ganglio aumentado de tamaño, de 1,4 cm de diámetro en la axila derecha, que realzaba con la inyección del material de contraste.
Dr. Melinda F. Lerwill: La escisión de un ganglio axilar derecho reveló una neoplasia maligna pobremente diferenciada (Figura 2A); las células malignas eran grandes, con abundante citoplasma eosinofílico, y marcado pleomorfismo nuclear (Figura 2 B). El diagnóstico diferencial incluía carcinoma, linfoma y melanoma.
Los estudios inmunohistoquímicos mostraron que las células tumorales eran positivas para citoqueratina, sosteniendo el diagnóstico de carcinoma, y negativos para el marcador linfoide antígeno común leucocitario y el marcador de melanoma S-100. Las células tumorales eran positivas para citoqueratina 7, y negativas para citoqueratina 20, un perfil común a carcinomas de sitios diversos, incluyendo mama, pulmón, y ovario. Las células eran difusamente positivas para la “proteína del fluido de la enfermedad quística” (GCDFP-15) (Gross cystic disease fluid protein-15 ) (Figura 2C), un marcador de diferenciación apócrina, que se expresa en 62 a 77% de los carcinomas de mama, así como de glándulas salivales y tumores anexiales de piel. (26)
La proteína del fluido de la enfermedad quística-15 es sólo raramente positivo en otros cánceres, y es por lo tanto un marcador fuertemente específico de cáncer originado en mama, habiendo descartado tumor en glándulas salivales y anexos cutáneos.
Una conjunción de cuadro clínico, y hallazgos inmunohistoquímicos en este caso sostienen el diagnóstico de carcinoma de mama metastásico. El tumor no expresaba ni receptores de estrógenos ni de progesterona, pero mostraban sobreexpresión 3+ de Her-2/neu (Figura 2D).
Figura 2. Biopsia de Ganglio Axilar Mostrando Compromiso Tumoral Difuso.
La mayor parte de la arquitectura del ganglio está borrada por un infiltrado difuso de células tumorales grandes (Panel A, hematoxilina y eosina). Las células tumorales tienen abu
 ndante citoplasma eosinofílico, núcleos pleomórficos, y macronucléolos (Panel B, hematoxilinay eosina).
ndante citoplasma eosinofílico, núcleos pleomórficos, y macronucléolos (Panel B, hematoxilinay eosina).Ocasionales células contienen vacuolas intracitopasmáticas (Panel B flecha), aumentando la posibilidad de que la células contengan mucina y sugiriendo el diagnóstico de carcinoma metastásico. Las células tumorales muestran tinción citoplasmática difusa para la proteína del fluido de la enfermedad quística-15 (Panel C, tinción de inmunoperoxidasa para proteína del fluido de la enfermedad quística-15), hallazgo visto en mama, glándulas salivales, y cánceres anexiales de piel). La mayoría de las células tumorales muestran fuerte tinción de inmunoperoxidasa para HER-2/neu, constituyendo un score 3+ de sobreexpresión (Panel D).
Menos de 1% de las pacientes con cáncer de mama se presentan con metástasis axilares como primer manifestación de enfermedad. (27) La evaluación clínica y radiográfica de las mamas, a menudo no muestra alteraciones en estas pacientes, aún con el uso de RMN. (27,28) Un carcinoma primario, es detectado en el examen patológico de la mama en 50 a 80% de los casos, (27) a veces meses a años después de que las metástasis axilares son detectadas. En casi dos tercios de los casos en que las metástasis axilares son la primer indicación de cáncer de mama, el carcinoma es pobremente diferenciadado, tiene un patrón de crecimiento difuso, y está compuesto por abundantes células grandes con abundante citoplasma eosinofílico, núcleos pleomórficos, y macronucléolos, todos hallazgos presentados por el tumor de esta paciente. (29)
Dr. Harris: Dr. Schmahmann, podría comentarnos la evolución de esta paciente?
Dr. Jeremy D. Schmahmann (Neurología): Yo ví a esta paciente durante su primera admisión, y la noté golpeada por el deterioro mental combinado con déficit cambiantes en la esfera de la memoria, disminución de la fluidez verbal, limitación del aprendizaje verbal y memoria inmediata afectada con apatía. Dado el componente cerebeloso, la presencia de anticuerpos anti-Yo, y la ausencia de afectación demostrada de los hemisferios cerebrales, yo interpreté el cuadro como un síndrome cognitivo afectivo cerebeloso. (30) Este trastorno neuroconductual se caracteriza por déficits en la performance de las esferas ejecutiva, visuo-espacial, y lingüística, con desorden en la regulación del afecto. El tratamiento con sertralina mejoraron el humor y el comportamiento. El reconocimiento de el síndrome cognitivo afectivo cerebeloso en este caso fue así clínicamente relevante, ya que el tratamiento del mismo permitió mejorar su calidad de vida.
Un clínico: El tumor de estos pacientes expresan antígeno Yo?
Dr. Dalmau: Si, el tumor en pacientes con anticuerpos anti-Yo expresan antígeno Yo. (31)
Dr. Robert H. Brown, Jr. (Neurología): Cuales son las proteínas a los que el anticuerpo está dirigido? Hay alguna correlación entre la distribución en sistema nervioso central y el fenotipo del síndrome paraneoplásico?
Dr. Dalmau: En la mayoría de estos síndromes, los antígenos han sido identificados, y los genes clonados. (32) El antígeno Yo es una proteína citoplasmática llamada CDR2 que interactúa con c-Myc. La proteína es expresada predominantemente en las células de Purkinje del cerebelo, y las grandes neuronas del tronco cerebral. Hay estudios que sugieren que CDR2 secuestra a c-Myc en el citoplasma, y down-regula su actividad. La disrupción de esta interacción por los anticuepos anti-Yo puede aumentar la actividad de c-Myc, llevando a la apoptosis de las células de Purkinje. Los anticuerpos pueden por lo tanto jugar un rol patogémico inicial, aunque se cree que las células T son responsables de la respuesta inmune y el factor patogénico fundamental en la degeneración neuronal. (33)
Diagnóstico Anatómico.
Degeneración cerebelosa paraneoplásica debida a anticuerpos anti-Yo.
Carcinoma pobremente diferenciado, afectando ganglio de axila derecha, consistente con metástasis de cáncer primario de mama (receptor estrogénico y de progesterona negativos, con sobreexpresión de HER2/neu).
Traducción de:
Case 4-2007 — "A 56-Year-Old Woman with Rapidly Progressive Vertigo and Ataxia"
Josep Dalmau, M.D., Ph.D., R. Gilberto Gonzalez, M.D., Ph.D., and Melinda F. Lerwill, M.D
Volume 356:612-620 February 8, 2007 Number 6
The New England Journal of Medicine
CASE RECORDS OF THE MASSACHUSETTS GENERAL HOSPITAL
Fuente.
From the Division of Neuro-oncology, Department of Neurology, Hospital of the University of Pennsylvania, University of Pennsylvania, Philadelphia (J.D.); the Departments of Radiology (R.G.G.) and Pathology (M.F.L.), Massachusetts General Hospital, Boston; and the Departments of Radiology (R.G.G.) and Pathology (M.F.L.), Harvard Medical School, Boston.
Conclusiones del Caso
Esta mujer de 56 años en buen estado de salud 2 meses y medio antes, comenzó con cuadro de vértigo, náuseas, y vómitos, seguidos de severa ataxia que en pocas semanas la confinaron a silla de ruedas, configurando un síndrome cerebeloso de evolución subaguda.
Depués de descartar rápidamente las principales causas de síndrome cerebeloso en base a la historia clínica de la paciente (Tabla 2) surge rápidamente la probabilidad de que el mismo esté ocasionado por un síndrome paraneoplásico.
La localización del tumor primario nunca fue realizada, y la sospecha de la localización mamaria, surge del propio síndrome paraneoplásico, descripto en cáncer de mama, la presencia de metástasis axilares derechas con histología que, aunque altamente indiferenciada, es compatible con cáncer de mama, y la inmunohistoquímica del material tumoral, que aunque no expresaba receptores de estrógenos ni progesterona, tenía sobreexpresión de Her-2/neu. Sin embargo, el tumor primario de mama no fue visto en mamografías, ecografías, RMN ni en el PET!!! De hecho, el caso nunca ameritó realizar mastectomía, y la paciente parece no tener evidencias de actividad de su enfermedad de base después del tratamiento con anticuerpos contra el factor de crecimiento epidérmico humano (trastuzumab) asociado a quimioterapia.
A pesar de que hay discusión al respecto, es evidente, que la fuerte respuesta inmunológica disparada por el tumor, hace que este sea objeto de la misma también, y sus posibilidades de crecimiento o diseminación se vean acotadas. Seguramente, el accionar de los anticuerpos y más aún, de la inmunidad celular sobre el tumor en estos interesantes aunque poco frecuentes situaciones, estén disparando líneas de investigación que involucren modelos similares de ataque inmunológico anti neoplásico, tratando de que a su vez este no dañe a las células normales. Si ya sabemos que la pérdida de la vigilancia inmunológica está implicada en la génesis de muchos tumores, también es cierto que una respuesta inmunológica adecuada puede controlar el proceso proliferativo en algún punto.
Aunque los síndromes paraneoplásicos tengan una incidencia baja, los tumores que con más frecuencia los producen (pulmón, mama, linfomas, y ovario) tienen una alta prevalencia. Por ello, debemos conocerlos, y estar atentos a su forma de presentación, sabiendo que muchas veces, el tipo de síndrome paraneoplásico, sugiere la localización tumoral primaria. Aunque mucho más sofisticada pero no menos redituable, es la investigación de los anticuerpos en juego, ya que también estos pueden ser indicadores del tipo de neoplasia de base.
Un alto porcentaje de los síndromes paraneoplásicos se presentan antes de que la neoplasia desencadenante sea reconocida, por lo que el umbral de sospecha debe ser alto ante cualquier cuadro compatible con síndrome paraneoplásico, porque establecer un diagnóstico precoz del mismo puede cambiar el pronóstico del paciente. En el caso bajo discusión, la paciente tuvo una RMN de cerebro casi normal dos meses antes, observándose en el estudio siguiente una importante atrofia cerebelosa. Seguramente si el diagnóstico se hubiese establecido antes, el tratamiento con vinorelbina-trastuzumab hubieran frenado antes el proceso apoptótico, y probablemente la secuela neurológica hubiera sido menor.
Para una más detallada actualización de síndromes paraneoplásicos neurológicos desarrollado por la Dra Mariana Perez de Antueno:
http://elrincondelamedicinainterna.blogspot.com/2008/07/sndromes-paraneoplsicos-neurolgicos.html
References
1) Glaspy JA. Hemostatic abnormalities in multiple myeloma and related disorders. Hematol Oncol Clin North Am 1992;6:1301-1314. [ISI][Medline]
2) Whitaker JN, Lisak RP, Bashir RM, et al. Immunoreactive myelin basic protein in the cerebrospinal fluid in neurological disorders. Ann Neurol 1980;7:58-64. [CrossRef][ISI][Medline]
3) Sharma OP. Neurosarcoidosis: a personal perspective based on the study of 37 patients. Chest 1997;112:220-228. [CrossRef][ISI][Medline]
4) Baehring JM, Longtine J, Hochberg FH. A new approach to the diagnosis and treatment of intravascular lymphoma. J Neurooncol 2003;61:237-248. [CrossRef][Medline]
5) McGuigan C, Bigham S, Johnston D, Hart PE. Encephalopathy in a patient with previous malignancy but normal brain imaging. Neurology 2005;65:165-165. [Free Full Text]
6) Bataller L, Dalmau JO. Paraneoplastic disorders of the central nervous system: update on diagnostic criteria and treatment. Semin Neurol 2004;24:461-471. [CrossRef][ISI][Medline]
7) Graus F, Delattre JY, Antoine JC, et al. Recommended diagnostic criteria for paraneoplastic neurological syndromes. J Neurol Neurosurg Psychiatry 2004;75:1135-1140. [Free Full Text]
8) Darnell RB. Paraneoplastic neurologic disorders: windows into neuronal function and tumor immunity. Arch Neurol 2004;61:30-32. [Free Full Text]
9) Younes-Mhenni S, Janier MF, Cinotti L, et al. FDG-PET improves tumour detection in patients with paraneoplastic neurological syndromes. Brain 2004;127:2331-2338. [Free Full Text]
10) Sommer C, Weishaupt A, Brinkhoff J, et al. Paraneoplastic stiff-person syndrome: passive transfer to rats by means of IgG antibodies to amphiphysin. Lancet 2005;365:1406-1411. [CrossRef][ISI][Medline]
11) Rousseau A, Benyahia B, Dalmau J, et al. T cell response to Hu-D peptides in patients with anti-Hu syndrome. J Neurooncol 2005;71:231-236. [CrossRef][Medline]
12) Albert ML, Austin LM, Darnell RB. Detection and treatment of activated T cells in the cerebrospinal fluid of patients with paraneoplastic cerebellar degeneration. Ann Neurol 2000;47:9-17. [CrossRef][ISI][Medline]
13) Mason WP, Graus F, Lang B, et al. Small-cell lung cancer, paraneoplastic cerebellar degeneration and the Lambert-Eaton myasthenic syndrome. Brain 1997;120:1279-1300. [Free Full Text]
14) Peterson K, Rosenblum MK, Kotanides H, Posner JB. Paraneoplastic cerebellar degeneration. I. A clinical analysis of 55 anti-Yo antibody-positive patients. Neurology 1992;42:1931-1937. [Free Full Text]
15) Verschuuren J, Chuang L, Rosenblum MK, et al. Inflammatory infiltrates and complete absence of Purkinje cells in anti-Yo-associated paraneoplastic cerebellar degeneration. Acta Neuropathol (Berl) 1996;91:519-525. [CrossRef][Medline]
16) Rojas-Marcos I, Rousseau A, Keime-Guibert F, et al. Spectrum of paraneoplastic neurologic disorders in women with breast and gynecologic cancer. Medicine (Baltimore) 2003;82:216-223. [CrossRef][Medline]
17) Shams'ili S, Grefkens J, de Leeuw B, et al. Paraneoplastic cerebellar degeneration associated with antineuronal antibodies: analysis of 50 patients. Brain 2003;126:1409-1418. [Free Full Text]
18) Bernal F, Shams'ili S, Rojas I, et al. Anti-Tr antibodies as markers of paraneoplastic cerebellar degeneration and Hodgkin's disease. Neurology 2003;60:230-234. [Free Full Text]
19) Sillevis Smitt P, Kinoshita A, De Leeuw B, et al. Paraneoplastic cerebellar ataxia due to autoantibodies against a glutamate receptor. N Engl J Med 2000;342:21-27. [Free Full Text]
20) Ances BM, Vitaliani R, Taylor RA, et al. Treatment-responsive limbic encephalitis identified by neuropil antibodies: MRI and PET correlates. Brain 2005;128:1764-1777. [Free Full Text]
21) El-Wakeel H, Umpleby HC. Systematic review of fibroadenoma as a risk factor for breast cancer. Breast 2003;12:302-307. [CrossRef][ISI][Medline]
22) Chiang SB, Rebenstock A, Guan L, Burns J, Alavi A, Zhuang H. Potential false-positive FDG PET imaging caused by subcutaneous radiotracer infiltration. Clin Nucl Med 2003;28:786-788. [CrossRef][ISI][Medline]
23) Dalmau J, Graus F, Rosenblum MK, Posner JB. Anti-Hu-associated paraneoplastic encephalomyelitis/sensory neuronopathy: a clinical study of 71 patients. Medicine (Baltimore) 1992;71:59-72. [Medline]
24) Graus F, Lang B, Pozo-Rosich P, Saiz A, Casamitjana R, Vincent A. P/Q type calcium-channel antibodies in paraneoplastic cerebellar degeneration with lung cancer. Neurology 2002;59:764-766. [Free Full Text]
25) Clouston PD, Saper CB, Arbizu T, et al. Paraneoplastic cerebellar degeneration. III. Cerebellar degeneration, cancer, and the Lambert-Eaton myasthenic syndrome. Neurology 1992;42:1944-1950. [Free Full Text]
26) Lerwill MF. Current practical applications of diagnostic immunohistochemistry in breast pathology. Am J Surg Pathol 2004;28:1076-1091. [ISI][Medline]
27) Rosen PP. Rosen's breast pathology. 2nd ed. Philadelphia: Lippincott Williams & Wilkins, 2001.
28) Galimberti V, Bassani G, Monti S, et al. Clinical experience with axillary presentation breast cancer. Breast Cancer Res Treat 2004;88:43-47. [CrossRef][ISI][Medline]
29) Haupt HM, Rosen PP, Kinne DW. Breast carcinoma presenting with axillary lymph node metastases: an analysis of specific histopathologic features. Am J Surg Pathol 1985;9:165-175. [CrossRef][ISI][Medline]
30) Schmahmann JD, Sherman JC. The cerebellar cognitive affective syndrome. Brain 1998;121:561-579. [Free Full Text]
31) Mathew RM, Cohen AB, Galetta SL, Alavi A, Dalmau J. Paraneoplastic cerebellar degeneration: Yo-expressing tumor revealed after a 5-year follow-up with FDG-PET. J Neurol Sci 2006;250:153-155. [CrossRef][ISI][Medline]
32) Darnell RB, Posner JB. Paraneoplastic syndromes involving the nervous system. N Engl J Med 2003;349:1543-1554. [Free Full Text]
33) Okano HJ, Park W-Y, Corradi JP, Darnell RB. The cytoplasmic Purkinje onconeural antigen cdr2 down-regulates c-Myc function: implications for neuronal and tumor cell survival. Genes Dev 1999;13:2087-2097. [Free Full Text]