Espacio virtual creado para discutir casos clínicos, actualizar temas y comentar inquietudes relacionadas con la práctica de la Medicina Interna
miércoles, 27 de enero de 2010
MUJER DE 51 AÑOS CON LINFOMA ESPLÉNICO DE LA ZONA MARGINAL.
Una mujer de 51 años fue admitida a este hospital por anemia y esplenomegalia.

Tabla 2. Resultado de los Tests Séricos Químicos e Inmunológicos.

Tabla 3. Resultados de Estudios de Coagulación.
El examen anatomopatológico de la biopsia de médula ósea reveló agregados linfoides que representaban aproximadamente el 10% de la celularidad, y células linfoides intersticiales aumentadas. La citometría de flujo mostró células B con cadenas livianas kappa, que expresaban CD19 pero no CD5, CD23, CD10, y CD103. Tres semanas antes de la admisión, la paciente vió a un hematólogo en una clínica oncológica en otro hospital. Los resultados de laboratorio se muestran en las Tabla 1, Tabla 2, y Tabla 3. Se derivó al Centro de Cáncer de este Hospital, pero antes de ser vista, debió ser readmitida en otro hospital debido a empeoramiento de su estado general, edema en miembros inferiores, y fiebre de 38,6ºC, con sudoración nocturna. Los resultados de los tests de laboratorio se muestran en la Tabla 1, Tabla 2, y Tabla 3. Dos unidades de células rojas fueron transfundidas. En el segundo día, fue transferida a este hospital.
Muchos años antes se había diagnosticado carcinoma folicular de tiroides que había sido tratado con tiroidectomía e iodo radioactivo. La paciente tenía migrañas, temblor, depresión y ansiedad. Había fumado en el pasado pero no había tomado alcohol o usado drogas ilícitas. Su madre había tenido lupus eritematoso sistémico, enfermedad arterial coronaria, y stroke, y había fallecido a los 55 años. Su padre de 80 años tenía temblor, había tenido stroke, infarto de miocardio, y aneurisma cerebral. Sus tres hermanas estaban sanas. Ella vivía con su esposo y un hijo, y no trabajaba fuera de su casa. Sus medicamentos incluían citalopram, ziprasidona, clonacepan, lamotrigina, furosemida, zolpidem, levotiroxina, sulfato ferroso, y eletriptan según necesidad por sus cefaleas. No presentaba alergias a medicamentos.
En el examen estaba ansiosa. La temperatura era de 38,3 ºC, la TA de 110/68, el pulso de 105 latidos por minuto, la respiración de 18 por minuto, y la saturación de oxígeno de 96% mientras respiraba aire ambiente. Había leve ictericia en las conjuntivas. El abdomen estaba blando, sin dolor ni distensión. El bazo era duro e indoloro y llegaba a la cresta ilíaca. No había linfadenopatías. El resto del examen físico era normal. La sangre era de tipo A Rh-positiva; el panel de screening de anticuerpos era negativo. La glucemia era normal, los electrolitos, fósforo, magnesio, y fosfatasa alcalina así como la función renal eran normales; el test de Coombs directo era negativo, y el test para crioaglutininas era negativo.
El análisis de orina mostraba bilirrubina 1+. Un electrocardiograma era normal. La electroforesis de proteínas revelaba una paraproteina IgM kappa, y una marcada disminución de las inmunoglobulinas normales. Un test para anticuerpo y antígeno de superficie de hepatitis B y antígeno de hepatitis C (HCV) fueron negativos. Los niveles de vitamina B12 y folato eran normales. El resto de los resultados del laboratorio son mostrados en las Tabla 1, Tabla 2, y Tabla 3. Una TAC tóraco-abdómino-pélvica no mostró cambios en cuanto a la esplenomegalia y las linfadenopatías. Dos unidades de glóbulos rojos fueron transfundidos. Zolpidem y eletriptan fueron suspendidos, y el resto de las medicaciones continuadas. Se comenzó con ácido fólico, y se comenzó con vitamina K subcutánea.
El tercer día de hospital, hubo que administrar otras 2 unidades más de glóbulos rojos, y 4 unidades de plasma fresco congelado; el tiempo parcial de tromboplastina no corregía con plasma normal. Los niveles de los factores de coagulación II, V, y X estaban en rango normal. El anticuerpo IgM para hepatitis A fue positivo; el anticuerpo total para hepatitis A fue negativo.
El cuarto día de internación se llevó a cabo un procedimiento diagnóstico.
Diagnóstico Diferencial.
La paciente había estado bien hasta hacía 2 meses, cuando empezó a presentar fatiga, seguida por sudoración nocturna, sensación de plenitud en el cuadrante superior izquierdo del abdomen, saciedad temprana, edema en miembros inferiores, y disnea de esfuerzo. Se le prescribió furosemida pero los síntomas persistieron. Un mes antes de la admisión, fue internadada en otro hospital.
En el examen físico el bazo estaba agrandado y llegaba hasta la cresta ilíaca, y había edema en miembros inferiores. Una prueba de Coombs directa fue negativa para IgG y complemento. El resto de los tests de laboratorio se muestran en la Tabla 1, Tabla 2, y Tabla 3. Se transfundieron 2 unidades de glóbulos rojos. Una TAC de tórax, abdomen y pelvis, llevada a cabo después de la administración de sustancia de contraste mostró esplenomegalia (30 cm x 10 cm), ascitis y adenomegalias en múltiples sitios, incluyendo la base de cuello a la izquierda, el hilio esplénico, y la región periaórtica. Un test para HIV fue negativo.
En el 5º día de internación, el tiempo de tromboplastina parcial no corrigió con plasma normal en una relación de 1:1, y permaneció prolongado después de 2 horas. Tres unidades de plasma fresco-congelado fueron administrados, así como dos unidades adicionales de glóbulos rojos. Una biopsia de médula ósea fue realizada y la paciente fue dada de alta del hospital.

En el examen físico el bazo estaba agrandado y llegaba hasta la cresta ilíaca, y había edema en miembros inferiores. Una prueba de Coombs directa fue negativa para IgG y complemento. El resto de los tests de laboratorio se muestran en la Tabla 1, Tabla 2, y Tabla 3. Se transfundieron 2 unidades de glóbulos rojos. Una TAC de tórax, abdomen y pelvis, llevada a cabo después de la administración de sustancia de contraste mostró esplenomegalia (30 cm x 10 cm), ascitis y adenomegalias en múltiples sitios, incluyendo la base de cuello a la izquierda, el hilio esplénico, y la región periaórtica. Un test para HIV fue negativo.
En el 5º día de internación, el tiempo de tromboplastina parcial no corrigió con plasma normal en una relación de 1:1, y permaneció prolongado después de 2 horas. Tres unidades de plasma fresco-congelado fueron administrados, así como dos unidades adicionales de glóbulos rojos. Una biopsia de médula ósea fue realizada y la paciente fue dada de alta del hospital.

Tabla 1. Resultados de los Tests Hematológicos de Laboratorio.

Tabla 2. Resultado de los Tests Séricos Químicos e Inmunológicos.

Tabla 3. Resultados de Estudios de Coagulación.
El examen anatomopatológico de la biopsia de médula ósea reveló agregados linfoides que representaban aproximadamente el 10% de la celularidad, y células linfoides intersticiales aumentadas. La citometría de flujo mostró células B con cadenas livianas kappa, que expresaban CD19 pero no CD5, CD23, CD10, y CD103. Tres semanas antes de la admisión, la paciente vió a un hematólogo en una clínica oncológica en otro hospital. Los resultados de laboratorio se muestran en las Tabla 1, Tabla 2, y Tabla 3. Se derivó al Centro de Cáncer de este Hospital, pero antes de ser vista, debió ser readmitida en otro hospital debido a empeoramiento de su estado general, edema en miembros inferiores, y fiebre de 38,6ºC, con sudoración nocturna. Los resultados de los tests de laboratorio se muestran en la Tabla 1, Tabla 2, y Tabla 3. Dos unidades de células rojas fueron transfundidas. En el segundo día, fue transferida a este hospital.
Muchos años antes se había diagnosticado carcinoma folicular de tiroides que había sido tratado con tiroidectomía e iodo radioactivo. La paciente tenía migrañas, temblor, depresión y ansiedad. Había fumado en el pasado pero no había tomado alcohol o usado drogas ilícitas. Su madre había tenido lupus eritematoso sistémico, enfermedad arterial coronaria, y stroke, y había fallecido a los 55 años. Su padre de 80 años tenía temblor, había tenido stroke, infarto de miocardio, y aneurisma cerebral. Sus tres hermanas estaban sanas. Ella vivía con su esposo y un hijo, y no trabajaba fuera de su casa. Sus medicamentos incluían citalopram, ziprasidona, clonacepan, lamotrigina, furosemida, zolpidem, levotiroxina, sulfato ferroso, y eletriptan según necesidad por sus cefaleas. No presentaba alergias a medicamentos.
En el examen estaba ansiosa. La temperatura era de 38,3 ºC, la TA de 110/68, el pulso de 105 latidos por minuto, la respiración de 18 por minuto, y la saturación de oxígeno de 96% mientras respiraba aire ambiente. Había leve ictericia en las conjuntivas. El abdomen estaba blando, sin dolor ni distensión. El bazo era duro e indoloro y llegaba a la cresta ilíaca. No había linfadenopatías. El resto del examen físico era normal. La sangre era de tipo A Rh-positiva; el panel de screening de anticuerpos era negativo. La glucemia era normal, los electrolitos, fósforo, magnesio, y fosfatasa alcalina así como la función renal eran normales; el test de Coombs directo era negativo, y el test para crioaglutininas era negativo.
El análisis de orina mostraba bilirrubina 1+. Un electrocardiograma era normal. La electroforesis de proteínas revelaba una paraproteina IgM kappa, y una marcada disminución de las inmunoglobulinas normales. Un test para anticuerpo y antígeno de superficie de hepatitis B y antígeno de hepatitis C (HCV) fueron negativos. Los niveles de vitamina B12 y folato eran normales. El resto de los resultados del laboratorio son mostrados en las Tabla 1, Tabla 2, y Tabla 3. Una TAC tóraco-abdómino-pélvica no mostró cambios en cuanto a la esplenomegalia y las linfadenopatías. Dos unidades de glóbulos rojos fueron transfundidos. Zolpidem y eletriptan fueron suspendidos, y el resto de las medicaciones continuadas. Se comenzó con ácido fólico, y se comenzó con vitamina K subcutánea.
El tercer día de hospital, hubo que administrar otras 2 unidades más de glóbulos rojos, y 4 unidades de plasma fresco congelado; el tiempo parcial de tromboplastina no corregía con plasma normal. Los niveles de los factores de coagulación II, V, y X estaban en rango normal. El anticuerpo IgM para hepatitis A fue positivo; el anticuerpo total para hepatitis A fue negativo.
El cuarto día de internación se llevó a cabo un procedimiento diagnóstico.
Diagnóstico Diferencial.
Los datos claves de la presentación en este caso son: esplenomegalia masiva, anemia, paraproteinemia, y coagulopatía. Podemos ver los estudios radiológicos?
La TAC de abdomen después de la administración de contraste (Figura 1) reveló esplenomegalia masiva, y algunos ganglios agrandados dispersos en las regiones para-aórtica e hiliar esplénica. El bazo mostró realce homogéneo del contraste, sin evidencias de masas o ruptura de la cápsula.

Figura 1. TAC de Abdomen.
Las imágenes coronal (Panel A), y axial (Panel B) muestran esplenomegalia (30 cm de largo mayor, Panel A) y ganglios linfáticos dispersos en la región para-aórtica y del hilio esplénico (flechas, Panel B).
Aunque el diagnóstico diferencial de esplenomegalia es amplio, las entidades que pueden causar una esplenomegalia masiva que llegan hasta la pelvis son mucho menos. (Tabla 4) Yo consideraré primero el diagnóstico en base a los hallazgos clínicos y de laboratorio, antes de considerar la biopsia de médula ósea, y después usaré información adicional para estrechar las posibilidades diagnósticas. >
Tabla 4. Causas de esplenomegalia.
Entidades Benignas.
Enfermedades Mieloproliferativas.
Las enfermedades mieloproliferativas son enfermedades clonales de la stem-cell caracterizadas clínicamente por el aumento en una o más líneas celulares. Ellas a menudo tienen esplenomegalia. Entra esas enfermedades, la mielofibrosis idiopática crónica puede presentarse con citopenias y esplenomegalia. Sin embargo, este trastorno, se caracteriza por una prominente fibrosis de la médula ósea, resultando en los hallazgos característicos de la sangre periférica, incluyendo células rojas nucleadas, células rojas en lágrima (teardrop erythrocytes), y precursores de células blancas, ninguna de las cuales son reportadas en este caso.
Linfomas de Células-B.
La leucemia linfocítica crónica, o linfoma linfocítico pequeño es una neoplasia de células B indolente, en pacientes de más de 50 años, que frecuentemente afecta el bazo, así como la sangre periférica y ganglios linfáticos.(3) Puede verse aquí hipogamaglobulinemia y paraproteína monoclonal, como en este paciente, pero el tamaño de la esplenomegalia en ausencia de linfocitosis periférica sería muy inusual.
El linfoma linfoblástico infiltra típicamente la médula ósea, los ganglios linfáticos, el bazo, y otros órganos, y a menudo produce una paraproteína IgM, un síndrome conocido como macroglobulinemia de Waldenström. (3) La paraproteína IgM está a menudo asociada con hiperviscosidad y fenómenos autoinmunes, incluyendo citopenias, y puede también unirse a factores de coagulación, produciendo una coagulopatía, que fue un notable hallazgo en esta paciente. El nivel de IgM en la macroglobulinemia de Waldenström está usualmente por encima de 3 grs /dl, y, aunque los criterios diagnósticos para esta enfermedad no se definen por un nivel sérico mínimo de IgM, en este paciente, el nivel relativamente bajo de IgM a pesar de la gran masa tumoral en el bazo, argumentan en contra de ese diagnóstico.
La leucemia de células peludas, pilosas o tricoleucemia, también se presenta con esplenomegalia y pancitopenia, (3) característicamente con monocitopenia. La médula ósea está virtualmente siempre afectada, y en sangre periférica pueden ser identificadas células malignas con proyecciones citoplasmáticas circunferenciales; ellas no fueron vistas en este caso. Esta paciente tenía esplenomegalia masiva sin gran cantidad de poliadenopatías, lo cual podrían ser compatibles con esta enfermedad, aunque la ausencia de pancitopenia y monocitopenia argumenta contra el diagnóstico de leucemia de células pilosas, como también lo hace la paraproteinemia, que no es característica de esa enfermedad. El infiltrado de la leucemia de células pilosas en la médula ósea es característico obtenido por biopsias por trepanación, y los hallazgos de la biopsia de médula ósea ayudarán a distinguir de otras entidades.
El linfoma de la zona marginal esplénico, un raro linfoma de células-B, es una enfermedad indolente que afecta el bazo y la médula ósea, merece consideración. Los pacientes se presentan típicamente con esplenomegalia (que puede ser masiva), mínima cantidad de linfadenopatías, y anemia; linfocitos vellosos circulantes y paraproteína IgM pueden ser vistos, pero el síndrome de hiperviscosidad es raro. (3,5,6,7,8,9) Los fenómenos autoinmunes son comunes, (10)particularmente la anemia hemolítica autoinmune, pero también han sido reportados púrpura trombocitopénica autoinmune, anticuerpos IgM anticardiolipinas, y anticoagulante lúpico. (10,11,12,13,14) Una asociación con hepatitis C es reportada en algunas partes del mundo. (15) Los hallazgos clínicos y de laboratorio de esta paciente encajan perfectamente con el diagnóstico de linfoma de la zona marginal esplénica.
Linfomas de Células-T.
La leucemia prolinfocítica de células-T típicamente se presenta con esplenomegalia masiva; sin embargo, los pacientes usualmente tienen marcada linfocitosis con recuento de glóbulos blancos elevados a diferencia de nuestra paciente.
La leucemia linfocítica de células-T grandes granular, se presenta con esplenomegalia, (3) sin linfadenopatía, y con modesta linfocitosis caracterizada por grandes linfocitos granulares y neutropenia. Los fenómenos autoinmunes, incluyendo anemia hemolítica, ocurren frecuentemente, (16) pero la esplenomegalia es raramente tan masiva como la encontrada en nuestra paciente, y, este hecho asociado a la ausencia de neutropenia hace a este diagnóstico improbable.
El linfoma de células-T hepatoesplénico (3) se presenta con hepatoesplenomegalia y citopenias, más a menudo trombocitopenia y anemia, sin compromiso de la sangre periférica con células neoplásicas, ni linfadenopatías, similar a lo encontrado en nuestra paciente. Esta enfermedad, típicamente afecta hombres entre los 20 y los 30 años, muchos de los cuales tienen inmunosupresión después de un transplante de órgano sólido (17,18); sin embargo, pueden ser afectadas también mujeres mayores. El sexo de nuestra paciente, su edad, la ausencia de hepatomegalia, y un recuento de plaquetas normal, hacen a este diagnóstico improbable.
Anemia.
Los defectos intrínsecos de los glóbulos rojos son poco probables en este caso. Causas extrínsecas que actúan sobre los glóbulos rojos pueden ser clasificadas como inmunes o no inmunes. Esta paciente no tiene evidencias clínicas de síndromes asociados con hemólisis mecánica, o la presencia de esquistocitos en sangre periférica. La destrucción mecánica vía secuestro esplénico es probable en esta paciente con esplenomegalia masiva, pero, por si misma, no justifica el aumento progresivo de los requerimientos transfusionales. El nivel de LDH parece desproporcionadamente elevado; aunque los linfomas por si mismos producen elevación de la LDH, esto es inusual en el caso de linfomas indolentes.
Aunque esta paciente tiene un test de Coombs directo negativo, 3% a 7% de las anemias hemolíticas autoinmunes por anticuerpos calientes, pueden dar tests de Coombs negativos. (20) El test de Coombs de rutina evalúa la unión de IgG y complemento a los glóbulos rojos. Un test negativo puede resultar de la presencia de la presencia de autoanticuerpos IgA o IgM calientes. Esta paciente tenía una paraproteína IgM, que puede haber estado funcionando como anticuerpo caliente, causando anemia hemolítica autoinmune, junto a otros epifenómenos, incluyendo la anticardiolipina IgM y un análisis falso positivo para hepatitis A (IgM anti HAV).
Coagulopatía.
Resumen y conclusiones.
Diagnóstico del Dr. Jeremy S. Abramson:
Linfoma de la zona marginal esplénica, con anemia debida a hemólisis autoinmune Coombs negativa y secuestro esplénico, con prolongación del tiempo de tromboplastina parcial debido a anticoagulante lúpico.
Discusión Patológica.
El examen anatomopatológico de la biopsia de médula ósea llevada a cabo en otro hospital confirmó la presencia de agregados de células-B pequeñas, alguna de las cuales se presentaron dentro de los senos medulares. (Figura 2A). Este patrón de infiltración excluye el diagnóstico de leucemia de células pilosas, que produce una infiltración intersticial difusa, más que un infiltrado nodular. La presencia de infiltración sinusoidal es característica pero no específica del linfoma de la zona marginal esplénica. Las células no muestran diferenciación plasmocítica prominente. El examen de la sangre periférica mostró ocasionales linfocitos levemente agrandados con citoplasma moderadamente abundante conteniendo proyecciones vellosas no circunferenciales (Figura 2A, inserto inferior) La citometría de flujo de la sangre periférica confirmó la presencia de una población de células-B expresando cadenas livianas kappa, pero sin marcadores específicos de ningún subtipo especial de linfoma-B de células pequeñas. La combinación de estos hallazgos morfológicos e inmunofenotípicos son característicos del linfoma de la zona marginal esplénica. (27,28)
Figura 2. Médula ósea, Sangre Periférica, y Bazo.

La muestra de médula ósea (Panel A) contiene múltiples agregados linfoides mal circunscritos y no paratrabeculares agregados linfoides (flecha) y linfocitos intersticiales aumentados; los linfocitos constituyen un 10% de la celularidad de la médula. Los agregados linfoides y los linfocitos intersticiales son principalmente células-B CD20+ (Panel A, inserto arriba); la tinción CD20 revela una distribución linear de algunas células-B, sugiriendo localización dentro de los sinusoides óseos. Un frotis de sangre periférica (Panel A, inserto abajo) muestra ocasionaleslinfocitos levemente agrandados, con cromatina levemente abierta, pequeños nucléolos, y un moderadamente abundante citoplasma basófilo pálido con proyecciones citoplasmáticas vellosas (flecha).
En el examen macroscópico de la superficie de corte del bazo (Panel B), hay una relativa prominencia de la pulpa blanca, con nódulos que van de 0,1 a 0,3 cm de diámetro. En el examen microscópico, los nódulos de la pulpa blanca están expandidos y reemplazados por un infiltrado monomorfo, pequeños linfocitos con nucleos irregulares y escaso a moderadamente abundante citoplasma (Panel B inserto).Cluster de células similares son vistos también en la pulpa roja. Las tinciones inmunohistoquímicas muestran que las células atípicas son células –B CD20+ (Panel D). La fuertemente coexpresada cadena pesada IgM pero no IgD con cadenas livianas kappa por hibridización in situ no se muestran.
El bazo pesaba 2,42 kg. El examen macroscópico mostraba prominencia de la pulpa blanca sin lesiones de masa (Figura 2B). El examen histológico mostró que la pulpa blanca estaba reemplazada por un infiltrado monomorfo de pequeñas células que tenían núcleo irregular y un moderadamente abundante citoplasma pálido similar al de la médula ósea (Figura 2C e inserto). Pequeños clusters de células de apariencia similar estaban presentes en la pulpa roja. Un infiltrado similar estaba presente en un bazo accesorio y en un ganglio linfático hiliar esplénico. El análisis por citometría de flujo del tejido esplénico confirmó la presencia de una población de células-B con el mismo inmunofenotipo del visto en la sangre periférica. La tinción inmunohistoquímica reveló células B CD20 (Figura rD) que expresaban fuertemente cadenas pesadas IgM, con con cadena liviana kappa por hibridización iu situ, y carencia de IgD. El análisis citogenético del tejido esplénico reveló un cariotipo femenino normal sin deleción de 7q21-32 por hibridización in situ fluorescente. El hallazgo morfológico e inmunofenotípico es diagnóstico de linfoma de la zona marginal esplénico.
El linfoma de la zona marginal esplénico deriva su nombre del hecho que en muchos casos, las células neoplásicas expanden las zonas marginales hasta la periferia de los folículos de pulpa blanca; sin embargo, también compromete el resto del folículo, y en muchos casos, tal como este, la acentuación en la zona marginal no se ve. Aunque originalmente se creía que correspondía a centro post-germinal, la célula B de la zona marginal, no se conoce su contrapartida. El inmunofenotipo y los hallazgos genéticos de los linfomas de la zona marginal esplénica son heterogéneos y puede predecirse su pronóstico. (29,30,31) Los casos que carecen de hipermutación somática en los genes de la región variable de las inmunoglobulinas, tienen pérdida de 7q21-32, y expresan IgD tienden a tener un curso clínico más agresivo que los que carecen de estos hallazgos. El análisis mutacional de la región variable de la cadena pesada de la inmunoglobulina no es rutinariamente llevada a cabo, pero en este caso, la ausencia de IgD y los hallazgos citogenéticos normales sugieren la presencia de hipermutación y predicen un pronóstico favorable.
El anticoagulante lúpico y el anticuerpo anticardiolipina detectados en esta paciente son autoanticuerpos adquiridos dirigidos contra los complejos proteína-fosfolípidos, que están asociados con riesgo aumentado de trombosis tanto arterial como venoso. (32) Aunque promueve hipercoagulabilidad, el anticoagulante lúpico prolonga los tiempos de coagulación in vitro debido a que se une a los fosfolípidos e interfiere con su capacidad de servir como cofactores de coagulación. (33) Por esta razón, los factores VIII y XII pueden no ser adecuadamente cuantificados en esta paciente con el uso de técnicas standard basadas en el tiempo de tromboplastina parcial. Los aparentemente bajos niveles de factores IX y XI reportados en otro laboratorio, antes de que se supiera de la presencia de un anticoagulante lúpico, es probablemente una falsa subestimación debido a la interferencia del anticoagulante lúpico. Los autoanticuerpos encontrados en esta paciente, y otros encontrados en los linfomas de la zona marginal esplénica (11,12,13,14,34) pueden representar un efecto autoinmune de la IgM producida por el linfoma, que en esta enfermedad, como en algunos otros linfomas, frecuentemente tienen regiones variables que son típicas de autoanticuerpos (14,30,31) En otros casos, los autoanticuerpos pueden resultar de estimulación indirecta por las células –T de antígenos independientes, que promueven la expansión clonal de las células-B. (14,31)
Discusión del Manejo.
Nuestras opciones incluían esplenectomía, irradiación esplénica, quimioterapia, y terapia con el anticuerpo monoclonal rituximab. (36,37,38) Si ella hubiera tenido infección por HCV, el tratamiento con interferón/ribavirina hubiera probablemente producido alguna respuesta. (39,40) Dado que la quimioterapia sistémica con agentes alquilantes y análogos de las purinas, efectivos en otros linfomas, ha sido desalentador en esta enfermedad, la estrategia más común es la esplenectomía sola. Esto puede producir respuestas sostenidas, (6, 10, 35, 41) incluyendo la resolución de las citopenias, los síntomas B (fiebre, pérdida de peso no buscada, y sudoración nocturna), y paraproteinemia, (10,41) y la resolución parcial o completa de las complicaciones autoinmunes tales como la anemia hemolítica. Se administró heparina de bajo peso molecular como profilaxis perioperatoria contra la trombosis y después fue discontinuada. Después de la esplenectomía, el hematocrito y la hemoglobina volvieron a valores normales en el término de 6 semanas, pero la LDH permaneció alta y la haptoglobina baja, sugiriendo que la hemólisis persistía. El tiempo de tromboplastina parcial se normalizó, pero el nivel de anticardiolipina IgM permaneció elevado, y el nivel de paraproteína disminuyó pero no desapareció. Una pequeña población de células B clonales persistió en la sangre periférica, dtectada por citometría de flujo. Ella inicialmente fue seguida sin ninguna otra intervención terapéutica para el linfoma.
Desafortunadamente, 15 meses después de la esplenectomía, recurrió la fatiga, y la paciente volvió a anemizarse, con recurrencia de la elevación de la paraproteína IgM, un elevado nivel de anticardiolipina IgM, un débilmente positivo test de Coombs para complemento pero no para IgG (hallazgo consistente con actividad de autoanticuerpo IgM de su paraproteína), y linfadenopatías retroperitoneales.
Se diagnosticó una trombosis venosa profunda, y se comenzó terapia con heparina de bajo peso molecular. Una biopsia con aguja de un ganglio retroperitoneal con control por TAC fue realizada para descartar transformación a linfoma-B difuso de células grandes. La biopsia mostró recurrencia del linfoma de zona marginal. Se comenzó tratamiento con rituximab, ciclofosfamida, vincristina y prednisona; la anemia se resolvió rápidamente, las linfadenopatías disminuyeron, y los niveles de paraproteínas y anticuerpos anticardiolipinas cayeron. Ella está actualmente en el 7º de los 8 ciclos planeados de tratamiento y está respondiendo con una reducción de las linfadenopatías y una disminución en el nivel de paraproteínas.
Diagnóstico Anatómico:
Linfoma de la zona marginal esplénico, con paraproteína IgM, anticuerpos antifosfolipídicos (anticoagulante lúpico e IgM anticardiolipina), y anemia hemolítica autoinmune.
Traducción de:
Case 39-2008 — A 51-Year-Old Woman with Splenomegaly and Anemia
Jeremy S. Abramson, M.D., Manjil Chatterji, M.D., and Aliyah Rahemtullah, M.D.
Volume 359:2707-2718 December 18, 2008 Number 25
CASE RECORDS OF THE MASSACHUSETTS GENERAL HOSPITAL
Fuente:
From the Cancer Center (J.S.A.) and the Departments of Radiology (M.C.) and Pathology (A.R.), Massachusetts General Hospital; and the Departments of Medicine (J.S.A.), Radiology (M.C.), and Pathology (A.R.), Harvard Medical School.
Conclusiones del Ateneo:
No es infrecuente que una enfermedad hematológica se presente con sintomatología dispéptica por crecimiento desmesurado del bazo, llevando a los pacientes a consultar por síntomas como distensión abdominal, pesadez posprandial, y saciedad precoz por compresión de dicha víscera sobre el estómago. Clásicamente la leucemia mieloide crónica se presenta de esta manera.
No hay muchas causas de esplenomegalia gigante (cuando el bazo rebasa la línea media del abdomen alcanzando la cresta ilíaca). Los libros básicos antiguos de Medicina Interna mencionan a la leucemia mieloide crónica, la policitemia vera, la metaplasia mieloide, el paludismo, el kala-azar, y la enfermedad de Gaucher. Curiosamente no mencionaban a los linfomas dentro de las causas. Sin embargo, todos hemos tenido oportunidad de ver linfomas (no-Hodgkin) con esplenomegalias gigantes, a veces inclusive a forma de comienzo esplénico, y como única manifestación de enfermedad.
Este caso, analiza el espectro clínico de los linfomas no Hodgkin de células B, y el nivel de complejidad que requiere hoy día su categorización, y su ubicación en la intrincada clasificación de los mismos.
En el estudio y clasificación de estas enfermedades intervienen elementos clínicos que van desde la edad y el sexo del paciente, datos del examen físico que van desde la presencia o no de esplenomegalia (gigante en este caso) la profusión o no de linfadenopatías, el compromiso de órganos extralinfáticos, el tiempo de evolución, la sintomatología, el laboratorio, las imágenes, asociado a una adecuada tipificación morfológica, inmunofenotípica, citogenética y molecular entre otros datos, en un contexto de certificación de clonalidad por técnicas de citometría de flujo.En este caso se agregaron elementos de interés clínico como la presencia de una paraproteinemia sintomática, fenómenos de autoinmunidad caracterizados por anemia hemolítica autoinmune, la presencia de anticoagulante lúpico y anticuerpos anticardiolipinas, además de resultados falsos positivos para el virus HAV, producto de la paraproteína IgM.
El linfoma de la zona marginal esplénico es una enfermedad neoplásica de células B poco frecuente, que se desarrolla, como su nombre lo indica, en la zona marginal del bazo. La zona marginal es la que rodea a la región del manto del folículo germinal secundario del bazo, aunque también se localiza en todos los órganos linfáticos, ganglios, placas de Peyer amígdalas etc.
El linfoma de la zona marginal esplénico, es un linfoma de bajo grado, indolente, de lenta evolución. La paciente que nos ocupa, sin embargo, se presentó con manifestaciones de enfermedad aguda/subaguda de 2 meses de evolución. El motivo de esta forma de comienzo, es que ella en realidad consulta por su síndrome anémico (hematocrito de 21%) ocasionado por anemia hemolítica autoinmune secundaria a paraproteína IgM. Este cuadro agregado, así como la presencia de otros autoanticuerpos que le ocasionaban un síndrome antifosfolipídico contribuyeron a la riqueza signo sintomatológica, haciendo que una enfermedad crónica se manifestara por un cuadro relativamente agudo.
La esplenomegalia gigante está descripta en esta entidad, a veces como primera manifestación de la misma, lo que nos obliga a considerarla en el diagnóstico diferencial de las esplenomegalias gigantes a partir de ahora.
Bibliografia
1. Beutler E. Lipid storage diseases. In: Lichtman MA, Beutler E, Kipps TJ, Seligsohn U, Kaushansky K, Prchal JT, eds. Williams hematology. 7th ed. New York: McGraw-Hill, 2006:1009-14.
2. Charrow J, Andersson HC, Kaplan P, et al. The Gaucher Registry: demographics and disease characteristics of 1698 patients with Gaucher disease. Arch Intern Med 2000;160:2835-2843. [Free Full Text]
3. Jaffe ES, Harris NL, Stein H, Vardiman JW, eds. World Health Organization classification of tumours: pathology and genetics of haematopoietic and lymphoid tissues. Lyon, France: IARC Press, 2001.
4. Owen RG, Treon SP, Al-Katib A, et al. Clinicopathological definition of Waldenstrom's macroglobulinemia: consensus panel recommendations from the Second International Workshop on Waldenstrom's Macroglobulinemia. Semin Oncol 2003;30:110-115. [CrossRef][ISI][Medline]
5. Arcaini L, Lazzarino M, Colombo N, et al. Splenic marginal zone lymphoma: a prognostic model for clinical use. Blood 2006;107:4643-4649. [Free Full Text]
6. Berger F, Felman P, Thieblemont C, et al. Non-MALT marginal zone B-cell lymphomas: a description of clinical presentation and outcome in 124 patients. Blood 2000;95:1950-1956. [Free Full Text]
7. Chacon JI, Mollejo M, Muñoz E, et al. Splenic marginal zone lymphoma: clinical characteristics and prognostic factors in a series of 60 patients. Blood 2002;100:1648-1654. [Free Full Text]
8. Iannitto E, Ambrosetti A, Ammatuna E, et al. Splenic marginal zone lymphoma with or without villous lymphocytes: hematologic findings and outcomes in a series of 57 patients. Cancer 2004;101:2050-2057. [CrossRef][ISI][Medline]
9. Parry-Jones N, Matutes E, Gruszka-Westwood AM, Swansbury GJ, Wotherspoon AC, Catovsky D. Prognostic features of splenic lymphoma with villous lymphocytes: a report on 129 patients. Br J Haematol 2003;120:759-764. [CrossRef][ISI][Medline]
10. Thieblemont C, Felman P, Berger F, et al. Treatment of splenic marginal zone B-cell lymphoma: an analysis of 81 patients. Clin Lymphoma 2002;3:41-47. [Medline]
11. Ciaudo M, Horellou MH, Audouin J, De Carbonnieres C, Conard J, Samama M. Lupus anticoagulant associated with primary malignant lymphoplasmacytic lymphoma of the spleen: a report of four patients. Am J Hematol 1991;38:271-276. [ISI][Medline]
12. Martin SE, Abel RF. Splenic marginal zone lymphoma, iliac vein thrombosis, and monoclonal immunoglobulin M kappa antiphospholipid antibody with Annexin A5 interaction. Leuk Lymphoma 2006;47:1994-1996. [CrossRef][ISI][Medline]
13. Murakami H, Irisawa H, Saitoh T, et al. Immunological abnormalities in splenic marginal zone cell lymphoma. Am J Hematol 1997;56:173-178. [CrossRef][ISI][Medline]
14. Ziakas PD, Giannouli S, Tasidou A, Skopouli FN, Voulgarelis M. Multiple autoimmune phenomena in splenic marginal zone lymphoma. Leuk Lymphoma 2006;47:772-775. [ISI][Medline]
15. Arcaini L, Paulli M, Boveri E, et al. Splenic and nodal marginal zone lymphomas are indolent disorders at high hepatitis C virus seroprevalence with distinct presenting features but similar morphologic and phenotypic profiles. Cancer 2004;100:107-115. [CrossRef][ISI][Medline]
16. Dhodapkar MV, Li CY, Lust JA, Tefferi A, Phyliky RL. Clinical spectrum of clonal proliferations of T-large granular lymphocytes: a T-cell clonopathy of undetermined significance? Blood 1994;84:1620-1627. [Free Full Text]
17. Belhadj K, Reyes F, Farcet JP, et al. Hepatosplenic gammadelta T-cell lymphoma is a rare clinicopathologic entity with poor outcome: report on a series of 21 patients. Blood 2003;102:4261-4269. [Free Full Text]
18. Cooke CB, Krenacs L, Stetler-Stevenson M, et al. Hepatosplenic T-cell lymphoma: a distinct clinicopathologic entity of cytotoxic gamma delta T-cell origin. Blood 1996;88:4265-4274. [Free Full Text]
19. Marchand A, Galen RS, Van Lente F. The predictive value of serum haptoglobin in hemolytic disease. JAMA 1980;243:1909-1911. [Abstract]
20. Garratty G. Immune hemolytic anemia associated with negative routine serology. Semin Hematol 2005;42:156-164. [CrossRef][ISI][Medline]
21. Kyriakou DS, Alexandrakis MG, Passam FH, et al. Acquired inhibitors to coagulation factors in patients with gastrointestinal diseases. Eur J Gastroenterol Hepatol 2002;14:1383-1387. [CrossRef][ISI][Medline]
22. Brody JI, Haidar ME, Rossman RE. A hemorrhagic syndrome in Waldenström's macroglobulinemia secondary to immunoadsorption of factor VIII: recovery after splenectomy. N Engl J Med 1979;300:408-410. [ISI][Medline]
23. Endo T, Yatomi Y, Amemiya N, et al. Antibody studies of factor VIII inhibitor in a case with Waldenström's macroglobulinemia. Am J Hematol 2000;63:145-148. [CrossRef][ISI][Medline]
24. Tefferi A, Hanson CA, Kurtin PJ, Katzmann JA, Dalton RJ, Nichols WL. Acquired von Willebrand's disease due to aberrant expression of platelet glycoprotein Ib by marginal zone lymphoma cells. Br J Haematol 1997;96:850-853. [CrossRef][ISI][Medline]
25. Mazurier C, Parquet-Gernez A, Descamps J, Bauters F, Goudemand M. Acquired von Willebrand's syndrome in the course of Waldenström's disease. Thromb Haemost 1980;44:115-118. [ISI][Medline]
26. Rao KP, Kizer J, Jones TJ, Anunciado A, Pepkowitz SH, Lazarchick J. Acquired von Willebrand's syndrome associated with an extranodal pulmonary lymphoma. Arch Pathol Lab Med 1988;112:47-50. [ISI][Medline]
27. Isaacson PG, Matutes E, Burke M, Catovsky D. The histopathology of splenic lymphoma with villous lymphocytes. Blood 1994;84:3828-3834. [Free Full Text]
28. Isaacson PG, Piris MA, Catovsky D, et al. Splenic marginal zone lymphoma. In: Jaffe ES, Harris NL, Stein H, Vardiman JW, eds. World Health Organization classification of tumours: tumours of the hematopoietic and lymphoid tissues. Lyon, France: IARC Press, 2001:135-7.
29. Algara P, Mateo MS, Sanchez-Beato M, et al. Analysis of the IgV(H) somatic mutations in splenic marginal zone lymphoma defines a subgroup of unmutated cases with frequent 7q deletion and adverse clinical course. Blood 2002;99:1299-1304. [Free Full Text]
30. Stamatopoulos K, Belessi C, Papadaki T, et al. Immunoglobulin heavy and light chain repertoire in splenic marginal zone lymphoma. Mol Med 2004;10:89-95. [Medline]
31. Papadaki T, Stamatopoulos K, Belessi C, et al. Splenic marginal-zone lymphoma: one or more entities? A histologic, immunohistochemical, and molecular study of 42 cases. Am J Surg Pathol 2007;31:438-446. [CrossRef][ISI][Medline]
32. Van Cott EM, Laposata M. Laboratory evaluation of hypercoagulable states. Hematol Oncol Clin North Am 1998;12:1141-1166. [CrossRef][ISI][Medline]
33. Idem. Coagulation, fibrinolysis and hypercoagulation. In: Henry JB, ed. Clinical diagnosis and management by laboratory methods. 20th ed. Philadelphia: W.B. Saunders, 2001:642-59.
34. Sawamura M, Yamaguchi S, Murakami H, et al. Multiple autoantibody production in a patient with splenic lymphoma. Ann Hematol 1994;68:251-254. [CrossRef][ISI][Medline]
35. Troussard X, Valensi F, Duchayne E, et al. Splenic lymphoma with villous lymphocytes: clinical presentation, biology and prognostic factors in a series of 100 patients. Br J Haematol 1996;93:731-736. [CrossRef][ISI][Medline]
36. Bennett M, Sharma K, Yegena S, Gavish I, Dave HP, Schechter GP. Rituximab monotherapy for splenic marginal zone lymphoma. Haematologica 2005;90:856-858. [Free Full Text]
37. Tsimberidou AM, Catovsky D, Schlette E, et al. Outcomes in patients with splenic marginal zone lymphoma and marginal zone lymphoma treated with rituximab with or without chemotherapy or chemotherapy alone. Cancer 2006;107:125-135. [CrossRef][ISI][Medline]
38. Kalpadakis C, Pangalis GA, Dimopoulou MN, et al. Rituximab monotherapy is highly effective in splenic marginal zone lymphoma. Hematol Oncol 2007;25:127-131. [CrossRef][ISI][Medline]
39. Hermine O, Lefrère F, Bronowicki JP, et al. Regression of splenic lymphoma with villous lymphocytes after treatment of hepatitis C virus infection. N Engl J Med 2002;347:89-94. [Free Full Text]
40. Vallisa D, Bernuzzi P, Arcaini L, et al. Role of anti-hepatitis C virus (HCV) treatment in HCV-related, low-grade, B-cell, non-Hodgkin's lymphoma: a multicenter Italian experience. J Clin Oncol 2005;23:468-473. [Free Full Text]
41. Mulligan SP, Matutes E, Dearden C, Catovsky D. Splenic lymphoma with villous lymphocytes: natural history and response to therapy in 50 cases. Br J Haematol 1991;78:206-209. [ISI][Medline
No hay muchas causas de esplenomegalia gigante (cuando el bazo rebasa la línea media del abdomen alcanzando la cresta ilíaca). Los libros básicos antiguos de Medicina Interna mencionan a la leucemia mieloide crónica, la policitemia vera, la metaplasia mieloide, el paludismo, el kala-azar, y la enfermedad de Gaucher. Curiosamente no mencionaban a los linfomas dentro de las causas. Sin embargo, todos hemos tenido oportunidad de ver linfomas (no-Hodgkin) con esplenomegalias gigantes, a veces inclusive a forma de comienzo esplénico, y como única manifestación de enfermedad.
Este caso, analiza el espectro clínico de los linfomas no Hodgkin de células B, y el nivel de complejidad que requiere hoy día su categorización, y su ubicación en la intrincada clasificación de los mismos.
En el estudio y clasificación de estas enfermedades intervienen elementos clínicos que van desde la edad y el sexo del paciente, datos del examen físico que van desde la presencia o no de esplenomegalia (gigante en este caso) la profusión o no de linfadenopatías, el compromiso de órganos extralinfáticos, el tiempo de evolución, la sintomatología, el laboratorio, las imágenes, asociado a una adecuada tipificación morfológica, inmunofenotípica, citogenética y molecular entre otros datos, en un contexto de certificación de clonalidad por técnicas de citometría de flujo.En este caso se agregaron elementos de interés clínico como la presencia de una paraproteinemia sintomática, fenómenos de autoinmunidad caracterizados por anemia hemolítica autoinmune, la presencia de anticoagulante lúpico y anticuerpos anticardiolipinas, además de resultados falsos positivos para el virus HAV, producto de la paraproteína IgM.
El linfoma de la zona marginal esplénico es una enfermedad neoplásica de células B poco frecuente, que se desarrolla, como su nombre lo indica, en la zona marginal del bazo. La zona marginal es la que rodea a la región del manto del folículo germinal secundario del bazo, aunque también se localiza en todos los órganos linfáticos, ganglios, placas de Peyer amígdalas etc.
El linfoma de la zona marginal esplénico, es un linfoma de bajo grado, indolente, de lenta evolución. La paciente que nos ocupa, sin embargo, se presentó con manifestaciones de enfermedad aguda/subaguda de 2 meses de evolución. El motivo de esta forma de comienzo, es que ella en realidad consulta por su síndrome anémico (hematocrito de 21%) ocasionado por anemia hemolítica autoinmune secundaria a paraproteína IgM. Este cuadro agregado, así como la presencia de otros autoanticuerpos que le ocasionaban un síndrome antifosfolipídico contribuyeron a la riqueza signo sintomatológica, haciendo que una enfermedad crónica se manifestara por un cuadro relativamente agudo.
La esplenomegalia gigante está descripta en esta entidad, a veces como primera manifestación de la misma, lo que nos obliga a considerarla en el diagnóstico diferencial de las esplenomegalias gigantes a partir de ahora.
Bibliografia
1. Beutler E. Lipid storage diseases. In: Lichtman MA, Beutler E, Kipps TJ, Seligsohn U, Kaushansky K, Prchal JT, eds. Williams hematology. 7th ed. New York: McGraw-Hill, 2006:1009-14.
2. Charrow J, Andersson HC, Kaplan P, et al. The Gaucher Registry: demographics and disease characteristics of 1698 patients with Gaucher disease. Arch Intern Med 2000;160:2835-2843. [Free Full Text]
3. Jaffe ES, Harris NL, Stein H, Vardiman JW, eds. World Health Organization classification of tumours: pathology and genetics of haematopoietic and lymphoid tissues. Lyon, France: IARC Press, 2001.
4. Owen RG, Treon SP, Al-Katib A, et al. Clinicopathological definition of Waldenstrom's macroglobulinemia: consensus panel recommendations from the Second International Workshop on Waldenstrom's Macroglobulinemia. Semin Oncol 2003;30:110-115. [CrossRef][ISI][Medline]
5. Arcaini L, Lazzarino M, Colombo N, et al. Splenic marginal zone lymphoma: a prognostic model for clinical use. Blood 2006;107:4643-4649. [Free Full Text]
6. Berger F, Felman P, Thieblemont C, et al. Non-MALT marginal zone B-cell lymphomas: a description of clinical presentation and outcome in 124 patients. Blood 2000;95:1950-1956. [Free Full Text]
7. Chacon JI, Mollejo M, Muñoz E, et al. Splenic marginal zone lymphoma: clinical characteristics and prognostic factors in a series of 60 patients. Blood 2002;100:1648-1654. [Free Full Text]
8. Iannitto E, Ambrosetti A, Ammatuna E, et al. Splenic marginal zone lymphoma with or without villous lymphocytes: hematologic findings and outcomes in a series of 57 patients. Cancer 2004;101:2050-2057. [CrossRef][ISI][Medline]
9. Parry-Jones N, Matutes E, Gruszka-Westwood AM, Swansbury GJ, Wotherspoon AC, Catovsky D. Prognostic features of splenic lymphoma with villous lymphocytes: a report on 129 patients. Br J Haematol 2003;120:759-764. [CrossRef][ISI][Medline]
10. Thieblemont C, Felman P, Berger F, et al. Treatment of splenic marginal zone B-cell lymphoma: an analysis of 81 patients. Clin Lymphoma 2002;3:41-47. [Medline]
11. Ciaudo M, Horellou MH, Audouin J, De Carbonnieres C, Conard J, Samama M. Lupus anticoagulant associated with primary malignant lymphoplasmacytic lymphoma of the spleen: a report of four patients. Am J Hematol 1991;38:271-276. [ISI][Medline]
12. Martin SE, Abel RF. Splenic marginal zone lymphoma, iliac vein thrombosis, and monoclonal immunoglobulin M kappa antiphospholipid antibody with Annexin A5 interaction. Leuk Lymphoma 2006;47:1994-1996. [CrossRef][ISI][Medline]
13. Murakami H, Irisawa H, Saitoh T, et al. Immunological abnormalities in splenic marginal zone cell lymphoma. Am J Hematol 1997;56:173-178. [CrossRef][ISI][Medline]
14. Ziakas PD, Giannouli S, Tasidou A, Skopouli FN, Voulgarelis M. Multiple autoimmune phenomena in splenic marginal zone lymphoma. Leuk Lymphoma 2006;47:772-775. [ISI][Medline]
15. Arcaini L, Paulli M, Boveri E, et al. Splenic and nodal marginal zone lymphomas are indolent disorders at high hepatitis C virus seroprevalence with distinct presenting features but similar morphologic and phenotypic profiles. Cancer 2004;100:107-115. [CrossRef][ISI][Medline]
16. Dhodapkar MV, Li CY, Lust JA, Tefferi A, Phyliky RL. Clinical spectrum of clonal proliferations of T-large granular lymphocytes: a T-cell clonopathy of undetermined significance? Blood 1994;84:1620-1627. [Free Full Text]
17. Belhadj K, Reyes F, Farcet JP, et al. Hepatosplenic gammadelta T-cell lymphoma is a rare clinicopathologic entity with poor outcome: report on a series of 21 patients. Blood 2003;102:4261-4269. [Free Full Text]
18. Cooke CB, Krenacs L, Stetler-Stevenson M, et al. Hepatosplenic T-cell lymphoma: a distinct clinicopathologic entity of cytotoxic gamma delta T-cell origin. Blood 1996;88:4265-4274. [Free Full Text]
19. Marchand A, Galen RS, Van Lente F. The predictive value of serum haptoglobin in hemolytic disease. JAMA 1980;243:1909-1911. [Abstract]
20. Garratty G. Immune hemolytic anemia associated with negative routine serology. Semin Hematol 2005;42:156-164. [CrossRef][ISI][Medline]
21. Kyriakou DS, Alexandrakis MG, Passam FH, et al. Acquired inhibitors to coagulation factors in patients with gastrointestinal diseases. Eur J Gastroenterol Hepatol 2002;14:1383-1387. [CrossRef][ISI][Medline]
22. Brody JI, Haidar ME, Rossman RE. A hemorrhagic syndrome in Waldenström's macroglobulinemia secondary to immunoadsorption of factor VIII: recovery after splenectomy. N Engl J Med 1979;300:408-410. [ISI][Medline]
23. Endo T, Yatomi Y, Amemiya N, et al. Antibody studies of factor VIII inhibitor in a case with Waldenström's macroglobulinemia. Am J Hematol 2000;63:145-148. [CrossRef][ISI][Medline]
24. Tefferi A, Hanson CA, Kurtin PJ, Katzmann JA, Dalton RJ, Nichols WL. Acquired von Willebrand's disease due to aberrant expression of platelet glycoprotein Ib by marginal zone lymphoma cells. Br J Haematol 1997;96:850-853. [CrossRef][ISI][Medline]
25. Mazurier C, Parquet-Gernez A, Descamps J, Bauters F, Goudemand M. Acquired von Willebrand's syndrome in the course of Waldenström's disease. Thromb Haemost 1980;44:115-118. [ISI][Medline]
26. Rao KP, Kizer J, Jones TJ, Anunciado A, Pepkowitz SH, Lazarchick J. Acquired von Willebrand's syndrome associated with an extranodal pulmonary lymphoma. Arch Pathol Lab Med 1988;112:47-50. [ISI][Medline]
27. Isaacson PG, Matutes E, Burke M, Catovsky D. The histopathology of splenic lymphoma with villous lymphocytes. Blood 1994;84:3828-3834. [Free Full Text]
28. Isaacson PG, Piris MA, Catovsky D, et al. Splenic marginal zone lymphoma. In: Jaffe ES, Harris NL, Stein H, Vardiman JW, eds. World Health Organization classification of tumours: tumours of the hematopoietic and lymphoid tissues. Lyon, France: IARC Press, 2001:135-7.
29. Algara P, Mateo MS, Sanchez-Beato M, et al. Analysis of the IgV(H) somatic mutations in splenic marginal zone lymphoma defines a subgroup of unmutated cases with frequent 7q deletion and adverse clinical course. Blood 2002;99:1299-1304. [Free Full Text]
30. Stamatopoulos K, Belessi C, Papadaki T, et al. Immunoglobulin heavy and light chain repertoire in splenic marginal zone lymphoma. Mol Med 2004;10:89-95. [Medline]
31. Papadaki T, Stamatopoulos K, Belessi C, et al. Splenic marginal-zone lymphoma: one or more entities? A histologic, immunohistochemical, and molecular study of 42 cases. Am J Surg Pathol 2007;31:438-446. [CrossRef][ISI][Medline]
32. Van Cott EM, Laposata M. Laboratory evaluation of hypercoagulable states. Hematol Oncol Clin North Am 1998;12:1141-1166. [CrossRef][ISI][Medline]
33. Idem. Coagulation, fibrinolysis and hypercoagulation. In: Henry JB, ed. Clinical diagnosis and management by laboratory methods. 20th ed. Philadelphia: W.B. Saunders, 2001:642-59.
34. Sawamura M, Yamaguchi S, Murakami H, et al. Multiple autoantibody production in a patient with splenic lymphoma. Ann Hematol 1994;68:251-254. [CrossRef][ISI][Medline]
35. Troussard X, Valensi F, Duchayne E, et al. Splenic lymphoma with villous lymphocytes: clinical presentation, biology and prognostic factors in a series of 100 patients. Br J Haematol 1996;93:731-736. [CrossRef][ISI][Medline]
36. Bennett M, Sharma K, Yegena S, Gavish I, Dave HP, Schechter GP. Rituximab monotherapy for splenic marginal zone lymphoma. Haematologica 2005;90:856-858. [Free Full Text]
37. Tsimberidou AM, Catovsky D, Schlette E, et al. Outcomes in patients with splenic marginal zone lymphoma and marginal zone lymphoma treated with rituximab with or without chemotherapy or chemotherapy alone. Cancer 2006;107:125-135. [CrossRef][ISI][Medline]
38. Kalpadakis C, Pangalis GA, Dimopoulou MN, et al. Rituximab monotherapy is highly effective in splenic marginal zone lymphoma. Hematol Oncol 2007;25:127-131. [CrossRef][ISI][Medline]
39. Hermine O, Lefrère F, Bronowicki JP, et al. Regression of splenic lymphoma with villous lymphocytes after treatment of hepatitis C virus infection. N Engl J Med 2002;347:89-94. [Free Full Text]
40. Vallisa D, Bernuzzi P, Arcaini L, et al. Role of anti-hepatitis C virus (HCV) treatment in HCV-related, low-grade, B-cell, non-Hodgkin's lymphoma: a multicenter Italian experience. J Clin Oncol 2005;23:468-473. [Free Full Text]
41. Mulligan SP, Matutes E, Dearden C, Catovsky D. Splenic lymphoma with villous lymphocytes: natural history and response to therapy in 50 cases. Br J Haematol 1991;78:206-209. [ISI][Medline
sábado, 23 de enero de 2010
Ensamblando una Historia Coherente.
En este ejercicio clínico se presenta un caso que es discutido por un médico internista al que se le van proporcionando datos de la historia clínica en forma secuencial, y este analiza el cuadro a la luz de los nuevos elementos, de una manera análoga al proceso diagnóstico en la práctica real de la medicina.
Un paciente Israelí de 44 años, trabajador agropecuario, que vivía en el Valle del Jordán fue admitido al hospital por un cuadro de 2 semanas de fiebre, ictericia, y malestar general. Su historia familiar no mostraba antecedentes de importancia. No tenía antecedentes de enfermedades hepáticas. No tomaba leche no-pasteurizada, ni consumía alcohol. No fumaba ni usaba drogas, era heterosexual y no tomaba medicamentos.
Aunque fiebre y malestar son síntomas inespecíficos que pueden ser atribuidos a casi cualquier proceso inflamatorio, el paciente claramente tiene compromiso del sistema hepatobiliar. Yo descartaría primero hepatitis aguda, aunque una causa obstructiva debe ser tenida en cuenta, aún en ausencia de dolor abdominal. Dado que el paciente vive cerca del Desierto de Judea, yo estaría preocupado por muchas enfermedades exóticas, incluyendo leishmaniasis, brucelosis, malaria, toxoplasmosis, tuberculosis, y rickettsiosis.
La temperatura del paciente era de 37,8ºC. Había unas pequeñas adenomegalias cervicales blandas. No había soplos. El bazo y el hígado se palpaban 4 cm debajo del reborde costal. No había otras alteraciones en el examen físico.
Los hallazgos en este punto pueden ser indicativos de hepatitis viral aguda. Yo solicitaría estudios de rutina, incluyendo recuentos de sangre, un frotis de sangre periférica, y tests de función hepática. Yo además ordenaría cultivos de sangre y tests serológicos específicos para descartar algunos agentes infecciosos determinados, incluyendo hepatitis A, hepatitis B, hepatitis C, virus de Epstein-Barr (EBV), y citomegalovirus (CMV).
Los resultados de laboratorio incluian una eritrosedimentación normal; hemoglobina 13,2 g/dl; volumen corpuscular medio de 84,7 u3; recuento de glóbulos blancos 8100/mm3 con 90% de neutrófilos y 10% de linfocitos atípicos; y plaquetas 271.000/mm3. Los resultados de los tests de función hepática son los siguientes: TGO 111 U/litro (normal 6 a 53); TGP 134 U/litro (normal 7 a 40); FAL 417 U/litro (normal 40 a 130); bilirrubina total 3,6 mg/dl (normal 0,1 a 1); albúmina sérica 3,8 g/dl; y un tiempo de protrombina normal. El paciente tenía altos títulos de anticuerpos IgM anti EBV, pero los tests para otros anticuerpos antivirales fueron negativos.
Los hemocultivos eran estériles.
Los hallazgos clínicos y de laboratorio son compatibles con hepatitis viral aguda causada por EBV. Lo único que llama la atención es la edad del paciente, dado que la mayoría de los sujetos con este cuadro son más jóvenes.
Se hizo diagnóstico de mononucleosis infecciosa con hepatitis. La ictericia del paciente y el malestar mejoraron con medidas generales, y fue dado de alta del hospital.
Ocho semanas más tarde, sin embargo, reapareció la fiebre, acompañada de escalofrios. Su temperatura era de 40 ºC, y fue rehospitalizado.
El segundo episodio de fiebre, acompañado ahora por escalofrios, me hace sospechar que el diagnóstico inicial amerita reevaluación. Yo repeteiría el examen físico, haría investigaciones de laboratorio más extensas, y buscaría causas infecciosas alternativas.
El paciente impresionaba en muy mal estado general. Había perdido 7 kg de peso en las últimas 8 semanas. Su temperatura era de 39,8ºC; su presión arterial era de 100/60 mmHg; su frecuencia cardíaca de 98 por minuto, y su frecuencia respiratoria de 18 por minuto. El examen cardíaco era normal excepto por un soplo sistólico grado 1/6 a 2/6 en el apex. Excepto por hepatoesplenomegalia, el resto del examen físico era normal.
En este punto, mi plan diagnóstico se orienta a sepsis; yo obtendría numerosos hemocultivos. Buscaría otro probable foco de infección, tal como el aparato urinario, pulmones, huesos, y piel. El hallazgo más relevante en este contexto es la aparición de un soplo cardíaco nuevo. Una evaluación completa para descartar endocarditis debe ser realizada, incluyendo un ecocardiograma en forma inmediata. La pregunta es, si iniciar tratamiento inmediatamente una vez tomadas las muestras para los diferentes cultivos, o tratar sintomáticamente al paciente asumiendo que el soplo es de origen funcional, como resultado de los cambios hemodinámicos causados por la fiebre alta. Un cuidadoso seguimiento es esencial.
La eritrosedimentación era de 120 mm en la primera hora. Los resultados de los tests de laboratorio fueron los siguientes: hemoglobina 8 g/dl; volumen corpuscular medio, 85 u3; recuento de glóbulos blancos 8200/mm3, con 90% de neutrófilos y algunos linfocitos atípicos en sangre periférica; un recuento de plaquetas normal; aspartato aminotransferasa 458U/L; alaninoaminotransferasa 690 U/L; FAL 717 U/L; bilirrubina total 4,4 mg/dl; bilirrubina directa 3,8 mg/dl. El tiempo de protrombina fue nuevamente normal. Los cultivos de sangre y orina fueron estériles, y los tests serológicos para fiebre tifoidea, brucelosis, toxoplasmosis, fiebre Q, y otras rickettsias, y psitacosis fueron negativos; no se observaron parásitos.
La eritrosedimentación elevada es inespecífica, aunque un marcado aumento dentro de 8 semanas es completamente remarcable. La endocarditis es una de las pocas enfermedades en que hay a menudo correlación directa entre el curso y la severidad de la enfermedad, con la velocidad de la sedimentación globular. La anemia normocítica es probablemente corresponde a la anemia de los trastornos crónicos, pero una biopsia de médula ósea puede estar indicada tanto para el examen morfológico, como para cultivos para tuberculosis brucelosis y leishmaniasis. En este punto, una Rx de tórax y abdomen están también indicadas.
Una biopsia de médula ósea reveló una aplasia pura de glóbulos rojos con precursores de las otras series normales.
Una aplasia pura de glóbulos rojos puede ser causada por una variedad de trastornos, los más relevantes de los cuales son una variedad de agentes infecciosos, incluyendo parvovirus, HIV, parotiditis, CMV, EBV, y virus de hepatitis. La leucemia de células T es otra posibilidad.
La Rx de tórax mostró derrame pleural bilateral pequeño. La ecografía abdominal confirmó la presencia de leve a moderada hepatoesplenomegalia, y la TAC reveló múltiples infartos esplénicos, un posible infarto renal derecho y cardiomegalia.
Cuál es el diagnóstico?
La combinación de fiebre alta, anemia, nuevo soplo cardíaco, e infartos esplénicos es casi patognomónico de endocarditis. Un ecocardiograma está urgentemente indicado.
Tres días después, de que el soplo fuera escuchado, el paciente desarrolló súbitamente edema agudo de pulmón. Una disminución de la intensidad del primer ruido cardíaco con un soplo holosistólico grado 3 sobre el área mitral, irradiándose a la axila fue escuchado, y fueron observadas hemorragias en astilla en los lechos ungueales de las manos. Un ecocardiograma bidimensional reveló una vegetación en la válvula mitral.
El paciente tiene endocarditis con cultivos negativos. La descompensación hemodinámica es indicación de urgente tratamiento que incluya antibióticos de amplio espectro.
El paciente fue transferido a una unidad de cuidados intensivos, y se comenzó tratamiento con nitratos, enalapril, furosemida, digoxina, vancomicina, tetraciclina, gentamicina, y metronidazol. Un ecocardiograma transesofágico reveló una buena función ventricular, moderada a severa regurgitación mitral, y una única vegetación de la valva posterior mitral.
Aunque el paciente fue adecuadamente tratado con antibióticos cubriendo el espectro de endocarditis a cultivos negativos, el tiene un severo fallo cardíaco congestivo, y su válvula mitral debe ser reemplazada.
El reemplazo de la válvula mitral fue llevado a cabo 5 días después de que desarrollara fallo cardíaco. Una vegetación de 1,5 cm fue encontrada en la valva posterior de la válvula mitral con perforación e invasión del anillo. Había también una vegetación en la valva anterior de la mitral. Después de la cirugía, el paciente mejoró gradualmente. Él permaneció hemodinámicamente estable, sin signos clínicos de fallo cardíaco. Una semana después de la cirugía, cuatro cultivos de sangre obtenidos justo antes de la operación fueron informados como positivos para Haemophilus parainfluenzae. Todos los demás cultivos siguieron siendo negativos.
H parainfluenzae es un agente inusual de endocarditis infecciosa. Yo ajustaría el régimen antibiótico de acuerdo a la sensibilidad in vitro del agente y probablemente incluya tanto ampicilina como un aminoglucósido.
La terapia antibiótica fue cambiada a ampicilina solamente, 12 gramos por día durante 6 semanas. El paciente gradualmente se recuperó, y su nivel de hemoglobina y los tests de función hepática volvieron a lo normal.
Comentario.
Muchas preguntas intrigantes surgen de la enfermedad de este paciente.
1) Tuvo hepatitis por virus de Epstein-Barr, y si así fuera, porqué a esta edad?
2) Cuál es la causa de la aplasia pura de glóbulos rojos?
3) Porqué desarrolló endocarditis, y porqué el organismo es una especie tan inusual?
4) Debió llegarse antes al diagnóstico?
5) Cuán urgente era el reemplazo valvular?
Más que enfrentarnos con estas preguntas, nosotros elegimos tratar de desarrollar una explicación coherente para los principales elementos de este caso.
Al inicio de los síntomas, el paciente tuvo un cuadro compatible con injuria hepática aguda, una eritrosedimentación normal, y ninguna manifestación de endocarditis. Hubo un largo período cuando él dejo de tener fiebre entre su enfermedad inicial y la segunda fase de su enfermedad. Esas observaciones argumentan a favor de la hipótesis que la endocarditis bacteriana desarrolló varias semanas después del inicio de su primera enfermedad, que nosotros creimos que se trataba de hepatitis por virus de Epstein-Barr. Si bien existen resultados falsos positivos por anticuerpos para virus de Epstein- Barr en endocarditis infecciosa, (1) nosotros creemos que este fue un resultado verdadero positivo.
La causa de la aplasia pura de glóbulos rojos nunca fue identificada. Una aplasia pura de glóbulos rojos aguda reversible es una complicación bien conocida de una variedad de infecciones incluyendo algunos virus mencionados por el médico que discutió el caso, así como infecciones con algunas bacterias, tales como meningococos y estafilococos (2). La endocarditis no es una causa conocida de anemia pura de glóbulos rojos, y nosotros nos orientamos más a atribuir la anormalidad hematológica a la infección por EBV en este paciente.
El hallazgo de endocarditis infecciosa en este paciente fue sorprendente, dado que el paciente nunca tuvo enfermedad valvular preexistente, ni ninguna otra causa de inmunocompromiso. (3) Muy a menudo, la historia de los pacientes con endocarditis provee pistas de gran valor diagnóstico, (4) pero en este caso, el paciente no tenía antecedentes de enfermedad cardíaca, y el soplo que apareció durante la segunda internación, fue primero interpretado como en relación a su estado hiperdinámico por la fiebre.
Otro hallazgo inusual fue el organismo cultivado de la sangre. H. parainfluenzae es una causa infrecuente de endocarditis. Especies de Haemophilus pueden causar endocarditis con cultivos negativos debido a que estos organismos son dificultosos para cultivar. H. parainfluenzae es un organismo fastidioso que crece lentamente, o decididamente no crece en los medios de cultivos de rutina. Sin embargo, la endocarditis causada por H. parainfluenzae puede distinguirse clínicamente de otros tipos de endocarditis dado que frecuentemente produce embolización de grandes arterias, mientras que los signos periféricos característicos de la endocarditis incluyendo manchas de Roth o lesiones de Janeway no son vistos con este germen. La presencia de valvulopatía de base está presente en sólo la mitad de los pacientes, y en algunos casos, el soplo, puede ser la única manifestación de endocarditis en el examen físico (5,6,7,8,9,10). El lento crecimiento de H. parainfluenzae, y la pobreza de signos clínicos fueron vistos en el paciente bajo discusión.
Podemos proponer una cadena patofisiológica causal que pueda dar cuenta de los síntomas de este paciente? Aunque es posible que desde el principio, el paciente tuviera endocarditis asentando en una válvula normal, nosotros nos inclinamos a pensar que la endocarditis fue un evento secundario y una segunda enfermedad. Nosotros creemos que el paciente tuvo hepatitis por EBV, asociado a aplasia pura de glóbulos rojos. Y sospechamos que algún grado de inmunocompromiso en relación a infección viral, y acompañando al daño hepático fue el factor que H. parainfluenzae infectara a un paciente por otro lado normal y sin valvulopatía previa.
No hace falta decir que el hecho de que una manifestación clínica siga a otra, no es suficiente justificación para asumir una asociación causal entre las dos. La cadena patofisiológica está basada en conceptos de sentido común y causalidad, que incluye los siguientes requerimientos: un efecto debe ser generado por una causa atendible o lógica; la causa y el efecto deben estar relacionadas en tiempo y espacio; y la causa y el efecto deben ser coherentes en términos de intensidad y magnitud. (11) En el caso de este paciente, la cadena patofisiológica que proponemos, reúne esos criterios.
Los clínicos deben siempre tratar de ensamblar un cuadro coherente de la enfermedad del paciente. Para hacerlo, deben tratar de explicar los hallazgos positivos y negativos, y establecer si los factores predisponentes y las complicaciones, son coherentes con la hipótesis diagnóstica. Si en el camino se encuentran muchas inconsistencias, la hipótesis diagnóstica debe ser cuestionada, y se debe comenzar a buscar otras alternativas diagnósticas.
Finalmente, aunque nosotros describimos una razonable cadena patofisiológica, que pueden dar cuenta de los hallazgos de este caso, no tenemos garantía de validez. De hecho, seguimos abiertos a otras explicaciones alternativas.
Fuente
From the Department of Medicine (R.O.) and the Hematology Unit (Y.M.), Hadassah University Hospital, Mount Scopus, Jerusalem, Israel.
Address reprint requests to Dr. Oren at the Department of Medicine, Hadassah University Hospital, Mount Scopus, Jerusalem 91240, Israel.
Traducción de:
Assembling a Coherent Story
Ran Oren, and Yaacov Matzner
Clinical Problem-Solving.
Volume 330:1618 June 2, 1994 Number 22
The New England Journal of Medicine.
Comentarios Finales.
Este caso clínico fue presentado en la sesión Clinical Problem-Solving de “The New England Journal of Medicine” en enero de 1994. Sin embargo, el caso de este paciente Israelí debe haberse desarrollado probablemente al comienzo de la década de 1980. Prueba de ello son las fechas de la bibliografía aportada, y algunos elementos que surgen de la historia clínica. Uno de ellos es que en presencia de un síndrome mononucleósico, evidenciado en este paciente por un síndrome febril con poliadenopatías, hepatoesplenomegalia, hepatitis, y 10% de linfocitos atípicos en sangre periférica no se haya planteado dentro de la lista de diagnósticos diferenciales, a la infección aguda por HIV. De hecho no figuran en la historia, la solicitud de una prueba de laboratorio destinada a descartar la infección por este retrovirus.
Otro elemento que nos hace sospechar de la antigüedad de este caso, es considerar como excepcional a la endocarditis por especies de Haemophilus. Sabemos que este germen hoy en día es un agente causal frecuente y pertenece al llamado grupo HACEK (el acrónimo HACEK se refiere a un grupo de bacilos gram negativos: Haemophilus species (Haemophilus parainfluenzae, Haemophilus aphrophilus, Haemophilus paraphrophilus), Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, y a especies de Kingella). Esta familia de gérmenes son una causa frecuente de endocarditis que debemos sospechar, sobre todo en endocarditis con “cultivos negativos”, y es una entidad en la que más que nunca debe haber una estrecha comunicación entre los médicos tratantes y personal de laboratorio de bacteriología, alertando al mismo sobre la sospecha clínica, y de esta manera llevar a cabo técnicas especiales y sobre todo someter a estas muestras a medios de cultivo adecuados. Un alto nivel de sospecha se requiere para el diagnóstico de esta entidad que da cuenta del 5 a 10% de todos los casos de endocarditis de válvulas nativas en individuos no drogadictos endovenosos. Se requiere no menos de 6 días de incubación para su desarrollo en medios de cultivos tradicionales no automatizados, aunque la introducción de los sistemas de cultivo automatizados permite aislarlos antes de 5 días.
Pero el aspecto más significativo de la historia está dado por la duda instalada de si este paciente tuvo endocarditis de entrada, o si tuvo primero mononucleosis y 8 semanas después desarrolló endocarditis bacteriana, relacionada o no con la primera enfermedad. Más allá de el valorable intento de ensamblar una “historia coherente” por los autores del artículo a través de un supuesto inmunocompromiso ocasionado por el virus de Epstein-Barr que habría predispuesto al paciente a endocarditis, no parece haber dudas de que el paciente tuvo mononucleosis infecciosa primero, y por supuesto endocarditis después. El lógico intento de buscar relación entre los dos procesos, no está avalado por la evidencia, y no hay descriptas enfermedades bacterianas secundarias al inmunocompromiso por EBV.
Si bien es cierto que hay algunas molestas “inconsistencias” para el diagnóstico de mononucleosis en la primera enfermedad, como hepatoesplenomegalia (la hepatomegalia es rara en la mononucleosis) y 90% de neutrófilos en el frotis de sangre periférica, la presencia de 10% de linfocitos atípicos, en el contexto de una hepatitis con títulos altos de IgM anti EBV le ponen el sello al diagnóstico, más aún habiéndose descartado la presencia de otros agentes como los de la hepatitis A, hepatitis B, hepatitis C, y citomegalovirus (CMV). No aclara, sin embargo, que metodología diagnóstica fue utilizada, aunque suponemos que fue solicitado un VCA IgM que es el anticuerpo dirigido contra la cápside viral ( VCA=viral capsid antigen) de alta sensibilidad y especificidad para el diagnóstico de infección aguda por EBV.
Finalmente digamos que es obligatorio tratar de ensamblar una historia coherente, pero que ello no siempre es posible. Creo que en este caso no se puede, y que un paciente “tiene derecho” a padecer dos enfermedades como las que tuvo, sin relación una con otra, aunque estas, estén separadas por un estrecho período de tiempo. De hecho, la probabilidad existe, y el azar interviene permanentemente en estas cuestiones.
Para terminar debemos recordar una frase del gran Maestro Sir William Osler “La Medicina es una Ciencia de Probabilidades y un Arte de manejar la Incertidumbre"
Bibliografía
1) Gray JJ, Caldwell J, Sillis M. The rapid serological diagnosis of infectious mononucleosis. J Infect 1992;25:39-46.[Medline]
2) Krantz SB. Acquired pure red cell aplasia. In: Hoffman R, Benz EJ Jr, Shattil SJ, Furie B, Cohen HJ, eds. Hematology: basic principles and practice. Philadelphia: Churchill Livingstone, 1991:172-85.
3) Gray IR. Rational approaches to the treatment of culture-negative infective endocarditis. Drugs 1991;41:729-736.[Medline]
4) Skehan JD, Murray M, Mills PG. Infective endocarditis: incidence and mortality in the North East Thames Region. Br Heart J 1988;59:62-68.[Abstract]
5) Calio AJ, Cusumano S, Ullman RF, Tjioe DY, Cunha BA. Haemophilus parainfluenzae endocarditis. Heart Lung 1987;16:222-223.[Medline]
6) Jemsek JG, Greenberg SB, Gentry LO, Welton DE, Mattox KL. Haemophilus parainfluenzae endocarditis: two cases and review of the literature in the past decade. Am J Med 1979;66:51-57.[Medline]
7) Ellner JJ, Rosenthal MS, Lerner PI, McHenry MC. Infective endocarditis caused by slow-growing, fastidious, Gram-negative bacteria. Medicine (Baltimore) 1979;58:145-158.[Medline]
8) Chunn CJ, Jones SR, McCutchan JA, Young EJ, Gilbert DN. Haemophilus parainfluenzae infective endocarditis. Medicine (Baltimore) 1977;56:99-113.[Medline]
9) Lynn DJ, Kane JG, Parker RH. Haemophilus parainfluenzae and influenzae endocarditis: a review of forty cases. Medicine (Baltimore) 1977;56:115-128.[Medline]
10) Simon MW, Mitchell BL, O'Connor WN, Noonan JA, Davis CA, Wyatt RJ. Glomerulonephritis, pulmonary hemorrhage and coagulopathy associated with Haemophilus parainfluenzae endocarditis. Pediatr Infect Dis 1985;4:183-188.[Medline]
11) Causal reasoning. In: Kassirer JP, Kopelman RI. Learning clinical reasoning. Baltimore: Williams & Wilkins, 1991:28-31.
Un paciente Israelí de 44 años, trabajador agropecuario, que vivía en el Valle del Jordán fue admitido al hospital por un cuadro de 2 semanas de fiebre, ictericia, y malestar general. Su historia familiar no mostraba antecedentes de importancia. No tenía antecedentes de enfermedades hepáticas. No tomaba leche no-pasteurizada, ni consumía alcohol. No fumaba ni usaba drogas, era heterosexual y no tomaba medicamentos.
Aunque fiebre y malestar son síntomas inespecíficos que pueden ser atribuidos a casi cualquier proceso inflamatorio, el paciente claramente tiene compromiso del sistema hepatobiliar. Yo descartaría primero hepatitis aguda, aunque una causa obstructiva debe ser tenida en cuenta, aún en ausencia de dolor abdominal. Dado que el paciente vive cerca del Desierto de Judea, yo estaría preocupado por muchas enfermedades exóticas, incluyendo leishmaniasis, brucelosis, malaria, toxoplasmosis, tuberculosis, y rickettsiosis.
La temperatura del paciente era de 37,8ºC. Había unas pequeñas adenomegalias cervicales blandas. No había soplos. El bazo y el hígado se palpaban 4 cm debajo del reborde costal. No había otras alteraciones en el examen físico.
Los hallazgos en este punto pueden ser indicativos de hepatitis viral aguda. Yo solicitaría estudios de rutina, incluyendo recuentos de sangre, un frotis de sangre periférica, y tests de función hepática. Yo además ordenaría cultivos de sangre y tests serológicos específicos para descartar algunos agentes infecciosos determinados, incluyendo hepatitis A, hepatitis B, hepatitis C, virus de Epstein-Barr (EBV), y citomegalovirus (CMV).
Los resultados de laboratorio incluian una eritrosedimentación normal; hemoglobina 13,2 g/dl; volumen corpuscular medio de 84,7 u3; recuento de glóbulos blancos 8100/mm3 con 90% de neutrófilos y 10% de linfocitos atípicos; y plaquetas 271.000/mm3. Los resultados de los tests de función hepática son los siguientes: TGO 111 U/litro (normal 6 a 53); TGP 134 U/litro (normal 7 a 40); FAL 417 U/litro (normal 40 a 130); bilirrubina total 3,6 mg/dl (normal 0,1 a 1); albúmina sérica 3,8 g/dl; y un tiempo de protrombina normal. El paciente tenía altos títulos de anticuerpos IgM anti EBV, pero los tests para otros anticuerpos antivirales fueron negativos.
Los hemocultivos eran estériles.
Los hallazgos clínicos y de laboratorio son compatibles con hepatitis viral aguda causada por EBV. Lo único que llama la atención es la edad del paciente, dado que la mayoría de los sujetos con este cuadro son más jóvenes.
Se hizo diagnóstico de mononucleosis infecciosa con hepatitis. La ictericia del paciente y el malestar mejoraron con medidas generales, y fue dado de alta del hospital.
Ocho semanas más tarde, sin embargo, reapareció la fiebre, acompañada de escalofrios. Su temperatura era de 40 ºC, y fue rehospitalizado.
El segundo episodio de fiebre, acompañado ahora por escalofrios, me hace sospechar que el diagnóstico inicial amerita reevaluación. Yo repeteiría el examen físico, haría investigaciones de laboratorio más extensas, y buscaría causas infecciosas alternativas.
El paciente impresionaba en muy mal estado general. Había perdido 7 kg de peso en las últimas 8 semanas. Su temperatura era de 39,8ºC; su presión arterial era de 100/60 mmHg; su frecuencia cardíaca de 98 por minuto, y su frecuencia respiratoria de 18 por minuto. El examen cardíaco era normal excepto por un soplo sistólico grado 1/6 a 2/6 en el apex. Excepto por hepatoesplenomegalia, el resto del examen físico era normal.
En este punto, mi plan diagnóstico se orienta a sepsis; yo obtendría numerosos hemocultivos. Buscaría otro probable foco de infección, tal como el aparato urinario, pulmones, huesos, y piel. El hallazgo más relevante en este contexto es la aparición de un soplo cardíaco nuevo. Una evaluación completa para descartar endocarditis debe ser realizada, incluyendo un ecocardiograma en forma inmediata. La pregunta es, si iniciar tratamiento inmediatamente una vez tomadas las muestras para los diferentes cultivos, o tratar sintomáticamente al paciente asumiendo que el soplo es de origen funcional, como resultado de los cambios hemodinámicos causados por la fiebre alta. Un cuidadoso seguimiento es esencial.
La eritrosedimentación era de 120 mm en la primera hora. Los resultados de los tests de laboratorio fueron los siguientes: hemoglobina 8 g/dl; volumen corpuscular medio, 85 u3; recuento de glóbulos blancos 8200/mm3, con 90% de neutrófilos y algunos linfocitos atípicos en sangre periférica; un recuento de plaquetas normal; aspartato aminotransferasa 458U/L; alaninoaminotransferasa 690 U/L; FAL 717 U/L; bilirrubina total 4,4 mg/dl; bilirrubina directa 3,8 mg/dl. El tiempo de protrombina fue nuevamente normal. Los cultivos de sangre y orina fueron estériles, y los tests serológicos para fiebre tifoidea, brucelosis, toxoplasmosis, fiebre Q, y otras rickettsias, y psitacosis fueron negativos; no se observaron parásitos.
La eritrosedimentación elevada es inespecífica, aunque un marcado aumento dentro de 8 semanas es completamente remarcable. La endocarditis es una de las pocas enfermedades en que hay a menudo correlación directa entre el curso y la severidad de la enfermedad, con la velocidad de la sedimentación globular. La anemia normocítica es probablemente corresponde a la anemia de los trastornos crónicos, pero una biopsia de médula ósea puede estar indicada tanto para el examen morfológico, como para cultivos para tuberculosis brucelosis y leishmaniasis. En este punto, una Rx de tórax y abdomen están también indicadas.
Una biopsia de médula ósea reveló una aplasia pura de glóbulos rojos con precursores de las otras series normales.
Una aplasia pura de glóbulos rojos puede ser causada por una variedad de trastornos, los más relevantes de los cuales son una variedad de agentes infecciosos, incluyendo parvovirus, HIV, parotiditis, CMV, EBV, y virus de hepatitis. La leucemia de células T es otra posibilidad.
La Rx de tórax mostró derrame pleural bilateral pequeño. La ecografía abdominal confirmó la presencia de leve a moderada hepatoesplenomegalia, y la TAC reveló múltiples infartos esplénicos, un posible infarto renal derecho y cardiomegalia.
Cuál es el diagnóstico?
La combinación de fiebre alta, anemia, nuevo soplo cardíaco, e infartos esplénicos es casi patognomónico de endocarditis. Un ecocardiograma está urgentemente indicado.
Tres días después, de que el soplo fuera escuchado, el paciente desarrolló súbitamente edema agudo de pulmón. Una disminución de la intensidad del primer ruido cardíaco con un soplo holosistólico grado 3 sobre el área mitral, irradiándose a la axila fue escuchado, y fueron observadas hemorragias en astilla en los lechos ungueales de las manos. Un ecocardiograma bidimensional reveló una vegetación en la válvula mitral.
El paciente tiene endocarditis con cultivos negativos. La descompensación hemodinámica es indicación de urgente tratamiento que incluya antibióticos de amplio espectro.
El paciente fue transferido a una unidad de cuidados intensivos, y se comenzó tratamiento con nitratos, enalapril, furosemida, digoxina, vancomicina, tetraciclina, gentamicina, y metronidazol. Un ecocardiograma transesofágico reveló una buena función ventricular, moderada a severa regurgitación mitral, y una única vegetación de la valva posterior mitral.
Aunque el paciente fue adecuadamente tratado con antibióticos cubriendo el espectro de endocarditis a cultivos negativos, el tiene un severo fallo cardíaco congestivo, y su válvula mitral debe ser reemplazada.
El reemplazo de la válvula mitral fue llevado a cabo 5 días después de que desarrollara fallo cardíaco. Una vegetación de 1,5 cm fue encontrada en la valva posterior de la válvula mitral con perforación e invasión del anillo. Había también una vegetación en la valva anterior de la mitral. Después de la cirugía, el paciente mejoró gradualmente. Él permaneció hemodinámicamente estable, sin signos clínicos de fallo cardíaco. Una semana después de la cirugía, cuatro cultivos de sangre obtenidos justo antes de la operación fueron informados como positivos para Haemophilus parainfluenzae. Todos los demás cultivos siguieron siendo negativos.
H parainfluenzae es un agente inusual de endocarditis infecciosa. Yo ajustaría el régimen antibiótico de acuerdo a la sensibilidad in vitro del agente y probablemente incluya tanto ampicilina como un aminoglucósido.
La terapia antibiótica fue cambiada a ampicilina solamente, 12 gramos por día durante 6 semanas. El paciente gradualmente se recuperó, y su nivel de hemoglobina y los tests de función hepática volvieron a lo normal.
Comentario.
Muchas preguntas intrigantes surgen de la enfermedad de este paciente.
1) Tuvo hepatitis por virus de Epstein-Barr, y si así fuera, porqué a esta edad?
2) Cuál es la causa de la aplasia pura de glóbulos rojos?
3) Porqué desarrolló endocarditis, y porqué el organismo es una especie tan inusual?
4) Debió llegarse antes al diagnóstico?
5) Cuán urgente era el reemplazo valvular?
Más que enfrentarnos con estas preguntas, nosotros elegimos tratar de desarrollar una explicación coherente para los principales elementos de este caso.
Al inicio de los síntomas, el paciente tuvo un cuadro compatible con injuria hepática aguda, una eritrosedimentación normal, y ninguna manifestación de endocarditis. Hubo un largo período cuando él dejo de tener fiebre entre su enfermedad inicial y la segunda fase de su enfermedad. Esas observaciones argumentan a favor de la hipótesis que la endocarditis bacteriana desarrolló varias semanas después del inicio de su primera enfermedad, que nosotros creimos que se trataba de hepatitis por virus de Epstein-Barr. Si bien existen resultados falsos positivos por anticuerpos para virus de Epstein- Barr en endocarditis infecciosa, (1) nosotros creemos que este fue un resultado verdadero positivo.
La causa de la aplasia pura de glóbulos rojos nunca fue identificada. Una aplasia pura de glóbulos rojos aguda reversible es una complicación bien conocida de una variedad de infecciones incluyendo algunos virus mencionados por el médico que discutió el caso, así como infecciones con algunas bacterias, tales como meningococos y estafilococos (2). La endocarditis no es una causa conocida de anemia pura de glóbulos rojos, y nosotros nos orientamos más a atribuir la anormalidad hematológica a la infección por EBV en este paciente.
El hallazgo de endocarditis infecciosa en este paciente fue sorprendente, dado que el paciente nunca tuvo enfermedad valvular preexistente, ni ninguna otra causa de inmunocompromiso. (3) Muy a menudo, la historia de los pacientes con endocarditis provee pistas de gran valor diagnóstico, (4) pero en este caso, el paciente no tenía antecedentes de enfermedad cardíaca, y el soplo que apareció durante la segunda internación, fue primero interpretado como en relación a su estado hiperdinámico por la fiebre.
Otro hallazgo inusual fue el organismo cultivado de la sangre. H. parainfluenzae es una causa infrecuente de endocarditis. Especies de Haemophilus pueden causar endocarditis con cultivos negativos debido a que estos organismos son dificultosos para cultivar. H. parainfluenzae es un organismo fastidioso que crece lentamente, o decididamente no crece en los medios de cultivos de rutina. Sin embargo, la endocarditis causada por H. parainfluenzae puede distinguirse clínicamente de otros tipos de endocarditis dado que frecuentemente produce embolización de grandes arterias, mientras que los signos periféricos característicos de la endocarditis incluyendo manchas de Roth o lesiones de Janeway no son vistos con este germen. La presencia de valvulopatía de base está presente en sólo la mitad de los pacientes, y en algunos casos, el soplo, puede ser la única manifestación de endocarditis en el examen físico (5,6,7,8,9,10). El lento crecimiento de H. parainfluenzae, y la pobreza de signos clínicos fueron vistos en el paciente bajo discusión.
Podemos proponer una cadena patofisiológica causal que pueda dar cuenta de los síntomas de este paciente? Aunque es posible que desde el principio, el paciente tuviera endocarditis asentando en una válvula normal, nosotros nos inclinamos a pensar que la endocarditis fue un evento secundario y una segunda enfermedad. Nosotros creemos que el paciente tuvo hepatitis por EBV, asociado a aplasia pura de glóbulos rojos. Y sospechamos que algún grado de inmunocompromiso en relación a infección viral, y acompañando al daño hepático fue el factor que H. parainfluenzae infectara a un paciente por otro lado normal y sin valvulopatía previa.
No hace falta decir que el hecho de que una manifestación clínica siga a otra, no es suficiente justificación para asumir una asociación causal entre las dos. La cadena patofisiológica está basada en conceptos de sentido común y causalidad, que incluye los siguientes requerimientos: un efecto debe ser generado por una causa atendible o lógica; la causa y el efecto deben estar relacionadas en tiempo y espacio; y la causa y el efecto deben ser coherentes en términos de intensidad y magnitud. (11) En el caso de este paciente, la cadena patofisiológica que proponemos, reúne esos criterios.
Los clínicos deben siempre tratar de ensamblar un cuadro coherente de la enfermedad del paciente. Para hacerlo, deben tratar de explicar los hallazgos positivos y negativos, y establecer si los factores predisponentes y las complicaciones, son coherentes con la hipótesis diagnóstica. Si en el camino se encuentran muchas inconsistencias, la hipótesis diagnóstica debe ser cuestionada, y se debe comenzar a buscar otras alternativas diagnósticas.
Finalmente, aunque nosotros describimos una razonable cadena patofisiológica, que pueden dar cuenta de los hallazgos de este caso, no tenemos garantía de validez. De hecho, seguimos abiertos a otras explicaciones alternativas.
Fuente
From the Department of Medicine (R.O.) and the Hematology Unit (Y.M.), Hadassah University Hospital, Mount Scopus, Jerusalem, Israel.
Address reprint requests to Dr. Oren at the Department of Medicine, Hadassah University Hospital, Mount Scopus, Jerusalem 91240, Israel.
Traducción de:
Assembling a Coherent Story
Ran Oren, and Yaacov Matzner
Clinical Problem-Solving.
Volume 330:1618 June 2, 1994 Number 22
The New England Journal of Medicine.
Comentarios Finales.
Este caso clínico fue presentado en la sesión Clinical Problem-Solving de “The New England Journal of Medicine” en enero de 1994. Sin embargo, el caso de este paciente Israelí debe haberse desarrollado probablemente al comienzo de la década de 1980. Prueba de ello son las fechas de la bibliografía aportada, y algunos elementos que surgen de la historia clínica. Uno de ellos es que en presencia de un síndrome mononucleósico, evidenciado en este paciente por un síndrome febril con poliadenopatías, hepatoesplenomegalia, hepatitis, y 10% de linfocitos atípicos en sangre periférica no se haya planteado dentro de la lista de diagnósticos diferenciales, a la infección aguda por HIV. De hecho no figuran en la historia, la solicitud de una prueba de laboratorio destinada a descartar la infección por este retrovirus.
Otro elemento que nos hace sospechar de la antigüedad de este caso, es considerar como excepcional a la endocarditis por especies de Haemophilus. Sabemos que este germen hoy en día es un agente causal frecuente y pertenece al llamado grupo HACEK (el acrónimo HACEK se refiere a un grupo de bacilos gram negativos: Haemophilus species (Haemophilus parainfluenzae, Haemophilus aphrophilus, Haemophilus paraphrophilus), Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, y a especies de Kingella). Esta familia de gérmenes son una causa frecuente de endocarditis que debemos sospechar, sobre todo en endocarditis con “cultivos negativos”, y es una entidad en la que más que nunca debe haber una estrecha comunicación entre los médicos tratantes y personal de laboratorio de bacteriología, alertando al mismo sobre la sospecha clínica, y de esta manera llevar a cabo técnicas especiales y sobre todo someter a estas muestras a medios de cultivo adecuados. Un alto nivel de sospecha se requiere para el diagnóstico de esta entidad que da cuenta del 5 a 10% de todos los casos de endocarditis de válvulas nativas en individuos no drogadictos endovenosos. Se requiere no menos de 6 días de incubación para su desarrollo en medios de cultivos tradicionales no automatizados, aunque la introducción de los sistemas de cultivo automatizados permite aislarlos antes de 5 días.
Pero el aspecto más significativo de la historia está dado por la duda instalada de si este paciente tuvo endocarditis de entrada, o si tuvo primero mononucleosis y 8 semanas después desarrolló endocarditis bacteriana, relacionada o no con la primera enfermedad. Más allá de el valorable intento de ensamblar una “historia coherente” por los autores del artículo a través de un supuesto inmunocompromiso ocasionado por el virus de Epstein-Barr que habría predispuesto al paciente a endocarditis, no parece haber dudas de que el paciente tuvo mononucleosis infecciosa primero, y por supuesto endocarditis después. El lógico intento de buscar relación entre los dos procesos, no está avalado por la evidencia, y no hay descriptas enfermedades bacterianas secundarias al inmunocompromiso por EBV.
Si bien es cierto que hay algunas molestas “inconsistencias” para el diagnóstico de mononucleosis en la primera enfermedad, como hepatoesplenomegalia (la hepatomegalia es rara en la mononucleosis) y 90% de neutrófilos en el frotis de sangre periférica, la presencia de 10% de linfocitos atípicos, en el contexto de una hepatitis con títulos altos de IgM anti EBV le ponen el sello al diagnóstico, más aún habiéndose descartado la presencia de otros agentes como los de la hepatitis A, hepatitis B, hepatitis C, y citomegalovirus (CMV). No aclara, sin embargo, que metodología diagnóstica fue utilizada, aunque suponemos que fue solicitado un VCA IgM que es el anticuerpo dirigido contra la cápside viral ( VCA=viral capsid antigen) de alta sensibilidad y especificidad para el diagnóstico de infección aguda por EBV.
Finalmente digamos que es obligatorio tratar de ensamblar una historia coherente, pero que ello no siempre es posible. Creo que en este caso no se puede, y que un paciente “tiene derecho” a padecer dos enfermedades como las que tuvo, sin relación una con otra, aunque estas, estén separadas por un estrecho período de tiempo. De hecho, la probabilidad existe, y el azar interviene permanentemente en estas cuestiones.
Para terminar debemos recordar una frase del gran Maestro Sir William Osler “La Medicina es una Ciencia de Probabilidades y un Arte de manejar la Incertidumbre"
Bibliografía
1) Gray JJ, Caldwell J, Sillis M. The rapid serological diagnosis of infectious mononucleosis. J Infect 1992;25:39-46.[Medline]
2) Krantz SB. Acquired pure red cell aplasia. In: Hoffman R, Benz EJ Jr, Shattil SJ, Furie B, Cohen HJ, eds. Hematology: basic principles and practice. Philadelphia: Churchill Livingstone, 1991:172-85.
3) Gray IR. Rational approaches to the treatment of culture-negative infective endocarditis. Drugs 1991;41:729-736.[Medline]
4) Skehan JD, Murray M, Mills PG. Infective endocarditis: incidence and mortality in the North East Thames Region. Br Heart J 1988;59:62-68.[Abstract]
5) Calio AJ, Cusumano S, Ullman RF, Tjioe DY, Cunha BA. Haemophilus parainfluenzae endocarditis. Heart Lung 1987;16:222-223.[Medline]
6) Jemsek JG, Greenberg SB, Gentry LO, Welton DE, Mattox KL. Haemophilus parainfluenzae endocarditis: two cases and review of the literature in the past decade. Am J Med 1979;66:51-57.[Medline]
7) Ellner JJ, Rosenthal MS, Lerner PI, McHenry MC. Infective endocarditis caused by slow-growing, fastidious, Gram-negative bacteria. Medicine (Baltimore) 1979;58:145-158.[Medline]
8) Chunn CJ, Jones SR, McCutchan JA, Young EJ, Gilbert DN. Haemophilus parainfluenzae infective endocarditis. Medicine (Baltimore) 1977;56:99-113.[Medline]
9) Lynn DJ, Kane JG, Parker RH. Haemophilus parainfluenzae and influenzae endocarditis: a review of forty cases. Medicine (Baltimore) 1977;56:115-128.[Medline]
10) Simon MW, Mitchell BL, O'Connor WN, Noonan JA, Davis CA, Wyatt RJ. Glomerulonephritis, pulmonary hemorrhage and coagulopathy associated with Haemophilus parainfluenzae endocarditis. Pediatr Infect Dis 1985;4:183-188.[Medline]
11) Causal reasoning. In: Kassirer JP, Kopelman RI. Learning clinical reasoning. Baltimore: Williams & Wilkins, 1991:28-31.
domingo, 17 de enero de 2010
Varón de 17 años con Tumor Pituitario y Alteraciones Craneales.
Un muchacho de 17 años fue visto en este hospital por un tumor pituitario, y alteraciones radiológicas en los huesos del cráneo. El paciente había estado bien hasta los 12 años de edad, cuando comenzó a presentar cefaleas. El tipo de dolor que refería iba desde un dolor sordo o sensación de pesadez cefálica hasta un dolor punzante de una intensidad de hasta 8 en una escala de 1 a 10 donde 10 es la máxima intensidad de dolor posible. El dolor estaba localizado en la región frontal izquierda (medial y retroorbitario izquierdo), y ocurría 1 o 2 veces por mes, sin eventos precipitantes. Ocasionalmente ocurrían náuseas sin vómitos por la mañana. Su visión periférica y su agudeza visual disminuyeron, y su rendimiento escolar decayó. Aproximadamente 2 años antes de la actual evaluación, su crecimiento se detuvo; sus padres notaron cambios del humor y crisis de ira, por lo que consultaron a un psiquiatra. Se le administró buspirona. Durante los siguientes 18 meses, la frecuencia de las cefaleas aumentó a 1 o 2 crisis de cefalea por semana, y comenzó a presentar fatiga, ocasional somnolencia, intolerancia al frio, oscurecimiento de la piel a nivel de los codos y cuello, y episodios de epistaxis. No había constipación, piel seca, o pérdida de pelo. Durante los 3 años anteriores a esta evaluación, el paciente ganó 13,6 kg de peso, y aparecieron estrías en su abdomen.
Aproximadamente 3 meses antes de la actual evaluación, las cefaleas se hicieron más punzantes, aumentaron su severidad, llegando a referirlas el paciente como de intensidad 10. Una TAC de senos paranasales llevada a cabo sin la administración de sustancia de contraste reveló senos normales, pero un aspecto de “apolillado” de la base de cráneo y del clivus (parte de la base de cráneo que conecta el dorso de la silla turca y foramen mágnum), con destrucción de la cortical ósea. Una RMN de cerebro con administración de gadolinio que reveló una lesión de apariencia quística de 2 cm de diámetro, en la región selar y expansión supraselar con compresión del quiasma óptico, y una masa sólida con intensidad de señal mixta y realce heterogéneo, que afectaba todo el clivus, se extendía a los huesos petrosos, improntaba en la protuberancia, y se extendía al ángulo médulo-cerebeloso.
Diez semanas antes de la actual evaluación, el paciente vió a un neurocirujano. En el examen había una leve parálisis del VI par; hemianopsia bitemporal; un signo de Hoffman positivo (la súbita flexión del tercer dedo de la mano por compresión de su lecho ungueal, induce extensión de la articulación interfalángica distal de ese dedo y flexión del pulgar e indica lesión del haz piramidal en alguna parte de su trayecto) del lado derecho; estrías en los hombros, axilas, y cintura; y áreas de hiperpigmentación del hombro derecho. No había pelos en la cara ni en el pecho y el paciente tenía un estadio 4 de la escala de Tanner para pubertad. Los resultados de los tests de laboratorio se muestran en la Tabla 1.

Tabla 1
Resultados de los Tests de Laboratorio.
Click sobre la imagen para ampliarla.
El examen oftalmológico mostró hemianopsia bitemporal no congruente, con hemianopsia temporal completa del lado derecho y menos severo déficit visual temporal izquierdo. La agudeza visual fue de 20/50 en ambos ojos, corrigiendo a 20/30 en el derecho y a 20/25 en el izquierdo. En la evaluación endocrinológica, el paciente reportó que el vello púbico, y el acné aparecieron a los 13 años. El peso era de 82,4 kg, la altura de 168 cm, el BMI DE 29,2; los signos vitales eran normales. Había leve acné facial y acantosis nigricans en el cuello y la axila. Un soplo sistólico eyectivo 2/6 se auscultaba en el borde esternal izquierdo, y el borde hepático se palpaba a 5 o 6 cm por debajo del reborde costal; el resto del examen físico era normal. La evaluación neuropsicológica reveló buena performance en casi todos los items explorados, alguna dificultad en la memoria a corto plazo, y mayor desarrrollo de la comunicación no verbal que verbal. Los resultados de los tests se muestran en la Tabla 1. Se comenzó el tratamiento con levotiroxina.
El paciente fue admitido en otro hospital. Los tests de laboratorio se muestran en la Tabla 1. El componente selar de la masa fue resecada a través de la vía transesfenoidal, con biopsia del clivus. El examen histopatológico reveló un adenoma secretor de prolactina. Dos días después de la operación, una RMN de cerebro y médula con gadolinio, reveló descompresión y resección del componente quístico hemorrágico en la región selar. El paciente fue dado de alta el 4º día de internación; la medicación de alta incluia cabergolina, dexametasona, levotiroxina, buspirona y ranitidina.
Dos semanas después de la operación, el paciente reportó mejoramiento de su visión, y cefaleas leves, infrecuentes y de un carácter sordo. La agudeza visual era de 20/25 en ambos ojos, y los campos visuales eran normales. Los resultados de los tests de laboratorio llevados a cabo 3 semanas de posoperatorio se muestran en la Tabla 1. Una tomografía por emisión de positrones (PET) de cuerpo entero y cráneo, con fluorodeoxiglucosa (18F-FDG) reveló una avidez variable pero en general baja de la 18F-FDG por la masa residual y sin evidencias de enfermedad en otra localización. Una punción lumbar fue negativa.
Cuatro semanas después de la cirugía, el paciente fue visto en la clínica de endocrinología pediátrica de este hospital, para evaluar la posibilidad de radioterapia con haces de protones (proton-beam irradiation) de la lesión ósea.
Su energía había mejorado, y las cefaleas habían disminuído en frecuencia y severidad.
El paciente había sido adoptado a la edad de 5 meses. El desarrollo temprano fue normal. El vivía con sus padres adoptivos. En la escuela secundaria había sido buen alumno y activo en deportes. No se conocían antecedentes de salud de su familia biológica.
Los signos vitales eran normales, y los hallazgos del examen físico no habían cambiado y consistían en un desarrolo puberal estadio 4 de Tanner. Los resultados de los tests de laboratorio se muestran en la Tabla 1. La dosis de cabergolina fue aumentada a 0,5 mg 2 veces por semana. La repetición de la RMN de cerebro con la administración de gadolinio reveló una gran masa con realce centrada en el clivus, con extensión a los huesos petrosos, borramiento de la cisterna prepontina con indentación en la protuberancia, y estrechamiento del ángulo pontocerebeloso.
Fue llevado a cabo un procedimiento diagnóstico.
Diagnóstico Diferencial.
Dr. Edward R. Smith: Este paciente de 17 años consultó por cefalea, pérdida progresiva de visión, cambios del humor, empeoramiento de su rendimiento académico, fatiga, intolerancia al frio, y aumento de peso.
El examen físico demostró una hemianopsia bitemporal; disminución de la agudeza visual; un signo de Hoffmann positivo del lado derecho; fuerza, sensibilidad, y otros reflejos normales; estrías en tronco; ausencia de vello facial y en tronco; y obesidad leve. Aunque yo vi a este paciente por primera vez después de que los estudios radiológicos se habían llevado a cabo, es pertinente revisar los hallazgos en la historia clínica y el examen físico que pueden indicar la presencia de una masa intracraneal.
Hallazgos Sugestivos de Proceso Intracraneal.
El problema del paciente puede ser agrupado en las siguientes tres categorías: cefalea, alteraciones visuales, y síntomas de disfunción endócrina.
Las cefaleas son comunes en este grupo etáreo, con casi un tercio de los adolescentes que refieren cefaleas semanales. (1) Uno de los temas más dificultosos con los que se enfrenta el médico pediatra en la evaluación de un niño con cefalea es identificar a ese aproximadamente 4% de tales niños que realmente tienen lesiones intracraneales. Llevar a cabo estudios de imágenes en todos los pacientes no es práctico por los costos, por la saturación de la disponibilidad de los servicios de imágenes, por los riesgos de la sedación en niños pequeños, y por el riesgo de la radiación (cuando se usa TAC). (2)
Los predictores de una masa incluyen: cefalea asociada al sueño, vómitos, confusión, signos de foco neurológico, la ausencia de fenómenos visuales típicos de la migraña, y la presencia de cefaleas de menos de 6 meses de evolución.
La presencia de déficits visuales, la ausencia de elementos de migraña, y la naturaleza progresiva de sus síntomas, sugieren en este paciente la necesidad de neuroimágenes.
Localización de la Lesión.
En este paciente, la hemianopsia bitemporal, es fuertemente sugestivo de compromiso del quiasma óptico, donde la compresión de las fibras cruzadas de los campos retinianos nasales puede causar este déficit. La disminución de la agudeza visual es indicativo de compresión de larga data del aparato óptico, o injuria secundaria a aumento de presión intracraneal. La fatiga, retraso de la aparición de caracteres sexuales secundarios, y la intolerancia al frio sugieren disfunción endócrina. Esos hallazgos dirigen al clínico directamente a la silla turca, con probable diagnóstico de masa de lento crecimiento pituitaria con compresión del quiasma óptico.
Las lesiones selares pueden causar cefalea por deformación anatómica de estructuras con receptores de dolor (duramadre) y aumento de presión intracraneana, así como efectos en el sistema trigémino-vascular a través de la alteración del metabolismo de la dopamina por tumores hormonalmente activos. (3)
Aunque la cefalea sola es un pobre elemento localizador, en este caso es más preocupante en este paciente que presenta signo de Hoffmann, usualmente indicativo de compresión del tracto corticospinal, o lesión de neurona motora superior. La naturaleza progresiva crónica de estos síntomas y la historia de cefalea que empeora a la mañana me llevan a sospechar una gran masa de lento crecimiento con aumento de la presión intracraneal o compresión del tronco cerebral o de la unión cérvico-medular.
Puedo ver los estudios radiológicos?
Dr. Stuart R. Pomerantz: La TAC de senos paranasales muestra un proceso destructivo extenso de la porción base-esfenoidal y base-occipital de la base de cráneo, con expansión difusa y destrucción del hueso cortical pero sin un patrón franco de matriz osteoide o condroide. (Figura 1 A).
Figura 1. TAC y RMN de Base de Cráneo.
Una TAC de senos paranasales muestra un proceso destructivo extenso de base-esfenoidal (Panel A flecha). Hay un aspecto “apolillado” de las estructuras óseas, incluyendo destrucción del hueso cortical, pero sin un franco patrón de matriz osteoide o condroide, son evidentes. La RMN de base de cráneo revela dos componentes distintos de lesiones. Una Imagen en T1 (Panel B) muestra que en la región selar y supraselar hay una masa expansiva de apariencia quística, hiperintensa, de aproximadamente 2 cm de diámetro (flecha), con niveles líquidos brillantes y oscuros en secuencias T2 (Panel C, flecha), hallazgos sugestivos de material hemorrágico o proteináceo. Cambios multiquísticos menores son vistos en al componente óseo adyacente (cabeza de flecha) Un corte coronal en T1 revela extensión supraselar comprimiendo el quiasma óptico, más a la izquierda (Panel D, flecha), e invasión de los senos cavernosos, más a la derecha (cabeza de flecha). Un corte sagital en T1 obtenida después de la administración de contraste (Panel E) revela una gran masa ósea de apariencia sólida, con intensidad de señal mixta y realce heterogéneo con gadolinio desde el piso de la silla turca hasta el foramen magno, con efecto de masa en la región ventral de la protuberancia (flecha) Una imagen axial en T1 obtenida después de la administración de contraste revela extensión al hueso petroso derecho (Panel F, flecha) y borramiento parcial de la cisterna del ángulo cerebelomedular (cabeza de flecha)
La RMN de base de cráneo reveló dos componentes distintos. En la región selar y supraselar, hay una lesión expansiva de aspecto quístico de 2 cm de diámetro (Figura 1B, 1C y 1D), que muestra hiperintensidad en secuencias T1 y T2 con nivel líquido sugestivo de material hemorrágico o proteináceo. Hay extensión supraselar que comprime el quiasma óptico, peor a la izquierda, e invasión de los senos cavernosos, peor a la derecha. La más grande, la porción ósea de la masa (Figura 1E y 1F) parece sólida, con intensidad de señal mixta y realce heterogéneo con gadolinio, y extensión desde el piso selar hasta el foramen magno, y dentro de los huesos petrosos bilateralmente, más extensamente a la derecha donde hay algún compromiso mastoideo. La lesión impronta la región anterior de la protuberancia, y ocupa parcialmente las cisterna del ángulo cerebelo-medular. La arteria basilar está desplazada lateralmente sin compresión ni estenosis.
Lesiones Selares.
Dr. Smith: El diagnóstico diferencial de las lesiones en esta región de la silla turca es amplio (Tabla 2). En este paciente, el hallazgo clave fue la elevación del nivel de prolactina. El nivel elevado de prolactina puede ser de varias causas, incluyendo agentes farmacológicos (particularmente drogas neurolépticas), compresión del infundíbulo o de la glándula pituitaria (el “efecto tallo”, donde por compresión de la glándula pituitaria o el tallo pituitario interfiere con la liberación de dopamina del hipotálamo a la pituitaria), o procesos normales (como el embarazo, lactancia, o estímulo del pezón). Sin embargo, la mayoría de esas causas no elevan los niveles de prolactina por encima de 100 a 200 ng/ml, y niveles de 500 ng/ml, como se vieron en este paciente, usualmente son indicativos de prolactinoma.
El tamaño tumoral y los niveles de prolactina sérica tienen correlación directa. (5) Niveles extraordinariamente altos de prolactina, pueden ocasionalmente aunque raramente dar resultados bajos en los dosajes (“efecto hook”). Si se sospechan niveles altos, y los resultados son bajos debe testearse a diluciones seriadas para evitar ese efecto. El hallazgo de niveles de 500 ng/ml de prolactina, en ausencia de agentes confundidores sugiere fuertemente el diagnóstico de prolactinoma en este caso. (6,7)

Tabla 2 Diagnóstico Diferencial de Lesiones Selares en Niños.
Lesiones de Base de Cráneo.
Un elemento que complica la interpretación de este caso es el extenso compromiso de la base de cráneo por un complejo proceso. La compresión del tronco cerebral en las imágenes provee una explicación para los hallazgos en el examen físico, de compromiso de neurona motora superior. El diagnóstico diferencial de las lesiones de base de cráneo en este grupo etáreo son mostradas en la Tabla 3.
El principio de la navaja de Occam sugiere que un adenoma pituitario invasivo o un carcinoma pituitario serían más probables. Otros posibilidades incluyen un craniofaringioma (10 a 20 veces más común que los adenomas pituitarios en este grupo etáreo), sarcomas (77% de los tumores pediátricos de base de cráneo), y cordoma. (4,8) Menos probable serían las lesiones óseas, tales como el osteoblastoma o la displasia fibrosa.

Tabla 3. Diagnóstico Diferencial de las Lesiones de Base de Cráneo.
Diagnóstico y Approach Terapéutico.
Mi primer diagnóstico es prolactinoma, sea invasivo, o asociado con un segundo proceso patológico distinto. El tratamiento de primera línea de los prolactinomas es usualmente farmacológico, pero en este caso, la necesidad de obtener tejido para diagnóstico, y los defectos en los campos visuales sería recomendable una intervención quirúrgica.
La indicación quirúrgica típicamente incluye: apoplejía pituitaria, rinorrea cerebroespinal (fístula de LCR), eventos adversos en relación a terapia con agonistas dopaminérgicos, y déficits de campos visuales en pacientes con macroadenomas (particularmente tumores quísticos), que rápidamente progresan, o no responden a la terapia médica.
Yo usaría la vía transesfenoidal para descomprimir el sistema óptico y obtener tejido de la lesión, tanto de la región selar, como de la base de cráneo. Este approach no está asociado con una tasa alta de efectos adversos, pero los riesgos incluyen fístula de líquido cefalorraquídeo (3% de los casos), infección, hipopituitarismo (18 a 87% de los casos), e injuria a las arterias carótidas internas o a los nervios craneales. (9) De importancia crítica es la administración de “dosis de stress” de corticosteroides en pacientes con situaciones de stress tales como la cirugía, para evitar una insuficiencia adrenal aguda. (6,7,10)
Diagnóstico del Dr. Edward R. Smith:
Prolactinoma, probablemente invasivo; descartar lesión ósea primaria.
Discusión Patológica
Dr. Anat Stemmer-Rachamimov: La revisión de los slides de otro hospital mostraron un tumor celular con un patrón de crecimiento difuso (Figura 2 A). Las células tumorales muestran un marcado pleomorfismo con nucléolos prominentes, células bizarras ocasionales, y figuras mitóticas (Figura 2 B). La apariencia inusual de la lesión histológica condujo a un amplio diagnóstico diferencial y a un gran panel de inmunotinciones fueron llevados a cabo para establecer el diagnóstico. La inmunotinción para hormonas pituitarias (Figura 2 C) mostró una fuerte tinción para prolactina, y débil tinción para hormona de crecimiento humana. El índice de proliferación medido con Ki 67, fue 3%, y la inmunotinción mostro raras células p53-positivas.

Figura 2. Muestra de Biopsia Transesfenoidal de la Masa de Silla Turca.
El tumor es celular, con figuras mitóticas dispersas y células pleomórficas (Panel A, hematoxilina-eosina). La preparación en frotis mostró células tumorales que tienen grandes núcleos irregulares con nucléolos prominentes (Panel B, hematoxilina-eosina). Las células tumorales muestran una fuerte y difusa tinción positiva para prolactina (Panel C, tinción inmuohistoquímica para prolactina)
La presencia de ocasionales células positivas para hormona de crecimiento humana aumenta la sospecha de un adenoma acidófilo de célula madre, un raro adenoma pituitario agresivo caracterizado por vacuolas intracitoplasmáticas, espirales de citoqueratina, y mitocondrias gigantes anormales en la microscopía electrónica. La tinción con citoqueratina no mostró cuerpos fibrosos en este caso, y el examen ultraestructural no reveló mitocondrias anormales. (11) En resumen, este es un adenoma secretor de prolactina con elementos atípicos, incluyendo actividad mitótica, nucléolos prominentes, y una elevada fracción de proliferación, que ha estado asociado a conducta agresiva. (12,13)
Dr. Smith: Nosotros concluimos que el paciente tenía un adenoma pituitario atípico invasivo. Se comenzó terapia farmacológica de la lesión, y se refirió a una clínica oncológica con orientación a radioterapia para discutir la posibilidad de radioterapia de la lesión ósea.
Dr. Jay Loeffler: La lesión ósea fue uno de los tumores más extensos vistos por nuestro grupo neuroendocrino en los últimos 20 años. El gran tamaño de la enfermedad residual sugiere que una sustancial cantidad de tumor debe estar pobremente diferenciado, porque de lo contrario, los niveles de prolactina debieran ser considerablemente mayores (en el orden de los miles de nanogramos por mililitro). La terapia radiante es raramente usada actualmente en el manejo de los adenomas hipofisarios secretores de prolactina, debido a la disponibilidad de la terapia agonista dopaminérgica, y solo se reserva para pacientes con eventos adversos asociados a la terapia con agonistas dopaminérgicos, y para aquellos con enfermedad inoperable (por ejemplo invasión de senos cavernosos o huesos de base de cráneo) La invasión de la base de cráneo en este paciente nos condujo a recomendar una agresiva terapia con haz de protones.
La planificación de la terapia con haz de protones fue llevada a cabo con RMN y contraste y TAC. El volumen tumoral y las estructuras normales críticas fueron delineadas en base a RMN asociada a TAC superpuestas. Se desarolló un plan que usó cuatro campos de protones para administrar 54 CGE (cobalt gray equivalents) en 30 fracciones en un período de 6 semanas. El plan final de tratamiento e imágenes fueron presentados en nuestra conferencia semanal de tratamiento protónico. El Dr. Norbert Liebsch, quien dirige la sección base de cráneo en el Departamento de Radiación Oncológica en este hospital, comentó que el componente expansivo óseo con fracciones osteolíticas y osteoblásticas era más sugestivo de un proceso óseo primario indolente, tal como displasia fibrosa u osteoblastoma, que de un hueso invadido por tumor.
Nosotros contactamos con el Dr, Smith, quien también tuvo la preocupación de que el compromiso óseo no era típico de un adenoma pituitario, y por esa razón se llevó a cabo una biopsia de clivus. Nosotros recomendamos que la muestra de biopsia sea obtenida a través del espacio retromastoideo, ya que el tejido de ese sitio estaba lo suficientemente alejado de la pituitaria, y no había entonces posibilidad de confusión.
Dr. Nancy Lee Harris (Patología): Dr. McKenna, podría describirnos el procedimiento?
Dr. Michael McKenna (ORL): Fue tomada la decisión de llevar a cabo una biopsia del componente mastoideo de la lesión ósea a través de un approach mastoideo. Se llevó a cabo una disección en la región del foramen yugular. Una masa ósea anormal fue encontrada. Se tomó una biopsia y se hicieron cortes para congelación para certificar que la muestra contenía tejido diagnóstico.
Dr. Miriam D. Post: La muestra consistió en un fragmento de hueso normal, de hueso reactivo, y de hueso neoplásico (Figura 3 A), con brusca demarcación entre el hueso neoplásico y no neoplásico, indicando un proceso de lento crecimiento. El tumor estaba compuesto de trabéculas distribuidas al azar, tejido fibroso con capilares prominentes, y una apariencia osteoblástica blanda a lo largo de la superficie ósea en crecimiento (Figura 3B). Esos hallazgos histológicos, en combinación con los hallazgos radiológicos de una masa expansiva heterogénea circunscripta, sostiene el diagnóstico de osteoblastoma. Una cuidadosa reevaluación de la muestra previa de biopsia mostró un diminuto fragmento de osteoblastoma. Había, sin embargo, insuficiente material para hacer diagnóstico.
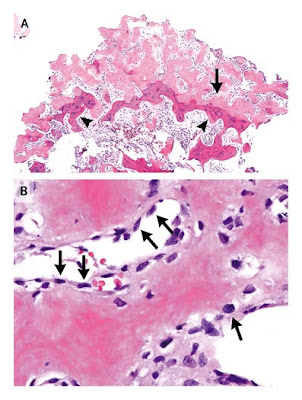 Figura 3. Biopsia Transmastoidea de Hueso Petroso (Hematoxilina-Eosina).
Figura 3. Biopsia Transmastoidea de Hueso Petroso (Hematoxilina-Eosina).
A pequeño aumento (Panel A), una clara demarcación entre hueso reactivo (cabeza de flecha) y hueso neoplásico (flecha) es evidente. Esto provee evidencias de un proceso de lento crecimiento, en otras palabras, un proceso benigno. A mayor aumento (Panel B), osteoblastos blandos son vistos dentro de tejido conectivo fibroso rodeando las trabéculas neoplásicas (flechas), hallazgo característico de osteoblastoma. Este es uno de los principales hallazgos que distingue esta entidad de la displasia fibrosa.
La base de cráneo es un sitio inusual para osteoblastoma, una forma rara de neoplasia benigna que ocurre más comúnmente en la espina. Cuando el osteoblastoma afecta el cráneo, generalmente compromete la mandíbula o el maxilar superior. (14,15) El diagnóstico diferencial histológico en este caso incluye el osteoma osteoide (que es histológicamente idéntico pero se caracteriza por un tamaño de menos de 2 cm de diámetro), osteosarcoma, y la displasia fibrosa. El tumor de este paciente está bien circunscripto, a diferencia del osteosarcoma, que típicamente muestra bordes infiltrativos, y las células observadas no tienen aspecto de malignas. En base a los hallazgos de imágenes, la displasia fibrosa fue el mayor diagnóstico diferencial, pero se caracteriza por tejido fibroso con células en huso, blandas, y trabéculas óseas curvilíneas, que no muestran el anillo osteoblástico visto en este caso. (16)
El tratamiento del osteoblastoma típicamente consiste en curetaje, aunque la resección en bloque puede ser llevada a cabo si el tumor es grande y fácilmente accesible. El pronóstico es excelente; sin embargo, aproximadamente 20% de los tumores recurre, generalmente cuando son cureteadas zonas de difícil acceso quirúrgico. (17)
Dr. Harris: Dr. Misra, podría discutir el manejo del prolactinoma?
Dr. Madhusmita Misra: Este paciente tenía hiperprolactinemia (nivel de prolactina de 674 ng/ml) en el rango de macroadenoma, (18) sin ginecomastia, galactorrea, disminución de la líbido, ni disfunción eréctil. Tenía evidencias de laboratorio de hipotiroidismo secundario y bajos niveles de factor de crecimiento insulina-like I (IGF-I) para su estadio puberal, sugestivos de deficiencia de hormona de crecimiento. Aunque el tumor se teñía tanto para hormona de crecimiento como para prolactina, su curva de crecimiento no mostraba crecimiento acelerado, y el nivel de IGF I no sugería adenoma cosecretor. Aún después del ajuste para edad y duración de los síntomas, hay mayor prevalencia de macroadenomas en niños que en niñas púberes, lo cual ha sido atribuido a la facilidad del diagnóstico en niñas en base a las irregularidades menstruales. Los tumores son más grandes en varones, además de ser más resistentes a la terapia médica y más invasivos, (19) indicando diferencias sexuales específicas en la biología tumoral.
Dado que la secreción de prolactina es inhibida por la unión de la dopamina a los receptores D2, en los lactotropos, los niños con prolactinomas tales como este paciente tienen una excelente respuesta a la terapia médica con agonistas dopaminérgicos, típicamente la bromocriptina (20,21) y cabergolina. (22) Nosotros generalmente indicamos cabergolina, ya que requiere menos dosis, tiene menos efectos colaterales, y generalmente normaliza con más efectividad los niveles de prolactina así como también reduce más el tamaño tumoral que la bromocriptina, tanto en micro como en macroprolactinomas. (22,23) Nuestra mayor preocupación es la que surge de que la dosis acumulativa de cabergolina (por ejemplo en pacientes con enfermedad de Parkinson) se asocia a riesgo de regurgitación valvular cardíaca. (24) El riesgo con las dosis mucho menores usadas en prolactinomas todavía no es conocido; recientemente, un riesgo aumentado de regurgitación tricuspídea moderada fue reportada cuando la dosis acumulada excedió los 280 mg, (25) aunque los datos medidos en su totalidad no muestran riesgo aumentado de regurgitación clínicamente significatvo. (26,27,28) Por esta razón, se practicó una ecocardiografía en este paciente; él tenía una regurgitación pulmonar y tricuspídea mínimas, que fueron seguidas anualmente.
Después de la cirugia se comenzó con cabergolina a una dosis de 0,25 mg dos veces por semana lo cual llevó a normalización completa de los niveles de prolactina y estos permanecieron en el extremo inferior dentro del rango normal. Nosotros buscamos deficiencias de tirotrofina, corticotrofina, hormona antidiurética, y hormona de crecimiento para determinar qué hormona sería necesario reemplazar.
Levotiroxina 75 ug/día se comenzó preoperatoriamente, y el paciente permaneció eutiroideo con esta dosis. Un nivel de cortisol matutino preoperatorio indicó suficiente secreción basal, y un test de estimulación postoperatoria con cosintropina indicó un pico normal del nivel de cortisol, en 26,1 ug/dl. No desarrolló diabetes insípida. Los niveles de IGF-I continuaron en el rango normal-bajo para la edad y eran bajos para el estadio puberal (225 a 240 ng/ml), pero la estimulación con hormona de crecimiento a los 18,7 años de edad fue normal. A los 17 años de edad cronológica y una desviación standard para la altura de -1,16, la edad ósea era de 18 años indicando culminación del crecimiento estatural.
El hipogonadismo del paciente mejoró gradualmente, y los actuales niveles de testosterona están en el rango normal-bajo. Él no tiene evidencias de hiperparatiroidismo o tumor pancreático, que sugieran neoplasia endócrina múltiple tipo 1.
Una RMN anual no reveló crecimiento del adenoma pituitario o del osteoblastoma. El z score para densidad mineral ósea en columna era de -1,8 inmediatamente después de la cirugía, y -1,7 después de un año de terapia con agonistas dopaminérgicos. Se le había ofrecido la opción de rotar a bromocriptina pero él eligió seguir con cabergolina.
Dr. Harris: La ocurrencia de dos tumores poco frecuentes y no relacionados uno con otro en este niño produjo incredulidad y en forma comprensible, los médicos que atendieron a este niño asumieron un diagnóstico unificante a través de un adenoma pituitario agresivo con invasión ósea. Dos diagnósticos unificantes pueden ser considerados. Primero, el síndrome de McCune-Albright, que asocia tanto adenomas pituitarios como lesión fibrosa-ósea benigna; puede este síndrome explicar los tumores de este paciente? Segundo, puede la hiperprolactinemia haber causado por irritación un osteoblastoma en el tallo pituitario, con degeneración quística de la glándula pituitaria?
Dr. Misra: Nosotros consideramos el síndrome de McCune-Albright cuando se discutió diagnósticos diferenciales de lesiones de base de cráneo que incluyen procesos óseos primarios tales como tal como la displasia fibrosa. El síndrome de McCune-Albright causado por una mutación activante del GNAS1, que codificaGs alfa, está asociado a manchas café con leche, displasia fibrosa poliostótica, y una o más condiciones de excesos hormonales, incluyendo pubertad precoz, exceso de hormona de crecimiento (con o sin hiperprolactinemia), hipertiroidismo, hiperparatiroidismo, e hipercortisolismo. No hay reportes de prolactinomas aislados, ni siquiera de hiperprolactinemia aislada en el síndrome de McCune-Albright.
Nuestro paciente no evidenciaba exceso de hormona de crecimiento ni de ninguna otra manifestación del síndrome. Finalmente el síndrome de McCune –Albright se asocia con displasia fibrosa ósea, no con osteoblastoma. Por lo tanto, este diagnóstico es improbable. Los elevados niveles de prolactina secundarios a compresión del tallo pituitario no exceden usualmente los 200 ng/ml. Los niveles excesivamente altos de nuestro paciente, junto a los hallazgos patológicos, confirman el diagnóstico de adenoma pituitario secretor de prolactina.
Dr. Harris: Así que la navaja de Occam fue dejada de lado y en cambio adoptada la sentencia de Hickam que dice: “un paciente puede tener tantos diagnósticos como le venga en gana” (29).
Diagnóstico Anatómico:
Adenoma pituitario secretor de prolactina, con hallazgos atípicos y alta fracción de crecimiento.
Osteoblastoma de Cráneo.
Traducción de:
Case 37-2008 — A 17-Year-Old Boy with a Pituitary Tumor and Skull Abnormalities
Edward R. Smith, M.D., Jay Loeffler, M.D., Madhusmita Misra, M.D., Stuart R. Pomerantz, M.D., Anat Stemmer-Rachamimov, M.D., and Miriam D. Post, M.D.
CASE RECORDS OF THE MASSACHUSETTS GENERAL HOSPITAL
Volume 359:2367-2377 November 27, 2008 Number 22
The New England of Medicine.
Conclusiones Finales.
La cefalea es un síntoma al cual el médico clínico se enfrenta cotidianamente, y una de las causas más prevalentes de consulta en la práctica ambulatoria. La etiología de la cefalea es amplia, y la patofisiología de la misma tiene su explicación en el compromiso de las estructuras sensibles al dolor (nociceptores)alojadas en la cabeza. El cerebro carece de estos nociceptores, y por lo tanto, no es, en si mismo, causa de dolor. Las áreas de la cabeza y cuello que tienen estructuras sensibles al dolor, y que por lo tanto pueden ser el origen del mismo, en forma práctica se dividen en intracraneales (vasos sanguíneos, meninges y nervios) y extracraneales (periostio del cráneo, músculos de la cabeza y cuello, nervios, arterias, venas, tejido celular subcutáneo, ojos, oídos, senos paranasales, y membranas mucosas).
Uno de los dilemas a los que el clínico se enfrenta constantemente es el de decidir qué paciente amerita estudios. Y cuando decimos estudios, nos referimos a imágenes de SNC como tomografía computada (TAC) o resonancia magnética (RMN) fundamentalmente.
Nuestra formación clínica nos indica que un buen interrogatorio, y un examen físico completo, arrojan luz sobre el origen de la cefalea en la mayoría de los casos, que en un porcentaje mayoritario nos orientan a cefalea tensional, originada en estructuras extracraneales, o migraña, con un origen del dolor asentando en estructuras neurovasculares.
Sin embargo, hoy día, la creciente disponibilidad de las imágenes, la mayor accesibilidad de las mismas para la población general, y razones médico-legales, entre otras cosas, hace que casi todos los pacientes con cefalea, sobre todo cuando nos referimos a una cefalea crónica, sean sometidos en algún momento de la evolución de su trastorno a neuroimágenes.
Más allá de que en este ateneo, el expositor aborda este aspecto del problema, dejando perfectamente establecido cuales son las situaciones en las que, sin duda uno debe estudiar una cefalea, casi se podría decir, que es de buena práctica médica solicitar alguna imagen a estos pacientes con cefalea crónica, independientemente de que tengamos perfectamente establecido el diagnóstico de jaqueca, cefalea tensional etc. Todos recordamos siempre algún caso en que un paciente presentó durante años una cefalea rotulada como migraña o fibromialgia, hasta que a alguien se le ocurrió solicitar un estudio.
En el caso de este paciente de 17 años, no quedan dudas de que ameritó estudios desde el primer momento, ya que se presentó a la consulta con cefalea, alteraciones visuales, y síntomas de disfunción endócrina.
La presencia de niveles excesivamente elevados de prolactina que inicialmente fueron de 657 ng/ml, no dejaron dudas del origen tumoral de los mismos, asociados a las neuroimágenes que mostraban un tumor pituitario con expansión extraselar y compresión del quiasma óptico. Sin embargo, la presencia de lesiones óseas destructivas en la base de cráneo asociadas a este tumor pituitario, hizo que, una vez más se enfrentaran la navaja de Occam (“porqué buscar más de un diagnóstico, si uno solo puede justificarlo todo”), y el "Dictado de Hickam" (“el pacientes pueden tener tantos diagnósticos como le venga en ganas”).
Y es aquí donde el caso nos deja más enseñanzas, sobre todo en lo referido a cuando un experto comenta el caso, y donde la sutileza en el análisis de algún elemento, y la extensa experiencia en el tema, pueden ayudar a optar entre la postura de Occam y la de Hickam. En este caso el médico asume que si toda la lesión fuese prolactinoma, el nivel de prolactina sería mucho más elevada (en el orden de miles de ng/ml), y no 600, a no ser que el grado de indiferenciación del tumor impidiera que este fabricara ese nivel de hormona.
Finalmente, otro experto, en este caso en “base de cráneo”, termina inclinando más aún la balanza en favor de la pluralidad de diagnósticos cuando establece que “el componente expansivo óseo con fracciones osteolíticas y osteoblásticas era más sugestivo de un proceso óseo primario indolente, tal como displasia fibrosa u osteoblastoma, que de un hueso invadido por tumor”
Source Information
From the Department of Neurosurgery, Children's Hospital of Boston (E.R.S.); the Departments of Radiation Oncology (J.L.), Pediatrics (M.M.), Radiology (S.R.P.), and Pathology (A.S-R., M.D.P.), Massachusetts General Hospital; and the Departments of Surgery (E.R.S.), Radiation Oncology (J.L.), Pediatrics (M.M.), Radiology (S.R.P.), and Pathology (A.S.-R., M.D.P.), Harvard Medical School.
References
1) Dooley JM, Gordon KE, Wood EP. Self-reported headache frequency in Canadian adolescents: validation and follow-up. Headache 2005;45:127-131. [CrossRef][ISI][Medline]
2) Medina LS, Pinter JD, Zurakowski D, Davis RG, Kuban K, Barnes PD. Children with headache: clinical predictors of surgical space-occupying lesions and the role of neuroimaging. Radiology 1997;202:819-824. [Free Full Text]
3) Levy MJ, Matharu MS, Meeran K, Powell M, Goadsby PJ. The clinical characteristics of headache in patients with pituitary tumours. Brain 2005;128:1921-1930. [Free Full Text]
4) Lafferty AR, Chrousos GP. Pituitary tumors in children and adolescents. J Clin Endocrinol Metab 1999;84:4317-4323. [Free Full Text]
5) Pinzone JJ, Katznelson L, Danila DC, Pauler DK, Miller CS, Klibanski A. Primary medical therapy of micro- and macroprolactinomas in men. J Clin Endocrinol Metab 2000;85:3053-3057. [Free Full Text]
6) Ciccarelli A, Daly AF, Beckers A. The epidemiology of prolactinomas. Pituitary 2005;8:3-6. [CrossRef][Medline]
7) Ciccarelli A, Guerra E, De Rosa M, et al. PRL secreting adenomas in male patients. Pituitary 2005;8:39-42. [CrossRef][Medline]
8) Hanbali F, Tabrizi P, Lang FF, DeMonte F. Tumors of the skull base in children and adolescents. J Neurosurg 2004;100:Suppl 2:169-178. [ISI][Medline]
9) Knappe UJ, Lüdecke DK. Transnasal microsurgery in children and adolescents with Cushing's disease. Neurosurgery 1996;39:484-492. [CrossRef][ISI][Medline]
10) Vergès B, Boureille F, Goudet P, et al. Pituitary disease in MEN type 1 (MEN1): data from the France-Belgium MEN1 multicenter study. J Clin Endocrinol Metab 2002;87:457-465. [Free Full Text]
11) Kontogeorgos G, Barkan AL, Watson RE Jr, Farrell WE, Lindell EP, Lloyd RV. Growth hormone producing adenoma. In: DeLellis RA, Lloyd RV, Heitz PU, Eng C, eds. World Health Organization classification of tumours. Vol. 8. Pathology and genetics of tumours of endocrine organs. Lyon, France: IARC Press, 2004:16-17.
12) Amar AP, Hinton DR, Krieger MD, Weiss MH. Invasive pituitary adenomas: significance of proliferation parameters. Pituitary 1999;2:117-122. [CrossRef][Medline]
13) Thapar K, Scheithauer BW, Kovacs K, Pernicone PJ, Laws ER Jr. p53 expression in pituitary adenomas and carcinomas: correlation with invasiveness and tumor growth fractions. Neurosurgery 1996;38:765-770. [CrossRef][ISI][Medline]
14) Unni KK, Inwards CY, Bridge JA, Kindblom LG, Wold LE. Tumors of the bones and joints. AFIP Atlas of tumor pathology. 4th series. Washington, DC: Armed Forces Institute of Pathology; 2005:126-35.
15) Malcolm AJ, Schiller AL, Schneider-Stock R. Osteoblastoma. In: Fletcher CDM, Unni KK, Mertens F, eds. World Health Organization classification of tumours. Vol. 4. Tumours of soft tissue and bone. Lyon, France: IARC Press, 2002: 262-3.
16) Lucas DR, Unni KK, McLeod RA, O'Connor MI, Sim FH. Osteoblastoma: clinicopathologic study of 306 cases. Hum Pathol 1994;25:117-134. [CrossRef][ISI][Medline]
17) Gibson SE, Prayson RA. Primary skull lesions in the pediatric population: a 25-year experience. Arch Pathol Lab Med 2007;131:761-766. [ISI][Medline]
18) Gillam MP, Molitch ME, Lombardi G, Colao A. Advances in the treatment of prolactinomas. Endocr Rev 2006;27:485-534. [Free Full Text]
19) Delgrange E, Trouillas J, Maiter D, Donckier J, Tourniaire J. Sex-related difference in the growth of prolactinomas: a clinical and proliferation marker study. J Clin Endocrinol Metab 1997;82:2102-2107. [Free Full Text]
20) Howlett TA, Wass JA, Grossman A, et al. Prolactinomas presenting as primary amenorrhoea and delayed or arrested puberty: response to medical therapy. Clin Endocrinol (Oxf) 1989;30:131-140. [CrossRef][Medline]
21) Tyson D, Reggiardo D, Sklar C, David R. Prolactin-secreting macroadenomas in adolescents: response to bromocriptine therapy. Am J Dis Child 1993;147:1057-1061. [Free Full Text]
22) Colao A, Di Sarno A, Landi ML, et al. Long-term and low-dose treatment with cabergoline induces macroprolactinoma shrinkage. J Clin Endocrinol Metab 1997;82:3574-3579. [Free Full Text]
23) Webster J, Piscitelli G, Polli A, Ferrari CI, Ismail I, Scanlon MF. A comparison of cabergoline and bromocriptine in the treatment of hyperprolactinemic amenorrhea. N Engl J Med 1994;331:904-909. [Free Full Text]
24) Zanettini R, Antonini A, Gatto G, Gentile R, Tesei S, Pezzoli G. Valvular heart disease and the use of dopamine agonists for Parkinson's disease. N Engl J Med 2007;356:39-46. [Free Full Text]
25) Colao A, Galderisi M, Di Sarno A, et al. Increased prevalence of tricuspid regurgitation in patients with prolactinomas chronically treated with cabergoline. J Clin Endocrinol Metab 2008;93:3777-3784. [Free Full Text]
26) Wakil A, Rigby AS, Clark AL, Kallvikbacka-Bennett A, Atkin SL. Low dose cabergoline for hyperprolactinaemia is not associated with clinically significant valvular heart disease. Eur J Endocrinol 2008;159:R11-R14. [Free Full Text]
27) Kars M, Delgado V, Holman ER, et al. Aortic valve calcification and mild tricuspid regurgitation but no clinical heart disease after 8 years of dopamine agonist therapy for prolactinoma. J Clin Endocrinol Metab 2008;93:3348-3356. [Free Full Text]
28) Lancellotti P, Livadariu E, Markov M, et al. Cabergoline and the risk of valvular lesions in endocrine disease. Eur J Endocrinol 2008;159:1-5. [Free Full Text]
29) Hilliard AA, Weinberger SE, Tierney LM Jr, Midthun DE, Saint S. Occam's razor versus Saint's triad. N Engl J Med 2004;350:599-603. [Free Full Text]
Aproximadamente 3 meses antes de la actual evaluación, las cefaleas se hicieron más punzantes, aumentaron su severidad, llegando a referirlas el paciente como de intensidad 10. Una TAC de senos paranasales llevada a cabo sin la administración de sustancia de contraste reveló senos normales, pero un aspecto de “apolillado” de la base de cráneo y del clivus (parte de la base de cráneo que conecta el dorso de la silla turca y foramen mágnum), con destrucción de la cortical ósea. Una RMN de cerebro con administración de gadolinio que reveló una lesión de apariencia quística de 2 cm de diámetro, en la región selar y expansión supraselar con compresión del quiasma óptico, y una masa sólida con intensidad de señal mixta y realce heterogéneo, que afectaba todo el clivus, se extendía a los huesos petrosos, improntaba en la protuberancia, y se extendía al ángulo médulo-cerebeloso.
Diez semanas antes de la actual evaluación, el paciente vió a un neurocirujano. En el examen había una leve parálisis del VI par; hemianopsia bitemporal; un signo de Hoffman positivo (la súbita flexión del tercer dedo de la mano por compresión de su lecho ungueal, induce extensión de la articulación interfalángica distal de ese dedo y flexión del pulgar e indica lesión del haz piramidal en alguna parte de su trayecto) del lado derecho; estrías en los hombros, axilas, y cintura; y áreas de hiperpigmentación del hombro derecho. No había pelos en la cara ni en el pecho y el paciente tenía un estadio 4 de la escala de Tanner para pubertad. Los resultados de los tests de laboratorio se muestran en la Tabla 1.

Tabla 1
Resultados de los Tests de Laboratorio.
Click sobre la imagen para ampliarla.
El examen oftalmológico mostró hemianopsia bitemporal no congruente, con hemianopsia temporal completa del lado derecho y menos severo déficit visual temporal izquierdo. La agudeza visual fue de 20/50 en ambos ojos, corrigiendo a 20/30 en el derecho y a 20/25 en el izquierdo. En la evaluación endocrinológica, el paciente reportó que el vello púbico, y el acné aparecieron a los 13 años. El peso era de 82,4 kg, la altura de 168 cm, el BMI DE 29,2; los signos vitales eran normales. Había leve acné facial y acantosis nigricans en el cuello y la axila. Un soplo sistólico eyectivo 2/6 se auscultaba en el borde esternal izquierdo, y el borde hepático se palpaba a 5 o 6 cm por debajo del reborde costal; el resto del examen físico era normal. La evaluación neuropsicológica reveló buena performance en casi todos los items explorados, alguna dificultad en la memoria a corto plazo, y mayor desarrrollo de la comunicación no verbal que verbal. Los resultados de los tests se muestran en la Tabla 1. Se comenzó el tratamiento con levotiroxina.
El paciente fue admitido en otro hospital. Los tests de laboratorio se muestran en la Tabla 1. El componente selar de la masa fue resecada a través de la vía transesfenoidal, con biopsia del clivus. El examen histopatológico reveló un adenoma secretor de prolactina. Dos días después de la operación, una RMN de cerebro y médula con gadolinio, reveló descompresión y resección del componente quístico hemorrágico en la región selar. El paciente fue dado de alta el 4º día de internación; la medicación de alta incluia cabergolina, dexametasona, levotiroxina, buspirona y ranitidina.
Dos semanas después de la operación, el paciente reportó mejoramiento de su visión, y cefaleas leves, infrecuentes y de un carácter sordo. La agudeza visual era de 20/25 en ambos ojos, y los campos visuales eran normales. Los resultados de los tests de laboratorio llevados a cabo 3 semanas de posoperatorio se muestran en la Tabla 1. Una tomografía por emisión de positrones (PET) de cuerpo entero y cráneo, con fluorodeoxiglucosa (18F-FDG) reveló una avidez variable pero en general baja de la 18F-FDG por la masa residual y sin evidencias de enfermedad en otra localización. Una punción lumbar fue negativa.
Cuatro semanas después de la cirugía, el paciente fue visto en la clínica de endocrinología pediátrica de este hospital, para evaluar la posibilidad de radioterapia con haces de protones (proton-beam irradiation) de la lesión ósea.
Su energía había mejorado, y las cefaleas habían disminuído en frecuencia y severidad.
El paciente había sido adoptado a la edad de 5 meses. El desarrollo temprano fue normal. El vivía con sus padres adoptivos. En la escuela secundaria había sido buen alumno y activo en deportes. No se conocían antecedentes de salud de su familia biológica.
Los signos vitales eran normales, y los hallazgos del examen físico no habían cambiado y consistían en un desarrolo puberal estadio 4 de Tanner. Los resultados de los tests de laboratorio se muestran en la Tabla 1. La dosis de cabergolina fue aumentada a 0,5 mg 2 veces por semana. La repetición de la RMN de cerebro con la administración de gadolinio reveló una gran masa con realce centrada en el clivus, con extensión a los huesos petrosos, borramiento de la cisterna prepontina con indentación en la protuberancia, y estrechamiento del ángulo pontocerebeloso.
Fue llevado a cabo un procedimiento diagnóstico.
Diagnóstico Diferencial.
Dr. Edward R. Smith: Este paciente de 17 años consultó por cefalea, pérdida progresiva de visión, cambios del humor, empeoramiento de su rendimiento académico, fatiga, intolerancia al frio, y aumento de peso.
El examen físico demostró una hemianopsia bitemporal; disminución de la agudeza visual; un signo de Hoffmann positivo del lado derecho; fuerza, sensibilidad, y otros reflejos normales; estrías en tronco; ausencia de vello facial y en tronco; y obesidad leve. Aunque yo vi a este paciente por primera vez después de que los estudios radiológicos se habían llevado a cabo, es pertinente revisar los hallazgos en la historia clínica y el examen físico que pueden indicar la presencia de una masa intracraneal.
Hallazgos Sugestivos de Proceso Intracraneal.
El problema del paciente puede ser agrupado en las siguientes tres categorías: cefalea, alteraciones visuales, y síntomas de disfunción endócrina.
Las cefaleas son comunes en este grupo etáreo, con casi un tercio de los adolescentes que refieren cefaleas semanales. (1) Uno de los temas más dificultosos con los que se enfrenta el médico pediatra en la evaluación de un niño con cefalea es identificar a ese aproximadamente 4% de tales niños que realmente tienen lesiones intracraneales. Llevar a cabo estudios de imágenes en todos los pacientes no es práctico por los costos, por la saturación de la disponibilidad de los servicios de imágenes, por los riesgos de la sedación en niños pequeños, y por el riesgo de la radiación (cuando se usa TAC). (2)
Los predictores de una masa incluyen: cefalea asociada al sueño, vómitos, confusión, signos de foco neurológico, la ausencia de fenómenos visuales típicos de la migraña, y la presencia de cefaleas de menos de 6 meses de evolución.
La presencia de déficits visuales, la ausencia de elementos de migraña, y la naturaleza progresiva de sus síntomas, sugieren en este paciente la necesidad de neuroimágenes.
Localización de la Lesión.
En este paciente, la hemianopsia bitemporal, es fuertemente sugestivo de compromiso del quiasma óptico, donde la compresión de las fibras cruzadas de los campos retinianos nasales puede causar este déficit. La disminución de la agudeza visual es indicativo de compresión de larga data del aparato óptico, o injuria secundaria a aumento de presión intracraneal. La fatiga, retraso de la aparición de caracteres sexuales secundarios, y la intolerancia al frio sugieren disfunción endócrina. Esos hallazgos dirigen al clínico directamente a la silla turca, con probable diagnóstico de masa de lento crecimiento pituitaria con compresión del quiasma óptico.
Las lesiones selares pueden causar cefalea por deformación anatómica de estructuras con receptores de dolor (duramadre) y aumento de presión intracraneana, así como efectos en el sistema trigémino-vascular a través de la alteración del metabolismo de la dopamina por tumores hormonalmente activos. (3)
Aunque la cefalea sola es un pobre elemento localizador, en este caso es más preocupante en este paciente que presenta signo de Hoffmann, usualmente indicativo de compresión del tracto corticospinal, o lesión de neurona motora superior. La naturaleza progresiva crónica de estos síntomas y la historia de cefalea que empeora a la mañana me llevan a sospechar una gran masa de lento crecimiento con aumento de la presión intracraneal o compresión del tronco cerebral o de la unión cérvico-medular.
Puedo ver los estudios radiológicos?
Dr. Stuart R. Pomerantz: La TAC de senos paranasales muestra un proceso destructivo extenso de la porción base-esfenoidal y base-occipital de la base de cráneo, con expansión difusa y destrucción del hueso cortical pero sin un patrón franco de matriz osteoide o condroide. (Figura 1 A).
Figura 1. TAC y RMN de Base de Cráneo.

Una TAC de senos paranasales muestra un proceso destructivo extenso de base-esfenoidal (Panel A flecha). Hay un aspecto “apolillado” de las estructuras óseas, incluyendo destrucción del hueso cortical, pero sin un franco patrón de matriz osteoide o condroide, son evidentes. La RMN de base de cráneo revela dos componentes distintos de lesiones. Una Imagen en T1 (Panel B) muestra que en la región selar y supraselar hay una masa expansiva de apariencia quística, hiperintensa, de aproximadamente 2 cm de diámetro (flecha), con niveles líquidos brillantes y oscuros en secuencias T2 (Panel C, flecha), hallazgos sugestivos de material hemorrágico o proteináceo. Cambios multiquísticos menores son vistos en al componente óseo adyacente (cabeza de flecha) Un corte coronal en T1 revela extensión supraselar comprimiendo el quiasma óptico, más a la izquierda (Panel D, flecha), e invasión de los senos cavernosos, más a la derecha (cabeza de flecha). Un corte sagital en T1 obtenida después de la administración de contraste (Panel E) revela una gran masa ósea de apariencia sólida, con intensidad de señal mixta y realce heterogéneo con gadolinio desde el piso de la silla turca hasta el foramen magno, con efecto de masa en la región ventral de la protuberancia (flecha) Una imagen axial en T1 obtenida después de la administración de contraste revela extensión al hueso petroso derecho (Panel F, flecha) y borramiento parcial de la cisterna del ángulo cerebelomedular (cabeza de flecha)
La RMN de base de cráneo reveló dos componentes distintos. En la región selar y supraselar, hay una lesión expansiva de aspecto quístico de 2 cm de diámetro (Figura 1B, 1C y 1D), que muestra hiperintensidad en secuencias T1 y T2 con nivel líquido sugestivo de material hemorrágico o proteináceo. Hay extensión supraselar que comprime el quiasma óptico, peor a la izquierda, e invasión de los senos cavernosos, peor a la derecha. La más grande, la porción ósea de la masa (Figura 1E y 1F) parece sólida, con intensidad de señal mixta y realce heterogéneo con gadolinio, y extensión desde el piso selar hasta el foramen magno, y dentro de los huesos petrosos bilateralmente, más extensamente a la derecha donde hay algún compromiso mastoideo. La lesión impronta la región anterior de la protuberancia, y ocupa parcialmente las cisterna del ángulo cerebelo-medular. La arteria basilar está desplazada lateralmente sin compresión ni estenosis.
Lesiones Selares.
Dr. Smith: El diagnóstico diferencial de las lesiones en esta región de la silla turca es amplio (Tabla 2). En este paciente, el hallazgo clave fue la elevación del nivel de prolactina. El nivel elevado de prolactina puede ser de varias causas, incluyendo agentes farmacológicos (particularmente drogas neurolépticas), compresión del infundíbulo o de la glándula pituitaria (el “efecto tallo”, donde por compresión de la glándula pituitaria o el tallo pituitario interfiere con la liberación de dopamina del hipotálamo a la pituitaria), o procesos normales (como el embarazo, lactancia, o estímulo del pezón). Sin embargo, la mayoría de esas causas no elevan los niveles de prolactina por encima de 100 a 200 ng/ml, y niveles de 500 ng/ml, como se vieron en este paciente, usualmente son indicativos de prolactinoma.
El tamaño tumoral y los niveles de prolactina sérica tienen correlación directa. (5) Niveles extraordinariamente altos de prolactina, pueden ocasionalmente aunque raramente dar resultados bajos en los dosajes (“efecto hook”). Si se sospechan niveles altos, y los resultados son bajos debe testearse a diluciones seriadas para evitar ese efecto. El hallazgo de niveles de 500 ng/ml de prolactina, en ausencia de agentes confundidores sugiere fuertemente el diagnóstico de prolactinoma en este caso. (6,7)

Tabla 2 Diagnóstico Diferencial de Lesiones Selares en Niños.
Lesiones de Base de Cráneo.
Un elemento que complica la interpretación de este caso es el extenso compromiso de la base de cráneo por un complejo proceso. La compresión del tronco cerebral en las imágenes provee una explicación para los hallazgos en el examen físico, de compromiso de neurona motora superior. El diagnóstico diferencial de las lesiones de base de cráneo en este grupo etáreo son mostradas en la Tabla 3.
El principio de la navaja de Occam sugiere que un adenoma pituitario invasivo o un carcinoma pituitario serían más probables. Otros posibilidades incluyen un craniofaringioma (10 a 20 veces más común que los adenomas pituitarios en este grupo etáreo), sarcomas (77% de los tumores pediátricos de base de cráneo), y cordoma. (4,8) Menos probable serían las lesiones óseas, tales como el osteoblastoma o la displasia fibrosa.

Tabla 3. Diagnóstico Diferencial de las Lesiones de Base de Cráneo.
Diagnóstico y Approach Terapéutico.
Mi primer diagnóstico es prolactinoma, sea invasivo, o asociado con un segundo proceso patológico distinto. El tratamiento de primera línea de los prolactinomas es usualmente farmacológico, pero en este caso, la necesidad de obtener tejido para diagnóstico, y los defectos en los campos visuales sería recomendable una intervención quirúrgica.
La indicación quirúrgica típicamente incluye: apoplejía pituitaria, rinorrea cerebroespinal (fístula de LCR), eventos adversos en relación a terapia con agonistas dopaminérgicos, y déficits de campos visuales en pacientes con macroadenomas (particularmente tumores quísticos), que rápidamente progresan, o no responden a la terapia médica.
Yo usaría la vía transesfenoidal para descomprimir el sistema óptico y obtener tejido de la lesión, tanto de la región selar, como de la base de cráneo. Este approach no está asociado con una tasa alta de efectos adversos, pero los riesgos incluyen fístula de líquido cefalorraquídeo (3% de los casos), infección, hipopituitarismo (18 a 87% de los casos), e injuria a las arterias carótidas internas o a los nervios craneales. (9) De importancia crítica es la administración de “dosis de stress” de corticosteroides en pacientes con situaciones de stress tales como la cirugía, para evitar una insuficiencia adrenal aguda. (6,7,10)
Diagnóstico del Dr. Edward R. Smith:
Prolactinoma, probablemente invasivo; descartar lesión ósea primaria.
Discusión Patológica
Dr. Anat Stemmer-Rachamimov: La revisión de los slides de otro hospital mostraron un tumor celular con un patrón de crecimiento difuso (Figura 2 A). Las células tumorales muestran un marcado pleomorfismo con nucléolos prominentes, células bizarras ocasionales, y figuras mitóticas (Figura 2 B). La apariencia inusual de la lesión histológica condujo a un amplio diagnóstico diferencial y a un gran panel de inmunotinciones fueron llevados a cabo para establecer el diagnóstico. La inmunotinción para hormonas pituitarias (Figura 2 C) mostró una fuerte tinción para prolactina, y débil tinción para hormona de crecimiento humana. El índice de proliferación medido con Ki 67, fue 3%, y la inmunotinción mostro raras células p53-positivas.

Figura 2. Muestra de Biopsia Transesfenoidal de la Masa de Silla Turca.
El tumor es celular, con figuras mitóticas dispersas y células pleomórficas (Panel A, hematoxilina-eosina). La preparación en frotis mostró células tumorales que tienen grandes núcleos irregulares con nucléolos prominentes (Panel B, hematoxilina-eosina). Las células tumorales muestran una fuerte y difusa tinción positiva para prolactina (Panel C, tinción inmuohistoquímica para prolactina)
La presencia de ocasionales células positivas para hormona de crecimiento humana aumenta la sospecha de un adenoma acidófilo de célula madre, un raro adenoma pituitario agresivo caracterizado por vacuolas intracitoplasmáticas, espirales de citoqueratina, y mitocondrias gigantes anormales en la microscopía electrónica. La tinción con citoqueratina no mostró cuerpos fibrosos en este caso, y el examen ultraestructural no reveló mitocondrias anormales. (11) En resumen, este es un adenoma secretor de prolactina con elementos atípicos, incluyendo actividad mitótica, nucléolos prominentes, y una elevada fracción de proliferación, que ha estado asociado a conducta agresiva. (12,13)
Dr. Smith: Nosotros concluimos que el paciente tenía un adenoma pituitario atípico invasivo. Se comenzó terapia farmacológica de la lesión, y se refirió a una clínica oncológica con orientación a radioterapia para discutir la posibilidad de radioterapia de la lesión ósea.
Dr. Jay Loeffler: La lesión ósea fue uno de los tumores más extensos vistos por nuestro grupo neuroendocrino en los últimos 20 años. El gran tamaño de la enfermedad residual sugiere que una sustancial cantidad de tumor debe estar pobremente diferenciado, porque de lo contrario, los niveles de prolactina debieran ser considerablemente mayores (en el orden de los miles de nanogramos por mililitro). La terapia radiante es raramente usada actualmente en el manejo de los adenomas hipofisarios secretores de prolactina, debido a la disponibilidad de la terapia agonista dopaminérgica, y solo se reserva para pacientes con eventos adversos asociados a la terapia con agonistas dopaminérgicos, y para aquellos con enfermedad inoperable (por ejemplo invasión de senos cavernosos o huesos de base de cráneo) La invasión de la base de cráneo en este paciente nos condujo a recomendar una agresiva terapia con haz de protones.
La planificación de la terapia con haz de protones fue llevada a cabo con RMN y contraste y TAC. El volumen tumoral y las estructuras normales críticas fueron delineadas en base a RMN asociada a TAC superpuestas. Se desarolló un plan que usó cuatro campos de protones para administrar 54 CGE (cobalt gray equivalents) en 30 fracciones en un período de 6 semanas. El plan final de tratamiento e imágenes fueron presentados en nuestra conferencia semanal de tratamiento protónico. El Dr. Norbert Liebsch, quien dirige la sección base de cráneo en el Departamento de Radiación Oncológica en este hospital, comentó que el componente expansivo óseo con fracciones osteolíticas y osteoblásticas era más sugestivo de un proceso óseo primario indolente, tal como displasia fibrosa u osteoblastoma, que de un hueso invadido por tumor.
Nosotros contactamos con el Dr, Smith, quien también tuvo la preocupación de que el compromiso óseo no era típico de un adenoma pituitario, y por esa razón se llevó a cabo una biopsia de clivus. Nosotros recomendamos que la muestra de biopsia sea obtenida a través del espacio retromastoideo, ya que el tejido de ese sitio estaba lo suficientemente alejado de la pituitaria, y no había entonces posibilidad de confusión.
Dr. Nancy Lee Harris (Patología): Dr. McKenna, podría describirnos el procedimiento?
Dr. Michael McKenna (ORL): Fue tomada la decisión de llevar a cabo una biopsia del componente mastoideo de la lesión ósea a través de un approach mastoideo. Se llevó a cabo una disección en la región del foramen yugular. Una masa ósea anormal fue encontrada. Se tomó una biopsia y se hicieron cortes para congelación para certificar que la muestra contenía tejido diagnóstico.
Dr. Miriam D. Post: La muestra consistió en un fragmento de hueso normal, de hueso reactivo, y de hueso neoplásico (Figura 3 A), con brusca demarcación entre el hueso neoplásico y no neoplásico, indicando un proceso de lento crecimiento. El tumor estaba compuesto de trabéculas distribuidas al azar, tejido fibroso con capilares prominentes, y una apariencia osteoblástica blanda a lo largo de la superficie ósea en crecimiento (Figura 3B). Esos hallazgos histológicos, en combinación con los hallazgos radiológicos de una masa expansiva heterogénea circunscripta, sostiene el diagnóstico de osteoblastoma. Una cuidadosa reevaluación de la muestra previa de biopsia mostró un diminuto fragmento de osteoblastoma. Había, sin embargo, insuficiente material para hacer diagnóstico.
 Figura 3. Biopsia Transmastoidea de Hueso Petroso (Hematoxilina-Eosina).
Figura 3. Biopsia Transmastoidea de Hueso Petroso (Hematoxilina-Eosina).A pequeño aumento (Panel A), una clara demarcación entre hueso reactivo (cabeza de flecha) y hueso neoplásico (flecha) es evidente. Esto provee evidencias de un proceso de lento crecimiento, en otras palabras, un proceso benigno. A mayor aumento (Panel B), osteoblastos blandos son vistos dentro de tejido conectivo fibroso rodeando las trabéculas neoplásicas (flechas), hallazgo característico de osteoblastoma. Este es uno de los principales hallazgos que distingue esta entidad de la displasia fibrosa.
La base de cráneo es un sitio inusual para osteoblastoma, una forma rara de neoplasia benigna que ocurre más comúnmente en la espina. Cuando el osteoblastoma afecta el cráneo, generalmente compromete la mandíbula o el maxilar superior. (14,15) El diagnóstico diferencial histológico en este caso incluye el osteoma osteoide (que es histológicamente idéntico pero se caracteriza por un tamaño de menos de 2 cm de diámetro), osteosarcoma, y la displasia fibrosa. El tumor de este paciente está bien circunscripto, a diferencia del osteosarcoma, que típicamente muestra bordes infiltrativos, y las células observadas no tienen aspecto de malignas. En base a los hallazgos de imágenes, la displasia fibrosa fue el mayor diagnóstico diferencial, pero se caracteriza por tejido fibroso con células en huso, blandas, y trabéculas óseas curvilíneas, que no muestran el anillo osteoblástico visto en este caso. (16)
El tratamiento del osteoblastoma típicamente consiste en curetaje, aunque la resección en bloque puede ser llevada a cabo si el tumor es grande y fácilmente accesible. El pronóstico es excelente; sin embargo, aproximadamente 20% de los tumores recurre, generalmente cuando son cureteadas zonas de difícil acceso quirúrgico. (17)
Dr. Harris: Dr. Misra, podría discutir el manejo del prolactinoma?
Dr. Madhusmita Misra: Este paciente tenía hiperprolactinemia (nivel de prolactina de 674 ng/ml) en el rango de macroadenoma, (18) sin ginecomastia, galactorrea, disminución de la líbido, ni disfunción eréctil. Tenía evidencias de laboratorio de hipotiroidismo secundario y bajos niveles de factor de crecimiento insulina-like I (IGF-I) para su estadio puberal, sugestivos de deficiencia de hormona de crecimiento. Aunque el tumor se teñía tanto para hormona de crecimiento como para prolactina, su curva de crecimiento no mostraba crecimiento acelerado, y el nivel de IGF I no sugería adenoma cosecretor. Aún después del ajuste para edad y duración de los síntomas, hay mayor prevalencia de macroadenomas en niños que en niñas púberes, lo cual ha sido atribuido a la facilidad del diagnóstico en niñas en base a las irregularidades menstruales. Los tumores son más grandes en varones, además de ser más resistentes a la terapia médica y más invasivos, (19) indicando diferencias sexuales específicas en la biología tumoral.
Dado que la secreción de prolactina es inhibida por la unión de la dopamina a los receptores D2, en los lactotropos, los niños con prolactinomas tales como este paciente tienen una excelente respuesta a la terapia médica con agonistas dopaminérgicos, típicamente la bromocriptina (20,21) y cabergolina. (22) Nosotros generalmente indicamos cabergolina, ya que requiere menos dosis, tiene menos efectos colaterales, y generalmente normaliza con más efectividad los niveles de prolactina así como también reduce más el tamaño tumoral que la bromocriptina, tanto en micro como en macroprolactinomas. (22,23) Nuestra mayor preocupación es la que surge de que la dosis acumulativa de cabergolina (por ejemplo en pacientes con enfermedad de Parkinson) se asocia a riesgo de regurgitación valvular cardíaca. (24) El riesgo con las dosis mucho menores usadas en prolactinomas todavía no es conocido; recientemente, un riesgo aumentado de regurgitación tricuspídea moderada fue reportada cuando la dosis acumulada excedió los 280 mg, (25) aunque los datos medidos en su totalidad no muestran riesgo aumentado de regurgitación clínicamente significatvo. (26,27,28) Por esta razón, se practicó una ecocardiografía en este paciente; él tenía una regurgitación pulmonar y tricuspídea mínimas, que fueron seguidas anualmente.
Después de la cirugia se comenzó con cabergolina a una dosis de 0,25 mg dos veces por semana lo cual llevó a normalización completa de los niveles de prolactina y estos permanecieron en el extremo inferior dentro del rango normal. Nosotros buscamos deficiencias de tirotrofina, corticotrofina, hormona antidiurética, y hormona de crecimiento para determinar qué hormona sería necesario reemplazar.
Levotiroxina 75 ug/día se comenzó preoperatoriamente, y el paciente permaneció eutiroideo con esta dosis. Un nivel de cortisol matutino preoperatorio indicó suficiente secreción basal, y un test de estimulación postoperatoria con cosintropina indicó un pico normal del nivel de cortisol, en 26,1 ug/dl. No desarrolló diabetes insípida. Los niveles de IGF-I continuaron en el rango normal-bajo para la edad y eran bajos para el estadio puberal (225 a 240 ng/ml), pero la estimulación con hormona de crecimiento a los 18,7 años de edad fue normal. A los 17 años de edad cronológica y una desviación standard para la altura de -1,16, la edad ósea era de 18 años indicando culminación del crecimiento estatural.
El hipogonadismo del paciente mejoró gradualmente, y los actuales niveles de testosterona están en el rango normal-bajo. Él no tiene evidencias de hiperparatiroidismo o tumor pancreático, que sugieran neoplasia endócrina múltiple tipo 1.
Una RMN anual no reveló crecimiento del adenoma pituitario o del osteoblastoma. El z score para densidad mineral ósea en columna era de -1,8 inmediatamente después de la cirugía, y -1,7 después de un año de terapia con agonistas dopaminérgicos. Se le había ofrecido la opción de rotar a bromocriptina pero él eligió seguir con cabergolina.
Dr. Harris: La ocurrencia de dos tumores poco frecuentes y no relacionados uno con otro en este niño produjo incredulidad y en forma comprensible, los médicos que atendieron a este niño asumieron un diagnóstico unificante a través de un adenoma pituitario agresivo con invasión ósea. Dos diagnósticos unificantes pueden ser considerados. Primero, el síndrome de McCune-Albright, que asocia tanto adenomas pituitarios como lesión fibrosa-ósea benigna; puede este síndrome explicar los tumores de este paciente? Segundo, puede la hiperprolactinemia haber causado por irritación un osteoblastoma en el tallo pituitario, con degeneración quística de la glándula pituitaria?
Dr. Misra: Nosotros consideramos el síndrome de McCune-Albright cuando se discutió diagnósticos diferenciales de lesiones de base de cráneo que incluyen procesos óseos primarios tales como tal como la displasia fibrosa. El síndrome de McCune-Albright causado por una mutación activante del GNAS1, que codificaGs alfa, está asociado a manchas café con leche, displasia fibrosa poliostótica, y una o más condiciones de excesos hormonales, incluyendo pubertad precoz, exceso de hormona de crecimiento (con o sin hiperprolactinemia), hipertiroidismo, hiperparatiroidismo, e hipercortisolismo. No hay reportes de prolactinomas aislados, ni siquiera de hiperprolactinemia aislada en el síndrome de McCune-Albright.
Nuestro paciente no evidenciaba exceso de hormona de crecimiento ni de ninguna otra manifestación del síndrome. Finalmente el síndrome de McCune –Albright se asocia con displasia fibrosa ósea, no con osteoblastoma. Por lo tanto, este diagnóstico es improbable. Los elevados niveles de prolactina secundarios a compresión del tallo pituitario no exceden usualmente los 200 ng/ml. Los niveles excesivamente altos de nuestro paciente, junto a los hallazgos patológicos, confirman el diagnóstico de adenoma pituitario secretor de prolactina.
Dr. Harris: Así que la navaja de Occam fue dejada de lado y en cambio adoptada la sentencia de Hickam que dice: “un paciente puede tener tantos diagnósticos como le venga en gana” (29).
Diagnóstico Anatómico:
Adenoma pituitario secretor de prolactina, con hallazgos atípicos y alta fracción de crecimiento.
Osteoblastoma de Cráneo.
Traducción de:
Case 37-2008 — A 17-Year-Old Boy with a Pituitary Tumor and Skull Abnormalities
Edward R. Smith, M.D., Jay Loeffler, M.D., Madhusmita Misra, M.D., Stuart R. Pomerantz, M.D., Anat Stemmer-Rachamimov, M.D., and Miriam D. Post, M.D.
CASE RECORDS OF THE MASSACHUSETTS GENERAL HOSPITAL
Volume 359:2367-2377 November 27, 2008 Number 22
The New England of Medicine.
Conclusiones Finales.
La cefalea es un síntoma al cual el médico clínico se enfrenta cotidianamente, y una de las causas más prevalentes de consulta en la práctica ambulatoria. La etiología de la cefalea es amplia, y la patofisiología de la misma tiene su explicación en el compromiso de las estructuras sensibles al dolor (nociceptores)alojadas en la cabeza. El cerebro carece de estos nociceptores, y por lo tanto, no es, en si mismo, causa de dolor. Las áreas de la cabeza y cuello que tienen estructuras sensibles al dolor, y que por lo tanto pueden ser el origen del mismo, en forma práctica se dividen en intracraneales (vasos sanguíneos, meninges y nervios) y extracraneales (periostio del cráneo, músculos de la cabeza y cuello, nervios, arterias, venas, tejido celular subcutáneo, ojos, oídos, senos paranasales, y membranas mucosas).
Uno de los dilemas a los que el clínico se enfrenta constantemente es el de decidir qué paciente amerita estudios. Y cuando decimos estudios, nos referimos a imágenes de SNC como tomografía computada (TAC) o resonancia magnética (RMN) fundamentalmente.
Nuestra formación clínica nos indica que un buen interrogatorio, y un examen físico completo, arrojan luz sobre el origen de la cefalea en la mayoría de los casos, que en un porcentaje mayoritario nos orientan a cefalea tensional, originada en estructuras extracraneales, o migraña, con un origen del dolor asentando en estructuras neurovasculares.
Sin embargo, hoy día, la creciente disponibilidad de las imágenes, la mayor accesibilidad de las mismas para la población general, y razones médico-legales, entre otras cosas, hace que casi todos los pacientes con cefalea, sobre todo cuando nos referimos a una cefalea crónica, sean sometidos en algún momento de la evolución de su trastorno a neuroimágenes.
Más allá de que en este ateneo, el expositor aborda este aspecto del problema, dejando perfectamente establecido cuales son las situaciones en las que, sin duda uno debe estudiar una cefalea, casi se podría decir, que es de buena práctica médica solicitar alguna imagen a estos pacientes con cefalea crónica, independientemente de que tengamos perfectamente establecido el diagnóstico de jaqueca, cefalea tensional etc. Todos recordamos siempre algún caso en que un paciente presentó durante años una cefalea rotulada como migraña o fibromialgia, hasta que a alguien se le ocurrió solicitar un estudio.
En el caso de este paciente de 17 años, no quedan dudas de que ameritó estudios desde el primer momento, ya que se presentó a la consulta con cefalea, alteraciones visuales, y síntomas de disfunción endócrina.
La presencia de niveles excesivamente elevados de prolactina que inicialmente fueron de 657 ng/ml, no dejaron dudas del origen tumoral de los mismos, asociados a las neuroimágenes que mostraban un tumor pituitario con expansión extraselar y compresión del quiasma óptico. Sin embargo, la presencia de lesiones óseas destructivas en la base de cráneo asociadas a este tumor pituitario, hizo que, una vez más se enfrentaran la navaja de Occam (“porqué buscar más de un diagnóstico, si uno solo puede justificarlo todo”), y el "Dictado de Hickam" (“el pacientes pueden tener tantos diagnósticos como le venga en ganas”).
Y es aquí donde el caso nos deja más enseñanzas, sobre todo en lo referido a cuando un experto comenta el caso, y donde la sutileza en el análisis de algún elemento, y la extensa experiencia en el tema, pueden ayudar a optar entre la postura de Occam y la de Hickam. En este caso el médico asume que si toda la lesión fuese prolactinoma, el nivel de prolactina sería mucho más elevada (en el orden de miles de ng/ml), y no 600, a no ser que el grado de indiferenciación del tumor impidiera que este fabricara ese nivel de hormona.
Finalmente, otro experto, en este caso en “base de cráneo”, termina inclinando más aún la balanza en favor de la pluralidad de diagnósticos cuando establece que “el componente expansivo óseo con fracciones osteolíticas y osteoblásticas era más sugestivo de un proceso óseo primario indolente, tal como displasia fibrosa u osteoblastoma, que de un hueso invadido por tumor”
Source Information
From the Department of Neurosurgery, Children's Hospital of Boston (E.R.S.); the Departments of Radiation Oncology (J.L.), Pediatrics (M.M.), Radiology (S.R.P.), and Pathology (A.S-R., M.D.P.), Massachusetts General Hospital; and the Departments of Surgery (E.R.S.), Radiation Oncology (J.L.), Pediatrics (M.M.), Radiology (S.R.P.), and Pathology (A.S.-R., M.D.P.), Harvard Medical School.
References
1) Dooley JM, Gordon KE, Wood EP. Self-reported headache frequency in Canadian adolescents: validation and follow-up. Headache 2005;45:127-131. [CrossRef][ISI][Medline]
2) Medina LS, Pinter JD, Zurakowski D, Davis RG, Kuban K, Barnes PD. Children with headache: clinical predictors of surgical space-occupying lesions and the role of neuroimaging. Radiology 1997;202:819-824. [Free Full Text]
3) Levy MJ, Matharu MS, Meeran K, Powell M, Goadsby PJ. The clinical characteristics of headache in patients with pituitary tumours. Brain 2005;128:1921-1930. [Free Full Text]
4) Lafferty AR, Chrousos GP. Pituitary tumors in children and adolescents. J Clin Endocrinol Metab 1999;84:4317-4323. [Free Full Text]
5) Pinzone JJ, Katznelson L, Danila DC, Pauler DK, Miller CS, Klibanski A. Primary medical therapy of micro- and macroprolactinomas in men. J Clin Endocrinol Metab 2000;85:3053-3057. [Free Full Text]
6) Ciccarelli A, Daly AF, Beckers A. The epidemiology of prolactinomas. Pituitary 2005;8:3-6. [CrossRef][Medline]
7) Ciccarelli A, Guerra E, De Rosa M, et al. PRL secreting adenomas in male patients. Pituitary 2005;8:39-42. [CrossRef][Medline]
8) Hanbali F, Tabrizi P, Lang FF, DeMonte F. Tumors of the skull base in children and adolescents. J Neurosurg 2004;100:Suppl 2:169-178. [ISI][Medline]
9) Knappe UJ, Lüdecke DK. Transnasal microsurgery in children and adolescents with Cushing's disease. Neurosurgery 1996;39:484-492. [CrossRef][ISI][Medline]
10) Vergès B, Boureille F, Goudet P, et al. Pituitary disease in MEN type 1 (MEN1): data from the France-Belgium MEN1 multicenter study. J Clin Endocrinol Metab 2002;87:457-465. [Free Full Text]
11) Kontogeorgos G, Barkan AL, Watson RE Jr, Farrell WE, Lindell EP, Lloyd RV. Growth hormone producing adenoma. In: DeLellis RA, Lloyd RV, Heitz PU, Eng C, eds. World Health Organization classification of tumours. Vol. 8. Pathology and genetics of tumours of endocrine organs. Lyon, France: IARC Press, 2004:16-17.
12) Amar AP, Hinton DR, Krieger MD, Weiss MH. Invasive pituitary adenomas: significance of proliferation parameters. Pituitary 1999;2:117-122. [CrossRef][Medline]
13) Thapar K, Scheithauer BW, Kovacs K, Pernicone PJ, Laws ER Jr. p53 expression in pituitary adenomas and carcinomas: correlation with invasiveness and tumor growth fractions. Neurosurgery 1996;38:765-770. [CrossRef][ISI][Medline]
14) Unni KK, Inwards CY, Bridge JA, Kindblom LG, Wold LE. Tumors of the bones and joints. AFIP Atlas of tumor pathology. 4th series. Washington, DC: Armed Forces Institute of Pathology; 2005:126-35.
15) Malcolm AJ, Schiller AL, Schneider-Stock R. Osteoblastoma. In: Fletcher CDM, Unni KK, Mertens F, eds. World Health Organization classification of tumours. Vol. 4. Tumours of soft tissue and bone. Lyon, France: IARC Press, 2002: 262-3.
16) Lucas DR, Unni KK, McLeod RA, O'Connor MI, Sim FH. Osteoblastoma: clinicopathologic study of 306 cases. Hum Pathol 1994;25:117-134. [CrossRef][ISI][Medline]
17) Gibson SE, Prayson RA. Primary skull lesions in the pediatric population: a 25-year experience. Arch Pathol Lab Med 2007;131:761-766. [ISI][Medline]
18) Gillam MP, Molitch ME, Lombardi G, Colao A. Advances in the treatment of prolactinomas. Endocr Rev 2006;27:485-534. [Free Full Text]
19) Delgrange E, Trouillas J, Maiter D, Donckier J, Tourniaire J. Sex-related difference in the growth of prolactinomas: a clinical and proliferation marker study. J Clin Endocrinol Metab 1997;82:2102-2107. [Free Full Text]
20) Howlett TA, Wass JA, Grossman A, et al. Prolactinomas presenting as primary amenorrhoea and delayed or arrested puberty: response to medical therapy. Clin Endocrinol (Oxf) 1989;30:131-140. [CrossRef][Medline]
21) Tyson D, Reggiardo D, Sklar C, David R. Prolactin-secreting macroadenomas in adolescents: response to bromocriptine therapy. Am J Dis Child 1993;147:1057-1061. [Free Full Text]
22) Colao A, Di Sarno A, Landi ML, et al. Long-term and low-dose treatment with cabergoline induces macroprolactinoma shrinkage. J Clin Endocrinol Metab 1997;82:3574-3579. [Free Full Text]
23) Webster J, Piscitelli G, Polli A, Ferrari CI, Ismail I, Scanlon MF. A comparison of cabergoline and bromocriptine in the treatment of hyperprolactinemic amenorrhea. N Engl J Med 1994;331:904-909. [Free Full Text]
24) Zanettini R, Antonini A, Gatto G, Gentile R, Tesei S, Pezzoli G. Valvular heart disease and the use of dopamine agonists for Parkinson's disease. N Engl J Med 2007;356:39-46. [Free Full Text]
25) Colao A, Galderisi M, Di Sarno A, et al. Increased prevalence of tricuspid regurgitation in patients with prolactinomas chronically treated with cabergoline. J Clin Endocrinol Metab 2008;93:3777-3784. [Free Full Text]
26) Wakil A, Rigby AS, Clark AL, Kallvikbacka-Bennett A, Atkin SL. Low dose cabergoline for hyperprolactinaemia is not associated with clinically significant valvular heart disease. Eur J Endocrinol 2008;159:R11-R14. [Free Full Text]
27) Kars M, Delgado V, Holman ER, et al. Aortic valve calcification and mild tricuspid regurgitation but no clinical heart disease after 8 years of dopamine agonist therapy for prolactinoma. J Clin Endocrinol Metab 2008;93:3348-3356. [Free Full Text]
28) Lancellotti P, Livadariu E, Markov M, et al. Cabergoline and the risk of valvular lesions in endocrine disease. Eur J Endocrinol 2008;159:1-5. [Free Full Text]
29) Hilliard AA, Weinberger SE, Tierney LM Jr, Midthun DE, Saint S. Occam's razor versus Saint's triad. N Engl J Med 2004;350:599-603. [Free Full Text]
Suscribirse a:
Entradas (Atom)

