Una mujer de 52 años fue admitida al hospital al finalizar el verano, por un cuadro de fiebre y confusión. La paciente había estado bien hasta 9 días antes, cuando les dijo a sus familiares que no se sentía muy bien.
Durante los siguientes 4 días, desarrolló fatiga, letargia, dolor en la región de la mastoides, hormigueos en la lengua, mialgias en piernas y cefalea.
Cinco días antes de su internación, consultó con su médico de atención primaria; los resultados de los tests de laboratorio se le dijo que estaban normales. Se solicitó una TAC de mastoides.
Dos días antes de la internación, la paciente volvió del trabajo a su casa sintiéndose “agotada” y se acostó directamente. A la mañana siguiente impresionaba apática y no se levantó; su marido notó que su piel estaba caliente y le controló su temperatura que era de 39,7ºC. Le administró acetaminofeno. Más tarde ese día, un vecino notó que la paciente estaba confusa. Se llamó al servicio de emergencias, y se la transportó a otro hospital en ambulancia.
En el departamento de emergencia, la paciente estaba letárgica y desorientada, con respuestas lentas e inapropiadas a las preguntas. Su temperatura era de 37,4ºC, y el pulso de 112 por minuto; las respiraciones de 28 por minuto, y la saturación de oxígeno de 95% mientras la paciente respiraba aire ambiente. Sus pupilas eran iguales y reactivas a la luz y a la acomodación. Las mucosas estaban secas y rosadas. No había rigidez de nuca. Movía los cuatro miembros; los reflejos y la marcha no fueron explorados. El resto del examen físico fue normal. Un electrocardiograma mostró taquicardia sinusal. Los tests de función renal y hepática fueron normales. Los resultados del resto de los tests de laboratorio se muestran en la Tabla 1.

Tabla 1. Datos de laboratorio.
Clickear sobre la imagen para ampliarla
Se obtuvieron muestras de sangre para hemocultivos. Una Rx de tórax reveló una pequeña atelectasia en el pulmón derecho, y una TAC de cráneo sin contraste mostró senos paranasles con densidad normal., no había evidencias de sangrado, efecto de masa, o lesiones focales. Una punción lumbar fue llevada a cabo; los resultados del análisis del líquido cefalorraquídeo se muestra en la Tabla 2.

Tabla 2. Análisis del líquido cefalorraquídeo.
Se enviaron muestras de LCR para cultivos virales y bacterianos, PCR para virus de herpes simplex, virus del Oeste del Nilo, y tests para anticuerpos contra Borrelia burgdorferi, virus del Oeste del Nilo, y virus de la encefalitis equina.
En el reexamen realizado por un especialista en enfermedades infecciosas, existía cierta rigidez de nuca, y había dolor a la flexión del cuello.
Se comenzó con ceftriaxona (2 grs), vancomicina (1 gr), aciclovir (750 mg), y dexametasona (12 mg) fueron administrados en forma intravenosa.
Aproximadamente 3 ½ horas después de el arribo de la paciente al hospital, presentó una convulsión tónico-clónica generalizada de 20 segundos de duración. La temperatura era de 39,4ºC rectal. Se administró fosfenitoina (1g) y lorazepan (2 mg) por vía intravenosa y acetaminofeno (1000 mg) por vía rectal. Después de la convulsión, la paciente aumentó su somnolencia, y dejó de responder a los estímulos dolorosos. La tráquea fue intubada para asegurars permeabilidad de la vía aérea. Aproximadamente 5 horas después del arribo al primer hospital, fue transferida a este hospital (Hospital General de Massachusetts).
A su arribo, se obtuvo una nueva historia clínica de su esposo y otros familiares. Ella había estado bien y trabajaba en una oficina. Estaba casada, no tenía hijos, y vivía con su esposo en un área rural, boscosa con moderada cantidad de zonas pantanosas en el sudeste de Massachusetts. No había viajado fuera del estado en los últimos 5 años. No tenía alergias ni exposición reciente a tuberculosis o a personas enfermas. No tenía mascotas, ni había estado expuesta a garrapatas, roedores, o pájaros. En el pasado había comido queso no pasteurizado; tomaba alcohol socialmente pero no fumaba ni usaba drogas ilícitas. Nadaba en una piscina clorada, hacía actividades al aire libre y había sido picada por mosquitos. Sieta días antes de la admisión, su comunidad había sido fumigada en forma aérea porque se había identificado mosquitos portadores de el virus de la encefalitis equina del este. Sus padres habían fallecido; ella tenía una hermana que estaba bien.
Al examen, la paciente estaba sedada y la tráquea estaba intubada. La temperatura era de 37,7ºC, la TA de 113/57 mmHg, y el pulso de 100 por minuto. Las pupilas tenían 2 mm de diámetro, los pulmones se auscultaban claros. Había dos pápulas que parecían ser picaduras de insectos en el maléolo externo derecho y en la región del calcáneo izquierdo. El resto del examen físico no presentaba cambios.
Un screening de suero y de orina fue negativo para la investigación de toxinas; otros tests de laboratorios se muestran en la Tabla 1. Un análisis de orina mostró glucosa (2+) y el resto era normal. Se enviaron muestras de sangre y orina para cultivos. Una Rx de tórax mostró el tubo endotraqueal con la punta a nivel de la carina; había escaso volumen pulmonar con atelectasia subsegmentaria bibasal; existía un tubo nasogástrico en el estómago.
La paciente intentaba intermitentemente sentarse, por lo que se administró propofol para sedación. Fue admitida a la unidad de cuidados intensivos.
Se enviaron al Massachusetts State Laboratory Institute, muestras de sangre en busca de evidencias de infección por encefalitis equina del este y virus del Oeste del Nilo. Se continuó con vancomicina, ceftriaxona ampicilina, aciclovir, dexametasona, y difenilhidantoina; se comenzó a corregir su hiperglucemia con dosis ajustadas de insulina; se aplicó dalteparina y esomeprazol. Se comenzó a administrar esomeprazol, acetaminofeno según temperatura, y gluconato de calcio intravenoso.
Durante el primer día de hospital, la temperatura máxima fue de 38,7ºC. Las pupilas eran de 1 mm de diámetro y mínimamente reactivas a la luz; no había rigidez de nuca. Había reflejos osteotendinosos 2+ en los brazos; otros reflejos estaban ausentes, y la respuestas plantares eran en flexión (no Babinski), el resto del examen era normal. Cuando se retiró el propofol intermitentemente, la paciente movía los cuatro miembros y estaba excitada. Se llevó a cabo otra punción lumbar cuyos resultados se ven en la tabla 2.
El segundo día de internación, un monitoreo electroencefalográfico continuo reveló actividad epileptiforme que se resolvió después de que propofol fuese discontinuado, por lo que se dió un bolo de lorazepan y difenilhidantoina, seguidos por leviracetam.
Una RMN de cerebro, llevada a cabo sin administración de contraste, mostró áreas de hiperintensidad en las imágenes con FLAIR (fluid-attenuated inversion recovery), con leve efecto de masa en ambos hemisferios cerebelosos, tálamo izquierdo, ínsula izquierda y ganglios basales izquierdos. La mayoría de las lesiones tenían difusión normal a disminuida. No había evidencias de hemorragia intracraneal. Se le realizaron hisopados de fauces y de recto para cultivos virales.
El examen mostrópostura extensora de los brazos, retirada de las piernas ante estímulos dolorosos, reflejos vivos, y clonus de 8 a 12 movimientos en pies. Apareció Babinski bilateral.
Una infusión de insulina fue iniciada, y se discontinuó el uso de soluciones hipotónicas por vía intravenosa. La temperatura aumentó a 39,2ºC, aplicándosele sábanas frias para su control.
En el tercer día de internación, había postura extensora en los cuatro miembros, reflejos corneanos disminuidos, y los tests calóricos de oido izquierdo revelaron mínimos movimientos horizontales de los ojos.
Los resultados de laboratorio se muestran en la Tabla 1.
Se comenzó a infundir solución salina hipertónica y manitol, y se insertó un catéter para control de presión intracraneana. Otra RMN no mostró cambios. La temperatura máxima fue de 39,9ºC.
El cuarto día de internación se recibió el resultado de un test diagnóstico.
Diagnóstico diferencial
Una RMN de cerebro obtenida sin la administración de sustancia de contraste muestra hiperintensidad en las imágenes de FLAIR en corteza temporal, frontal, parietal, y occipital, y áreas de sustancia blanca subcorticales (mayor del lado izquierdo que derecho), en ambos hemisferios cerebelosos, y en el tálamo izquierdo, ínsula izquierda y ganglios basales izquierdos (Figura 1).
Figura 1. RMN de cerebro. 
En imágenes en FLAIR (Fluid-attenuated inversion recovery) se ve hiperintensidad con leve inflamación en el cerebelo bilateralmente (Panel A flechas), lóbulo temporal izquierdo (Panel B flecha) y lóbulos frontal y parietal izquierdos así como el núcleo caudado izquierdo (Panel D flechas)
La mayoría de las lesiones tienen leve efecto de masa y difusión normal a disminuida.
El diagnóstico diferencial de las anormalidades difusas en núcleos grises profundos y áreas corticales y subcorticales con leve efecto de masa incluye las encefalitis virales, la injuria hipóxica isquémica subaguda, glioma multifocal infiltrante, y encefalitis límbica paraneoplásica
Dr. Hirsch: La mayoría de las personas en tiempo de verano en Massachusetts piensan en la playa, navegar, y nadar. Nosotros, los médicos, en cambio, pensamos en enfermedades infecciosas por virus transmitidos por artrópodos (arbovirus). Cuando una enfermedad febril caracterizada por cefalea, rigidez de nuca, confusión, y letargia que progresa al coma, en una mujer de 52 años previamente sana de una zona rural boscosa cerca de áreas pantanosas en el sudeste de Massachusetts, pensamos en primer término en encefalitis por arbovirus.
Aunque los hallazgos clínicos sugieren fuertemente encefalitis viral, inicialmente, es importante considerar un amplio espectro de diagnósticos diferenciales, para descartar situaciones tratables que puedan poner en riesgo la vida del paciente.
Causas no infecciosas tales como stroke, o tumores cerebrales, deben ser consideradas en todo paciente con disfunción neurológica progresiva, pero los hallazgos del líquido cefalorraquídeo de esta paciente, junto con los resultados de su electroencefalograma hacen estos diagnósticos altamente improbables.
Es lejos, mucho más probable que una infección aguda del sistema nervioso central haya sido la causa de la enfermedad de esta paciente. Aunque los factores epidemiológicos y clínicos nos fuerzan a pensar en encefalitis virales, debemos primero hacer un repaso de las infecciones tratables del sistema nervioso central.
Infecciones bacterianas.
La meningitis bacteriana aguda debe siempre ser descartada cuando una enfermedad febril presente cefalea, rigidez de nuca, y síntomas y signos neurológicos rápidamente progresivos. En este caso, es apropiado comenzar rápidamente con antibióticos de amplio espectro (como se hizo en esta paciente) con antibióticos que brinden cobertura para patógenos tales como Haemophilus influenzae, Neisseria meningitidis, Streptococcus pneumoniae, y Listeria monocytogenes. Sin embargo, en el análisis del líquido cefalorraquídeo, nivel de glucosa relativamente normal, linfocitosis relativa, una coloración de Gram que fue negativa, y cultivos negativos (por lo menos durante los primeros 3 días de internación) hacen a este diagnóstico improbable.
Puede ser este síndrome, manifestación temprana de enfermedad de Lyme en sistema nervioso central? La infección por B burgdorferi es común en la zona rural de Massachusetts durante el verano, y aunque la paciente no tuvo exposición conocida a picaduras de garrapatas, tal exposición a menudo puede pasar desapercibida. Aunque tales casos son raros, los síntomas y signos neurológicos pueden ser la primera manifestación de enfermedad de Lyme, y los clásicos hallazgos de eritema migrans y artritis pueden estar ausentes. La principal manifestación neurológica de la enfermedad de Lyme temprana es la meningitis, la neuropatía craneal, y la radiculoneuropatía. (1,2) Una encefalitis fulminante como la observada en esta paciente sería inusual para enfermedad de Lyme temprana. Aún así, y como la neuroborreliosis es una enfermedad potencialmente tratable, el test en LCR para DNA de B burgdorferi o los anticuerpos están indicados solicitarlos.
Otras varias infecciones bacterianas, incluyendo sífilis, leptospirosis, y tuberculosis, así como infecciones fúngicas, no parecen probables dado el ritmo, y la agudeza de la enfermedad, los hallazgos del LCR y las manifestaciones neuroradiológicas. Los focos de infección parameningea, incluyendo abscesos de cerebro, parecen también improbables de acuerdo a la naturaleza difusa de las manifestaciones radiológicas.
Infecciones virales:
La infección por enterovirus puede complicarse con manifestaciones en sistema nervioso central durante el verano. Sin embargo, la manifestación neurológica más frecuente de los enterovirus es la meningitis aséptica autolimitada, y la encefalitis es inusual. Otras infecciones virales, incluyendo parotiditis, HIV, y coriomeningitis linfocitaria, pueden causar encefalitis, pero no hay evidencia clínica ni epidemiológica de ninguna de esas infecciones en esta paciente.
Habiendo eliminado varias causas potenciales de enfermedad en esta mujer, me concentraré en los diagnósticos que parecen ser los más probables: virus del herpes simplex (HSV), virus del Este del Nilo y encefalitis equina del este.
Virus del Herpes Simplex
La encefalitis por HSV es la más frecuentemente reconocida encefalitis esporádica en los Estados Unidos, y se han hecho muchos progresos en el desarrollo tanto de técnicas para detección temprana como tratamientos más efectivos. (3,4) En este caso fue apropiado comenzar con aciclovir mientras se esperaban los resultados de los tests diagnósticos. Sin embargo, las neuroimágenes y el electroencefalograma usualmente comprometen el lóbulo temporal en este trastorno, y las lesiones raramente son vistas en los ganglios basales y en cerebelo. (4) Más importante, la amplificación con ácidos nucleicos para HSV tipo 1 y 2 en el líquido cefalorraquídeo, una técnica altamente sensible y altamente específica, (3) fue negativa, haciendo este diagnóstico altamente improbable.
Arbovirus.
Varios elementos de la historia clínica sugieren infección por arbovirus. Ellos incluyen: residencia en un medio rural, sobre todo en áreas boscosas cerca de pantanos en el sudeste de Massachusetts, antecedentes de actividades al aire libre, picaduras recientes de mosquitos que transmiten la encefalitis equina del este. Más aún, lo que parecían picaduras de insectos fueron objetivadas en la internación. Si ella hubiese viajado a otros estados dentro de los EE UU o viajado fuera del país, la lista de diagnósticos difernciales hubiese sido mucho más amplia. (5) Sin embargo ella no había salido del estado en los últimos 10 meses o internacionalmente desde hacía más de 5 años. Bajo estas circunstancias, nuestra consideración de posible arbovirus se limita a dos candidatos.
Virus el Oeste del Nilo
Varios elementos de la enfermedad de esta paciente son compatibles con encefalitis resultante de infección con virus del Oeste del Nilo, un flavivirus del subgrupo de la encefalitis Japonesa. (6) Un sistema enzoótico entre mosquitos y pájaros mantiene y amplifica el virus del Oeste del Nilo; los mamíferos, incluyendo caballos y humanos, son incidentales huéspedes finales.
Desde su reconocimiento en 1999, (7) elvirus del Oeste del Nilo, se ha diseminado por medio de aves migratorias a través de Norteamérica, dando como resultado la más grande epidemia de encefalitis por arbovirus en la historia de los Estados Unidos.
La enfermedad neurológica asociada al virus del Oeste del Nilo, incluye meningitis, encefalitis, y una combinación de las dos. Esta infección compromete principalmente a los viejos y a los pacientes con algún grado de inmunocompromiso. (8)
Las manifestaciones clínicas de la encefalitis del Oeste del Nilo incluyen fiebre, cefalea, y alteraciones del estado mental. Temblor, mioclonías, parálisis de pares craneales, y movimientos anormales son comunes, pero las convulsiones son inusuales. (8) Una parálisis aguda fláccida idéntica a la observada en la infección por el virus de la poliomielitis es vista en esta entidad. (9) Las anomalías electroencefalográficas pueden incluir enlentecimiento generalizado, como en este caso, y los estudios de neuroimágenes son a menudo normales, particularmente al comienzo de la enfermedad, a diferencia de lo observado en este caso. (8)
Este virus es aislado anualmente en el estado de Massachusetts.
Por lo tanto debemos considerar fuertemente este diagnóstico, y asumir que el resultado del líquido cefalorraquídeo enviado para testeo de este virus será muy informativo.
Virus de la Encefalitis Equina del Este
El virus de la encefalitis equina del este es el más neuropatogénico arbovirus transmitido en los EE UU. Una amplificación enzoótica es mantenida entre pájaros y el mosquito Culiseta melanura, en áreas pantanosas del este de Norteamérica, con varias especies de mosquitos que sirven como puentes vectores hacia los mamíferos susceptibles. (Figura 2)
Figura 2. Ciclo de transmisión del virus de la Encefalitis E quina del Este.
quina del Este.
El virus de la encefalitis equina del este (EEE) es amplificado y mantenido en un ciclo entre mosquitos Culiseta melanura y pájaros. C melanura en si mismo no es consideradoser un importante vector de transmisión del virus desde los pájaros a las personas. Otras especies de mosquitos que son más agresivos para los humanos y otros mamíferos en cuanto a la capacidad de picar actuan como puentes vectores entre los pájaros y mamíferos.
Esta mujer vivía en una zona boscosa, pasaba gran parte de su vida al aire libre, había recibido picaduras de mosquitos y tenía lesiones cutáneas consistentes con picaduras de mosquitos.
El período de incubación generalmente excede 1 semana y es seguido por pródromos de fiebre, cefalea, y otros síntomas influenza-like, similar a los que tuvo esta paciente. Una vez que aparecen las manifestaciones neurológicas, el deterioro es rápido. (13) Convulsiones y signos de foco neurológico, incluyendo parálisis de pares craneales son comunes, así como también lo es la leucocitosis y la hiponatremia.
En el líquido cefalorraquídeo, el aumento de la celularidad con predominio de neutrófilos es común, mientras que la glucorraquia es normal.
El electroencefalograma inicialmente muestra enlentecimiento generalizado; más tarde, pueden ser vistas descargas epileptiformes como ocurrió en este caso. (13) La RMN muestra áreas de aumento de intensidad de señal, a menudo unilateral o asimétrica, más comúnmente en los ganglios basales y el tálamo; puede también observarse efecto d emasa cuando las lesiones son grandes, como en este caso. (13)
El diagnóstico generalmente se hace con la detección de anticuerpos IgM contra la encefalitis equina del este en el LCR, aunque la detección del RNA viral o antígenos virales es también posible. El aumento sérico del nivel de anticuerpos contra el virus confirma el diagnóstico.
Resumen
En este caso, todos los datos epidemiológicos y clínicos sugieren el diagnóstico de infección por virus de la encefalitis equina del este, aunque no se puede descartar un caso severo de encefalitis causada por infección con el virus del Oeste del Nilo. Yo no puedo diferenciar esas dos entidades en base solo a la clínica, excepto que la encefalitis equina del este suele ser más severa que la encefalitis por virus del Oeste del Nilo.
Yo creo que los resultados de los tests diagnósticos recibidos el día 4 fueron referidos al líquido cefalorraquídeo y confirnaron el diagnóstico de encefalitis equina del este.
Dr. Eric S. Rosenberg (Patología): Dr. Ning, cuál fue su impresión cuando evaluó inicialmente a esta paciente?
Dr. Ming-Ming Ning (Neurología): La impresión del grupo de neurología que vimos a este paciente fue la de una injuria cerebral cortical difusa, que dió como resultado una irritación cortical, lo cual generó las convulsiones; el compromiso talámico contribuyó también a la obnubilación de la paciente. Dado lo rápido de la progresiónde la enfermedad, el pobre status neurológico de la paciente, y el hecho de que esta paciente es joven, inmunocompetente, y que vivía en una región donde la infección por arbovirus es endémica, nosotros sospechamos una encefalitis rápidamente progresiva por arbovirus, tal como la encefalitis equina del este. La encefalitis por HSV parecía menos probable, dado que con tan extenso compromiso, no había hemorragia, que es típica de HSV.
Diagnóstico Clínico:
Encefalitis equina del este.
Diagnóstico del Dr. Martin S. Hirsch's:
Encefalitis equina del este.
Discusión patológica:
Dr. John A. Branda: Se obtuvieron muestras de líquido cefalorraquídeo al ingreso, que fueron negativas para anticuerpos contra el virus del Oeste del Nilo, y los tests para anticuerpos contra
B burgdorferi también fueron negativos. El testeo para ácidos nucleicos en líquido cefalorraquídeo fueron negativos para RNA del virus del virus del Este del Nilo, para DNA de
B burgdorferi.
Las muestras obtenidas en el otro hospital u día antes de llegar a este hospital, y las obtenidas en este hospital al ingreso fueron positivas para IgM contra virus de la encefalitis equina del este, así como también lo fueron los tests de ácidos nucleicos de virus de encefalitis equina del este. Los tests de anticuerpos IgG contra virus de encefalitis equina del este (llevados a cabo solamente en suero) fueron negativos.
Para confirmar la especificidad del anticuerpo de encefalitis equina del este, se llevó a cabo un test de neutralización en placa en una muestra de suero, que fue positiva. Estos datos de laboratorio confirmaron el diagnóstico de infección por virus de la encefalitis equina del este.
Dr. Rosenberg: Dr. DeMaria, podría describirnos algunos datos epidemiológicos de la encefalitis equina del este en Massachusetts?
Dr. Alfred DeMaria, Jr.: El año en que esta paciente adquirió encefalitis equina del este, fue el tercer año consecutivo en que el número de casos en humanos ha aumentado en Massachusetts. (Tabla 3)
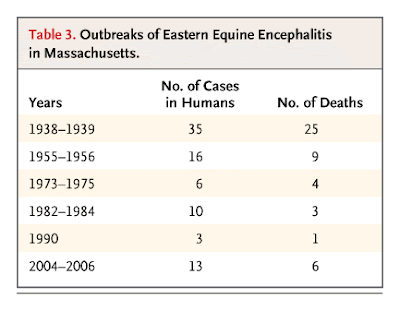
Tabla 3. Epidemia de Encefalitis Equina del Este en Massachusetts.
Desde 2004 hasta 2006, un total de 13 casos de EEE ocurrieron en el estado con 6 muertes. La infección fue adquirida en la región sudeste del estado, que es la zona mas rica en cedros y arces en zona pantanosa, que es a su vez el hábitad del mosquito C melanura y las aves migratorias que son los huéspedes intermediarios del virus. (14,15) Aunque los primeros casos en caballos se vieron en Massachusetts en 1831, el primer brote en humanos no se reportó hasta 1938. En el siglo XIX, cuando fueron talados los cedros de esa zona, que se destinó a la fabricación de tejas de arcilla, hubo una reducción del hábitat del C melanura, pero en el siglo XX, con la introducción de las tejas asfálticas, volvieron a crecer los cedros en estas húmedas tierras, facilitando posiblemente un aumento de los casos de EEE. (16)
Por razones no totalmente claras, casos de EEE en humanos en Massachusetts ocurren en ciclos que duran 2 a 3 años cada 10 a 20 años (Tabla 3) (12,14,15).
El aumento en el número de casos inmediatamente antes de que se enfermara esta paciente, motivó la fumigación aérea con fenotrina, un piretroide sintético, sobre un área amplia del sudeste de Massachusetts para reducir el número de mosquitos adultos infectados y de esa manera reducir el riesgo de infección humana. Los síntomas de esta paciente comenzaron casi simultaneamente a la aplicación aérea del pesticida, por lo que probablemente haya sido picada unos días antes de la fumigación por el mosquito. Además de la fumigación aérea, se difundieron medidas protectivas por personal de salud, y se desaconsejaron las actividades al aire libre al anochecer y al amanecer, momentos en los cuales los mosquitos son más activos; el uso consistente correcto y cuidadoso de repelentes; y la reducción de zonas donde los mosquitos se reproducen y crian alrededor de la casa.
Dr. Rosenberg: Dr. Buonanno, como está la paciente?
Dr. Ferdinando S. Buonanno (Neurología): El día 25 de internación, la paciente fue dada de alta y derivada a un hospital de rehabilitación. Yo la vi en mi consultorio alrededor de 5 meses después del alta, y en ese momento, ella seguía severamente comprometida. A pesar de medicación psicoestimulante tal como amantadina y altas dosis de metilfenidato, ella seguía estuporosa pero con estímulos se despertaba. Seguía espástica e hipertónica, con clonus no sostenido. En la visita no habló.
Dr. Thomas R. Spitzer (Onco-hematología): Existe algún avance promisorio en la terapia antiviral?
Dr. Hirsch: No hay aprobados agentes antivirales ni para la encefalitis del Oeste del Nilo ni para la EEE. Existen ensayos con interferón y globulinas hiperinmunes en encefalitis del Oeste del Nilo. Sin embargo, debido a la poca frecuencia de la EEE, no hay mucho incentivo en el desarrollo de nuevas drogas activas contra este virus.
Diagnóstico anatómico.
Encefalitis Equina del Este
FuenteFrom the Infectious Disease Service, Department of Medicine (M.S.H.), and the Departments of Radiology (P.W.S.) and Pathology (J.A.B.), Massachusetts General Hospital; the Massachusetts Department of Public Health (A.D.); and the Departments of Medicine (M.S.H.), Ambulatory Care and Prevention (A.D.), Radiology (P.W.S.), and Pathology (J.A.B.), Harvard Medical School — all in Boston.
Referencias bibliográficas
1) Pachner AR, Steere AC. The triad of neurologic manifestations of Lyme disease: meningitis, cranial neuritis, and radiculoneuritis. Neurology 1985;35:47-53. [Free Full Text]
2) Steere AC. Lyme disease. N Engl J Med 2001;345:115-125. [Free Full Text]
3) Lakeman FD, Whitley RJ, National Institute of Allergy and Infectious Diseases Collaborative Antiviral Study Group. Diagnosis of herpes simplex encephalitis: application of polymerase chain reaction to cerebrospinal fluid from brain-biopsied patients and correlation with disease. J Infect Dis 1995;171:857-863. [ISI][Medline]
4) Tyler KL. Herpes simplex virus infections of the central nervous system: encephalitis and meningitis, including Mollaret's. Herpes 2004;11:Suppl 2:57A-64A. [Medline]
5) Whitley RJ, Gnann JW. Viral encephalitis: familiar infections and emerging pathogens. Lancet 2002;359:507-514. [CrossRef][ISI][Medline]
6) Solomon T. Flavivirus encephalitis. N Engl J Med 2004;351:370-378. [Free Full Text]
7) Outbreak of West Nile-like viral encephalitis -- New York, 1999. MMWR Morb Mortal Wkly Rep 1999;48:845-849. [Medline]
8) Davis LE, DeBiasi R, Goade DE, et al. West Nile virus neuroinvasive disease. Ann Neurol 2006;60:286-300. [CrossRef][ISI][Medline]
9) Sejvar JJ, Bode AV, Marfin AA, et al. West Nile virus-associated flaccid paralysis. Emerg Infect Dis 2005;11:1021-1027. [ISI][Medline]
10) Case Records of the Massachusetts General Hospital (Case 17-2003). N Engl J Med 2003;348:2239-2247. [Free Full Text]
11) Case Records of the Massachusetts General Hospital (Case 22-2005). N Engl J Med 2005;353:287-295. [Free Full Text]
12) Hachiya M, Osborne M, Stinson C, Werner BG. Human eastern equine encephalitis in Massachusetts: predictive indicators from mosquitoes collected at 10 long-term trap sites, 1979-2004. Am J Trop Med Hyg 2007;76:285-292. [Free Full Text]
13) Deresiewicz RL, Thaler SJ, Hsu L, Zamani AA. Clinical and neuroradiographic manifestations of eastern equine encephalitis. N Engl J Med 1997;336:1867-1874. [Free Full Text]
14) Grady GF, Maxfield HK, Hildreth SW, et al. Eastern equine encephalitis in Massachusetts, 1957-1976: a prospective study centered upon analyses of mosquitoes. Am J Epidemiol 1978;107:170-178. [Free Full Text]
15) Edman JD, Timperi R, Werner B. Epidemiology of eastern equine encephalitis in Massachusetts. J Fla Mosq Control Assoc 1993;64:84-96.
16) Spielman A, D'Antonio M. Mosquito: a natural history of our most persistent and deadly foe. New York: Hyperion, 2001.



 , se reveló que todos los carcinomas adrenocorticales eran iguales o mayores a 4 cm de diámetro.
, se reveló que todos los carcinomas adrenocorticales eran iguales o mayores a 4 cm de diámetro. 














