Dr. Esperance A. Schaefer (Medicine): Una mujer de 38 años fue admitida al hospital debido a visión borrosa y dificultad respiratoria, 2 semanas después de una cesárea realizada debido a preeclampsia durante el embarazo.
La paciente había estado bien hasta aproximadamente 6 semanas antes de la internación, aproximadamente a las 22 semanas de embarazo, cuando se le hizo diagnóstico de preeclampsia en otro hospital. Diecisiete días antes de la internación, a las 25 semanas de gestación, presentó dificultad respiratoria y opresión precordial por lo que fue internada en otro hospita
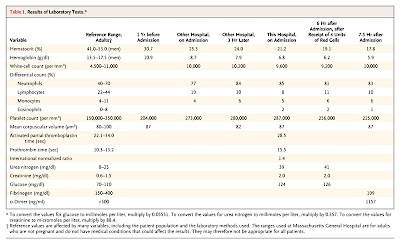
 l. La presión sanguínea era de 175/105 mmHg. Las transaminasas y el ácido úrico eran normales; los resultados de los otros resultados de laboratorio se muestran en las Tablas 1 y Tabla 2.
l. La presión sanguínea era de 175/105 mmHg. Las transaminasas y el ácido úrico eran normales; los resultados de los otros resultados de laboratorio se muestran en las Tablas 1 y Tabla 2. Una Rx de tórax reveló un aumento del intersticio y difuminación de la trama perihiliar, consistente con edema de pulmón. Una cesárea fue llevada a cabo en el tercer día de internación. El examen anatomopatológico de la placenta, reveló una placenta inmadura, que pesaba 130 grs, con infartos, a trivessel cord ,y una corionitis crónica activa. La presión sistólica mejoró después de la cesárea y de la administración de nifedipina y atenolol. El día después del parto, desarrolló visión borrosa y escotomas. Al día siguiente, la paciente fue despertada del sueño por cefalea occipital y temporal izquierda. En el examen de los ojos en estado no dilatado, un oculista encontró uveitis y una l
 esión placoide en la coroides. Se comenzó tratamiento con enoxaparina. La paciente fue dada de alta el 11º día de internación con un plan de seguimiento externo por un oftalmólogo.
esión placoide en la coroides. Se comenzó tratamiento con enoxaparina. La paciente fue dada de alta el 11º día de internación con un plan de seguimiento externo por un oftalmólogo.Cinco días más tarde, 2 días antes de la internación actual, la paciente vió al oftalmólogo . En ese momento, la agudeza visual era de 20/300 en el ojo derecho y de 20/200 en el izquierdo. Había blefaroconjuntivitis bilateral, uveitis no granulomatosa anterior, escleritis, vasculitis retiniana con hemorragias intraretinianas y exudados, y áreas placoides de hipopigmentación en la coroides; áreas de no perfusión fueron vistas por angiografía con fluoresceína. Los siguientes 2 días, se le administró una infusión intravenosa de metilprednisolona (1000 mg/día) en forma ambulatoria en otro establecimiento; la visión del ojo izquierdo mejoró después de la primera infusión. Los resultados de laboratorio se muestran en la Tabla 1 y Tabla 2.
La tarde antes de la internación, presentó tos seca y dificultad respiratoria. El día de la internación, se agregó ciclofosfamida intravenosa a la infusión de metilprednisolona; durante la infusión, la dificultad respiratoria empeoró súbitamente. La auscultación de los pulmones, reveló rales en ambas bases hasta campos medios de ambos pulmones; se le administró oxíge
 no, y se discontinuó la infusión, pero se mantuvo el acceso vascular. Se llamó al servicio de emergencias médicas que estuvo en el lugar a los 10 minutos; en el examen, la presión sanguínea era de 120/100 mm Hg; la frecuencia respiratoria era de 30 respiraciones por minuto mientras la paciente recibía 15 litros de oxígeno por minuto por medio de una máscara, y las respiraciones eran laboriosas. Los pulmones tenían sonidos respiratorios disminuídos y se auscultaban rales difusos.
no, y se discontinuó la infusión, pero se mantuvo el acceso vascular. Se llamó al servicio de emergencias médicas que estuvo en el lugar a los 10 minutos; en el examen, la presión sanguínea era de 120/100 mm Hg; la frecuencia respiratoria era de 30 respiraciones por minuto mientras la paciente recibía 15 litros de oxígeno por minuto por medio de una máscara, y las respiraciones eran laboriosas. Los pulmones tenían sonidos respiratorios disminuídos y se auscultaban rales difusos. Se le administró furosemida (40 mg intravenosos) y 2 tabletas sublinguales de nitroglicerina; la paciente se sintió mejor, y bajó la frecuencia respiratoria; fue derivada al departamento de emergencias de este hospital.
La paciente había tenido una poliartritis inflamatoria a los 14 años, y un test para anticuerpos antinucleares había sido positivo; se hizo en ese momento, diagnóstico de lupus eritematoso sistémico. Durante 3 años, ella recibió un tratamiento desconocido, después de lo cual, los síntomas se resolvieron y la medicación fue discontinuada; después de eso, la paciente no volvió a presentar síntomas. Cuatro años antes de la actual internación, desarrolló trombosis venosa profunda en la pierna izquierda, y fue tratada con anticoagulantes desde entonces, y más recientemente con heparina de bajo peso molecular. Ella no refería alergias, y su primera gesta era la reciente. Vivía con su marido; su hijo recién nacido estaba en cuidados neonatales en otro hospital. No era empleada, y era una ex-fumadora. Tenía un perro y un gato. No tomaba alcohol y no había viajado recientemente. Era blanca. Su madre estaba viva, tenía 80 años, y había tenido cáncer de mama y glaucoma; el padre de la paciente había fallecido a los 68 años, y una hermana tenía fenómeno de Raynaud.
La medicación al ingreso era nifedipina, atenolol, enoxaparina, ranitidina, sulfato de polimixina B, neomicina y una pomada oftálmica de dexametasona.
En el examen en el departamento de emergencias, la temperatura era de 36,4ºC, la presión arterial de 116/70 mm Hg, el pulso de 104 por minuto, la frecuencia respiratoria de 40 por minuto, y la saturación e oxígeno de 85% mientras la paciente respiraba aire ambiente. La conjuntiva izquierda estaba inyectada; había rales en ambas bases pulmonares , extendiéndose 273 de los campos pulmonares. Los ruidos cardiacos eran regulares, con galope por cuarto ruido; las yugulares estaban a 8 cm por encima del ángulo esternal mientras la paciente estaba a 30º; había edema en miembros inferiores. La incisión quirúrgica no estaba inflamada. Los resultados del resto del examen físico eran normales. Los electrolitos séricos, bilirrubina, aminotransferasas, y los niveles de calcio, fósforo y magnesio eran normales. Otros tests de laboratorio son mostrados en las Tabla 1 Tabla 2 y Tabla 3. Un electrocardiograma reveló alteraciones inespecíficas del segmento ST y de la onda T, y leve prolongación del intervalo QT. Una Rx de tórax reveló opacidades en parches en ambas bases pulmonares, principalmente en el derecho. Se le administró dalteparina, ceftriaxona, azitromicina, una segunda dosis de furosemida, y oxígeno por máscara. Sus síntomas mejoraron, y la saturación de oxígeno subió a 98%. La paciente fue admitida a este hospital.
En el segundo día de internación, la saturación de oxígeno era de 97% mientras respiraba aire ambiente; los datos de laboratorio se muestran en las Tabla 1, Tabla 2 y Tabla 3. Una ecografía renal no mostró cambios estructurales ni vasculares. Se le administró metilprednisolona intravenosa (500 mg) durante 3 días. Dos muestras de hemocultivos, obtenidas el segundo día de internación fueron negativos. Los antibióticos fueron discontinuados y se comenzó tratamiento con heparina no fraccionada. En el tercer y cuarto día de hospital, el gasto urinario cayó. Los resultados de laboratorio se muestran en las Tablas 1, Tabla 2 y Tabla 3. La agudeza visual era de 20/400 en ambos ojos.
En el quinto día de internación, presentó nauseas, artralgias, y edema generalizado. Un ecocardiograma transtorácico mostró dilatación ventricular izquierda e hipoquinesia ventricular izquierda difusa, con una fracción de eyección de 44%. Había moderada regurgitación mitral, insuficiencia aórtica leve, y leve elevación de la presión sistólica ventricular derecha (47 mmHg) Los tests serológicos para infección por hepatitis B y hepatitis C fueron negativos. Se discontinuó la metilprednisolona y se comenzó con prednisona por vía oral.
El sexto día de hospital, la capacidad de transporte de hierro, el colesterol total, y la el colesterol HDL eran normales; otros tests de laboratorio se muestran en las Tabla 1 y Tabla 2. La agudeza visual era de 20/200 bilateralmente.
Un procedimiento diagnóstico fue llevado a cabo.
Diagnóstico diferencial:
Dr. Colm C. Magee: Puedo ver los estudios de imágenes?
Dr. C. Stephen Foster: Tres días antes de la internación, la
 paciente tuvo inflamación ocular con escleritis, uveitis, vasculitis retiniana, y probablemente coroiditis inflamatoria. (Figura 1A) La angiografía con fluoresceína durante la fase arteriovenosa también mostró un área de tinción coroidea en el borde nasal de la papila del ojo izquierdo. (Figura 1B) El ojo derecho también tenía llenado en parches de la coroides; había un “blush coroideo” y grandes áreas de falta de llenado de la coroides. (Figura 1C) La fase tase tardía de la angiografía mostró tinción de la vasculatura coroidal, un marcador de inflamaciónde la retina y coroides (Figura 1D)
paciente tuvo inflamación ocular con escleritis, uveitis, vasculitis retiniana, y probablemente coroiditis inflamatoria. (Figura 1A) La angiografía con fluoresceína durante la fase arteriovenosa también mostró un área de tinción coroidea en el borde nasal de la papila del ojo izquierdo. (Figura 1B) El ojo derecho también tenía llenado en parches de la coroides; había un “blush coroideo” y grandes áreas de falta de llenado de la coroides. (Figura 1C) La fase tase tardía de la angiografía mostró tinción de la vasculatura coroidal, un marcador de inflamaciónde la retina y coroides (Figura 1D)En vista de la historia de lupus reportada por la paciente, mi primer diagnóstico fue coroiditis lúpica. Nosotros tratamos a la paciente con metilprednisolona intravenosa durante 3 días consecutivos, con el agregado de ciclofosfamida el tercer día.
Dr. Victorine V. Muse: La Rx de tórax llevada a cabo al arribo del paciente al departamento de emergencias, mostraba opacidades bibasales, del lado derecho más que del izquierdo. No había derrame pleural, y la silueta cardiaca era de tamaño normal. La ecografía renal llevada a cabo 24 horas más tarde no mostró anormalidades
Dr. Matthew P. Coggins: El ecocardiograma transtorácico mostró un ventrículo izquierdo hipocontráctil (Figura 2ª) El diámetro interno ventricular izquierdo es de 55 mm al final de la diástole (normal menos de 53 mm). Hay un leve engrosamiento tanto de la válvula mitral anterior como posterior. Hay un cierre incompleto de la válvula mitral durante la sístole debido a un cambio arquitectural del ventrículo izquierdo, fenómeno visto en las c
 ardiomiopatías dilatadas (como resultado de la dilatación de la cámara, los músculos papilares se separan del anillo mitral, tironeando las valvas hacia el apex alterando el cierre normal, lo cual resulta en una regurgitación mitral.
ardiomiopatías dilatadas (como resultado de la dilatación de la cámara, los músculos papilares se separan del anillo mitral, tironeando las valvas hacia el apex alterando el cierre normal, lo cual resulta en una regurgitación mitral.Un estudio de Doppler color (Figura 2B) revela un grado de regurgitación mitral mayor del que cabría esperar en base al pequeño grado de incompetencia del cierre, con 2 distintos jets de flujo regurgitante, así como una insuficiencia aórtica leve durante la diástole. Hay una leve regurgitación tricuspídea, y la presión sistólica en la arteria pulmonar estimada es de 47 mm Hg. En resumen, hay dilatación del ventrículo izquierdo e hipoquinesia difusa, moderada regurgitación mitral, leve insuficiencia aórtica, y elevación de la preseión sistólica ventricular derecha.
Dr. Magee: Esta paciente presentó visión borrosa y escotomas 1 día después de la operación cesárea realizada por severa preeclampsia; esto fue seguido por pérdida visual persistente (a pesar de la terapia con corticosteroides), dificultad respiratoria, y fallo renal progresivo. Su dificultad respiratoria se resolvió después de el aumento de su diuresis provocada por diuréticos, y fue secundaria probablemente a edema pulmonar. Los tests anormales de laboratorio incluyen FAN positivos (pero un test negativo para DNA nativo), un bajo nivel de complemento, y un bajo nivel de C4. Su ecocardiograma mostró un ventrículo izquierdo dilatado e hipoquinético, regurgitación mitral, e hipertensión pulmonar. El embolismo pulmonar es una preocupación en esta paciente, pero la TAC con material de contraste, está relativamente contraindicada debido al fallo renal.
En casos de insuficiencia renal aguda, debemos considerar causas pre-renales, renales y post-renales. Puede haber un componente pre-renal como en este caso, debido a fallo cardiaco congestivo, pero esto no explica adecuadamente el severo fallo renal. La ausencia de hidronefrosis, descarta el componente post-renal. Así, al menos una causa intrarenal debe estar presente. La moderada proteinuria sugiere enfermedad glomerular, pero puede también reflejar una endoteliosis glomerular asociada a preeclampsia, incompletamente resuelta.
El diagnóstico diferencial de enfermedad inflamatoria ocular y enfermedad intrarenal aguda en las primeras 2 semanas del posparto es amplio, pero hay varios elementos en este caso que ayudan a estrechar el diagnóstico diferencial. Primero, los tests de laboratorio sugieren que la paciente tiene alguna forma de enfermedad del tejido conectivo. Segundo, la preeclampsia ocurrió relativamente temprano en el embarazo, y fue severa. Tercero, a pesar de dosis masivas de corticosteroides, , su condición ocular, no mejoró, y su función renal, de hecho, empeoró. Ella probablemente tiene una condición que afecta múltiples órganos simultaneamente: los ojos, el corazón, los pulmones, y los riñones. Finalmente, los resultados de los análisis de orina llevados a cabo en este hospital, son sugetsivos de injuria tubular aguda, más que de glomerulonefritis.
Imfecciones.
La progresión de la enfermedad, a pesar del tratamiento con corticosteroides, el recuento alto de glóbulos blancos al arribo a este hospital, y el alto nivel sérico de IgM, aumentan la posibilidad de infección. Sin embargo, no hay fiebre, y los hemocultivos son negativos. No se vieron vegetaciones en el ecocardiograma. Más aún, es difícil explicar el patrón de afectación multiorgánico en base solo a infección.
Sarcoidosis:
La sarcoidosis es una causa bien conocida de uveitis anterior y posterior. El compromiso renal severo y el compromiso cardiaco pueden ocurrir, pero son raros. No hay elementos en la Rx de tórax sugestivos de sarcoidosis. La ausencia de hipercalcemia y el rápido empeoramiento de la función renal a pesar del tratamiento con corticosteroides, hacen a este diagnóstico improbable.
Lupus eritematoso sistémico:
Una severa exacerbación del lupus (incluyendo glomerulonefritis lúpica) deben ser consideradas, ya que la paciente había previamente recibido el diagnóstico de lupus eritematoso sistémico, los FAN permanecían positivos, y la paciente tuvo artralgias y niveles de C4 bajos. Sin embargo, el anti DNA-nativo fue negativo (un hallazgo inusual en pacientes con glomerulonefritis lupica agresiva), y el rápido empeoramiento de la glomerulonefritis lúpica a pesar de dosis masivas de corticosteroides sería un evento inusual.
Nefritis túbulo-intersticial aguda y uveítis (síndrome TINU)
Esta rara condición, típicamente afecta mujeres, y está caracterizado por uveitis y nefritis tubulointersticial. La enfermedad renal es usualmente leve y responde a los corticosteroides. Los pulmones, y el corazón no se ven afectados. Por lo tanto, este diagnóstico es improbable.
Granulomatosis de Wegener o poliangeitis microscópica:
En una paciente con severa enfermedad multiorgánica, tal como esta paciente, la vasculitis de pequeños vasos debida a granulomatosis de Wegener o poliangeitis microscópica estarían asociados con evidencias serológicas de anticuerpos anti-mieloperoxidasa o anti-proteinasa 3. Estos tests fueron negativos. (El hallazgo de ANCA-p es un falso positivo debido a la presencia de anticuerpos antinucleares). Así, esta condición es improbable.
Crioglobulinemia:
Una pequeña cantidad de crioglobulinas tipo-1 fue encontrada en el suero de esta paciente. La crioglobulinemia tipo 1 puede causar simultaneamente enfermedad del ojo y del riñón, usualmente por medio de trombosis o hiperviscosidad, más que de inflamación. La crioglobulinemia tipo 1 está usualmente asociada a macroglobulinemia de Waldenstrom o mieloma múltiple. Sin embargo, estos trastornos se ven en pacientes mayores, y además, esta paciente no tenía otros elementos como la presencia de paraproteínas en la inmunofijación de una muestra de suero. Más aún, el patrón de compromiso multiorgánico no es típico de crioglobulinemia tipo 1.
Síndrome antifosfolipídico:
El síndrome antifosfolipídico está caracterizado por trombosis vascular (arterial o venosa) o morbilidad durante el embarazo (prematurez debido a severa preeclampsia, o abortos espontáneos recurrentes) y l
 a presencia de de ciertos anticuerpos en el suero en al menos 2 oportunidades, con 12 semanas de diferencia. (1)
a presencia de de ciertos anticuerpos en el suero en al menos 2 oportunidades, con 12 semanas de diferencia. (1)Hay varios hallazgos en este caso, que sugieren síndrome antifosfolipídico agudo severo.
Primero: la paciente tiene un antecedente de enfermedad de tejido conectivo, lo que aumenta el riesgo de síndrome antifosfolipídico secundario.
Segundo: ella tiene antecedentes de trombosis venosa profunda. Sería importante saber si cuando tuvo el episodio trombótico se llevó a cabo el test de anticuerpo antifosfolipídico.
Tercero: ella tuvo una precoz y severa preeclampsia.
Cuarto: la enfermedad ocular fulminante desarrolló solo 1 día después del parto, un período de hipercoagulabilidad para cualquier paciente, pero mucho más para esta, ya que la anticoagulación debió haberse suspendido por la operación cesárea. Las exacerbaciones del síndrome antifosfolipídico durante el período de hipercoagulabilidad posparto están perfectamente descriptos. En este caso, el fallo renal progresivo, a pesar de la inmunosupresión, impresiona obedecer más a un cuadro trombótico que a una enfermedad inflamatoria. Finalmente, el patrón de compromiso multiorgánico, sugiere un síndrome antifosfolipídico severo; los títulos de anticardiolipinas IgG e IgM son relativamente altos, y hay alguna correlación entre el nivel de los títulos y la severidad de la enfermedad. Sería útil saber si la paciente también tenía algunos cambios en piel sugestivos de esta enfermedad, tal como livedo reticularis.
La enfermedad del ojo en este caso es claramente inflamatoria en naturaleza. Es esto consistente con síndrome antifosfolipídico? Si. La enfermedad ocular asociada a la presencia de anticuerpos anticardiolipinas es típicamente una enfermedad inflamatoria y no trombótica. (2) El síndrome antifosfolipídico puede también explicar la cardiomiopatía, el engrosamiento y la regurgitación de la válvula mitral, y probablemente la hipertensión pulmonar. (3) De hecho, en vista de la agudeza severidad, y naturaleza multiorgánica de la condición de esta paciente, es probable que se tate de un síndrome antifosfolipídico catastrófico. (Tabla 4). (4)
La ausencia de anticoagulante lúpico y trombocitopenia es inusual en pacientes con síndrome antifosfolipídico catastrófico, pero ha sido reportado. (5)
Ya que los resultados de los tests de laboratorio no son típicos de microangiopatía trombótica (la paciente no tiene trombocitopenia, esquistocitosis, o bajos niveles de haptoglobina sérica), deben considerarse formas alternativas de compromiso renal por síndrome antifosfolipídico. En casos raros, el síndrome antifosfolipídico se asocia a trombosis bilateral de las arterias o de las venas renales, aunque en este caso, la ausencia de dolor en el flanco, inicio abrupto de anuria, o macrohematuria, o proteinuria masiva, descartan en principio estos mecanismos como causa.
Yo creo que el procedimiento diagnóstico que se llevó a cabo fue una biopsia renal, y que la biopsia tiene elementos de síndrome antifosfolipídico agudo o subagudo. Hay probablemente evidencias también de injuria tubular aguda (consistente con la historia de fallo cardiaco congestivo y cilindros granulosos en el sedimento). La endoteliosis glomerular residual y aún una leve glomerulonefritis por complejos inmunes (el último sugerido por el fenotipo de enfermedad de tejido conectivo y el bajo nivel de C4 sérico) pueden también estar presentes, pero los hallazgos predominantes deberían ser por injuria tubular aguda por síndrome antifosfolipídico.
El síndrome antifosfolipídico catastrófico conlleva el riesgo de muerte. Además de las terapias de sostén, el tratamiento usualmente comprende altas dosis de corticosteroides, intercambio de plasma, IgG intravenosa y anticoagulación sistémica.
Finalmente, sería útil saber si había evidencias de leucoencefalopatía posterior en las imágenes de cerebro; estas pueden estar asociadas a preeclampsia severa o a síndrome antifosfolipídico, y causa ceguera cortical, que puede haber exacerbado la alteración de la visión que ya tenía esta paciente por la severa afectación oftálmica.
Dr. Nancy Lee Harris (Patología): Dr. Niles, podría usted decirnos su opinión acerca del procedimiento diagnóstico?
Dr. John L. Niles (Nefrología): Nosotros consideramos dos diagnósticos: el síndrome antifosfolipídico y la crioglobulinemia. Para distinguir entre ambos, llevamos a cabo una biopsia renal.
Diagnóstico clínico:
Síndrome antifosfolipídico catastrófico.
Diagnóstico del Dr. Colm C. Magee.
Síndrome antifosfolipídico catastrófico con compromiso de múltiples órganos.
Discusión patológica
Dr. Robert B. Colvin: La muestra de la biopsia renal consistió en tres muestras, con un total de más de 30 glomérulos. No había evidencias de enfermedad renal crónica o enfermedad vascular hipertensiva. Pocos glomérulos tenían una marcada inflamación endotelial y células espumosas (endoteliosis) (Figura 3A), hallazgos característicos de preeclampsia. (6,7,8)
Sin embargo, el hallazgo más importante, no puede ser explicado solo por la preeclampsia y era la microangiopatía trombótica. A
 lrededor de 1/3 de los glomérulos mostraron necrosis segmentaria (Figura 3B) o marcada congestión (“parálisis glomerular”) (Figura 3C). Había ocasionales cilindros eritrocitarios (Figura 3B), que no son comunes en casos de microangiopatía trombótica (9) y son a veces encontrados en el riñón pero no en la orina, como en esta paciente. Varias pequeñas arterias y arteriolas contenían trombos frescos de fibrina (Figura 3B). La necrosis cortical focal afectaba al 10 a 20% de la muestra, con células epiteliales desprendidas de los túbulos. (Figura 3C). Pocas arteriolas y pequeñas arterias tenían células tenían células rojas fragmentadas atrapadas en la íntima o engrosamiento de la íntima con pérdida celular.
lrededor de 1/3 de los glomérulos mostraron necrosis segmentaria (Figura 3B) o marcada congestión (“parálisis glomerular”) (Figura 3C). Había ocasionales cilindros eritrocitarios (Figura 3B), que no son comunes en casos de microangiopatía trombótica (9) y son a veces encontrados en el riñón pero no en la orina, como en esta paciente. Varias pequeñas arterias y arteriolas contenían trombos frescos de fibrina (Figura 3B). La necrosis cortical focal afectaba al 10 a 20% de la muestra, con células epiteliales desprendidas de los túbulos. (Figura 3C). Pocas arteriolas y pequeñas arterias tenían células tenían células rojas fragmentadas atrapadas en la íntima o engrosamiento de la íntima con pérdida celular.En la inmunofluorescencia, no había depósitos de IgG en los glomérulos, eliminando el diagnóstico de glomerulonefritis lúpica. Había moderado depósito de IgM (Figura 3D) Y C3 en el mesangio glomerular a lo largo de la membrana basal glomerular, así como prominentes depósitos segmentarios de fibrina (Figura 3D), pero no había IgAo C1q. Las IgM y la fibrina estaban también en las pequeñas arterias, un hallazgo típico de microangiopatía trombótica.
En la tinción con inmunoperoxidasa, el fragmento de complemento C4d estaba fuertemente depositado a lo largo de las paredes capilares glomerulares (Figura 3E). Los capilares peritubulares eran negativos para C4d. Usando la misma técnica de tinción, nosotros encontramos depósitos glomerulares de C4d en muestras de otras 2 o 3 pacientes con preeclampsia, pero en ninguna de las muestras de 6 pacientes con microangiopatía trombótica no relacionada con el embarazo. Así, la preclampsia, puede explicar el Cd4, pero los datos son muy limitados para sacar conclusiones. Reportes previos han notado bajo nivel sérico de C4 en pacientes con preeclampsia, (10,11) y en un paciente con preclampsia, el Cd4 fue detectado en secciones de glomérulos. (12)
La microscopía electrónica reveló hallazgos típicos de microangiopatía trombótica. Ellos incluian pérdida segmentaria de las células endotelio-capilares glomerulares, con colapso de los capilares u oclusión con material granular y restos celulares (Figura 3F)
Este caso es típico de la condición descripta por Robson y col. (9) en un Case Record (13) como fallo renal posparto. Las lesiones arteriales y los trombos y necrosis glomerulares distinguen este trastornode los cambios endoteliales glomerulares usuales de la preeclampsia, y son característicos del síndrome antifosfolipídico. (14,15,16) Las mujeres que tienen síndrome antifosfolipídico a menudo se presentan con fallo renal posparto, (17) como lo hizo esta paciente.
Las células endoteliales glomerulares son un target común en la preeclampsia y en la microangiopatía trombótica. La preeclampsia es considerada ser promovida por el bloqueo soluble de receptores del factor de crecimiento endotelio vascular, y la microangiopatía trombótica ha sido causada por tratamientos con bloqueantes del factor de crecimiento endotelio vascular. (18,19)
Dr. Harris: Dr. Muse, podría describir los estudios de imágenes cerebrales, que fueron llevados a cabo después del procedimiento diagnóstico?
Dr. Muse: LaRMN de cerebro, llevada a cabo sin el uso de material de contraste, mostró infartos occipitales bilaterales crónicos, pero no mostró cambios típicos de la leucoencefalopatía posterior reversible.
Dr. Harris: Dr. Niles, podría decirnos que pasó con la paciente durante la internación?
Dr. Niles: El fallo renal agudo cuando yo vi a la paciente, era de rápido desarrollo, y requirió diálisis en el término de 24 horas. La ciclofosfamida y los corticoides fueron continuados, y se comenzó a realizar recambios de plasma. Ella estaba ansiosa de volver a su hospital para estar con su bebé. Fue dada de alta el día 24 de internación, mientras todavía estaba requiriendo diálisis, sin evidencias de recuperación renal.
Dr. Harris: Dr. Amrein, podría comentarnos como fue el manejo del síndrome antifosfolipídico en esta paciente?
Dr. Philip C. Amrein (Onco-hematología): El pronóstico de los pacientes con síndrome antifosfolipídico catastrófico es malo; 46% de los pacientes mueren durante el evento inicial, de acuerdo a las revisiones. (20) Algún mejoramiento en los resultados han sido encontrados con el uso de anticoagulación, corticosteroides, recambio de plasma, todos los cuales fueron usados en esta paciente. Además, se agregó rituximab, que ha sido reportado como causando algún beneficio. (21)
Dr. Harris: Dr. Foster, podría darnos su impresión?
Dr. Foster: Cinco meses después del alta, su agudeza visual ha mejorado desde la ceguera legal a 20/50 en ojo derecho y a 20/25 en el ojo izquierdo. La inflamación ocular se resolvió, y las cicatrices coroidoretinales y atrofia permanecen. A pesar de la presencia de lesiones occipitales en las imágenes de cerebro, la pérdida de visión fue totalmente explicada por las alteraciones patológicas de la coroides y la retina. Ella fue sometida a sesiones de hemodiálisis 3 veces por semana, y recibe infusiones mensuales de rituximab y está anticoagulada con warfarina sódica. Su nivel de creatinina es de 3,5 mg/dl.
Dr. Michael Laposata (Patología): Quisiera detenerme en dos puntos:
Primero, el test negativo para anticoagulante lúpico no descarta el síndrome antifosfolipídico. Nosotros debemos investigar todos los anticuerpos antifosfolipídicos, incluyendo anticoagulante lúpico, IgG e IgM anticardiolipina, y IgG y IgM anti-beta-2 glicoproteina 1; a mayor cantidad de anticuerpos, mayor riesgo trombótico.
Segundo, podría haberse realizado un perfil completo de hipercoagulabilidad. Si la paciente tiene factor V Leiden, la mutación 20210 de la protrombina, o deficiencias en la proteína C o S, o antitrombina, su riesgo trombótico es aún mayor, y esto tiene implicacancias en la duración de la anticoagulación.
Dr. Harris: Usted piensa que el episodio previo de trombosis venosa previa y su reciente preeclampsia tienen relación con el síndrome antifosfolipídico crónico?
Dr. Niles: Yo pienso que es muy probable.
Dr. Isaac E. Stillman (Patología, Beth Israel Deaconess Medical Center): Creo que es más probable que ella tuviera síndrome antifosfolipídico más que preeclampsia desde el principio. Los hallazgos clínicos de las pacientes con preeclampsia son relativamente inespecíficos, y hay una comprensible resistencia a llevar a cabo una biopsia renal durante el embarazo. Como resultado de ello, hay una tendencia a adscribir todas las patologías renales de reciente comienzo durante el embarazo a preeclampsia. Sin embargo, un estudio (22) mostró que el diagnóstico clínico de preeclampsia, cuando se realizó antes de la semana 37 de gestación (como en esta paciente) está más a menudo equivocado que correcto. Este caso ejemplifica porqué la biopsia renal permanece necesaria para el diagnóstico definitivo de preeclampsia.
Dr. Nina Rubin-Tolkoff (Medicina Interna): Deben los pacientes con síndrome antifosfolipídico recibir anticoagulación durante el embarazo?
Dr. Amrein: No está claro si los pacientes con anticuerpos anticardiolipinas y sin historia de trombosis necesitan recibir terapia anticoagulante durante el embarazo, pero muchos clínicos recomiendan el uso de aspirina. Nuestra paciente tuvo un episodio de trombosis venosa profunda antes del embarazo. En una gran serie prospectiva de tales pacientes, (23) el riesgo de trombosis durante el embarazo fue de 5%. La anticoagulación en este contexto ha mostrado beneficios; así, el American College of Chest Physicians actualmente recomienda el uso de aspirina y heparina subcutánea o de bajo peso molecular durante todo el embarazo y hasta 6 semanas después del parto. (24)
Dr. Joseph Bonventre (Nefrología, Brigham and Women's Hospital): En vista de la necrosis cortical vista en la biopsia de esta paciente, podría esperarse algún grado de recuperación de su función renal?
Dr. Colvin: Más del 90% de los pacientes que tienen necrosis cortical no se recuperan. Además, la presencia de trombos en las arterias, así como en los glomérulos sugiere un mal pronóstico.
Diagnóstico anatómico:
Fallo renal posparto debido a microangiopatía trombótica asociada con anticuerpos antifosfolipídicos
Traducción de:
Case 2-2008 — A 38-Year-Old Woman with Postpartum Visual Loss, Shortness of Breath, and Renal Failure
Colm C. Magee, M.D., Matthew P. Coggins, M.D., C. Stephen Foster, M.D., Victorine V. Muse, M.D., and Robert B. Colvin, M.D.
Volume 358:275-289. January 17, 2008. Number 3
Fuente
From the Renal Division, Brigham and Women's Hospital (C.C.M.); the Division of Cardiology (M.P.C.) and Departments of Radiology (V.V.M.) and Pathology (R.B.C.), Massachusetts General Hospital; and the Departments of Medicine (C.C.M., M.P.C.), Ophthalmology (C.S.F.), Radiology (V.V.M.), and Pathology (R.B.C.), Harvard Medical School — all in Boston; and the Immunology and Uveitis Foundation and the Massachusetts Eye Research and Surgery Institute, Cambridge, MA (C.S.F.).
References
1) Miyakis S, Lockshin MD, Atsumi T, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost 2006;4:295-306. [CrossRef][ISI][Medline]
2) Miserocchi E, Baltatzis S, Foster CS. Ocular features associated with anticardiolipin antibodies: a descriptive study. Am J Ophthalmol 2001;131:451-456. [CrossRef][ISI][Medline]
3) Cervera R, Piette JC, Font J, et al. Antiphospholipid syndrome: clinical and immunologic manifestations and patterns of disease expression in a cohort of 1,000 patients. Arthritis Rheum 2002;46:1019-1027. [CrossRef][ISI][Medline]
4) Asherson RA, Cervera R, de Groot PG, et al. Catastrophic antiphospholipid syndrome: international consensus statement on classification criteria and treatment guidelines. Lupus 2003;12:530-534. [Free Full Text]
5) Asherson RA, Cervera R, Piette JC, et al. Catastrophic antiphospholipid syndrome: clues to the pathogenesis from a series of 80 patients. Medicine (Baltimore) 2001;80:355-377. [CrossRef][Medline]
6) Strevens H, Wide-Swensson D, Hansen A, et al. Glomerular endotheliosis in normal pregnancy and pre-eclampsia. BJOG 2003;110:831-836. [ISI][Medline]
7) Spargo B, McCartney CP, Winemiller R. Glomerular capillary endotheliosis in toxemia of pregnancy. Arch Pathol 1959;68:593-599. [ISI][Medline]
8) Gaber LW, Spargo BH, Lindheimer MD. Renal pathology in pre-eclampsia. Baillieres Clin Obstet Gynaecol 1994;8:443-468. [CrossRef][ISI][Medline]
9) Robson JS, Martin AM, Ruckley V, Macdonald MK. Irreversible post-partum renal failure: a new syndrome. Q J Med 1968;37:423-435. [ISI][Medline]
10) Abramson SB, Buyon JP. Activation of the complement pathway: comparison of normal pregnancy, preeclampsia, and systemic lupus erythematosus during pregnancy. Am J Reprod Immunol 1992;28:183-187. [ISI][Medline]
11) Buyon JP, Cronstein BN, Morris M, Tanner M, Weissmann G. Serum complement values (C3 and C4) to differentiate between systemic lupus activity and pre-eclampsia. Am J Med 1986;81:194-200. [CrossRef][ISI][Medline]
12) Joyama S, Yoshida T, Koshikawa M, et al. C4d and C4bp deposition along the glomerular capillary walls in a patient with preeclampsia. Am J Kidney Dis 2001;37:E6-E6. [Medline]
13) Case Records of the Massachusetts General Hospital (Case 2-1973). N Engl J Med 1973;288:93-99. [ISI][Medline]
14) Nochy D, Daugas E, Hill G, Grünfeld JP. Antiphospholipid syndrome nephropathy. J Nephrol 2002;15:446-461. [ISI][Medline]
15) Nochy D, Daugas E, Droz D, et al. The intrarenal vascular lesions associated with primary antiphospholipid syndrome. J Am Soc Nephrol 1999;10:507-518. [Free Full Text]
16) Piette JC, Cacoub P, Wechsler B. Renal manifestations of the antiphospholipid syndrome. Semin Arthritis Rheum 1994;23:357-366. [CrossRef][ISI][Medline]
17) Espinosa G, Bucciarelli S, Cervera R, et al. Thrombotic microangiopathic haemolytic anaemia and antiphospholipid antibodies. Ann Rheum Dis 2004;63:730-736. [Free Full Text]
18) Frangié C, Lefaucheur C, Medioni J, Jacquot C, Hill GS, Nochy D. Renal thrombotic microangiopathy caused by anti-VEGF-antibody treatment for metastatic renal-cell carcinoma. Lancet Oncol 2007;8:177-178. [CrossRef][ISI][Medline]
19) Eremina V, Sood M, Haigh J, et al. Glomerular-specific alterations of VEGF-A expression lead to distinct congenital and acquired renal diseases. J Clin Invest 2003;111:707-716. [CrossRef][ISI][Medline]
20) Erkan D, Asherson RA, Espinosa G, et al. Long term outcome of catastrophic antiphospholipid syndrome survivors. Ann Rheum Dis 2003;62:530-533. [Free Full Text]
21) Rubenstein E, Arkfeld DG, Metyas S, Shinada S, Ehresmann S, Liebman HA. Rituximab treatment for resistant antiphospholipid syndrome. J Rheumatol 2006;33:355-357. [Free Full Text]
22) Ihle BU, Long P, Oats J. Early onset pre-eclampsia: recognition of underlying renal disease. Br Med J (Clin Res Ed) 1987;294:79-81. [Medline]
23) Branch DW, Silver RM, Blackwell JL, Reading JC, Scott JR. Outcome of treated pregnancies in women with antiphospholipid syndrome: an update of the Utah experience. Obstet Gynecol 1992;80:614-620. [ISI][Medline]
24) Bates SM, Greer IA, Hirsh J, Ginsberg JS. Use of antithrombotic agents during pregnancy: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004;126:Suppl:627S-644S. [CrossRef][ISI][Medline]