Paciente de 72 años derivado de una localidad vecina
se interna en el hospital Pintos de Azul con una tumoración en región esternal
de 3 meses de evolución.
Según el paciente, quien no presenta antecedentes
clínicos, ni personales ni familiares, y que se desempeñó toda su vida en
tareas rurales, comienza hace 3 meses con la aparición de una tumoración en
región medioesternal que tuvo un más rápido crecimiento en los últimos 45 días.
La misma es indolora. No refiere síntomas sistémicos, fiebre, sudoración
nocturna, ni adelgazamiento.
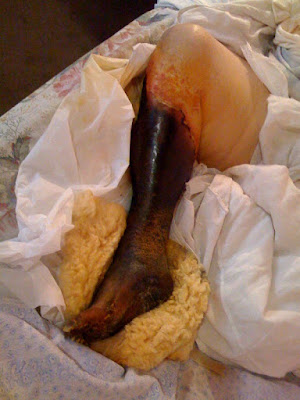
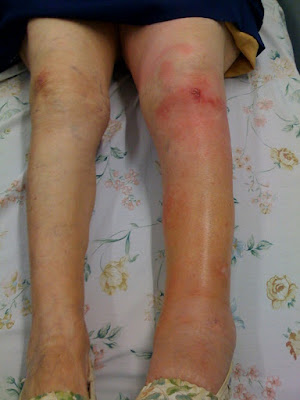
En el examen físico se palpa una masa localizada en
región esternal media de 15 cm de largo por 10 cm de ancho y 8 cm de altura, dura
con leve aumento de temperatura en su superficie, que despierta dolor leve, en
la región medioesternal. La masa está firmemente adherida a los planos óseos.
El resto del examen es normal
En el laboratorio presenta: GR 3410000/mm3. GB
7700/mm3 con fórmula normal Hb 10,3. Hto 31% Plaquetas 407000/mm3. Urea 44 mg%,
creatinina 1,1 mg%. VSG 5 mm/hora. Proteínas totales 10,6 Gr/dl Albúmina 3,3
Gr/dl, se solicitó proteinograma electroforético. Hepatograma s/p FAL 275 mg%
(250) Proteinuria de Bence Jones negativa.
Se solicitaron Rx de cráneo, columna, pelvis, que no
mostraron anormalidades. En la Rx de tórax presenta pequeño derrame pleural
derecho y seudo ensanchamiento mediastínico por masa localizada en región
anterior de tórax. Los bordes del esternón no se ven con claridad en el perfil
de la Rx de tórax
 |
| Se llevó a cabo biopsia quirúrgica de la masa. |
 |
| La Masa proyectada en la radiografía de tórax de frente da la imagen de pseudoensanchamiento mediastinal. |
 |
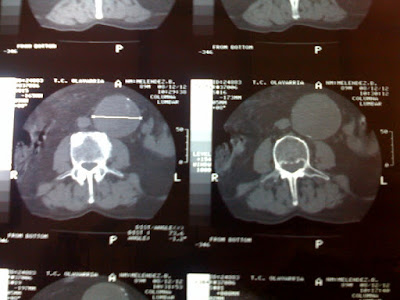
| TC de tórax. A nivel preesternal se observa una masa con densidad de partes blandas. |
Se llevó a cabo una PAMO y una biopsia quirúrgica de
la masa preesternal que mostró los siguientes resultados: Análisis
histopatológico: proliferación linfoide monomorfa de células de mediano tamaño
con núcleos leptocromáticos y nucleolos prominentes. Inmunomarcación: CD45(+)
CD20(-) CD3(-) CD79(+)
Conclusión : Plasmocitoma poco diferenciado
Se espera el resultado de PAMO y proteinograma
electroforético. Se está evaluando si se trata de un mieloma múltiple o de un
plasmocitoma óseo localizado.
Se recibió resultado de PAMO que informa médula ósea
normal y 1% de células plasmáticas, por lo que se confirma el diagnóstico de
plasmocitoma óseo solitario
Plasmocitoma
Un plasmocitoma es una masa solitaria de células
plasmáticas neoplásicas monoclonales que se encuentra a nivel óseo
(plasmocitoma óseo solitario) o en tejidos blandos (plasmocitoma extramedular).
Para simplificar, los plasmocitomas solitarios
pueden ser divididos en 2 grupos de acuerdo a su localización:
1) Plasmocitomas óseos
2) Plasmocitomas extramedulares
Criterios diagnósticos para plasmocitoma óseo
solitario:
Los criterios para identificar plasmocitoma óseo
solitario varía entre los autores. (1,2,3) Algunos incluyen pacientes con más
de una lesión y niveles elevados de proteínas de mieloma y excluyen pacientes
cuya enfermedad progresó dentro de los dos años o cuyo nivel de proteinemia
persistió después de la radioterapia. Con el uso de RMN, citometría de flujo,
reacción en cadena de polimerasa (PCR) los criterios actualmente aceptados son
como sigue (4,5)
1) Área única de destrucción ósea debido a células
plasmáticas clonales.
2) Infiltración de células plasmáticas en médula
ósea que no exceden del 5% de las células nucleadas
3) Ausencia de lesiones óseas líticas u otro
compromiso tisular (no evidencia de mieloma)
4) Ausencia de, anemia, hipercalcemia o
insuficiencia renal atribuibles a mieloma
5) Baja, si es que está presente, concentración de
proteínas monoclonales séricas o urinarias
6) Niveles preservados de inmunoglobulinas no
comprometidas
Criterios diagnósticos de plasmocitoma extramedular:
Los criterios diagnósticos de plasmocitoma
extramedular son como sigue (6)
1) Biopsia tisular que muestra células plasmáticas
monoclonales (histología)
2) Infiltración de médula ósea por células
plasmáticas que no excedan de 5% de todas las células nucleadas
3) Ausencia de lesiones óseas líticas o compromiso
de otros tejidos (ausencia de mieloma)
4) Ausencia de hipercalcemia o insuficiencia renal
5) Baja concentración de proteína M, si está
presente
Patofisiología
El plasmocitoma puede asentar en cualquier parte del
cuerpo. Un plasmocitoma óseo solitario deriva de las células plasmáticas
localizadas en médula ósea, mientras que el plasmocitoma extramedular se
considera que deriva de las células plasmáticas de las superficies mucosas. (7)
Ambas representan un grupo diferente de neoplasias en términos de localización,
progresión tumoral, y tasa de sobrevida(8,9) Algunos autores sugieren que el
plasmocitoma óseo solitario representa linfoma de células marginales con
diferenciación plasmocitaria extensa. (9)
Tanto el plasmocitoma óseo solitario como el
plasmocitoma extramedular sin embargo, comparten muchos de los elementos
biológicos de otras células plasmáticas.
Los estudios citogenéticas muestran pérdida
recurrente en el brazo largo del cromosoma 13 y en el brazo corto del cromosoma
14, así como ganancias en el brazo largo del cromosoma 19, largo del 9 y corto
del 1. (10) La interleukina 6 (IL-6) es todavía considerada el principal factor
de crecimiento en la progresión de los trastornos de células plasmáticas. (5)
Los roles específicos de los marcadores de
superficie, moléculas de adhesión y angiogénesis en plasmocitoma solitario,
necesitan ser estudiados más.
En un estudio de Kumar y col, el alto grado de
angiogénesis en plasmocitoma óseo solitario, estuvo asociado a progresión mas
rápida a mieloma múltiple. Algunos han postulado que el plasmocitoma óseo
solitario es un paso intermedio desde la gamapatía monoclonal de significado
incierto (MGUS) a mieloma múltiple. (5)
Frecuencia:
Los plasmocitomas óseos solitarios representan menos
del 5% de las gamapatías monoclonales (4,5), y el plasmocitoma extramedular el
3% de las mismas.
Morbi/mortalidad:
1) El plasmocitoma óseo solitario evoluciona a
mieloma múltiple en 50 a 60% de los pacientes. (12) La sobrevida media es de 10
años. (13)
2) El plasmocitoma solitario extramedular evoluciona
a mieloma múltiple en 11-30% de los pacientes a los 10 años. La sobrevida a 10
años es 70%
Sexo:
El plasmocitoma óseo solitario tiene una relación
hombre/mujer de 2:1
Tres cuartas partes de los extramedulares afectan a
los hombres.(6,7,13,14,15)
Edad:
Para ambos (óseo y extramedular la edad de
presentación es 55 años., 10 años mas jóvenes que el mieloma múltiple.
(6,7,13,14,15)
Clínica:
Plasmocitoma óseo solitario
El síntoma mas común es el dolor en el sitio de la
lesión esquelética debido a la destrucción ósea por infiltración con células
plasmáticas tumorales. (5,16)
Fracturas de cuerpos vertebrales lumbares y dorsales
pueden producir dolor severo por compresión. Algunos pacientes pueden
experimentar compresión de las raíces o de la médula espinal. (5) La compresión
de la médula representa una emergencia oncológica/neuroquirúrgica que requiere
inmediato diagnóstico y tratamiento para evitar daño definitivo. (paraplejia,
disfunción vesical e intestinal, dolor crónico)
El dolor pleurítico debido a fracturas costales o
claviculares patológicas, se asocian con marcado dolor en la zona.
Plasmocitoma extramedular solitario:
Se presenta como una masa que crece en el tracto
aerodigestivo en el 80 a 90% de los casos, a menudo con diseminación a los
ganglios linfáticos, aunque también se pueden afectar otros sitios.
Las quejas comunes incluyen inflamación, cefalea,
rinorrea, epistaxis, obstrucción nasal, odinofagia, ronquera, disfonía,
disfagia, disnea, dolor epigástrico y hemoptisis. (6)
Los síntomas por afectación de otros tejidos están
asociados con el sitio y el tamaño del tumor, y la compresión y o compromiso de
estructuras vecinas.
Los plasmocitomas extramedulares que comprometen el
pulmón más comúnmente se presentan como nódulos o masas hiliares
Examen físico
Plasmocitoma óseo solitario
Puede comprometer cualquier hueso, pero tiene predisposición
por la médula ósea del esqueleto axial. La enfermedad espinal es observada en
34 a72% de los casos. Las vértebras torácicas están mas frecuentemente
comprometidas, seguidas por las lumbares, sacras y cervicales. (4). Las
costillas, esternón, clavícula, o escápula se afectan en el 20% de los casos.
(17) El examen físico está relacionado con el sitio de compromiso,
presentándose como masa dolorosa, fractura patológica, o compresión de las
raíces y médula espinal.
Los pacientes con compromiso de huesos largos pueden
debutar con fracturas patológicas. (4)
Ocasionalmente los pacientes con plasmocitoma óseo
solitario se presentan con polineuropatía, (18,19) o con hallazgos consistentes
con el síndrome de POEMS (polineuropatía, organomegalia, endocrinopatía,
proteína M, y cambios cutáneos) (20)
Plasmocitoma extramedular
Aunque el plasmocitoma extramedular puede ocurrir en
cualquier sitio, 80 a 90% de los tumores desarrollan en cabeza y cuello
especialmente en tracto aerodigestivo.
Aproximadamente 80% de los casos comprometen la
mucosa de senos paranasales, faringe, cavidad nasal, encias o mucosa oral
(4,6,7,14,15) Una masa (plasmocitoma) en esas áreas es el hallazgo más común
con compresión o invasión de estructuras vecinas. Los pacientes con tumor en base
de cráneo se pueden presentar con parálisis de pares craneales.
Hay reportes de casos de compromiso de vejiga
urinaria, vesícula, sistema nervioso central, órbita, tracto gastrointestinal,
hígado, bazo, páncreas, pulmón, mama, piel, testículos, parótida, mediastino,
tiroides. (4,6,7,14,15)
En 30 a 40% de los casos, los ganglios linfáticos
están afectados en la presentación o en las recidivas.(13)
Causas:
No hay causa definida para el plasmocitoma óseo
solitario, sin embargo en las formas extramedulares la forma de presentación
mucosa del tracto aerodigestivo (>80%) se sospecha que pueda estar
relacionada con estimulación de irritantes inhalados o infección viral. (7)
Diagnóstico diferencial:
Linfoma inmunoblastico de alto grado
Linfoma no Hodgkin
Linfoma B de zona marginal
Granuloma de células plasmáticas
Neoplasias pobremente diferenciadas
Plasmocitosis reactiva
Laboratorio:
Plasmocitoma óseo solitario
* Aunque los niveles son menores que en el mieloma
múltiple, la electroforesis revela una proteína monoclonal en suero y en orina
en 24 a 72% de los pacientes. (21,22,23,24,25,26,27,28)
*Las inmunoglobulinas no comprometidas están
usualmente en rango de referencia
El recuento en sangre periférica , función renal y
calcio están dentro del rango de referencia
Plasmocitoma extramedular solitario
La electroforesis sérica muestra un componente
monoclonal en 14 a 25% de los casos. (4,6,15) En una serie de 46 pacientes de
Galieni y col todos los pacientes tenian las inmunoglobulinas normales.(6)
El recuento de sangre periférica, la función renal y
el calcio están dentro del rango de referencia
Imágenes
Plasmocitoma óseo solitario
En la Rx, clásicamente tiene aspecto osteolítico con
un margen claro y una estreacha zona de transición hasta la zona sanaque lo rodea.
(5) Raramente se ven quistes, lesiones trabeculadas que recuerdan al tumor de
células gigantes o un quiste aneurismático óseo. (29) La lesión esclerótica
está asociada con polineuropatía, organomegalia, endocrinopatía y cambios
cutáneos (síndrome POEMS). (30)
En RMN es hipointenso en T1 e hiperintenso en T2 o
en STIR, que en un contexto adecuado es consistente con plasmocitoma óseo
solitario. (31)
Plasmocitoma extramedular solitario
Las Rx muestran destrucción ósea en la mayoría de
los pacientes con compromiso de cavidad nasal o compromiso de senos
paranasales. (15)
La TAC, RMN, y el examen endoscópico del tracto
aerodigestivo y gastrointestinal se requieren para determinar la exacta
extensión del tumor, y su potencial resecabilidad. (14) Esas lesiones pueden
estar asociadas con variable efecto de masa, infiltración y/o destrucción de
hueso adyacente, músculo, grasa o compromiso vascular. (32)
Histología
El plasmocitoma óseo solitario revela infiltración
ósea por células plasmáticas monoclonales
El plasmocitoma extramedular muestra infiltración
por células plasmáticas monoclonales, con crecimiento submucoso, requiriendo
biopsia profunda, o biopsia abierta o extirpación completa dependiendo de la
localización del tumor. (14). Histológicamente se clasifican como de bajo,
intermedio o alto grado. (33) La PAMO muestra <5 color="#ff0000">Estadificación
Wiltshaw clasificó los plasmocitomas de tejidos
blandos en 3 estadios como sigue:
Estadio I. Limitado a un sitio extramedular.
Estadio II. Compromiso de ganglios linfáticos
regionales.
Estadio III. Múltiples metástasis (aunque aquí no se
podría hablar de plasmocitoma solitario)
El pronóstico depende de esta clasificación
Tratamiento
Tratamiento médico
Plasmocitoma óseo solitario:
La radioterapia local es el tratamiento de elección.
(4,5,13,22)
El control local se logra 88 a 100% de los
pacientes. Virtualmente todos los pacientes tienen alivio sintomático(13) y la
recurrencia tumoral es de aproximadamente 10%
La mayoría de los centros usan 40 Gy para lesiones espinales
y 45 para lesiones en otros huesos. Para lesiones más grandes de 5 cm. 50 Gy
deben considerarse.
No hay relación entre la dosis y la desaparición de
la proteína monoclonal en una serie de pacientes con plasmocitoma óseo
solitario (22)
Las proteínas monoclonales se reducen marcadamente
después de radioterapia en la mayoría de los pacientes, pero la desaparición se
observa solo en 20 a 50% de los pacientes. (14)
La cirugía está contraindicada en ausencia de
inestabilidad estructural o compromiso neurológico. (12)
La quimioterapia puede ser considerada en los
pacientes que no responden a la radioterapia, y el tratamiento es similar a los
regímenes utilizados en mieloma múltiple.
No hay lugar para la quimioterapia adyuvante en el
plasmocitoma óseo solitario.
Plasmocitoma extramedular
La radioterapia es el tratamiento de elección.
Cuando una lesión es completamente resecada, la
cirugía provee los mismos resultados que la radioterapia
La terapia combinada (cirugía y radioterapia) es un
tratamento aceptado dependiendo de la resecabilidad de la lesión
(4,6,13,14,15), y puede ofrecer los mejores resultados. (14)
La dosis óptima para control local es 40-50 Gy
(dependiendo del tamaño tumoral) aplicadas en el término de 4-6 semanas
(13,14,15)
Debido a la alta tasa de compromiso ganglionar esas
zonas deben ser incluidas en el campo de radiación. (13)
La radioterapia adyuvante debe ser recomendada para
pacientes con márgenes quirúrgicos positivos
La quimioterapia puede ser considerada para
pacientes con enfermedad refractaria o recidivada, con los mismos regímenes que
para mieloma múltiple. (12)
La quimioterapia adyuvante puede ser considerada
para pacientes con tumores mas grandes de 5 cm. Así como aquellos con
histología de alto grado
Tratamiento quirúrgico
Aunque la resección quirúrgica no es aconsejada para
el tratamiento del plasmocitoma óseo solitario, cuando hay compromiso de
columna a veces son necesarios estos tratamientos para restablecer la
arquitectura normal de la columna u otros huesos afectados
Si es posible la resección de la lesión, incluyendo
disección de ganglios linfáticos, debe ser intentado para los plasmocitomas
extramedulares
Seguimiento
Cuidado ambulatorio posterior
La evaluación periódica para la progresión y
desarrollo de mieloma múltiple es recomendada cada 6 semanas por los primeros 6
meses en plasmocitomas óseos solitarios y extramedulares. Se deben realizar los
siguientes tests: Recuento completo de células sanguíneas, panel metabólico
completo con LDH calcio fósforo, PCR, y beta2 microglobulina.
Eritrosedimentación, electroforesis sérica con inmunofijación, cuantificación
de inmunoglobulina sérica. Electroforesis urinaria con inmunofijación (en
muestra de 24 hs). Evaluación ósea completa
Pronóstico
Plasmocitoma óseo solitario
Progresa a mieloma múltiple en una tasa de 65 a84% a
10 años y 65 a 100% a 15 años
La tasa promedio de conversión a mieloma múltiple es
2 a 5 años con una tasa de sobrevida de 15-46%
El tiempo medio de sobrevida es 10 años
Kyle describió 3 formas de fallo de tratamiento
(16): desarrollo de mieloma múltiple (54%), recurrencia local (11%) y
desarrollo de nuevas lesiones óseas en ausencia de mieloma múltiple (2%)
La probabilidad de evolucionar de plasmocitoma óseo
solitario a mieloma múltiple está en relación a: 1) tamaño de la lesión de mas
de 5 cm. 2) pacientes de más de 40 años, 3) alto nivel de proteína M, 4)
persitencia de la proteína M después del tratamiento, 5) lesiones espinales
En un estudio de Wilder y col la sobrevida libre de
mieloma fue de 91% versus 29% en pacientes cuya proteína M no se resolvió al
año de la radioterapia. (34)
Plasmocitoma extramedular
La tasa de sobrevida a 10 años es 70%
La tasa de progresión a mieloma múltiple es menor
que en plasmocitoma óseo solitario y va desde el 11 a 30% a los 10 años. Los
pacientes con plasmocitoma extramedular que progresan a mieloma múltiple tienen
una tasa de sobrevida a los 5 años de 100% comparados con 33% de plasmocitomas
óseos solitarios (35) En una revisión de 721 casos de Alexiou y col, después
del tratamiento, aproximadamente 65% de los pacientes estuvieron libres de
recurrencia y no progresaron a mieloma múltiple, 22% experimentaron
recurrencia, y 15% de los casos evolucionaron a mieloma múltiple (14)
En un estudio, el control local siguiendo a la
radioterapia se logró en 83% de los casos con bajo grado versus 17% en los
tumores de grado intermedio o alto. (33)
Fuente
1. Bataille R,
Sany J. Solitary myeloma: clinical and prognostic features of a review of 114
cases. Cancer. Aug 1 1981;48(3):845-51. [Medline].
2. Corwin J,
Lindberg RD. Solitary plasmacytoma of bone vs. extramedullary plasmacytoma and
their relationship to multiple myeloma. Cancer. Mar 1979;43(3):1007-13.
[Medline].
3. McLain RF,
Weinstein JN. Solitary plasmacytomas of the spine: a review of 84 cases. J
Spinal Disord. Jun 1989;2(2):69-74. [Medline].
4. Dimopoulos
MA, Kiamouris C, Moulopoulos LA. Solitary plasmacytoma of bone and
extramedullary plasmacytoma. Hematol Oncol Clin North Am. Dec
1999;13(6):1249-57. [Medline].
5. Dimopoulos
MA, Moulopoulos LA, Maniatis A, Alexanian R. Solitary plasmacytoma of bone and
asymptomatic multiple myeloma. Blood. Sep 15 2000;96(6):2037-44. [Medline].
[Full Text].
6. Galieni P,
Cavo M, Pulsoni A, et al. Clinical outcome of extramedullary plasmacytoma.
Haematologica. Jan 2000;85(1):47-51. [Medline]. [Full Text].
7. Wiltshaw E.
The natural history of extramedullary plasmacytoma and its relation to solitary
myeloma of bone and myelomatosis. Medicine (Baltimore). May 1976;55(3):217-38.
[Medline].
8. Frizzera G.
Castleman's disease and related disorders. Semin Diagn Pathol. Nov
1988;5(4):346-64. [Medline].
9. Hussong JW,
Perkins SL, Schnitzer B, Hargreaves H, Frizzera G. Extramedullary plasmacytoma.
A form of marginal zone cell lymphoma?. Am J Clin Pathol. Jan
1999;111(1):111-6. [Medline].
10. Aalto Y,
Nordling S, Kivioja AH, et al. Among numerous DNA copy number changes, losses
of chromosome 13 are highly recurrent in plasmacytoma. Genes Chromosomes
Cancer. Jun 1999;25(2):104-7. [Medline].
11. Pasqualetti
P, Festuccia V, Collacciani A, Casale R. The natural history of monoclonal
gammopathy of undetermined significance. A 5- to 20-year follow-up of 263
cases. Acta Haematol. 1997;97(3):174-9. [Medline].
12. Soutar R,
Lucraft H, Jackson G, et al. Guidelines on the diagnosis and management of
solitary plasmacytoma of bone and solitary extramedullary plasmacytoma. Clin
Oncol (R Coll Radiol). Sep 2004;16(6):405-13. [Medline].
13. Hu K,
Yahalom J. Radiotherapy in the management of plasma cell tumors. Oncology
(Williston Park). Jan 2000;14(1):101-8, 111; discussion 111-2, 115. [Medline].
14. Alexiou C,
Kau RJ, Dietzfelbinger H, et al. Extramedullary plasmacytoma: tumor occurrence
and therapeutic concepts. Cancer. Jun 1 1999;85(11):2305-14. [Medline]. [Full
Text].
15. Liebross RH,
Ha CS, Cox JD, et al. Clinical course of solitary extramedullary plasmacytoma.
Radiother Oncol. Sep 1999;52(3):245-9. [Medline].
16. Kyle RA.
Monoclonal gammopathy of undetermined significance and solitary plasmacytoma.
Implications for progression to overt multiple myeloma. Hematol Oncol Clin
North Am. Feb 1997;11(1):71-87. [Medline].
17. Burt M,
Karpeh M, Ukoha O, et al. Medical tumors of the chest wall. Solitary
plasmacytoma and Ewing's sarcoma. J Thorac Cardiovasc Surg. Jan
1993;105(1):89-96. [Medline].
18. Read D,
Warlow C. Peripheral neuropathy and solitary plasmacytoma. J Neurol Neurosurg
Psychiatry. Feb 1978;41(2):177-84. [Medline]. [Full Text].
19. Schindler
OS, Briggs TW, Gillies SA. Bilateral demyelinating neuropathy in a solitary
lytic and sclerotic myeloma of the proximal humerus: a case report. Int Orthop.
1997;21(1):59-61. [Medline].
20. Iwashita H,
Ohnishi A, Asada M, Kanazawa Y, Kuroiwa Y. Polyneuropathy, skin
hyperpigmentation, edema, and hypertrichosis in localized osteosclerotic
myeloma. Neurology. Jul 1977;27(7):675-81. [Medline].
21. Knowling MA,
Harwood AR, Bergsagel DE. Comparison of extramedullary plasmacytomas with
solitary and multiple plasma cell tumors of bone. J Clin Oncol. Apr
1983;1(4):255-62. [Medline].
22. Liebross RH,
Ha CS, Cox JD, et al. Solitary bone plasmacytoma: outcome and prognostic
factors following radiotherapy. Int J Radiat Oncol Biol Phys. Jul 15
1998;41(5):1063-7. [Medline].
23. Brinch L,
Hannisdal E, Abrahamsen AF, Kvaløy S, Langholm R. Extramedullary plasmacytomas
and solitary plasma cell tumours of bone. Eur J Haematol. Feb 1990;44(2):132-5.
[Medline].
24. Bolek TW,
Marcus RB, Mendenhall NP. Solitary plasmacytoma of bone and soft tissue. Int J
Radiat Oncol Biol Phys. Sep 1 1996;36(2):329-33. [Medline].
25. Jackson A,
Scarffe JH. Prognostic significance of osteopenia and immunoparesis at
presentation in patients with solitary myeloma of bone. Eur
J Cancer. Mar 1990;26(3):363-71. [Medline].
26. Galieni P, Cavo M, Avvisati G, et al. Solitary plasmacytoma of bone and extramedullary
plasmacytoma: two different entities?. Ann Oncol. Sep 1995;6(7):687-91.
[Medline].
27. Holland J,
Trenkner DA, Wasserman TH, Fineberg B. Plasmacytoma. Treatment results and
conversion to myeloma. Cancer. Mar 15 1992;69(6):1513-7. [Medline].
28. Frassica DA,
Frassica FJ, Schray MF, Sim FH, Kyle RA. Solitary plasmacytoma of bone: Mayo
Clinic experience. Int J Radiat Oncol Biol Phys. Jan 1989;16(1):43-8.
[Medline].
29. Huvos AG,
ed. Multiple myeloma including solitary osseous myeloma. Bone Tumors:
Diagnosis, Treatment, and Prognosis. Philadelphia, Pa: WB Saunders Co;
1992:653-67.
30. Miralles GD,
O'Fallon JR, Talley NJ. Plasma-cell dyscrasia with polyneuropathy. The spectrum
of POEMS syndrome. N Engl J Med. Dec 31 1992;327(27):1919-23. [Medline].
31. Moulopoulos
LA, Dimopoulos MA, Weber D, et al. Magnetic resonance imaging in the staging of
solitary plasmacytoma of bone. J Clin Oncol. Jul 1993;11(7):1311-5. [Medline].
32. Ooi GC, Chim
JC, Au WY, Khong PL. Radiologic manifestations of primary solitary
extramedullary and multiple solitary plasmacytomas. AJR Am J Roentgenol. Mar
2006;186(3):821-7. [Medline]. [Full Text].
33. Susnerwala
SS, Shanks JH, Banerjee SS, et al. Extramedullary plasmacytoma of the head and
neck region: clinicopathological correlation in 25 cases. Br J Cancer.
1997;75(6):921-7. [Medline].
34. Wilder RB,
Ha CS, Cox JD, et al. Persistence of myeloma protein for more than one year
after radiotherapy is an adverse prognostic factor in solitary plasmacytoma of
bone. Cancer. Mar 1 2002;94(5):1532-7. [Medline]. [Full Text].
35. Mendenhall
CM, Thar TL, Million RR. Solitary plasmacytoma of bone and soft tissue. Int J
Radiat Oncol Biol Phys. Nov 1980;6(11):1497-501. [Medline].
36. Bachar G,
Goldstein D, Brown D, et al. Solitary extramedullary plasmacytoma of the head
and neck--long-term outcome analysis of 68 cases. Head Neck. Aug
2008;30(8):1012-9. [Medline].
37. Bezwoda WR,
Gordon V, Bagg A, Mendelow B. Light chain restriction analysis of bone marrow
plasma cells in patients with MGUS or 'solitary' plasmacytoma: diagnostic value
and correlation with clinical course. Br J Haematol. Apr 1990;74(4):420-3.
[Medline].
38. Bink K,
Haralambieva E, Kremer M, et al. Primary extramedullary plasmacytoma:
similarities with and differences from multiple myeloma revealed by interphase
cytogenetics. Haematologica. Apr 2008;93(4):623-6. [Medline]. [Full Text].
39.
Delauche-Cavallier MC, Laredo JD, et al. Solitary plasmacytoma of the spine.
Long-term clinical course. Cancer. Apr 15 1988;61(8):1707-14. [Medline].
40. Kumar S,
Fonseca R, Dispenzieri A, et al. Prognostic value of angiogenesis in solitary
bone plasmacytoma. Blood. Mar 1 2003;101(5):1715-7. [Medline]. [Full Text].
41. Mill WB,
Griffith R. The role of radiation therapy in the management of plasma cell tumors.
Cancer. Feb 15 1980;45(4):647-52. [Medline].
42. Straetmans
J, Stokroos R. Extramedullary plasmacytomas in the head and neck region. Eur
Arch Otorhinolaryngol. Feb 26 2008;epub ahead of print. [Medline].
43. Weber DM.
Solitary bone and extramedullary plasmacytoma. Hematology Am Soc Hematol Educ
Program. 2005;373-6. [Medline]. [Full Text].
extramedullary
plasmacytoma, plasma cell tumor, plasmocytoma, plasmacytoma of the skeletal
system, solitary bone plasmacytoma, SBP, soft tissue plasmacytoma, EMP, neoplastic
monoclonal cell, bone marrow, multiple myeloma
Contributor
Information and Disclosures
Author
Suzanne R
Fanning, DO, Medical Oncologist, Cancer Centers of the CarolinasSuzanne R
Fanning, DO is a member of the following medical societies: American College of
Physicians, American Medical Association, and American Society of Hematology
Disclosure: Nothing to disclose
Coauthor
Mohamad A
Hussein, MD, Clinical Director, Malignant Hematology, Moffitt Cancer
CenterMohamad A Hussein, MD is a member of the following medical societies:
American Association of Blood Banks, American College of Physicians, American
Medical Association, and American Society of Hematology Disclosure: Nothing to
disclose
Medical Editor
Paul Schick, MD,
Emeritus Professor, Department of Internal Medicine, Thomas Jefferson
University Medical College; Research Professor, Department of Internal
Medicine, Drexel University College of MedicinePaul Schick, MD is a member of
the following medical societies: American College of Physicians, American Heart
Association, American Society of Hematology, International Society on
Thrombosis and Haemostasis, and New York Academy of Sciences Disclosure:
Nothing to disclose
Pharmacy Editor
Francisco
Talavera, PharmD, PhD, Senior Pharmacy Editor, eMedicineDisclosure: Nothing to
disclose
Managing Editor
Wendy Hu, MD,
Consulting Staff, Department of Hematology/Oncology and Bone Marrow
Transplantation, Huntington Memorial Medical CenterWendy Hu, MD is a member of
the following medical societies: American Association for the Advancement of
Science, American College of Physicians, American Society for Blood and Marrow
Transplantation, American Society of Hematology, and Physicians for Social
Responsibility Disclosure: Nothing to disclose
CME Editor
Rajalaxmi McKenna,
MD, FACP, Consulting Staff, Department of Medicine, Southwest Medical
Consultants, SC, Good Samaritan Hospital, Advocate Health SystemsRajalaxmi
McKenna, MD, FACP is a member of the following medical societies: American
Society of Clinical Oncology, American Society of Hematology, and International
Society on Thrombosis and Haemostasis Disclosure: Nothing to disclose
Chief Editor
Emmanuel C Besa,
MD, Professor, Department of Medicine, Division of Hematologic Malignancies,
Kimmel Cancer Center, Thomas Jefferson UniversityEmmanuel C Besa, MD is a
member of the following medical societies: American Association for Cancer
Education, American College of Clinical Pharmacology, American Federation for
Medical Research, American Society of Hematology, and New York Academy of
Sciences Disclosure: Nothing to disclose
 Esta angio resonancia muestra los hallazgos típicos de la arteritis de Takayasu.
Esta angio resonancia muestra los hallazgos típicos de la arteritis de Takayasu.