1) la neoplasia contiene un antígeno superficial o una proteína intracelular que es la diana del sistema inmune
2) síndromes de gammapatía monoclonal asociados a la secreción de una anticuerpo por la neoplasia.
En algunos SPN, como son la neuropatía motora asociada al linfoma, la miopatía necrótica subaguda, la dermatomiositis y la miopatía necrotizante, no se ha identificado aun anticuerpos o antígenos tumorales y por lo tanto no son clasificables en este esquema
Cuadros paraneoplásicos neurológicos según su localización
Encéfalo
Encefalitis límbicaEncefalitis del tronco encefálicoDegeneración cerebelosaOpsoclonía/mioclonía
Médula espinal
Mielopatía necrotizante
Nervio periférico
Neuropatía sensitivaNeuropatía motoraNeuropatía sensitivo-motora Mononeuritis múltiple Neuromiotonía(de Isaac)
Neuropatía amiloide Neuropatía autónoma Neuropatía desmielinizante Neuropatía motora multifocal Antisulfátido POEMS Polineuropatía desmielinizante inflamatoria crónica
Unión neuromuscular
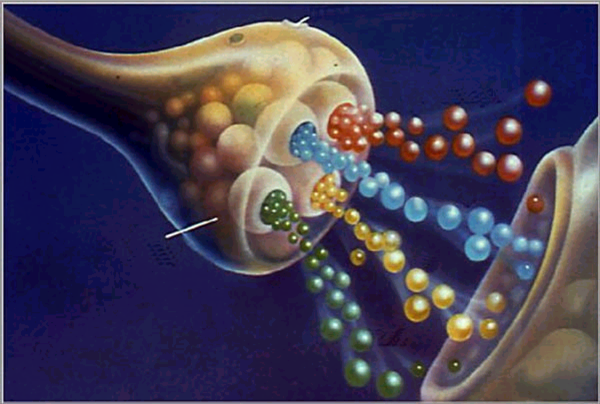
Síndrome miasténico de Lamber-Eaton.
Miastenia Gravis
Músculo
Miopatía necrotizante
Dermatomiositis Atrofia tipo IIMiopatía con AC antidecorina
Enfermedad Muscular hipertónica
Escleromixedema
La mayoría de los síndromes paraneoplásicos sintomáticos son raros. Las excepciones son el sindrome miasténico de Lambert-Eaton, que afecta a cerca del 3% de los pacientes con cáncer de pulmón de células pequeñas, la miastenia gravis, que afecta a un 15% de los pacientes con timoma y la neuropatía periférica desmielinizante, la cual afecta a alrededor del 50% de los pacientes con una forma rara osteoesclerótica del plasmacitoma (síndrome constituido por polineuropatía, vísceromegalia, endocrinopatía, proteína M y, alteraciones cutáneas) (POEMS).
Los estudios clínicos y electrofisiológicos de los pacientes con cáncer, en particular el cáncer de pulmón de células pequeñas, suelen revelar debilidad muscular proximal o conducción retardada de los nervios periféricos en los pacientes asintomáticos. Todavía no ha quedado establecido si estos trastornos neurológicos son paraneoplásicos verdaderos o no.
Hallazgos de laboratorio
Líquido cefalorraquídeo:
Revela pleocitosis leve (30 a 40 leucocitos/mm3),
Una elevación leve del nivel proteico (50 a 100 mg/dl) .IgG elevada. (La pleocitosis suele aparecer al principio de la enfermedad y desaparece en varias semanas o meses. Sin embargo, el nivel elevado de IgG persiste.)
El análisis de las células del líquido cefalorraquídeo en los pacientes con degeneración cerebelosa paraneoplásica( mediante la identificación de las células activadas por fluorescencia) ha revelado que el tipo celular predominante (más del 75%) es el de las células T, con componente pequeño (menos del 10%) de células B y células "killer" naturales.
Anticuerpos
Desde el punto de vista diagnóstico, lo más importante en los síndromes paraneoplásicos es la presencia de anticuerpos en el suero (y el líquido cefalorraquídeo) que reaccionan con el sistema nervioso y el cáncer subyacente. La identificación de esos anticuerpos y sus antígenos neurales blanco ha permitido un avance muy importante en el diagnóstico precoz y el concepto de que los trastornos neurológicos paraneoplásicos tienen una base inmunológica. Dicen algunos autores que cada uno de esos anticuerpos se asocia con un espectro reducido de síndromes clínicos y un subgrupo restringido de cánceres. Los anticuerpos, son altamente específicos para identificar al paciente con trastorno neurológico que presenta un síndrome paraneoplásico. Estos anticuerpos también indican el sitio de localización del cáncer. Por ejemplo, los autores sostienen que la presencia de los anticuerpos anti-Yo en el suero de una mujer con síntomas cerebelosos es concluyente para diagnosticar la degeneración cerebelosa paraneoplásica y el cáncer ginecológico, usualmente ovárico o mamaPor desgracia, no todos los pacientes con síndromes paraneoplásicos tienen anticuerpos identificables en el suero.
Anticuerpos contra antígenos celulares
Antígenos
En la mayoría de los casos de síndromes paraneoplásicos asociados con anticuerpos, el antígeno ha sido identificado y el gen que codifica el antígeno ha sido clonado y secuenciado. Algunos de esos antígenos son expresados por todos los tumores de un determinado tipo histológico, siempre que el paciente tenga una respuesta inmune contra ellos. Otros tumores raramente expresan tales antígenos.
El mejor pronóstico no depende solo del diagnóstico precoz del cáncer sino de la enfermedad neurológica que induce a la búsqueda del cáncer.
En los trastornos neurológicos paraneoplásicos, los anticuerpos reaccionan con la porción del sistema nervioso responsable de los síntomas clínicos, por ejemplo, los anticuerpos anti células de Purkinje aparecen en los pacientes con degeneración cerebelosa paraneoplásica. En los trastornos neurológicos paraneoplásicos que afectan al cerebro, el título de anticuerpos en el líquido cefalorraquídeo relativamente elevado (relativo al total de IgG) indica que el anticuerpo es sintetizado dentro del cerebro, quizás por células B específicas que han atravesado la barrera hematoencefálica.
Temas no resueltos
Modelos de experimentación en animales:Los autores enumeran los temas que todavía no tienen respuesta a partir de la investigación científica. Los estudios en animales no han podido reproducir los síndromes neurológicos paraneoplásicos, mientras que los estudios en los seres humanos han comprendido un componente celular importante en la respuesta inmune en varios sindrome neurológicos paraneoplásicos. En un trabajo, los animales inmunizados con el DNA correspondiente al antígeno Hu estaban protegidos contra la inoculación posterior del tumor, pero la importancia de este trabajo, comparado con muchos informes similares en los cuales la protección fue inducida en los modelos animales de tumores no se asoció con trastornos neurológicos paraneoplásicos, es incierto.
Protección contra el tumor. Se desconoce si en los trastornos neurológicos paraneoplásicos la respuesta inmune antitumoral inducida por la terapéutica puede ocurrir sin dañar el sistema nervioso. En el modelo actual de trastornos neurológicos paraneoplásicos, la apoptosis de las células tumorales dispara una respuesta inmune antitumoral. En efecto, se ha demostrado que las células tumorales apoptósicas de los trastornos neurológicos paraneoplásicos son un medio potente de activación de las células T específicas del tumor. Estas células T killer despertarían un circuito de retroalimentación induciendo la apoptosis y amplificando la respuesta inmune antitumoral. Estas observaciones indican que el conocimiento de los mecanismos que estimulan las respuestas inmunes tumorales efectivas en los pacientes con trastornos neurológicos paraneoplásicos, pueden tener un papel importante en el desarrollo de abordajes exitosos a través de la inmunoterapia tumoral.
Variantes de los cuadros anatomopatológicos Otro factor que se interpone en el conocimiento de la degeneración neuronal, en los trastornos neurológicos paraneoplásicos, es que los cuadros anatomopatológicos son muy variados. Por ejemplo, dicen los autores, en la degeneración cerebelosa paraneoplásica, existe una pérdida total de las células de Purkinje del cerebelo, con modificaciones escasas o nulas en el sistema nervioso y sin infiltrados inflamatorios identificables dentro del cerebelo mismo. Por el contrario, agregan, en la encefalomielitis paraneoplásica no solo hay destrucción difusa de las neuronas, incluyendo las células de Purkinje, sino también una inflamación marcada dentro del sistema nervioso central y depósitos intraneuronales de anticuerpos
En algunos pacientes con sindrome paraneoplásicos, en particular el opsoclonus-mioclonus, la autopsia puede mostrar un cerebro completamente normal, aun cuando los cortes seriados pasan por el sitio de las neuronas afectadas, a las cuales se las considera responsables del opsoclonus. En el sindrome miasténico de Lambert-Eaton, el microscopio electrónico revela la unión de los anticuerpos en los canales de calcio sensibles al voltaje, en la unión neuromuscular, lo cual interrumpe los sitios activos. Por lo tanto, acotan los autores, aunque los sindrome paraneoplásicos que comprometen el sistema nervioso puede tener una mediación inmunológica, el sitio del daño y el mecanismo exacto pueden variar entre un sindrome y otro, lo que hace difícil su comprensión.
En los trastornos neurológicos paraneoplásicos del sistema nervioso central, donde la mayor parte de los antígenos blanco conocidos son proteínas intracelulares, los modelos animales no han brindado evidencia de que los anticuerpos tengan un papel en la patogenia. El hecho de haberse documentado la expresión de las moléculas presentadoras de antígeno de las clases I y II del complejo mayor de histocompatibilidad (MHC) en las neuronas avala la posibilidad de que las células T reconozcan al antígeno intracelular presentado a ellas como un complejo péptido MHC y por lo tanto, letal para las neuronas. La identificación de las células T antígeno específicas en el sistema nervioso central avalaría esta hipótesis, como en el modelo animal, en el cual las células T antígeno específicas mediaban la degeneración neuronal.
Es importante mencionar también en este artículo a la neurotoxicidad inducida por la propia terapia antitumoral, o neurotoxicidad mediada por fármacos, no porque se trate de síndromes paraneoplásicos, sino por que pueden en ocasiones confundirse con ellos, y además pueden coexistir con ellos haciendo mas complejo aún el diagnóstico y la categorización del cuadro clínico.
Neurotoxicidad producida por fármacos
Alcaloides de la vinca
La más neurotóxica es la vincristina (VCR). El daño puede ser a nivel central, periférico o autonómico. El dato más precoz es la abolición del reflejo aquíleo y las parestesias en dedos de la mano. Éstas progresan proximalmente y después se continúa con debilidad muscular. Puede afectar a los pares craneales y al sistema parasimpático y autónomo.La vinorelbina y la vinblastina son menos neurotóxicas pero poseen la característica de afectar más al SNA produciendo cuadros de estreñimiento y de íleo paralítico.
Cisplatino y oxaliplatino
La incidencia de neurotoxicidad con este fármaco alcanza el 100% dependiendo de la dosis, la dosis acumulativa, la exposición previa a otros neurotóxicos y el sexo (son más sensibles las mujeres).La toxicidad más frecuente del cisplatino (CDDP) es la neuropatía sensitiva periférica.,. Las parestesias se distribuyen en guante y calcetín, y afectan más a las extremidades inferiores que la vincristina.La neurotoxicidad del oxaliplatino es muy parecida a la del platino, con la diferencia de que es más frecuente y más intensa de modo que es la toxicidad limitante de dosis. Las parestesias pueden ser de inicio precoz o tardío dentro de un ciclo, las precoces desaparecen sin dejar secuelas y las tardías son las acumulativas y las que representan la toxicidad limitante. Existe una neurotoxicidad específica de este fármaco que es la disestesia farigolaríngea.
Citarabina
Presenta un amplio espectro de neurotoxicid tanto a nivel central como a nivel periférico: disfunciones cerebelosas, convulsiones, encefalopatía generalizada, leucoencefalopatía necrotizante, neuropatía periférica, mielopatía espinal, necrosis de ganglios basales y parálisis pseudobulbar. Generalmente la toxicidad se manifiesta de forma aguda sin tener relación con la dosis acumulada. La forma más común de neurotoxicidad es la manifestada sobre el cerebelo y que en la práctica clínica se manifiesta por disartria, ataxia y dismetría.La neuropatía periférica es rara. La administración intratecal puede desencadenar una mielopatía ascendente de pronóstico incierto.
Ifosfamida
Es más frecuente la afectación a nivel del SNC que de la SNP. El comienzo suele ser agudo en unos 5 días tras el inicio del fármaco y en general mejora progresivamente tras su supresión. Las toxicidades a nivel del SNP y las reacciones extrapiramidales, aunque existen, tienen una frecuencia mucho menor.Su etiología no es del todo bien conocida pero se cree que puede mejorar con azul de metileno3 y algunos autores dicen que también con diacepán4 .
5-Fluorouracilo
También es más frecuente la toxicidad a nivel del SNC que del SNP. Se manifiesta por disfunción cerebelosa. Es muy frecuente la asociación de factor citrovorum con este fármaco que puede aumentar el riesgo y a la vez ser la causa de convulsiones.El comienzo de estas toxicidades es agudo, no tienen un tratamiento específico. Histológicamente se encuentran focos de desmielinización diseminados.MetotrexateSu toxicidad neurológica viene condicionada por la dosis, la vía de administración y el uso concomitante de otros tratamientos.La administración intratecal produce sobre todo meningitis asépticas (incidencia del 10%-50% de los pacientes tratados). Los síntomas, que suelen ser autolimitados, comienzan a las 2-4 horas de la infusión del fármaco y pueden durar 12-72 horas. No hay tratamiento específico. Puede prevenirse infundiendo esteroides junto al metotrexate. Con menor frecuencia el metotrexate intratecal puede producir una mielitis transversa y, raramente, otras complicaciones potencialmente letales.Dosis elevadas de metotrexate pueden producir diversos grados de encefalopatía con o sin signos focales, e incluso una forma de leucoencefalopatía crónica. Su desarrollo es favorecido por tratamientos concomitantes con radioterapia. Clínicamente se manifiesta por un gradual deterioro cognitivo.TaxanosSu neuropatía se caracteriza por parestesias en guante y calcetín, o como dolor, pérdida de la sensibilidad vibratoria, pérdida de los reflejos profundos, signo de Lhermite e hipotensión ortostática. Puede aparecer tras una sola administración del fármaco. La causa es la desmielinización y degeneración axonal que producen al alterar los microtúbulos neuronales, con efectos electromiográficos claros.Se han descrito otras neurotoxicidades como debilidad de extremidades, déficits visuales secundarios a neuropatía del óptico, y encefalopatías en formas de confusiones y cambios de personalidad.HexametilmelaminaEs más frecuente la toxicidad a nivel del SNP (parestesia, hiperparestesia, hiporreflexia y disminución de la propiocepción), pero también está descrita a nivel del SNC (temblor parkinsoniano, somnolencia, convulsiones, ataxia y cambios de personalidad).ProcarbacinaPuede afectar al SNC y SNP, aunque es más frecuente la afectación del primero en forma de letargia, depresión, alucinación, psicosis, etc.A diferencia de la toxicidad en el SNC que se resuelve rápidamente, la del SNP suele tardar de semanas a meses.FludarabinaSu toxicidad a nivel del SNC puede llegar hasta el coma y la cuadraplejía flácida, no obstante a las dosis habituales es rara. Se han descrito casos esporádicos de neurotoxicidad fatal incluso meses después de suspender el tratamiento citostático
Otras causas a tener en cuenta son secundarias a :
metabólicas (hiponatremia, hipoglucemia),
infecciones (meningitis, abcesos, encefalitis y leucoencefalopatía multifocal),
vasculares (infarto o hemorragia) e
iatrógenas (sobredosis farmacológica o efectos de quimio o radioterapia).
Síndromes paraneoplásicos del SNC, son de difícil diagnóstico y se llega a ellos por exclusión
Tratamiento
Debido a que se considera que los síndromes paraneoplásicos están mediados por el sistema inmune, se han utilizado dos tratamientos: 1)la eliminación de la fuente del antígeno mediante el tratamiento del tumor subyacente 2) la supresión de la respuesta inmune. Para muchos síndromes paraneoplásicos, el único tratamiento efectivo es el primer enfoque. En el sindrome miasténico de Lambert-Eaton y la miastenia gravis, suele ser eficaz el intercambio plasmático o la inmunoglobulina intravenosa, con lo cual se suprime la respuesta inmune. Si la enfermedad está mediada por las células T, como se sospecha en muchos trastornos del sistema nervioso central, como la degeneración cerebelosa paraneoplásica con anticuerpos anti-Yo o la encefalomielitis con anticuerpos anti-Hu, pueden usarse fármacos como el tacrolimus o el mofetil micofenolato. Debido que la inmunidad humoral y celular pueden intervenir en el mecanismo patológico, puede ser apropiado suprimir ambas ramas del sistema inmune.
No existen protocolos para el tratamiento de la mayoría de los síndromes paraneoplásicos, pero si la condición del paciente es muy mala, el médico suele usar una combinación de ambos tratamientos: intercambio plasmático o inmunoglobulina intravenosa y agentes inmunosupresores, como los corticosteroides, la ciclofosfamida o el tacrolimus.
Ante la carencia de protocolos para el tratamiento inmunosupresor, informan la modalidad MAS utilizada :En cuanto a la primera, se administra 0,5 g/kg/día de inmunoglobulina iv. durante 5 días, más 1 g/día de metilprednisolona iv. durante 3 días y, 600 mg/m2 de superficie corporal de ciclofosfamida iv., de 1 a 4 días. Si hay mejoría o estabilidad, puede repetirse tres veces con intervalos de 3 semanas. Con tacrolimus hay menos experiencia. Al respecto, los autores utilizan 0,15 mg/kg/día de tacrolimus, durante 14 días, seguido por 0,3 mg/kg/día durante 7 días. Este régimen disminuyó el número de células T activadas en el líquido cefalorraquídeo pero no tuvo un efecto importante sobre la evolución clínica.La inmunoterapia no es efectiva para la mayoría de los sindrome paraneoplásicos. Sin embargo, hay informes de casos aislados que describen respuesta a varias intervenciones inmunoterapéuticas, lo que en las situaciones desesperadas anima a los médicos a combinar la inmunoterapia con el tratamiento oncológico.
Pronóstico
Algunos trastornos, como el sindrome miasténico de Lambert-Eaton y la miastenia gravis, responden bien a la inmunosupresión y, por consiguiente, al tratamiento del tumor subyacente. La neuropatía periférica asociada con el mieloma osteoesclerótico suele resolverse cuando el tumor es tratado con radioterapia. Algunos trastornos, como la opsoclonus-mioclonus en los adultos, pueden responder al tratamiento del tumor subyacente, la inmunosupresión o ambos, o pueden resolverse espontáneamente. En muchos casos, no se sabe bien si el sindrome paraneoplásico se resuelve en forma espontánea o en respuesta al tratamiento. Los trastornos que afectan al sistema nervioso central, como la encefalomielitis asociada con el cáncer o la degeneración cerebelosa paraneoplásica, suelen responden muy poco al tratamiento, aunque pueden estabilizarse cuando el tumor subyacente recibe tratamiento
La razón de la diferencia en los pronósticos probablemente se deba a la patología subyacente.El sindrome miasténico de Lambert-Eaton y la miastenia grave son enfermedades de la unión neuromuscular, las cuales pueden recuperar su función una vez que el agente causal a desaparecido, porque no hay pérdida de la neurona madre. Los trastornos como la degeneración cerebelosa paraneoplásica suelen asociarse con pérdida de neuronas, y debido a que evolucionan en forma subaguda, con retraso del tratamiento, las neuronas mueren, lo que hace imposible la recuperación. Es posible que algunos trastornos del sistema nervioso central como el opsoclonus-mioclonus no sufran la pérdida celular y, de ese modo, no presentan cuadros patológicos identificables. Por lo tanto, dicen los autores, los pacientes que sufren estos trastornos tienen posibilidad de recuperación.Un interrogante importante es si el tratamiento inmunosupresor del sindrome paraneoplásico estimula el crecimiento del tumor??, aun no han hallado evidencia publicada al respecto.
Encefalitis límbica
Comienzo subagudo. Los pacientes se presentan con crisis epilépticas(intratables o refractarias al tratamiento), confusión, síntomas psiquiatrícos como agitación , alucinaciones, depresión , ansiedad y cambios en la personalidad, o una pérdida de la memoria a corto plazo.Vértigos, ataxia, nistagmus, parestesias y debilidad simétrica o asimétrica.
Progresa a lo largo de semanas antes de estabilizarse, pudiendo producirse exacerbaciones.Se asocia frecuentemente(70%) a cáncer de pulmón microcítico, menos a menudo a timoma, enfermedad de Hodgkin, mama, colon y vejiga.RMN: lesión extensa del SNC, la señal en T2 puede estar aumentada no solo en lóbulos temporales, sino también en corteza o el tronco encefálico.La espectroscopia de protones por Resonancia Magnética nos proporciona información acerca de los cambios metabólicos que suceden en la encefalitis límbica necrotizante.
EEG: el 75% muestra anomalías como lentificación focal, ondas agudas y puntas.LCR: puede mostrar proteínas elevadas, discreta pleocitosis de mononucleares, bandas oligoclonales, o un aumento de la síntesis de IgG, pero también puede ser normal.En suero o LCR se detectan anticuerpos anti-Hu. La asociación de AC anti-Hu con las neoplasias es muy elevada(90%).Solo en casos excepcionales se produce la mejoría de la encefalitis límbica con inmunoterapia (plasmaféresis, Ig IV, ciclofosfamida o glucocorticoides), con la resección del tumor primario o combinación de estas.
La búsqueda de Ac antineuronales en sangre y/o LCR es positiva en 60% de los casos, aunque su negatividad no excluye el diagnóstico. Los más frecuentes y conocidos son los Ac anti-Hu.
Por otra parte los Ac parecen tener únicamente papel en la ayuda al diagnóstico, desconociéndose su auténtico valor patogénico y pronóstico; presentando además las siguientes limitaciones: a) su presencia en sangre aparece sólo en el 60% de los casos; b) pueden aparecer en encefalitis lìmbicas no-neoplásicas; c) las asociaciones síndrome paraneoplásico-Ac-tumor no son fijas; y d) al ser un estudio relativamente nuevo resulta caro y de accesibilidad limitada.
Cuadro clínico ejemplificador:
Varón de 49 años. Un mes antes del ingreso presentó un episodio sincopal y una semana antes un cuadro calificado como brote psicótico. Al ingreso presenta desorientación, fluctuación del nivel de consciencia, fiebre y monoparesia braquial. La punción lumbar no mostró más que una discreta hiperproteinorraquia. Desarrolló una epilepsia refractaria al tratamiento convencional, con crisis focales repetidas y estatus convulsivo y frecuentes crisis de alucinaciones acompañadas de percepciones sensoriales muy vívidas (crisis uncinadas). En la RMN en la secuencia ponderada en densidad de protones se aprecia un aumento de señal en polo anterior medial del lóbulo temporal derecho. En la I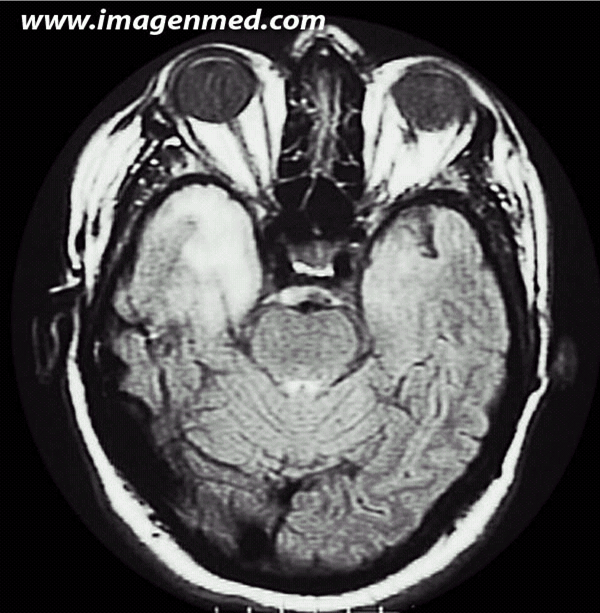 magen 2, ponderada en T2, se aprecian múltiples
magen 2, ponderada en T2, se aprecian múltiples 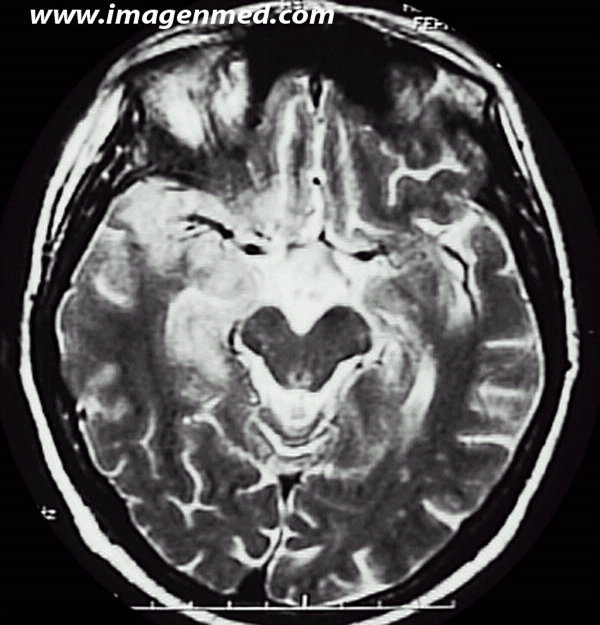 áreas de hiperseñal en polo anterior temporal y circunvolución del hipocampo. Hay además múltiples lesiones puntiformes con aumento de la señal en la substancia blanca subcortical temporo-occipital izquierda. En la necropsia se halló un carcinoma indiferenciado de pulmón tipo “oat cell”. Los anticuerpos anti-Hu fueron positivos.
áreas de hiperseñal en polo anterior temporal y circunvolución del hipocampo. Hay además múltiples lesiones puntiformes con aumento de la señal en la substancia blanca subcortical temporo-occipital izquierda. En la necropsia se halló un carcinoma indiferenciado de pulmón tipo “oat cell”. Los anticuerpos anti-Hu fueron positivos.
Encefalitis De tronco encefálico
Por lo general se asocian a una enfermedad en otra parte del SNC o SNP.Los síntomas predominantes se deben a la afección del bulbo, con náuseas, vómitos, nistagmo, vértigo y ataxia.Se la ha relacionado con disartria y disfagia por la afección de la protuberancia.La inflamación del mesencéfalo y la pérdida de neuronas dan lugar a anomalías nucleares del movimiento ocular, la diplopía que pueden causar incapacidad.
La participación del mesencéfalo rostral y de la sustancia negra pueden producir rigidezOtros transtornos raros son la sordera y la hipoventilaciónAC anti-huAsociado a neoplasia pulmonar microcítica.El manejo de este síndrome depende de su rápida identificación como procesos de etiología paraneoplásica y del diagnóstico y tratamiento precoz del cáncer.
Degeneración Cerebelosa Paraneoplásica
El 90% de los casos se producen por carcinoma pulmonar microcítico, linfoma Hodgkin, cánceres de mama y ovario.La manifestación inicial es un trastorno pancerebeloso subagudo que consiste en nistagmo,ataxia oculomotora, disartria y ataxia de extremidades y de la marcha.En muchos pacientes y en especial los que tienen AC anti-Yo, los signos se limitan a la disfunción cerebelosa.Los síntomas pueden progresar a lo largo de semanas y terminan por estabilizarse, dejando al paciente incapacitado.
RMN: suele mostrar atrofia cerebelosa.LCR:puede ser normal o mostrar ligera elevación de proteínas, pleocitosis mononuclear, aumento del índice de Ig G, bandas oligoclonalesNeuropatología: pérdida difusa de células de PurkinjePuede asociarse a AC policlonales Ig G anti-Yo, anti-Tr, anti- receptor de glutamato(mGLuR1), en suero y LCR.Los AC anti-Yo, se relacionan con cáncer de mama y ovarioEn el linfoma Hodgkin se dan AC anti-Tr y anti-mGLuR1
Síndrome de Opsoclono-Mioclono paraneoplásico
(Síndrome del baile de ojos y pies). Movimientos oculares conjugados involuntarios, de gran amplitud, arrítmicos, en muchas direcciones, que persisten durante el sueño y con los ojos cerrados.Se acompaña de parpadeo y miocloníaEl síndrome opsoclonus-mioclonus (SOM) es un trastorno poco frecuente que ha sido descrito como manifestación paraneoplásica, fundamentalmente asociado al neuroblastoma en niños(AC anti-filamentos) y a tumores de mama(AC anti-Ri) y pulmón(AC anti-Hu) en adultos. La asociación con cáncer de ovario es excepcional
Se han descripto AC contra neurofilamentosPuede mejorar luego de tratamiento con adrenocorticotropina(ACTH) Y glucocorticoides.Para el tratamiento sintomático puede resultar útil el clonazepam, el valproato o su combinación.
Retinopatía Asociada a carcinoma
El síntoma principal es la pérdida de la visión unilateral o bilateral simétrica o asimétrica.
La manifestación inicial puede ser la ceguera nocturna. La pérdida de visión puede ser gradual o en escalones en semanas o meses. Otro síntoma puede ser visión titilante, destellos o distorsiones de imágenes.
La exploración detecta deterioro de la agudeza visual, trastorno de la visión de los colores y un defecto pupilar aferente.Los defectos en el campo visual pueden ser escotomas anulares o centrales.Se produce fundamentalmente con el carcinoma pulmonar microcítico, melanoma y con algunos tumores ginecológicosEl electrorretinograma suele ser plano por la pérdida de conos y bastones.AC asociados: Ig G anti recoverina ( prot. Fijadora de calcio), enolasa retiniana, antígeno Stratamiento, glucocorticoides produce ligera mejoría.
Mielopatía paraneoplásica
Es un trastorno poco frecuente, que se presenta como choque espinal agudo.
Se manifiesta en forma de paraparesia flácida con nivel sensitivo y trastornos de esfínteres.
La disfunción medular progresa con rapidez y es ascendente.
Pronóstico malo.
LCR, muestra pleocitosis con proteínas elevadas.
RMN, alteraciones en la señal de T2 en la médula espinal, con tumefacción de la médula y afectación de estructuras de la sustancia blanca y la sustancia gris.
Las neoplasias que producen este Síndrome son:LinfomaLeucemiaCáncer de pulmónNo hay tratamiento efectivo.
Síndrome del hombre rígido (Stiff Man Syndrome)
Es una enfermedad rara, se han descrito 250 casos desde 1956, caracterizada por una rigidez muscular progresiva que oscila con espasmos musculares y mialgias del esqueleto axial.Es más frecuente en mujeres. Aparece en adultos entre los 30 y 60 años. Últimamente se la asocia al grupo de enfermedades autoinmunes y en el estudio del Líquido Céfalo Raquídeo cursa con aumento de IgG, con presencia de bandas oligoclonales.Los anticuerpos que se forman, se dirigen contra las neuronas y los nervios terminales del sistema Gabaérgico (GABA). El antígeno dominante reconocido por estos anticuerpos es la enzima Glutámico descarboxilasa (GAD).
Los síntomas se inician de manera insidiosa con dolor y rigidez de los músculos axiales, particularmente en el cuello y región lumbar. La rigidez de los músculos axiales progresa lentamente hasta afectar a los músculos proximales de los miembros, causando dolor y dificultad para realizar movimientos voluntarios; pérdida de la flexibilidad troncal y requerimiento de ayuda para caminar; y marcha robótica (marcha lenta y rígida).Intensos espasmos musculares son desencadenados por movimientos bruscos, estímulos externos como ruidos o manipulación de las partes del cuerpo afectadas y estímulos emocionales.Pueden ser severos y dolorosos con fuerza suficiente para causar fracturas de huesos.Pérdida de reflejos posturales: caída de los pacientes a la deambulación.Las actividades de la vida diaria, como levantarse de la cama, vestirse, o sentarse en una silla son muy limitadas; si no tienen una persona que les ayude, los pacientes permanecen encamados
Una pequeña minoría se presentan asociados a neoplásias como cáncer de mama, pulmonar microcítico, enfermedad de Hodgkin y el cáncer de colon.En el suero se detectan AC anti-anfifisina.Algunos pacientes responden con glucocorticoides o extirpación del tumor.Responde a tratamiento con Diazepan
Síndrome de Eaton-Lambert
El síndrome de Eaton-Lambert es un trastorno con síntomas muy similares a los de miastenia grave, en el cual se presenta una debilidad muscular relacionada con el bloqueo de la comunicación entre los nervios y los músculos.Se debe a una respuesta autoinmune contra canales de calcio presinápticos. Es poco frecuente. Más frecuente en hombres que en mujeres (proporción 5:2). En el 70% de los hombres (40% de mujeres) se asocia a neoplasia, como síndrome paraneoplásico, especialmente carcinoma de células pequeñas.
Menos frecuentemente, puede observarse en cáncer de mama, cáncer de próstata,
cáncer de estómago, cáncer de recto, linfomas. En casi un tercio de los casos no se encuentra tumor asociado, especialmente en casos infantiles.
El primer caso reportado lo presenta Anderson y col, hacia el año 1953, y la referencia cita que se trató de un hombre de 47 años con carcinoma bronquial quien presentó debilidad muscular progresiva e hiporreflexia y apnea prolongada posterior a la administración de succinilcolina. Tres años después, durante el encuentro de la Sociedad Americana de Fisiología, los señores Lambert, Eaton y Rooke presentaron un informe de seis pacientes con transmisión neuromuscular defectuosa asociada a neoplasias. En 1957 Eaton y Lambert describieron las características clínicas y electrofisiológicas del síndrome miasténico.
CLINICA:Síndrome caracterizado por paresia (debilidad) acusada de los músculos proximales (cinturas escapular y pelviana), del tronco y de las extremidades inferiores.Puede presentar hiporreflexia (reflejos ostotendinosos apagados) si bien es rara la arreflexia (abolición completa de los reflejos), hallazgo que obliga a plantear la posibilidad de una polineuropatía. El
síndrome puede acompañarse de parestesias, dolor periarticular y disfunción vegetativa (sequedad de boca, estreñimiento, dificultad miccional, impotencia). Estos síntomas son raros en la miastenia gravis.
Diagnóstico:Muestra marcada sensibilidad al curare y una respuesta a la neostigmina poco llamativa.La electromiografía es útil para confirmar el diagnóstico:Estimulación repetitiva: a frecuencias elevadas de estimulación (50 estímulos por segundo), puede ponerse de manifiesto respuestas de incremento patológicas (>150% de incremento de la amplitud). Una contracción voluntaria del músculo durante 10-15 segundos, provoca una llamativa potenciación postetánica. Electromiografía de fibra simpleLa existencia de un cuadro miasteniforme tipo Lambert-Eaton, puede confirmarse por el estudio electromiográfico compatible (que permite descartar una causa secundaria a citostáticos o infiltración metastásica)y por la existencia de anticuerpos contra canales del calcio. Éste puede responder a tratamiento de recambio plasmático, a diferencia de los SPN del sistema nervioso central como la encefalomielitis paraneoplásica.El diagnóstico diferencial debe hacerse fundamentalmente con la miastenia gravis, que suele debutar con insuficiencia (fracaso funcional) respiratoria.
Tratamiento:El síndrome se alivia con poliquimioterapia. Si el tratamiento no es satisfactorio, puede ser beneficioso administrar diaminopiridina, 10-25 mg por vía oral, 4 veces al día. Los síntomas empeoran con la utilización de antagonistas del calcio por lo que éstos fármacos están contraindicados en este síndrome.
Miastenia Gravis.
Un 10% de los pacientes miasténicos son portadores de una timoma y 90% de ellos presentan un anticuerpo detectable en suero que es dirigido contra el receptor de acetilcolina post sináptica a nivel de la placa motora. Como consecuencia hay disminución del número de receptores necróticos a ese nivel.Clínicamente se manifiesta como déficit motor fluctuante por falla intermitente de la transmisión neuromuscular. La electromiografía revela respuesta motora que disminuye a baja frecuencia de estimulación nerviosa,La evolución es independiente de la remoción del tumor, incluso pudiendo progresar. El cuadro clínico en general es más difícil de controlar en los pacientes con timoma que en aquellos que no lo presentan.
La presencia de anticuerpos contra receptores de acetilcolina en un paciente con manifestaciones clínicas compatibles con la miastenia gravis confirma el diagnóstico El tratamiento de esta entidad es controvertido y debe ser individualizado, ya que no existe un régimen terapéutico uniforme para todos los pacientes. Entre los tratamientos disponibles se destacan los fármacos anticolinesterásicos, los corticosteroides, la plasmaféresis, la inmunoglobulina, los inmunosupresores y la timectomía.
Neuropatía
En esta entidad se afecta básicamente el axón respetándose relativamente la mielina.
La característica típica en el estudio histológico es la de una gangliorradiculitis. La NSS paraneoplásica es infrecuente, se asocia con el Ca microcítico en el 77% de los casos y puede preceder al diagnóstico de Ca pulmonar en meses.
En un adulto con polineuropatía periférica e historia de tabaquismo prolongado, la seropositividad de los autoanticuerpos nucleares anti-neuronales tipo 1 (ANNA-1) también denominados Anti-Hu es un marcador de Ca microcítico de pulmón.
Estos anticuerpos pueden detectarse en pacientes con Ca microcítico sin síntomas neurológicos pero no en personas sanas.
Los ANNA-1 están presentes tanto en el líquido cefalorraquídeo como en el suero de pacientes con neuropatía sensitiva paraneoplásica.
También se detectan en otros SP neurológicos existentes en el Ca microcítico como la encefalopatía límbica.La lesión se ubica principalmente en ganglios de las raíces dorsales , con degeneración neuronal infiltrado linfocitario. Secundariamente se produce degeneración de raíces posteriores, de cordones posteriores de la médula espinal y de raíces periféricas sensitivas.
Anticuerpos:Se trata de anticuerpos IgG que reconocen específicamente a proteínas de peso molecular entre 35 y 40 kDa expresadas en las neuronas y en las células del Ca microcítico y que constituyen una familia de proteínas fijadoras de RNA. Estos autoanticuerpos pueden no ser perjudiciales, aunque la amplia distribución de sus antígenos en el sistema nervioso refleja la gran diversidad de síndromes paraneoplásicos descritos en los portadores de anticuerpos ANNA-1. Clínica: La NSS se caracteriza por el desarrollo subagudo de alteraciones asimétricas sensoriales como dolor, parestesias y entumecimiento que afecta distalmente a las extremidades, se acompaña de una ataxia sensorial que suele ser incapacitante. Los reflejos tendinosos profundos están abolidos, mientras que la función motora está preservada. Se asocia a alteraciones autonómicas (estreñimiento, síndrome sicca, e hipotensión ortostática
Los mecanismos para determinar este síndrome paraneoplásico aún no han sido establecidos. No hay relación entre la evolución del tumor y de la enfermedad.En algunos pacientes al tratar el cáncer mejora la miopatía pero también hay otros que tienen mejoría espontánea. La respuesta a corticoides es similar a la de los no paraneoplásicos.La mayoría de los pacientes mueren por complicaciones del tumor.
Diagnóstico:Al inicio de la enfermedad el estudio neurofisiológico puede ser normal, pero posteriormente se produce una ausencia o disminución de los potenciales sensitivos y evocados somatosensoriales.Tratamiento:: El manejo de este síndrome incluye el tratamiento del Ca subyacente, aunque generalmente no suele mejorar el cuadro neurológico que progresa de forma rápida. Con escasos resultados se han utilizado los corticoides, plasmaféresis, ciclofosfamida y azatioprina.
Neuropatía sensitivo motora.La incidencia de neuropatía periférica en pacientes con cáncer varía del 2 a 3% si es clínica o de un 37 a 50% si es electrofisiológica. Se puede asociar a cualquier cáncer pero es más frecuente en cáncer pulmonar, linfoma y mieloma múltiple.Puede preceder el diagnóstico del tumor hasta en cinco años.Se presenta con déficit motor sensitivo distal y simétrico, mayor en extremidades inferiores y con pérdida de reflejos osteotendinosos . La progresión es lenta, en semanas a meses.
Neuropatía Autonómica: Se presenta con trastornos gastrointestinales, vejiga neurogénica, distrofia simpática refleja, hipotención ortostática , alteraciones pulmonares, disfunción de glándulas sudoríparas e impotencia. Es producto de lesión de nervios simpáticos y parasimpáticos y de ganglios de raíces dorsales.
Dermatomiositis-Polimiositis
Aproximadamente el 10% de los pacientes con estas miopatías constituyen síndrome paraneoplásicos. La asociación con cáncer es más notoria en pacientes mayores de 40 años y con dermatomiositis. En 60 a 80% de los casos el déficit neurológico precede al diagnóstico del tumor. Las neoplasias más frecuentes son cáncer de mama, ovario y útero en mujeres y cáncer pulmonar y gástrico en hombres.Clínicamente es similar al cuadro no paraneoplásico, es decir, hay paresia proximal, alteraciones cutáneas en dermatomiositis, CPK aumentada en suero y alteraciones electromiográficas características (potenciales miopáticos) como también de la biopsia muscular (inflamación y necrosis de fibras musculares).
Presentó
Dra Mariana Perez Antueno
Médica oncóloga radioterapeuta
Centro Médico VIDT
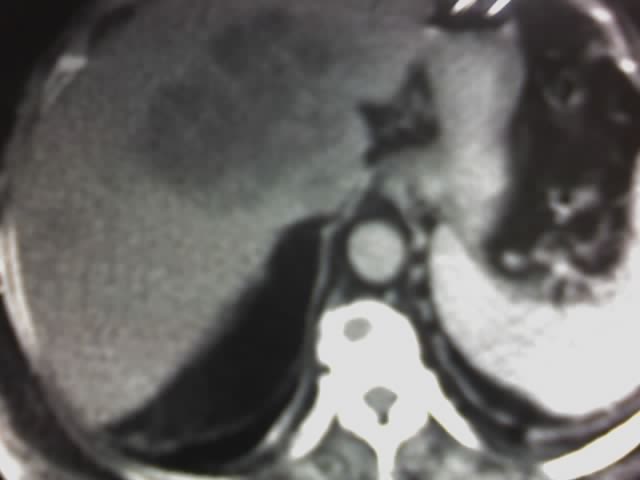
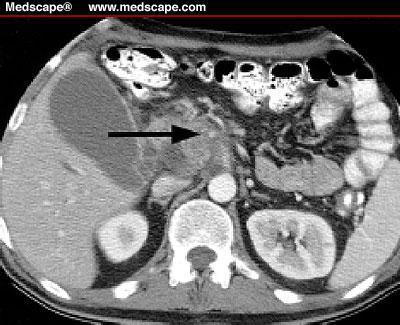 Un paciente de 69 años con cancer de páncreas en estadio no quirúrgico, estaba siendo tratado con Gemcitabina y 5-fluorouracilo (5-FU) asociado a radioterapia antálgica con buena respuesta, comienza con anorexia, nauseas, y malestar general seguido de cefalea, irritabilidad y confusión, calambres y debilidad generalizada.
Un paciente de 69 años con cancer de páncreas en estadio no quirúrgico, estaba siendo tratado con Gemcitabina y 5-fluorouracilo (5-FU) asociado a radioterapia antálgica con buena respuesta, comienza con anorexia, nauseas, y malestar general seguido de cefalea, irritabilidad y confusión, calambres y debilidad generalizada.