Historia
Clínica
 |
| Hospital "Dr. Ángel Pintos" de Azul |
Sexo: masculino Edad: 60 años
ANTECEDENTES
1994: Se detecta con motivo de Colecistectomía por
colecistitis aguda tumor bilateral de
glándulas suparrenales . Es estudiado
posteriormente a la resolución del cuadro agudo con resultados de
catecolaminas aumentadas, tensión
arterial elevada e imágenes ecográficas y RMN. Se deriva al paciente al
Hospital Ramos Mejía (Dra. Judith Yampey: Jefa del Departamento de Endocrinología).
Juntamente con la Dra. Susana Lupi, recomiendan repetir análisis de
catecolaminas en el Hospital Gutierrez con la Dra. Marta Barontini, quién
confirma los análisis de laboratorio con AVM elevado, Noradrenalina alta y
Adrenalina normal. Se confirma diagnóstico de feocromocitoma bilateral en
glándulas suprarrenales mediante centellograma con IMBG (
Iodo-Metil-Bencil-Guanidina) realizado por parte del Dr. Ibazeta en la ciudad
de Azul donde se detecta localización
solamente suprarrenal del trazador. Se
deriva nuevamente al Hospital Ramos Mejía para práctica quirúrgica de
suprarrenalectomía bilateral a cargo del Dr. Lami. La cirugía dura 8 horas. Con
posterior normalización de valores catecolaminas y descenso de tensión
arterial. Tratado con una dosis diaria
supletoria de 30 mg. diarios de hidrotisona.
2000: Se realizan análisis genéticos en Hospital
Gutierrez cotejados por CONICET y Centro Especializado de Alemania, que
confirman el origen genético del feocromocitoma y la enfermedad de Von Hippel
Lindau. Se realiza la misma práctica a su padre con resultados negativos. Se
sospecha dos orígenes: de su madre fallecida en 1963 de tumor de cerebro con
antecedentes de pérdida de visión en un ojo, que podría atribuirse a presencia
de hemagioblastoma.
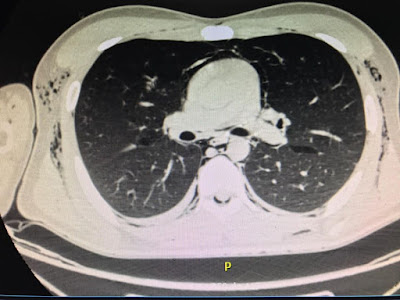
2006: Consulta por dolor abdominal. Se detecta por
Ecografía, TC y RM lesión tumoral en
cabeza de páncreas ( tamaño 11 cm.) Se deriva al Dr. Alejandro Oría, se realiza
biopsia cuyo resultado es tumor
neuroendocrino, con imposibilidad de resecarlo por alto riesgo quirúrgico .
Se trata el mismo con radioquimioterapia. Se
realizan prácticas con 25 rayos tridimensionales y quimioterapia endovenosa con
Streptotocin, Fluracilo y Cortisona, durante 1 año y medio cada 14 días.
Resultados poco satisfactorios reduciéndose la lesión pancreática a 7,4 cm.
2008: Se practica cirugía bilateral por presencia de
feocromocitoma en glándulas suprarrenales a su hijo. Se confirma la existencia
de la enfermedad de VHL mediante análisis en Hospital Gutierrez. A los pocos
meses se diagnostican hemagioblastomas multiples cerebelosos y se somete a 5
neurocirugías. Fallece el 2 de Junio de 2015.
2009- 2010: Se detecta imagen dudosa en riñón
izquierdo en uno de los múltiples quistes simples localizados en ambos riñones,
adoptando una conducta expectante hasta abril de 2010, en que aparece
hematuria. Se realiza nefrectomía de riñón izquierdo, y biopsia con resultados
positivos de presencia de tumor renal de células claras, asociado a la
enfermedad de base. Los valores de creatinina son anormales entre 1.9 y
2.6. por Insuficiencia Renal Crónica.
2010-2012: Se detectan imágenes dudosas en hígado y
bazo, las que no fueron tratadas, por confirmarse mediante biopsias su origen
benigno. Las mismas fueron
desapareciendo en los controles de imágenes posteriores, focalizándose el
tratamiento en el seguimiento de riñón derecho y páncreas. Una vez al año se
tomaron imágenes de cerebro y cerebelo (RM) sin detectarse la presencia de
hemagioblastomas, al igual que en los controles oftalmológicos.
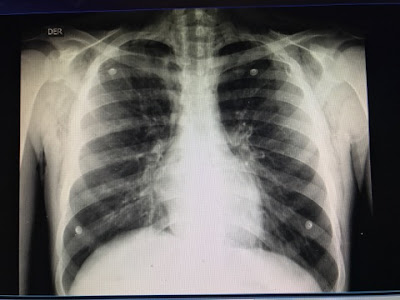
2012: En un control de imágenes se detectan nódulos
de 1 cm. en ambos pulmones. Ante el
crecimiento de una de ellos, localizado en pulmón derecho se realiza
videotoracoscopia y resección de
metástasis de origen renal (células claras). En sucesivos controles aparecen
nuevas lesiones en ambos pulmones de lento crecimiento pero sospechadas de
tener el mismo origen.
2013: En agosto se resuelve una nueva cirugía en
ambos pulmones. Se extraen 4, de las cuales 3 confirman la presencia de
metástasis de origen renal y 1 benigna.
En septiembre, se detecta por tomografías una imagen quística dudosa en el polo
inferior del riñón derecho y por resonancia con alta definición y se confirma
la presencia de una lesión presumiblemente Bostknia III o IV. Previsible de acuerdo
a la evolución de la enfermedad de VHL. En consulta con oncólogo se resuelve
reiniciar tratamiento con quimioterapia, previo ateneo con urólogo y nefrólogo,
ya que la práctica de nuevas cirugías no dieron resultados favorables para la
eliminación total de las lesiones y con alto riesgo quirúrgico y postquirúrgico
de realizar nuevas prácticas. (El tamaño del nódulo es de 3,6 cm. no
presentando modificaciones significativas hasta el último estudio realizado el
2-05-17)
10-09-2013 al 1-09-2014: Tratamiento con sunitinib de
administración oral durante 28 días seguidos y 14 días de descanso. Controles
de laboratorio mensuales, cardiológicos cada 3 meses e imágenes con TC con
contrates oral, para seguir la evolución de las lesiones y efectividad del
tratamiento. El uso del antiangiogénico
tiene múltiples efectos colaterales. Se logra reducir algunas lesiones y el
resto se mantienen sin cambios significativos, salvo el tumor pancreático que
disminuye a 6 cm. Debido a la alta toxicidad y la estabilización de las
lesiones se suspende el tratamiento.
2-09-2014 al 03-03-2016: Sin tratamiento con
quimioterapia. En 2015 en uno de los controles de rutina se detecta un valor de
150 en ayunas de glucemia.
2016: En el control de imágenes se detectan
crecimientos en las lesiones pulmonares confirmándose lo anticipado por los
oncólogos de iniciar un nuevo tratamiento con pazopanib, via oral 400 mg./d. Se
aumenta la dosis a 600 con vista a lograr la dosis de uso de 800. Por efectos
colaterales, especialmente frecuentes diarreas y estado del paciente, se reduce
la dosis a 400 que se mantiene hasta la actualidad.
El 24-05-2016 se realiza un control con
Centellograma Oseo sin resultados de secundarismos.
En Junio de 2016, se detecta Poliglobulia, y aumento
de la EPO, de El aumento de la EPO se atribuye a la enfermedad de base y
también al uso de pazopanib. En abril 2017 se realizó el control de RM cerebral
ante la presencia de vértigo, no detectándose la presencia de hemangioblastomas.
El último control con TC del 2-05-2017 indica que no
existen modificaciones significativas de las imágenes nodulares. El control
hematológico del 22-05-2017 indica Hemograma normal.
EN RESUMEN:
- Feocromocitoma bilateral
- Tumor neuroendocrino pancreático
- Carcinoma renal de células claras
- Análisis genético positivo para VHL
- Antecedentes familiares: madre fallecida por
probable hemagioblastoma, 1 hijo con feocromocitoma bilateral fallecido por hemangiomatosis cerebelosa. Enfermedad
de Von Hipell Lindau.
ENFERMEDAD DE VON HIPPEL-LINDAU
La enfermedad de Von Hippel-Lindau (EVHL) es una
alteración multisistémica caracterizada por la aparición de neoplasias
múltiples, entre las que se incluyen hemangioblastomas de la retina y del
sistema nervioso central (SNC) (principalmente del cerebelo y la médula
espinal), carcinoma renal de células claras, feocromocitoma, quistes del
páncreas, riñón, hígado y epidídimo y, según se recoge en un estudio muy
reciente, tumores del saco endolinfático1.
Los primeros casos descritos de este proceso se
remontan a hace más de un siglo, aunque se conoce con este nombre sólo desde
1932. Eugene Von Hippel fue el primero en describir, en 1904, como
hemangioblastomas los tumores de la retina. Arvid Lindau, en 1926, fue quien de
modo definitivo asoció los hemangiomas retinianos con los del SNC y los
procesos viscerales2,3.
Se trata de una enfermedad con una herencia
autosómica dominante, de alta penetrancia, determinada por la alteración de un
gen (gen VHL) localizado en el brazo corto del cromosoma 3 (3p25.5)4. Este gen
tiene las características de un gen supresor tumoral, que responde al modelo
two-hits5. Según este modelo, en los procesos cancerosos hereditarios debidos a
un gen supresor tumoral, los pacientes heredan del padre afectado el alelo
mutado (mutación germinal) (first-hit), que les predispone a desarrollar el
tumor, pero se precisa una segunda mutación en el alelo normal, que procede del
padre sano (mutación somática) (second-hit), para que el tumor aparezca, ya que
sólo cuando las 2 copias de un gen supresor tumoral están inactivadas, aparece
la neoplasia. La alteración del alelo normal se produciría por mutaciones
puntuales o por hipermetilación6.
El gen VHL se localizó en el brazo corto del
cromosoma 3 en 19887, fue clonado en 19938 y está compuesto por tres exones.
Estos tres exones codifican una proteína VHL, de aproximadamente 30 kD,
compuesta por 213 aminoácidos. Esta proteína se une a las proteínas denominadas
elonguinas B y C y cullina 2, que regulan la elongación de la transcripción
mediada por la ARN-polimerasa II. Las mutaciones en el gen VHL comprometen la
capacidad de unión de la proteína VHL a las elonguinas B y C, siendo ésta
incapaz de secuestrarlas, lo que estimula la actividad de la ARN-polimerasa II
y aumenta la transcripción génica9,10. De todos modos, todavía no se conocen
cuáles son los genes regulados por la proteína VHL, que probablemente se
activan sólo en algunos tejidos específicos, en los que se desarrollan los
tumores11. Las elonguinas y la cullina parecen actuar, especialmente, sobre
proteínas reguladoras de algunos ARN mensajeros (ARNm) inducibles por hipoxia
(como los ARNm del factor de crecimiento endotelial o del factor de
permeabilidad vascular), lo que se ha relacionado con la naturaleza altamente
vascularizada de los tumores de EVHL y con su capacidad para producir péptidos
angiogénicos12,13.
EPIDEMIOLOGÍA
La EVHL es un proceso infrecuente con una incidencia
estimada de entre 1/36.000 y 1/45.000 nacidos vivos. La prevalencia de
portadores se ha calculado entre 1/53.000 y 1/85.000 habitantes14,15, siendo
más elevada (1/39.000) en la Selva Negra alemana, donde las distintas familias
afectadas parecen tener un ancestro común16-18.
CLÍNICA
La expresividad clínica de la EVHL es muy
heterogénea. Cada familia afectada puede presentar diferentes manifestaciones
de la enfermedad, según los distintos tipos y localizaciones de las mutaciones
del gen. El National Cancer Institute de EE.UU. propuso en 1995 la
clasificación de la EVHL en dos tipos: tipo 1, cuando no presenta feocromocitoma,
y tipo 2, cuando lo presenta 19,20. La edad de aparición de las lesiones
tumorales (hemangioma, feocromocitomas, carcinoma renal, etc.) es mucho más
temprana que cuando estos procesos se presentan aislados. El 80% de las
lesiones son clínicamente aparentes antes de los 40 años21 y a los 50 años el
95% de los afectados ya ha desarrollado una o más alteraciones2. A pesar de
tratarse de un síndrome pluritumoral, en algunas series, la mitad de los
afectados presenta alteración en un solo órgano16.
Según la revisión de Neumann y Wiestler16, en la que
se recogen las características de las familias con más de 8 miembros afectados,
las manifestaciones más frecuentes son los hemangioblastomas del SNC y los
angiomas de la retina que aparecen entre el 8 y el 100% de los casos. Los
hemangioblastomas del SNC son tumores generalmente quísticos, de crecimiento
lento. Aparecen en el cerebelo (el 60-80% de casos), el bulbo raquídeo o la
médula espinal, raramente son supratentoriales o se localizan en el nervio óptico
y, en ocasiones, pueden ser múltiples15,22. Clínicamente, pueden presentarse
como un síndrome cerebeloso, con hidrocefalia, hipertensión endocraneana,
sangrado o siringomielia2,3. Según un registro regional de tumores en el norte
de Inglaterra15, el 14% de los hemangioblastomas del SNC forman parte de una
EVHL y constituyen, junto con el carcinoma renal, las causas de muerte más
frecuentes de los pacientes con EVHL12,15,21.
Los hemangiomas retinianos son una de las primeras
alteraciones en aparecer, incluso durante la primera década de la vida, aunque
sus manifestaciones clínicas son posteriores2,23. Son tumores vasculares
benignos, múltiples en más de la mitad de los casos, bilaterales (el 20% de los
casos) y recurrentes24. Si no se identifican en fases tempranas y se tratan,
evolucionan a la ceguera del ojo afectado, por hemovítreo.
El carcinoma renal de células claras se presenta
aproximadamente en el 40% de los casos (entre el 13 y 91%)16,25. A diferencia
de los casos aislados, no es más frecuente en los varones y puede ser
multifocal. En las series más antiguas, se diagnosticaban con metástasis en el
50% de los casos y eran la causa de muerte en un tercio de los individuos
afectados por la EVHL2. Los quistes renales, también muy frecuentes, a menudo
albergan carcinomas.
Los feocromocitomas se presentan aproximadamente en
el 20% de los pacientes20, aunque existen familias de EVHL en las que el
feocromocitoma es mucho más frecuente4,26,27, e incluso puede ser la única
manifestación de la enfermedad28,29. En este último caso, se ha sugerido
clasificar a los pacientes como tipo 2C12. Pueden ser adrenales o
extraadrenales30 y son generalmente benignos, aunque existen casos de
malignidad26. La presentación clínica del feocromocitoma en la EVHL se diferencia
de los casos aislados en que son de aparición temprana, incluso aparecen
durante la primera década4, bilaterales (50%) y, en ocasiones, poco
sintomáticos31. Si constituyen la primera manifestación de la EVHL, pueden
confundirse con casos aislados o con feocromocitomas familiares26,27,32-35.
Los quistes pancreáticos y hepáticos parecen menos
frecuentes, quizá porque no todas las series los registran (entre el 7-60% de
los casos)16 y son de comportamiento generalmente benigno. En el páncreas, los
cistadenomas pueden ser múltiples, afectando a toda la glándula36.
El cistadenoma del epidídimo aparece en la mitad de
los varones afectados37 y se localiza principalmente en la cabeza del conducto.
Pueden ser palpables, de tamaño en general inferior a los 2 cm, sólidos o
quísticos, uni o bilaterales y de curso benigno. En las mujeres, se han
descrito algunos casos de cistadenomas papilares en el ligamento redondo, de
características histológicas muy semejantes a las descritas en el epidídimo38.
La última lesión que se ha asociado a la EVHL ha
sido el tumor del saco endolinfático. Cuando se estudió detenidamente la
función auditiva de una serie de 121 pacientes con EVHL, la prevalencia de
trastornos auditivos fue muy elevada (> 65% de casos y bilateral en >
50%), con una incidencia de tumores del saco endolinfático del 11%1,39.
La bibliografía recoge otras lesiones esporádicas en
el tiroides, el pulmón, el epiplón, meninges, el hueso, la piel, etc., que no
se han llegado a establecer como manifestaciones propias de la enfermedad3,17.
Los tumores renales y los hemangioblastomas pueden acompañarse
de un aumento de eritropoyetina, asociado a la policitemia, que presentan entre
el 10-20% de los hemangioblastomas3 y a la producción de factores de
crecimiento y permeabilidad vascular, a los que se atribuye la
hipervascularización de dichos tumores13.
DIAGNOSTICO Y SEGUIMIENTO CLINICO
Hasta el descubrimiento del gen causante de la
enfermedad, el diagnóstico se realizaba, siguiendo los criterios establecidos
por Melmon y Rose en 1964, en aquellos pacientes con más de un hemangioblastoma
del SNC o con un único hemangioma, asociado a otra de las manifestaciones
viscerales de la enfermedad, y en aquellos que presentaban una sola
manifestación, cuando existía historia familiar positiva3. Neumann et al32, en
1993, diagnosticaron clínicamente la EVHL en el 19% de los pacientes afectados
de feocromocitomas, por lo que recomendaron descartarla en todos los
feocromocitomas aislados. Posteriormente, al analizar las mutaciones en dicho
grupo de pacientes, se descubrió que la gran mayoría tenían la misma mutación y
que existía entre ellos un "efecto fundador" que explicaba el alto
porcentaje de afectados18,40. Recientemente, Brauch y Bar18,41, en sujetos con
feocromocitoma esporádico, sin antecedentes familiares, sólo encontraron
mutaciones del gen VHL en un 3,7 y un 3% de los casos, por lo que sostienen que
la EVHL es rara y no debe descartarse clínicamente en los casos de
feocromocitoma aislado.
Cuando se siguen pacientes con EVHL o se estudia a
los portadores de la mutación, la historia de los antecedentes familiares debe
ser detallada, ya que el tipo de manifestación clínica y la cronología de su
presentación dependen de cada familia. Actualmente, muchas de las
manifestaciones pueden y deben diagnosticarse antes de su expresividad clínica.
Los hemangioblastomas del SNC se diagnosticarán por resonancia magnética
nuclear (RMN) con contraste y estudio angiográfico42, el feocromocitoma por
determinación periódica de catecolaminas en orina, los hemangiomas retinianos
por oftalmoscopia indirecta, el carcinoma renal y los quistes pancreáticos y
hepáticos por tomografía computarizada (TC), y el cistadenoma del epidídimo por
ecografía. En cuanto al tumor del saco endolinfático, los pacientes al
diagnóstico deben ser estudiados detenidamente por ORL, con estudios audiométricos,
potenciales evocados auditivos y RMN del peñasco del temporal.
El seguimiento de los individuos clínicamente
afectados y de los portadores asintomáticos de la mutación debe abordarse desde
una perspectiva multidisciplinaria12 y mantenerse desde el diagnóstico hasta
los 50 años, ya que es raro que aparezcan manifestaciones por encima de esta
edad2, aunque se han descrito casos de portadores que no manifiestan la
enfermedad a los 65 años43. La pauta de exploraciones sistemáticas indicada es
la siguiente2,4,44: estudio del fondo del ojo anual por oftalmoscopia indirecta
desde los 5 años, determinación anual de catecolaminas en orina desde los 5
años, RMN craneal bianual desde los 15 años, ecografía o TC abdominal bianual a
partir de los 20 años, y estudio auditivo, con una periodicidad todavía no
establecida, con exploración por RMN del peñasco del temporal en cuanto
aparezcan síntomas auditivos1; tampoco está establecida la edad para practicar
la ecografía para descartar los cistadenomas del epidídimo. La aparición de
cualquier síntoma o alteración en las exploraciones sistemáticas llevará a
agotar las posibilidades diagnósticas. Las imágenes de lesiones renales, cuando
aparecen, deben seguirse mediante TC semestral45. El coste del seguimiento clínico
de un portador durante 20 años, sin estudio ORL, se ha calculado en 13.000
dólares4 (unos 2 millones de pesetas al cambio).
DIAGNOSTICO MOLECULAR
Confirma el diagnóstico clínico y permite
identificar a los familiares asintomáticos. Debe realizarse en los casos índice
y en sus familiares directos. Las mutaciones en el gen de la EVHL se detectan
sólo en el 80% de las familias afectadas. Hasta la fecha, se han descrito más
de 500 mutaciones46 (http://www.umd.necker.fr). Este gran número de mutaciones
dificulta la correlación del genotipo con las diferentes manifestaciones
fenotípicas. Cada mutación puede llegar a tener una expresión fenotípica
característica. Se han descrito muy pocas mutaciones iguales en más de 2
familias, lo que indica que tienen un origen reciente, ya que de lo contrario
se identificaría la misma mutación en un mayor número de familias, con un
probable ancestro común29. De acuerdo con esta observación, se han descrito
familias con mutaciones aparecidas de novo47.
Las mutaciones se han descrito en los tres exones
del gen, especialmente en el 1 y el 3: extremo 5' del exón 3 y 3' del exón 1,
siendo más raras en el exón 2. Las mutaciones son distintas según se trate de
familias tipo 1 o tipo 2. Las mutaciones descritas en familias tipo 1 son
microdeleciones, inserciones, macrodeleciones, mutaciones que dan lugar a un
cambio en el marco de lectura y mutaciones que producen un codón de paro,
situadas frecuentemente en el exón 1. En las familias tipo 2, se identifican
mutaciones puntuales con mayor frecuencia (entre el 85-96% de los casos)41,
especialmente en el exón 3, en los nucleótidos 712 o 713, que resultan en la
sustitución de la arginina por triptófano o glutamina en el codón 23820,34,35.
Este tipo de mutación se asocia a un riesgo para desarrollar feocromocitoma del
62%. Las mutaciones en los codones situados en los extremos del gen,
probablemente, cambian poco la conformación de la proteína VHL y se asocian a
las familias tipo 226,34, con escasas manifestaciones, a excepción del feocromocitoma,
que puede ser la única manifestación de la enfermedad28.
Distintas mutaciones en el mismo codón provocan
cambios que dan lugar a diferentes aminoácidos y a distintas expresiones
fenotípicas, lo que puede reflejar un fenotipo específico para cada distinta
sustitución de aminoácidos o un fenotipo variable, o simplemente, que el
fenotipo no esté totalmente expresado en el momento del estudio genético26.
El gen VHL mutado se ha descrito no sólo en los
pacientes afectados de EVHL, sino también en el tejido tumoral de los
carcinomas de células claras, en hemangioblastomas del SNC y en cistadenomas
del epidídimo de casos esporádicos19,48,49.
El diagnóstico molecular tiene un coste aproximado
de 45.000 pesetas. Aunque la incidencia de la EVHL en los casos de
feocromocitoma aislado sea baja y se haya aconsejado limitar el análisis
genético a los casos de presentación clínica atípica (familiar, temprana y
múltiple)34,41, como indican Brauch et al18, valorando el coste-beneficio del
diagnóstico de un caso índice, puede estar indicado realizar dicho estudio
molecular en los casos de feocromocitoma esporádico y probablemente la misma
consideración deba aplicarse a otros de los tumores relacionados con la EVHL
(hemangioblastomas, angiomas retinianos o carcinoma renal). El diagnóstico
molecular permite, además, el consejo genético a los afectados por la mutación.
Como inconveniente del diagnóstico molecular, cabe
señalar que entre el 20-38% de las mutaciones escapan a la detección,
especialmente en familias con EVHL tipo 112,20,29.
TRATAMIENTO
Por tratarse de procesos neoplásicos, el tratamiento
debe ser quirúrgico y supone la implicación de distintas especialidades para
cada proceso. Cuanto más temprano sea el diagnóstico, menor será el tamaño del
tumor, la resección quirúrgica podrá ser más radical y supondrá menor riesgo de
complicaciones. Los hemangioblastomas del SNC se intervendrán, en función de su
tamaño y localización, cuando las lesiones sean sintomáticas. La radioterapia o
la radiocirugía pueden ser útiles en los casos no extirpables o residuales50.
Los hemangioblastomas de la retina son susceptibles de fotocoagulación y
crioterapia, especialmente efectivas en lesiones pequeñas o de vitrectomía si
existe sangrado.
El carcinoma renal de células claras precisa de una
cirugía conservadora con escisiones lo menores posible, ante la posible
aparición de nuevos focos tumorales51. La cirugía radical debe reservarse para
tumores de más de 5 cm52. En los casos de nefrectomía bilateral que se someten
a trasplante, no se ha descrito que la terapia inmunosupresora aumente el
riesgo de recurrencia tumoral53. El feocromocitoma tiene el mismo tratamiento
que en los casos esporádicos, siendo preciso descartarlo en todos los pacientes
afectados de la EVHL, antes de la intervención por cualquier otro proceso. Los
tumores del saco endolinfático deben resecarse completamente, de lo contrario
existe un alto índice de recurrencias, aunque el riesgo de pérdida auditiva por
iatrogenia quirúrgica es considerable, si el tumor no es muy pequeño1. Los
quistes hepáticos, pancreáticos y del epidídimo son raramente sintomáticos y no
suelen intervenirse.
Pese a los grandes progresos que se han producido en
los últimos 5 años en el conocimiento de esta enfermedad, es preciso
desentrañar los mecanismos de actuación de la proteína del gen VHL para
desarrollar nuevas estrategias terapéuticas dirigidas a inhibir el crecimiento
tumoral12. Por el momento, el diagnóstico temprano de los casos índice y el
diagnóstico molecular de portadores y su seguimiento estricto son los mejores
medios para combatirla. Puesto que las lesiones tumorales de la EVHL pueden ser
aisladas, asincrónicas y de diagnóstico y de estudio por especialidades
diversas, la enfermedad puede pasar desapercibida en los casos índice. Hay que
considerar el diagnóstico de EVHL en todos los pacientes con hemangioblastomas
del SNC o la retina, feocromocitomas familiares o bilaterales, carcinomas
renales familiares o multicéntricos o de aparición temprana y tumores del saco
endolinfático bilaterales12.
Fuente: Elsevier.
Bibliografía citada
1
Manski
TJ,Heffner DK,Glenn GM,Patronas NJ,Pikus AT,Katz D et al.
Endolymphatic
sac tumors. A source of morbid hearing loss in von Hippel-Lindau disease.
JAMA, 277
(1997), pp. 1461-1466
Medline
2
Huson SM,Harper
PS,Hourihan MD,Cole G,Weeks RD,Compston DAS.
Cerebellar
haemangioblastoma and Von Hippel-Lindau disease.
Brain, 109
(1986), pp. 1297-1310
Medline
3
Melmon KL,Rosen
SW.
Lindau's
disease: review of the literature and study of a large kindred.
Am J Med, 36
(1964), pp. 595-617
Medline
4
Pheochromocytoma
in Von Hippel-Lindau disease: clinical presentation and mutation analysis in a
large, multigenerational kindred. J Clin Endocrinol Metab 1998; 117-120
5
Knudson AG Jr.
Antioncogenes
and human cancer.
Proc Natl Acad Sci USA, 90 (1993), pp. 10914-10921
Medline
6
Prowse A,Webster
A,Richards F,Richard S,Olschwang S,Resche F et al.
Somatic
inactivation of the VHL gene in Von Hippel-Lindau disease tumores.
Am J Genet, 60
(1997), pp. 765-771
7
Seizinger
BR,Rouleau GA,Ozelius LJ,Lane AH,Farmer GE,Lamiell JM et al.
Von
Hippel-Lindau disease maps to the region of chromosoma 3 associated with renal
carcinoma.
Nature (Lond),
332 (1988), pp. 268-269
8
Latif F,Tory
K,Gnarra JR,Yao M,Duh FM,Orcutt ML et al.
Identification
of the Von Hippel-Lindau disease tumor suppressor gen.
Science, 260
(1993), pp. 1317-1320
Medline
9
Takagi Y,Pause
A,Conaway RC,Conaway JW.
Identification
of elongin C sequences required for interaction with the von Hippel-Lindau
tumor suppressor protein.
J Biol Chem, 272
(1997), pp. 27444-27449
Medline
10
Kibel A,Ilopoulos O,De Caprio JA,Kaelin WG.
Binding of the
Von Hippel-Lindau tumor supressor protein to elongin B and C.
Science, 269
(1995), pp. 1444-1446
Medline
11
Bertherat J.
Von
Hippel-Lindau tumor supressor protein and transcription elongation: new
insights into regulation of gene expression.
Eur J
Endocrinol, 134 (1996), pp. 157-159
Medline
12
Maher ER,Kaelin
WG.
Von
Hippel-Lindau disease.
Medicine
(Baltimore), 76 (1997), pp. 381-391
13
Iliopoulos
O,Levy AP,Jiang C,Kaelin WG,Goldberg MA.
Negative
regulation fo hipoxia-inducible genes by the Von Hippel-Lindau protein.
Proc Natl Acad Sci USA, 93 (1996), pp. 10595-10599
Medline
14
Maher ER,Iselius
L,Yales JR,Littler M,Benjamin C,Harris R et al.
Von Hipple-Lindau
disease: a genetic study.
J Med Genet, 28
(1991), pp. 443-447
Medline
15
Maddock IR,Moran
A,Maher ER,Teare H,Norman A,Payne S et al.
A genetic
register for von Hippel-Lindau disease.
J Med Genet, 33
(1996), pp. 120-127
Medline
16
Neumann
HP.H,Wiestler OD.
Clustering of
features of Von Hippel-Lindau syndrome: evidence for a complex genetic locus.
Lancet, 337
(1991), pp. 1052-1054
Medline
17
Newman HP.H,Eng
C,Mulligan LM,Glavac D,Zäuner I,Ponder BA et al.
Consequences of
direct genetic testing for germline mutations in the clinical management of
families with multiple endocrine neoplasia, type II.
JAMA, 274
(1995), pp. 1149-1151
Medline
18
Brauch
H,Hoeppner W,Jähnig HH,Wöhl T,Engelhardt D,Spelsberg F et al.
Sporadic
pheocromocytomas are rarely associated with germline mutations in the vhl tumor
supressor gene or the ret protooncogene.
J Clin
Endocrinol Metab, 82 (1997), pp. 4101-4104
http://dx.doi.org/10.1210/jcem.82.12.4454
Medline
19
Linehan
WM,Lerman MI,Zbar B.
Identification
of the Von Hippel-Lindau gene.
JAMA, 273
(1995), pp. 564-570
Medline
20
Chen F,Kishida
T,Yao M,Hustad T,Glavac D,Dean M et al.
Germ-line
mutations in the Von Hippel-Lindau disease tumor suppressor gene: correlations
with phenotype.
Hum Mutat, 5
(1995), pp. 66-75 http://dx.doi.org/10.1002/humu.1380050109
Medline
21
Neumann HPH.
Basic criteria
for clinical diagnosis and genetic counselling in Von Hippel-Lindau syndrome.
J Vasc Dis, 16 (1987), pp. 220-226
22
Chamorro A,Saldaña C,Rodríguez R,García D.
Hemangiomas supratentoriales en la enfermedad de Von
Hippel-Lindau.
Med Clin (Barc),
91 (1988), pp. 759
23
Maher ER,Yates
JR.W,Harries R,Benjamin C,Harris R,Moore AT et al.
Clinical
features and natural history of Von Hippel-Lindau disease.
Q J Med, 77
(1990), pp. 1151-1163
Medline
24
Annesley
WH,Leonard BC,Shields JA,Tasman WS.
Fifteen years
review of treated cases of retinal angiomatosis.
Transact Am Acad
Ophthalmol Otolaryngol, 83 (1977), pp. 446-453
25
Poston CD,Jaffe
GS,Solomon D,Zbar B,Linehan WM,Walther MM.
Characterization
of the renal pathology of a familial form of renal cell carcinoma associated
with von Hippel-Lindau disease: clinical and molecular genetic implications.
J Urol, 153
(1995), pp. 22-26 http://dx.doi.org/10.1097/00005392-199501000-00009
Medline
26
Gross DJ,Avishai
N,Meiner V,Filon D,Zbar B,Abeliovich D.
Familial
pheocromocytoma associated with a novel mutation in the Von Hippel-Lindau gene.
J Clin
Endocrinol Metab, 81 (1996), pp. 147-149
http://dx.doi.org/10.1210/jcem.81.1.8550742
Medline
27
Atuk NO,McDonald
T,Wood T,Carpenter JT,Walzack MP,Donaldson M et al.
Familial
pheocromocytoma, hypercalcemia and Von Hippel-Lindau disease: a ten years study
of a large family.
Medicine
(Baltimore), 58 (1979), pp. 209-218
28
Ritter
MM,Frilling A,Crossey PA,Höppner W,Maher ER,Mulligan L et al.
Isolated
familial pheochromocytoma as a variant of Von Hippel-Lindau disease.
J Clin
Endocrinol Metab, 81 (1996), pp. 1035-1037
http://dx.doi.org/10.1210/jcem.81.3.8772572
Medline
29
Zbar B,Kishida
T,Chen F,Schmidt L,Maher ER,Richards FM et al.
Germline
mutations in the Von Hippel-Lindau disease gene in families from North America,
Europe and Japan.
Hum Mutat, 8
(1996), pp. 348-357
http://dx.doi.org/10.1002/(SICI)1098-1004(1996)8:4<348::aid-humu8>3.0.CO;2-3
Medline
30
Bender
BU,Altehofer C,Januszewicz A,Gartner R,Schmidt H,Hoffmann MM et al.
Functioning
thoracic paraganglioma: association with Von Hippel-Lindau syndrome.
J Clin
Endocrinol Metab, 82 (1997), pp. 3356-3360
http://dx.doi.org/10.1210/jcem.82.10.4050
Medline
31
Burgos R,Simó R,Hernández-Pascual C,Mesa J.
Feocromocitoma y enfermedad de Von Hippel-Lindau.
Med Clin (Barc),
102 (1994), pp. 797
32
Neumann
HP.H,Berger DP,Sigmund G,Blum U,Schmidt D,Parmer RJ et al.
Pheochromocytomas,
multiple endocrine neoplasia type 2 and Von Hippel-Lindau disease.
N Engl J Med,
329 (1993), pp. 1531-1538 http://dx.doi.org/10.1056/NEJM199311183292103
Medline
33
Richard
S,Beigelman C,Duclos JM,Fendler JP,Plauchu H,Plouin PF et al.
Pheocromocytoma
as the first manifestation of Von Hippel-Lindau disease.
Surgery, 116
(1994), pp. 1076-1081
Medline
34
García
A,Matías-Guiu X,Cabezas R,Chico A,Prat J,Baiget M et al.
Molecular
diagnosis of Von Hippel-Lindau disease in kindred with predominance of
pheocromocytoma.
Clin Endocrinol
(Oxf), 46 (1997), pp. 359-363
35
Crossey
PA,Richards FM,Foster K,Green JS,Prowse A,Latif F et al.
Identification
of intragenic mutations in the Von Hippel-Lindau disease tumor suppressor gene
and correlations with disease phenotype.
Hum Mol Genet, 3
(1994), pp. 1303-1308
Medline
36
Girelli R,Bassi C,Falcono M,De Santis L,Bonora
A,Caldiron E et al.
Pancreatic
cystic manifestations in Von Hippel-Lindau disease.
Int J
Pancreatol, 22 (1977), pp. 101-109 http://dx.doi.org/10.1007/BF02787467
Medline
37
Choyke PL,Glenn GM,Lubensky
IA,Lubensky IA,Thakore K,Zbar B et al.
Epididymal
cystadenomas in Von Hippel-Lindau disease.
Urology, 49
(1997), pp. 926-931
Medline
38
Werness
BA,Guccion JG.
Tumor of broad
ligament in Von Hippel-Lindau disease of probable mullerian origin.
Int J Gynecol
Pathol, 16 (1997), pp. 282-285
Medline
39
Should
endolymphatic sac tumors be considered part of the Von Hippel-Lindau complex?
Neurosurgery 1997; 40: 848-855
40
Brauch H,Kishida
T,Glavac D,Chen F,Pausch F,Hofler H et al.
Von
Hippel-Lindau disease with feocromocitoma in the Black Forest region in
Germany: evidence for a founder effect.
Hum Genet, 95
(1995), pp. 551-556
Medline
41
Bar M,Friedman
E,Jakobovitz O,Leibowitz G,Lerer I,Albeliovich D et al.
Sporadic
phaechromocytomas are rarely associated with germline mutations in the Von
Hippel-Lindau and RET genes.
Clin Endocrinol
(Oxf), 47 (1997), pp. 707-712
42
Spetzger
U,Bertalanffy H,Huffmann B,Mayfrank L,Reul J,Gilsbach JM.
Hemangioblastomas
of the spinal cord and the brainsted: diagnostic and therapeutic features.
Neurosurg Rev,
19 (1996), pp. 147-151
Medline
43
Davies DR,Norman
AM,Whitehouse RW,Evans DG.
Non-expression
of Von Hippel-Lindau phenotype in a obligate gene carrier.
Clin Genet, 45 (1994), pp. 104-106
Medline
44
Escudero D,Moral A,Pou A.
El seguimiento en la enfermedad de Von
Hippel-Lindau.
Med Clin (Barc),
93 (1989), pp. 319
45
Choyke P,Glenn
G,Walther M,Zbar B,Weiss G,Alexander RB et al.
The natural
history of a renal lesions in von Hippel-Lindau disease: a serial CT study in
28 patients.
Am J Roentgenol,
159 (1992), pp. 1229-1234
46
Beroud C,Joly
D,Gallou C,Staroz F,Orfanelly MT,Junien C.
Software and
database for the analysis of mutations in the Von Hippel-Lindau gene.
Nucleic Acids
Res, 26 (1998), pp. 256-258
Medline
47
Richards FM,Payne
SJ,Zbar B,Affara NA,Fergusson-Smith MA,Maher ER.
Molecular
analysis of the novo germline mutations in the Von Hippel-Lindau disease gene.
Hum Mol Genet, 4
(1995), pp. 2139-2143
Medline
48
Gilcrease
MS,Schmidt L,Zbar B,Troung L,Rutledge M,Wheller T.
Somatic VHL
mutation in clear cell papillary cystadenoma of the epididymis.
Hum Pathol, 26
(1995), pp. 1341-1346
Medline
49
Kanno H,Kondo
K,Ito S,Yamamoto I,Fujii S,Torigoe S et al.
Somatic
mutations of the Von Hippel-Lindau tumor supressor gene in sporadic central
nervous system hemangioblastomas.
Cancer Res, 54
(1994), pp. 4845-4847
Medline
50
Schiff D,Wen PY.
Tumores cerebrales raros.
Cl??nicas Neurol??gicas de Norteam??rica, 4 (1995),
pp. 975-998
51
Persad
RA,Probert JL,Sharma SD,Haq A,Doyle PT.
Surgical
management of the renal manifestations of Von Hippel-Lindau disease: a review
of a United Kingdom case series.
Br J Urol, 80
(1997), pp. 392-396
Medline
52
Chassagne
S,Martin X,Cloix P,Dawahra M,Bret P,Giraud S et al.
Atteintes rénales et surrénaliennes dans la maladie
de Von Hippel-Lindau: aspects cliniques et stratégies therapeutiques.
Prog Urol, 6
(1996), pp. 878-883
Medline
53
Golfarb
DA,Neumann HP,Penn I,Novick AC.
Results of renal
transplantation in patients with renal cell carcinoma and Von Hippel-Lindau
disease.
Transplantation, 64 (1997), pp. 1726-1729
Medline
La Enfermedad de Von Hippel Lindau ( o angiomatosis
del SNC) es un trastorno autosómico dominante causado por la deficiencia de un
gen supresor tumoral en el cromosoma 3p25-p26 y que se caracteriza por angiomas
retinianos, hemangioblastomas encefálicos ( generalmente cerebelosos) y de la
médula espinal, carcinomas de células renales, tumores del saco endolinfático,
feocromocitomas, cistoadenomas papilares de epidídimo, angiomas hepáticos y
renales y quistes de páncreas, riñón e hígado .
Ambos sexos se afectan por igual.
Presentó
Dr. Rodolfo H Álvarez Prat
Ex Jefe de Departamento de Clínica
Médica
Hospital “Ángel Pintos” de Azul