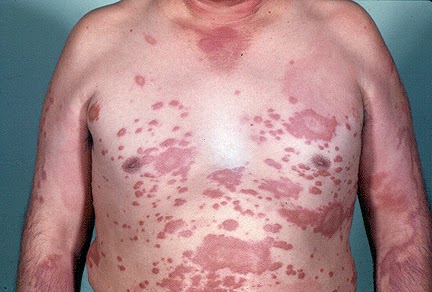
MOTIVO DE INTERNACIÓN: Ingresa
el 18/02 por deshidratación y pérdida de peso
ANTECEDENTES DE ENFERMEDAD ACTUAL:
Inicia
a principios de enero con aftas orales, múltiples y dolorosas. Consultas al
Servicio de Odontología recibiendo buches y analgésicos sin respuesta, en
varias oportunidade
El 31/01 consulta a su médico de cabecera que interpreta las lesiones como faringoamigdalitis y cumple tratamiento con amoxicilina/ácido clavulánico 500/125 mg cada 8 hs por 7 días, sin respuesta
En los 15 días previos a la consulta agrega astenia, hiporexia, odinofagia importante qe le impide la alimentación a sólidos, seleccionando solo los blandos y líquidos. MEG
El 31/01 consulta a su médico de cabecera que interpreta las lesiones como faringoamigdalitis y cumple tratamiento con amoxicilina/ácido clavulánico 500/125 mg cada 8 hs por 7 días, sin respuesta
En los 15 días previos a la consulta agrega astenia, hiporexia, odinofagia importante qe le impide la alimentación a sólidos, seleccionando solo los blandos y líquidos. MEG
•
Antec:
HTA (hidroclorotiazida 25 mg día y enalapril 10 mg día), ex tabaquista, ACV
isquémico (2005), prostatismo (tamsulosina 0.4 mg dia), artrosis con consumo de
DAINES. FR++ interpretado como AR sin aparente tratamiento.
•
Reconsulta por guardia el 18/02 por acrecentarse los
síntomas:
▫
Deterioro
del estado general
▫
Pérdida
de peso
▫
Odinofagia
▫
Lesiones
en cavidad oral
Laboratorio: GB 5000, Hto33, Hb11, plaquetas 290000,
urea 98, creatinina 2.12, ionograma 124/4.56/92, TyCP 13” 100%. Colesterol 145,
TG 82
Toma de biopsia del carrillo
izquierdo
Se interna para diagnóstico
y tratamiento
EXAMEN FÍSICO:
•
El paciente se encontraba en regular estado
general, adelgazado, afebril, hipotenso, con signo de pliegue ++
•
En
cavidad oral: mal estado dentario, nunca uso prótesis. Presentaba lesiones
ulceradas algunas blanquecinas de tipo leucoplásica (que no se eliminan con el
raspado), ubicadas en piso de la boca, labio inferior y ambos carrillos.
Dificultosa evaluación de región amigdalina y retrofaringe limitada por el
dolor y el edema.
•
A
nivel del cuello presentaba pequeños ganglios linfáticos no adenomegálicos de
consistencia fibroelástica no adheridos a planos profundos, bilaterales en
región yugulocarotideas.
•
R1R2
en 4 focos hipofoneticos silencios libres
•
BEAB
con roncus aislados, Sat de O2 95%
•
Abdomen
BDI con RHA +, sin visceromegalias, diuresis y catarsis conservada
EVOLUCION:
•
El
20/02 agrega tos que moviliza secreciones mucopurulentas, inicia tratamiento
con Ceftazidime
•
Lab:
ERS 150
•
Diagnósticos
diferenciales:
▫
Penfigo
ampollar
▫
Penfigoide
cicatrizal
▫
Carc
de cél escamosas de cavidad oral
▫
Liquen
plano
▫
Otras:
Lupus discoide, Shogren, etc
▫
En
vista de los diagnósticos diferenciales planteados se solicitan estudios
complementarios
•
Solicita
TAC cabeza cuello y torax
•
Rx
de ambas manos: erosiones y signos de osteopenia
•
Se
solicita en alta complejidad: AntiCCP, C3, C4, CH50, FAN, Proteinograma
electroforético, PSA
•
Por
sospecha de lesión ampollar en cavidad oral:
Pénfigo Vs Penfigoide
Pénfigo Vs Penfigoide
•
Inicia
tto con corticoesteroides a altas dosis
dexametasona 8 mg cada 12 hs ev
dexametasona 8 mg cada 12 hs ev
24 DE FEBRERO
Franca mejoría de las lesiones, se pasa corticoides a vía oral deltisona 60 mg día
•
Anatomía
Patológica: aftoides bucales de mecanismo penfigoide
•
TAC
cabeza cuello tórax:
▫
En
lób parietal posterior izquierdo área hipodensa sin efecto de masa, ni refuerzo
con cte, sugerente de secuela vascular
▫
Imag
ganglionares de aspecto reactivo y en rango no adenomeg de localización yugulo
carotidea bilaterales
▫
Imagen
subpleural LSD de 1.6 cm, imagen fibrótica basal izquierda. Derrame pleural
Se realiza IC
con neumonología quien sugiere pequeña condensación LSD, completar ATB y
realizar TC de torax control por consultorios externos
El 27/02
impresiona que las lesiones recrudecen
Se aumenta
corticoesteroides vía oral a Deltisona 80 mg/día
El 04/03
debido a buena evolución se otorga alta hospitalaria
Se cita a
control todos los viernes, para supervisar tratamiento
•
Se
recibe laboratorio de alta complejidad:
▫
AntiCCP
26.70U/ml (+débil)
▫
C3,
C4 y CH50 Normal
▫
FAN
-
▫
Proteinograma
electroforético: leve descenso de las proteínas totales
▫
PSA 2.86 ng/ml
DIAGNÓSTICOS DIFERENCIALES
DE LESIONES ULCERADAS EN MUCOSA ORAL
Diagnósticos
diferenciales de lesiones ulceradas en mucosa oral
•
Liquen
plano oral
•
Pénfigo
•
Penfigoide
LIQUEN PLANO ORAL
•
Enfermedad muco-cutánea
crónica
•
Etiología desconocida
•
Representa una reacción
autoinmune, mediada por los linfocitos T y dirigida contra los queratinocitos
basales
•
Se ha reportado asociación
con infecciones virales (hepatitis C), fármacos, alérgenos de contacto,
neoplasias internas y stress
•
Relación
hombre mujer 1: 3-4
CLINICA:
•
Lesión
papular blanquecina, circunscrita, de pequeño tamaño
•
Se
pueden agrupar en racimos, estrías o placas
•
El epitelio puede
llegar a atrofiarse, haciéndose susceptible a la ulceración por roces o
traumatismo, originando áreas de eritema y erosiones
•
Afecta la mucosa oral,
labios, zona gingival, suelo de la boca y paladar (en orden de frecuencia)
•
El liquen plano
erosivo es una variante dolorosa que conduce a deterioro severo por dolor
persistente. Permanece por años, la remisión espontánea escasa, y el
tratamiento insatisfactorio
HISTOPATOLOGIA
•
Hiperqueratosis
(aumento del espesor de la capa cornea)
•
Acantosis
(aumento del número de capas de cél granulares donde se disponen a modo de
dientes de sierra
•
Degeneración
hidrópica del estrato basal (degeneración de los queratinocitos basales,
relacionada con la patogenesis). Cuerpos de Civatte
TRATAMIENTO
•
El tratamiento va
enfocado a eliminar las úlceras, aliviar los síntomas y reducir el riesgo de
una posible malignización
•
Eliminar los factores
traumáticos próximos a la lesión, tales como restos radiculares, aristas
cortantes, ganchos de prótesis
•
Eliminar los factores
irritantes locales como el tabaco, alcohol y especias
•
La higiene bucal
minuciosa eliminando los depósitos de sarro
•
Los glucocorticoides
siguen siendo los fármacos de elección en el caso de la variante
atrófico-erosiva.
PENFIGO
VULGAR
•
Enfermedad autoinmune,
ampollare, de carácter crónico
•
Donde
las lesiones en la mucosa oral pueden anteceder a las lesiones cutáneas
•
El
odontólogo asume un papel importante en la identificación de las lesiones
•
Incidencia
de 0.1-0.5 por 100000habit año
•
Afecta
a amos sexos por igual.
•
Pico
incidencia 40-60 años
•
El comienzo y
desarrollo del pénfigo depende de la interacción entre los factores genéticos
predisponentes y factores inductores, que condicionan una rta inmunológica del
individuo contra los desmosomas epidérmicos
Clínica:
•
Es la forma de comienzo
alrededor del 50-70 % de los casos, con lesiones mucosas.
•
Es muy característica y
frecuente, siendo un hecho casi constante que aparece en la evolución del PV.
•
De ellas, la mucosa
oral es la más frecuentemente involucrada, y en ocasiones marca el comienzo de
la enfermedad.
•
Estas lesiones suelen
ser dolorosas y resistentes al tratamiento sint.
•
Son
lesiones en forma de erosiones irregulares, grandes y extensas, que dejan al
descubierto una mucosa hiperémica, o a veces cubiertas de lesiones blanquecinas
Histopatología
•
Edema intercelular que
se localiza en las capas más inferiores de la epidermis, con desaparición de
los puentes intercelulares: fenómeno de acantolisis
•
Cuando progresa da
lugar a la ampolla intraepidérmica suprabasal cuyo suelo está formado
por una hilera de células basales, que se disponen como una «hilera de lápidas
sepulcrales», y cuyo techo se encuentra constituido por el resto de la capa
espinosa, las capas granulosas y la córnea
•
En el interior de la
ampolla se suelen encontrar queratinocitos acantolíticos, aislada o en grupos
•
La demostración del
depósito intercelular de IgG alrededor de los queratinocitos por
inmunofluorescencia directa en piel perilesional es una prueba sensible y
específica que confirma el diagnóstico de pénfigo
•
El título de Ac IgG
circulantes del suero de la mayoría de los enfermos está en relación con la
extensión y la actividad de la enfermedad, y es un marcador evolutivo que,
junto con la remisión clínica, se utiliza para valorar la eficacia del
tratamiento
Tratamiento:
•
Los corticoides
son el tratamiento de primera elección.
•
Se utilizan dosis de
1-3mg/kg día de prednisona oral dependiendo de la gravedad del cuadro, durante
6-10 semanas.
•
Cuando remite el brote
se bajan dosis paulatimanente hasta llegar a un mantenimiento de 10-40mgr cada
48 horas. Si es posible se elimina la corticoterapia o se mantiene con dosis
mínima para evitar la recidiva.
•
Inmunosupresores. Se
utilizan con el fin reducir la dosis de corticoides o cuando el paciente no
tolera el tratamiento con ellos.
•
Se utiliza Metotrexato,
Ciclofosfamida a dosis de 100mgr/día, Azatioprina a dosis de 1-2mgr/kg/día
Analgésicos
y antisépticos. Dieta blanda y lidocaina antes de las comidas cuando tenga
lesiones que impidan comer.
PENFIGO
PARANEOPLÁSICO
•
Variante
de pénfigo asociada a neoplasia oculta o previa/ diag. Casi siempre corresponde
a un trastorno linfoproliferativo de linf B
•
44%
asoc a LNH, 19% a LLC, 16% a Enf de Castelman (hiperplasia folicular gigante)
•
Severa
estomatitis dolorosa, persistente y refractaria al tratamiento
•
Se manifiesta como erosiones, úlceras, lesiones
liquenoides y necróticas que afectan cualquier porción de la orofaringe. Siendo
característico el compromiso de bordes laterales de la lengua y extensión hacia
los labios
•
Se
diferencia del pénfigo vulgar por el
compromiso más severo y la refractariedad a todo tipo de tratamiento
inmunosupresor
PENFIGOIDE
•
Enfermedad ampollar
cutaneomucosa crónica
de carácter autoinmune y benigna
de carácter autoinmune y benigna
•
También llamado
Penfigoide cicatrizal, vesículo-ampollar sub-epidérmica
•
Aparece en las mucosas
del cuerpo (bucal, ocular y genital) con menor frecuencia en la piel. En un 80% de los casos está afectada la mucosa bucal
•
Edad
media 60 años (40-80 años)
•
Predominio
sexo femenino 2:1
CLINICA
•
Dentro de la cavidad
oral las localizaciones preferentes de aparición son:
▫
Encías
▫
Paladar
▫
Mucosa yugal
▫
Infrecuente su
presentación en la lengua
▫
Las lesiones son de
< tamaño que las del pénfigo, con menor tendencia a la hemorragia y con
ampollas más resistentes a la rotura.
•
La ampolla es la lesión
elemental, permanece intacta unas 24-48 horas gracias a su grueso techo, una
vez que se rompe deja una erosión cubierta por una membrana blanca friable.
•
Las lesiones en la
mucosa ocular son habituales. Secuelas cicatriciales,e incluso ceguera
Hay
6 variantes clínicas de penfigoide cicatrizal
•
Penfigoide cicatrizal
con anticuerpos anti-laminina- 5. Los pacientes
padecen ampollas y cicatrices en las mucosas oral y ocular y en algunos de
estos, el penfigoide es paraneoplásico.
•
Penfigoide cicatrizal
con afectación ocular exclusivamente:
Los autoAc van dirigidos contra la subunidad β4 de la integrina (proteínas
transmembrana), en su mayor parte de dominio extracelular de los hemidesmosomas
de la unión dermo-epidérmica.
•
Penfigoide cicatrizal
con lesiones cutáneas y mucosas
•
Penfigoide cicatrizal
con lesiones orales exclusivamente
•
Penfigoide cicatrizal
con afectación de varias mucosas, pero sin afectación cutánea
•
Penfigoide cicatrizal
de Brunsting-Perry: Cursa con lesiones
cutáneas localizadas en cara, cuero cabelludo y parte alta del tronco, pero sin
afectación de mucosas.
HISTOPATOLOGIA:
Ampolla
subepidérmica, con un moderado a denso infiltrado inflamatorio
superficial constituido principalmente por neutrófilos, tanto en la dermis
superficial como en el interior de la cavidad
•
Los estudios de IFD en
las biopsias de penfigoide cicatricial demuestran un depósito lineal de IgG y C3 a lo largo de la
zona de la membrana basal
•
Los de IFI sólo
detectan Ac circulantes anti-membrana basal en el 20% de los pacientes
•
La mayoría de los
pacientes muestran fijación de inmunoglobulinas en el lado epidérmico de la
ampolla, excepto los pacientes con penfigoide cicatricial anti-laminina 5, que
muestran fijación en el lado dérmico, porque la laminina 5 está situada en la
lámina densa, debajo de la lámina lúcida.
TRATAMIENTO
•
Los corticoides
sistémicos constituyen el tratamiento de elección.
•
Se administrar prednisona, a una dosis inicial
de 40-60 mg/día, durante 2-3 semanas y luego reducirla gradual/.
•
Habitual/ es necesario
dejar una dosis de mantenimiento de 10 mg/día.
•
La
combinación de prednisona y dapsona son la mejor terapéutica para el control de
la enfermedad. Dapsona (50-200mgr/día).
•
Otra alternativa:
prednisona 0,5mg/Kg. Con bajas dosis de azatioprina (100mgr/día)
•
Todos estos
tratamientos pueden ser eficaces para remitir los brotes, pero el peligro es la
cicatrización y las secuelas en la mucosa ocular, que en brotes sucesivos
pueden ocasionar erosiones y sinequias y acabar con ceguera del paciente
CARCINOMA ESCAMOSO CAVIDAD ORAL
•
El cáncer oral ocupa, a
nivel mundial, el 8ª lugar de incidencia en hombres y 14ª en mujeres
•
Representando el 3% de
todos los cánceres en el mundo
•
Tasa mundial de
mortalidad de 8,3 por 100.000
•
Corresponde en un 94% a
carcinoma epidermoide, localización más frecuente en labio inferior
•
Principales fact de
riesgo:
▫
Alcohol
▫
Tabaco
▫
Infección por HPV de
alto riesgo oncogénicos 16 y 18
•
El orden de frecuencia
decreciente, que se encontró para los carcinomas intraorales es:
▫
Lengua
▫
Encía
▫
Piso de la boca
▫
Paladar duro
▫
Carrillo
•
Media
de 50 años
•
Relación
hombre-mujer 4:1
•
El motivo de consulta
de la mayoría de los pacientes es: una lesión tumoral indurada, de varios
centímetros de diámetro, con ulceración central, coexistencia de placas blancas
(leucoplasia) pueden observarse en la adyacenciadel carcinoma
•
Lo que confirma que el
diagnóstico, se realiza en etapas avanzadas en un número importante de casos.
•
Síntomas asociados:
otalgia, halitosis, dificultad al hablar, al abrir la boca,trismus, odinofagia,
pérdida de peso, deterioro del estado general
•
Un gran tamaño tumoral
de presentación, se asocia a alto riesgo de recurrencia local, metástasis en
ganglios linfáticos cervicales y pobre sobrevida
•
La mayoría posee un
grado de diferenciación moderado. Hay publicaciones que han encontrado hasta un
90% de carcinomas orales y orofaríngeos moderadamente diferenciados
•
En etapas iniciales y
loco-regionalmente avanzadas pero resecables, el abordaje terapéutico inicial
es quirúrgico
•
Y las metas son dos:
▫
la remoción completa
del tumor primario con márgenes suficientes en forma tridimensional,
manteniendo siempre un equilibrio entre la seguridad oncológica, la
funcionalidad y la calidad de vida
▫
además de lograr una
adecuada estadificación histopatológica que nos permita diferenciar entre pac
con riesgo moderado y con riesgo elevado de recurrencia para que se decida
el tratamiento oncológico adyuvante (únicamente radioterapia o asociación de
quimioterapia-radioterapia concomitantes).
•
Tiene gran capacidad de
enviar metástasis ganglionares en fase temprana, principal/ a los primeros relevos,
considerados los localizados en los niveles submentoniano, submaxilares,
yugulares superiores y yugulares medios
•
La tasa de metástasis
clínicas y ocultas depende del tamaño del tumor y oscila entre 30% y 70%
•
Debido a la elevada
tasa de metástasis ganglionares cervicales de ésta neoplasia, en el tratamiento
quirúrgico inicial se debe incluir además de la resección del tumor primario,
la linfadenectomía cervical

Presentó
Dra. María Josefina Rodríguez Kelly
Residente de Clínica Médica de 3° año.
Hospital “Ángel Pintos” de Azul.