Un hombre de 56 años, previamente sano, jubilado de mecánico de autos, fue internado en el hospital vía departamento de emergencias, por cefalea de 1 semana de evolución. Él describía la cefalea como moderada a severa, y afectaba toda la cabeza. No había factores que exacerbaran ni que mejoraran el síntoma, y no refería haber padecido nunca antes cefalea.
El día anterior a la internación, el paciente presentó visión doble, dolor, envaramiento en el cuello, y vómitos. El día de la internación presentó asimetría de la cara por paresia del lado derecho de la misma, debilidad en la pierna derecha, y dificultad en la marcha, con alteraciones del equilibrio. No había presentado fiebre, escalofríos, ni otros síntomas sistémicos antes de la admisión. No había viajado recientemente, ni había estado en contacto con personas enfermas. No había antecedentes médicos de importancia.
En el examen presentaba un score de 15/15 en la escala de Glasgow. Su temperatura era de 38,5ºC, su tensión arterial de 135/68 mmHg, y el pulso de 90 latidos por minuto. Tenía rigidez de nuca moderada, y caída del lado derecho de la cara que comprometía el párpado, indicativos de lesión de neurona motora inferior del VII par. Tenía una sutil dismetría en la prueba dedo nariz del lado derecho, con alteración de la prueba talón rodilla derechas consistentes con signos cerebelosos derechos. El resto del examen neurológico era normal.
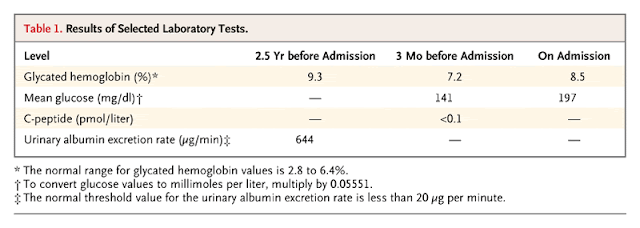
Los análisis de sangre en el ingreso mostraron un recuento de glóbulos blancos de 17.000/mm3 (15.500 neutrófilos), proteína C reactiva (PCR) de 120 mg/l (normal menos de 6), urea y creatinina normales. El sodio sérico estaba levemente bajo, 131 mmol/l.
Se realizó una TAC y una punción lumbar al ingreso. La RMN fue realizada al día siguiente. El análisis del LCR mostró proteínas 0,96g/l, glucosa 21 mg/dl, y un recuento celular de 535/mm3 (85% de polimorfonucleares, 10% linfocitos, y 5% de células atípicas). No fueron observados microorganismos en el Gram.
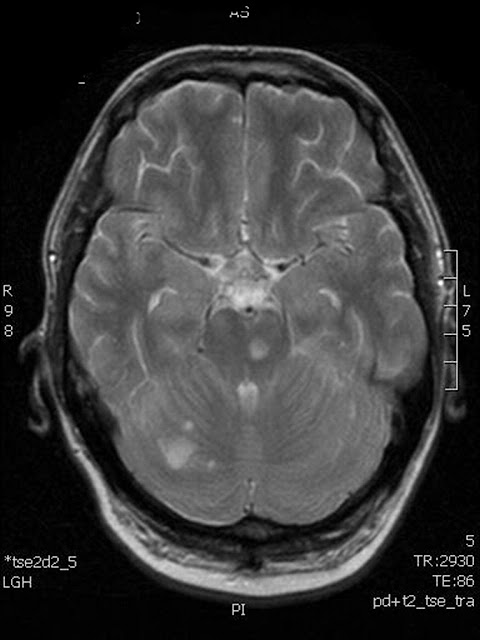
Fig 1. RMN en T1 de cerebro.
• En base a la presentación clínica, cuales son los diagnósticos diferenciales?
• Qué muestra la resonancia magnética?
• Cuál es el diagnóstico más probable?
• Cómo lo confirmaría?
1) En base a la presentación clínica, cuales son los diagnósticos diferenciales?
Las meningoencefalitis infecciosas agudas, las trombosis de los senos venosos intracraneales, los abscesos cerebrales, y los empiemas subdurales deben todos ser considerados ante cualquier paciente con fiebre y signos de foco neurológico. (1) Trastornos autoinmunes como la encefalitis del tronco cerebral de Bickerstaff, y la neurosarcoidosis son procesos menos probables, dado la fiebre en este paciente.
Dado el cuadro febril, los marcadores inflamatorios aumentados (aumento de los glóbulos blancos y de la PCR), el principal diagnóstico diferencial inicial es la meningoencefalitis infecciosa. Streptococcus pneumoniae o Neisseria meningitidis, son las causas más comunes de meningitis en adultos, siendo responsables de alrededor de 80% de los casos de las meningitis bacterianas en adultos. (2)
Los trastornos autoinmunes del sistema nervioso central, tales como la encefalitis del tronco cerebral de Bickerstaff, la neurosarcoidosis, y el neuro- Behçet, deben ser también considerados, aunque la fiebre y los marcadores de inflamación tan elevados los hacen menos probables.
Sin embargo, la parálisis del VII par craneal junto a signos cerebelosos (la combinación de signos de tronco y de cerebelo) apunta hacia meningitis por Listeria, con romboencefalitis, o infarto cerebral complicando la meningitis neumocóccica. En la romboencefalitis por Listeria, en la meningitis tuberculosa, y en la meningitis por Borrelia (enfermedad de Lyme), otros nervios craneales pueden también ser afectados, dado que estos microorganismos causan meningitis basales, con signos neurológicos de pares craneales. (3)La historia clínica y los diferentes patrones de exposición del paciente pueden ayudar a discriminar entre estas infecciones. La enfermedad de Lyme es endémica en algunas regiones, mientras que la Listeria tiene mayor predilección por los pacientes añosos, inmunocomprometidos, y mujeres embarazadas.
Listeria monocytogenes es la tercera causa más común de meningitis aguda en adultos inmunocompetentes, pero es el responsable de menos del 5% de los casos. (3) La romboencefalitis por Listeria da cuenta de alrededor del 10% de las infecciones por listeria del sistema nervioso central, y se ve principalmente en pacientes de edad media de la vida, previamente sanos. (4)
La trombosis de senos venosos intracraneales, abscesos cerebrales, y empiemas subdurales como complicación de meningitis bacteriana deben también ser considerados en este caso por los signos de foco neurológicos, y deben ser descartados por imágenes. (1)
2) Qué muestra la resonancia magnética cerebral?
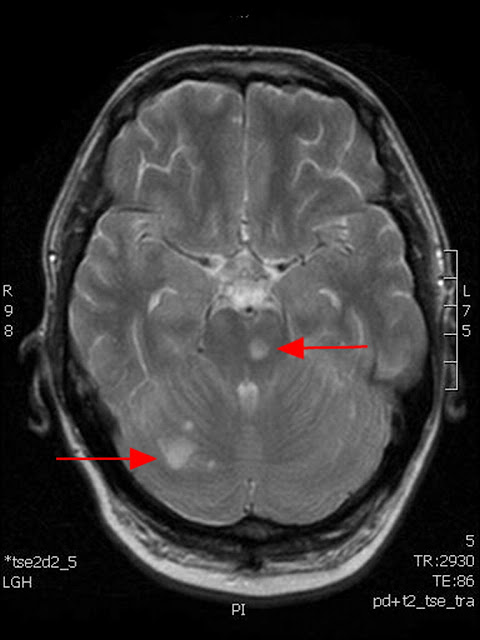
La RMN en T2 muestra hiperintensidades en lóbulo cerebeloso derecho e hiperintensidad pontina izquierda, compatibles con inflamación o infarto. (Figura 2).
Figura 2. La RMN en T2 muestra hiperintensidades en lóbulo cerebeloso derecho (flecha inferior) y una hiperintensidad pontina del lado izquierdo (flecha superior), consistentes con inflamación aguda o infarto.
Las imágenes en T2 de la RMN muestra áreas de alta señal en el lóbulo cerebeloso derecho y en región pontina izquierda, compatibles con infartos múltiples en áreas irrigadas por la circulación posterior. La inflamación aguda es una explicación alternativa para este hallazgo, pero las imágenes de la difusión apoyaron el diagnóstico de isquemia en nuestro paciente.
La TAC con contraste mostró áreas focales de baja densidad en el hemisferio cerebeloso derecho, con una imagen de baja densidad en la protuberancia. Esos hallazgos son sugestivos de múltiples infartos en la circulación posterior. La imagen de la RMN fue llevada a cabo para clarificar la naturaleza de la lesión vista en la TAC, dada que es superior a la TAC para evaluar la fosa craneal posterior.
3) Cuál es el diagnóstico más probable, y cómo lo confirmaría?
La meningitis con romboencefalitis secundaria a infección con L monocytogenes. Esta puede ser confirmada a menudo en el Gram y cultivo del LCR. La presencia de bacilos Gram postivos en el líquido cefalorraquideo es altamente específico para Listeria. Si los cultivos son negativos, entonces la PCR (polymerase chain reaction) 16S, debe usarse para detectar un amplio rango de DNA ribosómico de diferentes bacterias. Debe tomarse hemocultivos, ya que tienen gran valor cuando son positivos.
Dado la constelación de meningitis aguda con signos de tronco cerebral, y cambios en las imágenes de RMN, el diagnóstico considerado más probable fue el de meningoencefalitis (meningitis con romboencefalitis) secundaria a L. monocytogenes, a pesar de la falta de factores de riesgo obvios para contraer Listeria en este paciente.
L. monocytogenes es un bacilo Gram positivo con un tropismo por el tronco cerebral y las meninges. (5) Los factores de riesgo para meningitis por Listeria incluyen la edad, comorbilidades, y estados de inmunocompromiso como el embarazo. El consumo de quesos blandos (no-pasteurizados) pueden causar pequeños brotes epidémicos de listeriosis, (6) aunque el número total de casos es bajo. (7)
El líquido cefalorraquideo fue negativo, así como también fue negativa la PCR para meningo y neumococos. Se llevó a cabo una reacción de PCR 16S. Esta técnica detecta DNA ribosomal bacteriano, y está creciendo mucho su uso, sobre todo cuando los cultivos convencionales son negativos, aunque no se usa actualmente como rutina. (1) Este test está disponible sólo en grandes centros, y los resultados pueden demorar varios días. Por lo tanto se debe comenzar tratamiento empírico para Listeria si se sospecha infección por este agente. Si la PCR 16S es positiva, hay que realizar entonces PCR específica para microorganismos específicos.
Un test de HIV debe ser llevado como regla en todo paciente con infección de sistema nervioso central. (8)
4) Cómo debe tratarse este paciente?
Este paciente fue tratado empíricamente con cefalosporinas de amplio espectro, junto a ampicilina 2 gr cada 4 horas durante 21 días, para cubrir la posibilidad de Listeria monocytogenes.
Sin confirmación microbiológica de un microorganismo responsable, el paciente debe ser tratado empíricamente con cefalosporinas de tercera generación de amplio espectro, de acuerdo a protocolos. (2) El tratamiento empírico puede modificarse más adelante cuando el microorganismo es identificado, si se demuestra que amerita un cambio de tratamiento.
Dexametasona debe ser dada antes de la primer dosis de antibióticos, y continuada por 4 días. Existe poca evidencia disponible para apoyar estas recomendaciones, aunque 6 a 10 mg 4 veces por día son utilizadas generalmente. Una revisión de Cochrane en 2003 (actualizada en 2007) apoyó el uso de dexametasona en este contexto agudo, dado que reduce la tasa de sordera y muerte en adultos, sin causar mayores efectos adversos. (10)
Dado que las cefalosporinas no tratan adecuadamente a Listeria, altas dosis de ampicilina o amoxicilina deben ser aplicadas (2 gr cada 4 horas) y continuadas por 21 días. (1,2,3) El tratamiento de segunda línea es meropenem intravenoso 2 gr cada 8 horas, o cotrimoxazol 3-5 mg/kg cada 6 horas.
Los pacientes con meningitis aguda deben ser tratados por infectólogos y neurólogos. Sin embargo, si dichas especialidades no están disponibles, pueden hacerlo los médicos especialistas en medicina interna. Durante las etapas iniciales, si existe deterioro del nivel de conciencia (medida por la escala de Glasgow), o existe sepsis sistémica no controlada, la internación debe transcurrir en unidades de terapia intensiva. Si el score de la escala de Glasgow cae, hay que repetir rápidamente las imágenes, ya que la profundización del deterioro de conciencia puede ser expresión de una complicación, tal como trombosis de los senos venosos, empiema subdural, o hidrocefalia.
Evolución del paciente.
Este paciente desarrolló una marcada erupción por drogas una vez que la dexametasona fue interrumpida. Se interpretó secundaria a la amoxicilina, la cual se cambió a meropenem sin eventuales efectos adversos. La PCR 16S fue negativa, por lo que no se alcanzó un diagnóstico microbiológico definitivo. Un test de HIV fue negativo, y la serología para enfermedad de Lyme fue negativa, tanto en la fase aguda como en la de convalecencia. Las imágenes de RMN fueron repetidas antes del alta, mostrando que la lesión pontina tenía restricción de la difusión, lo cual favoreció el diagnóstico de infarto. Fue dado de alta después de completar 3 semanas de antibióticos intravenosos, teniendo una recuperación completa.
Traducción de:
“A 56 year old man with headache, fever, and neurological symptoms”
Ruth Dobson, specialty registrar in neurology
Clare Shannon, foundation year 2 trainee
BMJ 2010; 340:b5603 doi: 10.1136/bmj.b5603 (Published 20 January 2010)
Referencias
EPIDEMIOLOGÍA Y PATOGÉNESIS DE LA INFECCIÓN POR LISTERIA MONOCYTOGENES.
Listeria monocytogenes (única especie de Listerias que infecta al humano), es un bacilo Gram positivo aeróbico y anaeróbico facultativo, móvil, beta hemolítico, no formador de esporas. Puede confundirse con neumococo o difteroides (Corynebacterias), o aún con especies de Haemophilus.
PATOGÉNESIS.
Listeria es un parásito intracelular facultativo. Su hábitat es el suelo, la tierra y los materiales vegetales en descomposición. La mayoría de las infecciones por Listeria en el adulto son consideradas resultado de la ingestión oral con penetración de la mucosa intestinal e infección sistémica.
La inmunidad hacia Listeria depende principalmente de la activación de la activación de linfoquinas de células T por parte de los macrófagos, que aclaran la Listeria de la sangre. La Interleukina 18 parece jugar un rol en la protección contra Listeria por aumentar el clearence bacteriano, aún en ausencia de interferon gamma, y por a los macrófagos a secretar TNF y óxido nítrico. Cualquier factor que deteriore la función o sobrevida macrofágica, favorece la susceptibilidad a la infección listeriósica.
Listeria tiene predilección por la placenta y el sistema nervioso central. La Listeria cruza la placenta durante la bacteriemia materna e infecta el feto.
EPIDEMIOLOGÍA CLÍNICA.
Como dijimos, el principal hábitat de Listeria es el suelo, y los vegetales en descomposición. Se ha aislado del polvo, de numerosos productos alimenticios de origen animal, de alimentos para animales, agua, aguas servidas, numerosas especies de animales, y humanos asintomáticos. Aproximadamente 1 a 5% de individuos sanos, son excretores de Listeria por heces.
La incidencia de infección es en general baja, menor de 1/100000 habitantes/año en países desarrollados como EEUU. Es mayor en países en vías de desarrollo, y las tasas reales son desconocidas, ya que muchos casos pasan sin diagnóstico.
En EEUU, Listeria es la segunda más alta tasa de mortalidad entre las infecciones transmitidas por alimentos después de Vibrio vulnificus (18% vs 39%).
Un aumento de la tasa de listeriosis ha sido reportada en varios países Europeos, aparentemente relacionados con la disminución de la concentración de sal en la preparación de los alimentos.
Listeriosis es más a menudo una enfermedad esporádica que la que ocurre en brotes. Las gastroenteritis esporádicas debidas a Listeria monocytogenes parece ser infrecuente, por lo que no se requieren estudios específicos de cultivo para Listeria en muestras de heces en casos de estudios de diarrea. La fuente de infección en casos esporádicos, a menudo es desconocido, pero se considera que la mayoría de los casos es por adquisición a través de alimentos. El contagio por contacto directo con animales es raro, y ocurre sobre todo en veterinarios, trabajadores de mataderos, y trabajadores rurales.
Un estudio mostró que un porcentaje alto de los casos esporádicos fueron adquiridos por ingestión de quesos blandos o alimentos comprados en rotiserías. Casi el 70% de los pacientes tienen algún grado de inmunocompromiso (cáncer, HIV, receptores de transplantes de órganos, embarazo, pacientes añosos, o aquellos que reciben terapia con corticosteroides). El pollo insuficientemente cocido aumenta el riesgo de adquirir listeriosis.
Listeria es la causa más común de meningitis bacteriana en pacientes con cáncer, especialmente linfomas, en receptores de transplantes de órganos, y en aquellos que por alguna razón reciben corticoides.
La embarazada, especialmente en el tercer trimestre, es particularmente susceptible a la infección por Listeria, sobre todo en embarazos múltiples. Puede llevar a muerte fetal, partos prematuros, o recién nacidos infectados.
La terapia crónica con corticosteroides es el mayor factor predisponente en pacientes no embarazadas. Las enfermedades neoplásicas hematológicas o tumores sólidos, y los transplantados (especialmente de riñón), pacientes con SIDA, insuficiencia renal crónica terminal por nefropatía diabética (incluyendo hemodializados o quienes reciben diálisis peritoneal), sobrecarga de hierro (hemocromatosis con cirrosis, o sobrecarga transfisional de hierro en pacientes dializados), o enfermedades colágeno-vasculares, también son factores predisponentes importantes. La sobrecarga de hierro puede actuar por un doble mecanismo: disminuye la fagocitosis de los macrófagos cargados con hierro, y aumenta la virulencia bacteriana.
La profilaxis para Pneumocystis jirovecii con trimetoprima-sulfametoxazol, ha disminuido la incidencia de infección por Listeria en poblaciones con SIDA.
Se ha reportado adquisición intrahospitalaria de listeriosis.
MANIFESTACIONES CLÍNICAS Y DIAGNÓSTICO DE LAS INFECCIONES POR LISTERIA MOMOCYTOGENES.
La Listeria monocytogenes es un importante patógeno bacteriano en neonatos, inmunocomprometidos, ancianos, embarazadas, y ocasionalmente en individuos previamente sanos.
SÍNDROMES CLÍNICOS.
Listeria monocytogenes es considerado como un patógeno que causa enfermedad invasiva, incluyendo meningitis, meningoencefalitis, o bacteriemia en pacientes inmunosuprimidos, en edades extremas de la vida incluyendo neonatos y gerontes, y mujeres embarazadas. Sin embargo, Listeria puede también causar gastroenteritis febril aguda autolimitada en huésped normal si se ingiere un alto número de microrganismos con un alimento.
Es más común en meses de verano. El período de incubación va de 6 horas a 90 días, pero es de generalmente un día en el caso de las gastroenteritis febriles agudas.
GASTROENTERITIS FEBRILES.
Listeria produce menos del 1% de las infecciones bacterianas adquiridas por alimentos. Puede presentarse en brotes epidémicos. Ocurre después de la ingesta de un gran inóculo bacteriano. La tasa de ataque en un brote de gastroenteritis es de 50 a 100%, y la incubación promedio es de 24 horas (con un rango de 6 a 240 horas). Los síntomas son fiebre, diarrea acuosa, náuseas, vómitos, cefalea, y artromialgias generalizadas. Los síntomas suelen durar 2 días y los pacientes se recuperan completamente. La infección invasiva es rara, estando más en riesgo los inmunocomprometidos, embarazadas, o ancianos. Los quesos blandos no-pasteurizados han sido fuente de infección. En un brote de 57 adultos quienes ingirieron queso contaminado 21% tuvieron bacteriemia, 40% meningitis, 39% meningoencefalitis. El 42% tenían enfermedades de base, y más de la mitad tenían más de 65 años de edad. Estos hallazgos sugieren que un número sustancial de personas normales, que tienen exposición a Listeria, tienen infección asintomática o subclínica.
Las gastroenteritis esporádicas por Listeria monocytogenes parecen ser una enfermedad infrecuente (0,5%).
INFECCIÓN EN EL EMBARAZO.
La listeriosis en el embarazo ocurre más comúnmente durante el tercer trimestre.
Fiebre, escalofríos, lumbalgia ocurre como forma de presentación en la embarazada, con un cuadro seudogripal. La infección puede ser leve, resolverse sin terapia y el diagnóstico puede pasarse por alto si no se toman muestras de hemocultivos.
No hay indicadores clínicos específicos de bacteriemia por listeria en la mujer embarazada, y la invasión del sistema nervioso central es poco frecuente. Por lo tanto hay que obtener hemocultivos en toda embarazada febril cuando no existe una explicación evidente (infección urinaria, faringitis).
La infección por Listeria en la embarazada puede ocasionar muerte fetal, parto prematuro, o neonatos infectados. Una característica infección uterina severa, la granulomatosis infantiséptica, puede resultar en transmisión transplacentaria. Los infantes con este trastorno, tienen abscesos diseminados y/o granulomas en múltiples órganos internos (hígado, bazo, pulmones, riñones y cerebro). Pueden desarrollar también lesiones dermatológicas papulares o ulceradas. La mayoría de los neonatos con granulomatosis infantiséptica son mortinatos o mueren inmediatamente después de nacidos.
Los obstetras a veces reciben consultas de pacientes embarazadas que han ingerido alimentos implicados en brotes de listeriosis que han recibido amplia difusión pública en los medios. Es razonable tranquilizar a estas pacientes y recomendar cultivos de materia fecal y de sangre para pacientes con cualquier síntoma, incluyendo diarrea.
SEPSIS DE ORIGEN DESCONOCIDO.
La sepsis por Listeria ocurre en pacientes de todas las edades. Los neonatos probablemente adquieren la infección durante o después del nacimiento. En adultos, la sepsis por Listeria se da generalmente en pacientes con inmunocompromiso o en ancianos. Clásicamente se presenta con escalofríos y fiebre. Puede haber shock séptico, y puede haber metástasis séptica en cerebro y meninges, produciendo meningitis o cerebritis. La bacteriemia sin invasión de sistema nervioso central es la regla en la embarazada con listeriosis, pero el riesgo es mayor, a mayor inmunocompromiso (por ej transplantados renales). El diagnóstico de bacteriemia por Listeria se hace por cultivos de sangre.
INFECCIONES DE SISTEMA NERVIOSO CENTRAL.
La manifestación más común de infección por listeria de SNC es la meningoencefalitis. La cerebritis, que raramente progresa a absceso, y la romboencefalitis (encefalitis del tronco cerebral) son menos comunes.
Meningoencefalitis.
La meningoencefalitis por Listeria ocurre especialmente en neonatos y en inmunocomprometidos.
La presentación clínica de la meningoencefalitis por Listeria varía desde una enfermedad leve con fiebre y cambios en el estado mental del paciente, hasta un curso fulminante que evoluciona rápidamente al coma. La mayoría de los adultos tienen enfermedad subaguda, con o sin irritación meníngea.
Pueden existir signos de foco neurológico, lo que indica un componente encefalítico. Se puede ver entonces alteraciones de los pares craneales, ataxia, temblor, hemiplejia, e hipoacusia con evolución a sordera. Puede haber convulsiones tardíamente en el curso de la enfermedad.
Una presentación subaguda con parálisis de pares craneales, y un líquido cefalorraquideo con aumento de las células a predominio linfocitario, aumento de proteínas, y descenso de la glucosa, puede confundirse con meningitis tuberculosa o meningitis fúngica. En este grupo de pacientes, el cultivo del líquido cefalorraquídeo es positivo para Listeria, pero los hemocultivos positivos raramente ocurren si el cultivo del líquido cefalorrquídeo es negativo.
Cerebritis.
La cerebritis resulta de una invasión hematógena del parénquima cerebral, con escaso o nulo compromiso meníngeo. Sin embargo, pueden ocurrir cerebritis y meningitis en el mismo paciente. La cerebritis se presenta clínicamente con un amplio rango de manifestaciones, desde fiebre y cefalea, hasta hemiplejia, que recuerda un accidente cerebrovascular.
La evolución a absceso cerebral es rara.
Romboencefalitis.
La romboencefalitis (encefalitis de tronco cerebral) es una rara manifestación de infección por listeria, que ocurre típicamente en un paciente sano, que ha adquirido listeriosis vía consumo de alimentos contaminados, a menudo en brotes.
La romboencefalitis sigue frecuentemente un curso bifásico, comenzando con cefalea, fiebre, náuseas, y vómitos, seguido después de varios días de parálisis de pares craneales, ataxia, temblor y otros signos cerebelosos, alteraciones de la conciencia, y a veces convulsiones y hemiparesia. Casi la mitad evoluciona a fallo respiratorio.
El diagnóstico diferencial de la romboencefalitis incluye la encefalitis por herpes simplex, la tuberculosis, la toxoplasmosis, criptococosis, y otras infecciones fúngicas, la sarcoidosis, la enfermedad de Lyme, linfoma y vasculitis.
El análisis del líquido cefalorraquídeo a menudo revela sólo anormalidades leves, lo cual puede hacer que se retrase el diagnóstico. El cultivo del LCR y los hemocultivos son positivos en 40 y 60% de los casos respectivamente. La RMN mejor método que la TAC, para ver las imágenes características de la enfermedad, aunque no suelen observarse en estadios precoces del proceso.
La mortalidad es alrededor de 60%. Los no tratados tienen 100% de mortalidad, mientras que los tratados sobreviven 70%, aunque un porcentaje alto, queda con alguna secuela neurológica.
INFECCIONES LOCALES.
Numerosas manifestaciones focales de listeriosis han sido descriptas, más comúnmente en inmunocomprometidos. Las infecciones de piel u ojos, como resultado de la inoculación directa ocurre en veterinarios, granjeros, y trabajadores de laboratorios.
Otra complicación incluye el síndrome óculoglandular de Parinaud, la linfadenitis, neumonía, empiema, miocarditis, endocarditis (usualmente de presentación subaguda), artritis séptica, osteomielitis, infección de prótesis articulares, fascitis necrotizante, arteritis, e infección de injertos (incluyendo fístulas de diálisis).
Abscesos espinales y cerebrales, y colecistitis son el resultado de la siembra hematógena, y de una hepatitis aguda que simula una hepatitis viral pueden verse en pacientes con infección diseminada por listeria.
Puede haber peritonitis en pacientes tratados con diálisis peritoneal continua ambulatoria, o en pacientes con cirrosis (peritonitis espontánea).
DIAGNÓSTICO.
El diagnóstico de infección por listeria debe ser sospechada clínicamente, aunque no es fácil ya que puede simular la presentación de cualquier otra enfermedad infecciosa, y por lo tanto, el diagnóstico puede ser solamente establecido por el aislamiento del organismo por cultivo del líquido cefalorraquídeo o de hemocultivos. Sin embargo, los cultivos del LCR son positivos en la romboencefalitis por listeria sólo en 40%, y menos aún, en pacientes con abscesos cerebrales. En cambio, la positividad es mayor en los hemocultivos, en pacientes con infecciones del sistema nervioso central (60 a 70%).
El análisis del LCR en pacientes con listeriosis muestra pleocitosis que va desde 100% de polimorfonucleares hasta 100% de células mononucleares. La listeria es la única causa de meningitis bacteriana (no tuberculosa) que presenta aumento sustancial número de linfocitos (más de 25%) en el LCR en ausencia de terapia antibiótica. Las proteínas aumentan en LCR en forma moderada. También es moderado el descenso de la glucorraquia.
La tinción de Gram en la meningitis por Listeria tiene baja sensibilidad (35%). La Listeria puede confundirse con neumococo, o difteroides (Corynebacteria), o puede ser Gram variable y confundirse con especies de Haemophilus.
Por lo tanto, cada vez que se informe “difteroides” en el crecimiento de un cultivo de LCR, debe sospecharse Listeria, y debe tenerse especial cuidado de rotular como “meningitis viral” (aséptica) una meningitis negativa a la tinción de Gram en un paciente con inmunocompromiso o en un geronte.
Entre los pacientes con romboencefalitis, el examen del LCR puede ser normal, o mostrar sólo alteraciones leves.
Cultivos de Materia Fecal.
Los cultivos de heces no están indicados en pacientes con listeriosis sistémica. Sin embargo, en pacientes con sospecha de gastroenteritis por Listeria, o cuando se está investigando un brote de listeriosis, deben utilizarse medios de cultivos especiales, ya que los medios de cultivo comunes no son aptos para el crecimiento de Listeria.
Imágenes.
La resonancia magnética (RMN) es más sensible que la TAC para la detección de lesiones por Listeria en cerebelo, tronco encefálico y corteza. Señales hiperintensas en T2, y lesiones con realce en T1 después de la administración de contraste EV son vistas en el parénquima cerebral.
Se recomienda usar RMN con contraste en todo paciente con meningitis por Listeria, en todo paciente con bacteriemia por Listeria y síntomas o signos de sistema nervioso central, y en pacientes con lesiones intracraneanas. El compromiso aislado del tronco cerebral sugiere fuertemente infección por Listeria (romboencefalitis).
TRATAMIENTO, PRONÓSTICO Y PREVENCIÓN DE LA INFECCIÓN POR LISTERIA MONOCYTOGENES.
Tratamiento.
Ampicilina o penicilina G son las drogas de elección
En adultos la dosis de ampicilina es de 2 gr IV/4 hs. La dosis de penicilina en adultos es de 4 millones UI/4 hs. La ampicilina y la penicilina demuestran una lenta actividad bactericida in vitro a las concentraciones logradas en líquido cefalorraquídeo. Como resultado de ello se utiliza como agente asociado a cualquiera de esas dos drogas, gentamicina en las infecciones de sistema nervioso central, endocarditis, y en las infecciones en neonatos e inmunocomprometidos para lograr sinergia bactericida. La dosis de gentamicina en el adulto es de 3 mg/kg/día IV divididas en tres dosis.
En alergias a penicilina debe desensibilizarse a estos pacientes si es necesario, o tratarlos con trimetoprima-sulfametoxazol 10 a 20 mg/kg IV por día dividido cada 6 a cada 12 hs. TMS es bactericida contra Listeria, y logra adecuados niveles en suero y LCR, y se ha demostrado que la combinación ampicilina/TMS puede ser más efectiva que la combinación ampicilina/gentamicina.
TMS se absorbe bien por vía oral, y se puede rotar a la vía oral rápidamente una vez que la terapia parenteral se ha administrado por unos días tres comprimidos simples cada 6 horas.
Imipenem o meropenem son alternativas excelentes.
Gastroenteritis Febril.
La necesidad de tratamiento de una gastroenteritis listeriósica febril depende de las características del huésped:
En un paciente inmunocompetente, una gastroentritis listeriósica febril se resuelve espontáneamente en la mayoría de los pacientes en el término de 2 días, y por lo tanto no deben tratarse con ATB. Es raro que en un inmunocompetente, la infección se haga invasiva y produzca meningitis, meningoencefalitis, o bacteriemia, aunque esto puede verse en los inmunocomprometidos, y otros grupos como las embarazadas y los ancianos. En estos pacientes hay que dar ampicilina o TMS por varios días.
Embarazo:
La mujer embarazada con bacteriemia listerial puede ser tratada con ampicilina sola 2 gr IV/4 hs. TMS es una alternativa 10 a 20 mg/kg de peso, aunque debe evitarse durante el primer trimestre ya que el metabolismo del ácido fólico puede verse afectado, y durante el último mes por la posibilidad de kernicterus en el feto. Las infecciones de sistema nervioso central por Listeria son raras en la embarazada. La vancomicina es una alternativa entre pacientes embarazadas que se infectan durante un período durante el cual no puede administrarse TMS.
Infecciones Focales.
Numerosas manifestaciones focales de infección por Listeria han sido descriptas, incluyendo el síndrome óculoganglionar de Parinaud, linfadenitis, neumonía, empiema, miocarditis, endocarditis 8usualmente subaguda), artritis séptica, y osteomielitis. El tratamiento de estas localizaciones debe ser adaptado a la condición inmune de cada paciente, estado de embarazo, alergias a drogas, y función renal y hepática.
Duración de la Terapia.
La duración óptima del tratamiento varía según el paciente y el tipo de infección. Entre los pacientes con infecciones de sistema nervioso central, el tratamiento debe continuar hasta que los cultivos del LCR sean negativos, las imágenes cerebrales hayan mejorado significativamente.
En inmunocompetentes es suficiente 2 semanas para una bacteriemia por Listeria, y 2 a 4 semanas para una infección de sistema nervioso central. Esta duración produce recidivas en los inmunocomprometidos, y por lo tanto, son necesarios 3 a 6 semanas son necesarios en estos pacientes con bacteriemias, y 4 a 8 semanas en los que cursan infecciones de sistema nervioso central.
Después de la finalización del tratamiento antibiótico, los pacientes deben ser monitoreados en búsqueda de signos de recidiva clínica. No se aconseja repetir un cultivo de LCR al finalizar el tratamiento, si se ha obtenido un cultivo negativo DURANTE la terapia. En cambio, los pacientes con endocarditis, deben tener repetidos cultivos negativos después de finalizada la terapia, para dar por terminado el tratamiento.
En pacientes tratados con drogas inmunosupresoras (por ejemplo los transplantados renales) es aconsejable disminuir el nivel de inmunosupresión, aunque muchos pacientes han sido tratados exitosamente sin disminuir el nivel de inmunodepresión, lo cual no es siempre posible.
Monitoreo Durante la Terapia.
La respuesta a la terapia dbe ser monitoreada clínicamente (temperatura, signos clínicos, y síntomas) En los pacientes que permanecen febriles, o en aquellos que tienen otros signos o síntomas sugestivos de pobre respuesta después de varios días de tratamiento, hay que repetir los hemocultivos, y en pacientes con infecciones de sistema nervioso central, se repiten los cultivos de LCR, y, si inicialmente fueron anormales, se repiten las imágenes de RMN.
Pronóstico.
El pronóstico de las infecciones por Listeria, es altamente variable, y determinada por el status inmune, el sitio de la infección, y la presencia o ausencia de diagnóstico temprano e iniciación del tratamiento, cuando este esté indicado. Los adultos inmunocompetentes, casi siempre evolucionan bien. Los factores de riesgo de mortalidad son: presencia de neoplasias no hematológicas, alcoholismo, edad mayor de 70 años, uso de corticoides, y enfermedad renal, o receptores de transplantes, sobre todo riñón. Otro factor de riesgo de morbi/mortalidad es la infección del sistema nervioso central. Por ejemplo, los pacientes con meningoencefalitis o romboencefalitis tienen una mortalidad si son tratados, de entre 13 a 43%. Más aún, las secuelas neurológicas son comunes entre los sobrevivientes.
La romboencefalitis típicamente ocurre en individuos jóvenes y sanos que adquieren la Listeria, vía alimentos contaminados, mientras que los abscesos cerebrales ocurren la mayoría en inmunocomprometidos.
Por último, algunas recomendaciones para la prevención de esta infección a través de alimentos contaminados.
Esas recomendaciones incluyen: no consumir leche no pasteurizada, o alimentos que contengan leche no pasteurizada. Lavar minuciosamente los vegetales antes de consumirlos. Mantener la temperatura del refrigerador a 4,4 ºC o menos; el freezer a -17,8ºC o menos. Consumir alimentos pre-cocidos lo antes posible. Mantener la carne, pescado, y aves, separadas de otros alimentos que no serán cocinados, o de aquellos ya cocinados. Lavado de manos, cuchillos o elementos de corte, después de cortar alimentos crudos. Cocinar los alimentos de origen animal, hasta temperaturas seguras en el interior de los mismos (carne vacuna 71 ºC, pollo 77 ºC, pavo 82 ºC, cerdo 71 ºC).
Las siguientes recomendaciones deben hacerse en individuos tales como mujeres embarazadas, y aquellos que están inmunodeprimidos:
No comer hot dogs, fiambres derivados de cerdo, salchichas ahumadas, u otro tipo de carnes de rotisería, a menos que estas sean hervidas antes de consumir; evitar hornos de microondas para recalentar tales carnes, ya que puede producirse una cocción despareja de los alimentos. Evitar que los líquidos de los paquetes de salchichas estén en contacto con otros alimentos, utensilios, y superficies donde se preparan comidas; además, lavarse las manos después de tocar salchichas, fiambres derivados de cerdo, carnes de rotisería, o carne cruda, pollo, pavo, o frutos del mar o sus líquidos. No consumir ensaladas preempaquetadas con jamón, pollo, huevos, atún o frutos del mar. No comer quesos blandos tales como queso en fetas, Camembert, Brie, Roquefort, o quesos estilo Mexicano tales como queso blanco, queso fresco, y Panela, a menos que se tenga la certeza de que la leche en su preparación haya estado pasteurizada. No comer patés refrigerados o. Sin embargo, los productos enlatados o de larga vida son seguros para la embarazada. No comer frutos del mar ahumados refrigerados, a menos que sean cocinados en una cacerola antes de consumirse.
Finalmente, algunas direcciones útiles en relación al manejo y consumo seguro de los alimentos se detallan abajo
www.cdc.gov/ncidod/dbmd/diseaseinfo/listeriosis_g.htm.
http://www.fsis.usda.gov/
Fuente de la actualización en Infecciones por Listeria:
UpToDate 2011
El día anterior a la internación, el paciente presentó visión doble, dolor, envaramiento en el cuello, y vómitos. El día de la internación presentó asimetría de la cara por paresia del lado derecho de la misma, debilidad en la pierna derecha, y dificultad en la marcha, con alteraciones del equilibrio. No había presentado fiebre, escalofríos, ni otros síntomas sistémicos antes de la admisión. No había viajado recientemente, ni había estado en contacto con personas enfermas. No había antecedentes médicos de importancia.
En el examen presentaba un score de 15/15 en la escala de Glasgow. Su temperatura era de 38,5ºC, su tensión arterial de 135/68 mmHg, y el pulso de 90 latidos por minuto. Tenía rigidez de nuca moderada, y caída del lado derecho de la cara que comprometía el párpado, indicativos de lesión de neurona motora inferior del VII par. Tenía una sutil dismetría en la prueba dedo nariz del lado derecho, con alteración de la prueba talón rodilla derechas consistentes con signos cerebelosos derechos. El resto del examen neurológico era normal.
Los análisis de sangre en el ingreso mostraron un recuento de glóbulos blancos de 17.000/mm3 (15.500 neutrófilos), proteína C reactiva (PCR) de 120 mg/l (normal menos de 6), urea y creatinina normales. El sodio sérico estaba levemente bajo, 131 mmol/l.
Se realizó una TAC y una punción lumbar al ingreso. La RMN fue realizada al día siguiente. El análisis del LCR mostró proteínas 0,96g/l, glucosa 21 mg/dl, y un recuento celular de 535/mm3 (85% de polimorfonucleares, 10% linfocitos, y 5% de células atípicas). No fueron observados microorganismos en el Gram.
Fig 1. RMN en T1 de cerebro.
• En base a la presentación clínica, cuales son los diagnósticos diferenciales?
• Qué muestra la resonancia magnética?
• Cuál es el diagnóstico más probable?
• Cómo lo confirmaría?
1) En base a la presentación clínica, cuales son los diagnósticos diferenciales?
Las meningoencefalitis infecciosas agudas, las trombosis de los senos venosos intracraneales, los abscesos cerebrales, y los empiemas subdurales deben todos ser considerados ante cualquier paciente con fiebre y signos de foco neurológico. (1) Trastornos autoinmunes como la encefalitis del tronco cerebral de Bickerstaff, y la neurosarcoidosis son procesos menos probables, dado la fiebre en este paciente.
Dado el cuadro febril, los marcadores inflamatorios aumentados (aumento de los glóbulos blancos y de la PCR), el principal diagnóstico diferencial inicial es la meningoencefalitis infecciosa. Streptococcus pneumoniae o Neisseria meningitidis, son las causas más comunes de meningitis en adultos, siendo responsables de alrededor de 80% de los casos de las meningitis bacterianas en adultos. (2)
Los trastornos autoinmunes del sistema nervioso central, tales como la encefalitis del tronco cerebral de Bickerstaff, la neurosarcoidosis, y el neuro- Behçet, deben ser también considerados, aunque la fiebre y los marcadores de inflamación tan elevados los hacen menos probables.
Sin embargo, la parálisis del VII par craneal junto a signos cerebelosos (la combinación de signos de tronco y de cerebelo) apunta hacia meningitis por Listeria, con romboencefalitis, o infarto cerebral complicando la meningitis neumocóccica. En la romboencefalitis por Listeria, en la meningitis tuberculosa, y en la meningitis por Borrelia (enfermedad de Lyme), otros nervios craneales pueden también ser afectados, dado que estos microorganismos causan meningitis basales, con signos neurológicos de pares craneales. (3)La historia clínica y los diferentes patrones de exposición del paciente pueden ayudar a discriminar entre estas infecciones. La enfermedad de Lyme es endémica en algunas regiones, mientras que la Listeria tiene mayor predilección por los pacientes añosos, inmunocomprometidos, y mujeres embarazadas.
Listeria monocytogenes es la tercera causa más común de meningitis aguda en adultos inmunocompetentes, pero es el responsable de menos del 5% de los casos. (3) La romboencefalitis por Listeria da cuenta de alrededor del 10% de las infecciones por listeria del sistema nervioso central, y se ve principalmente en pacientes de edad media de la vida, previamente sanos. (4)
La trombosis de senos venosos intracraneales, abscesos cerebrales, y empiemas subdurales como complicación de meningitis bacteriana deben también ser considerados en este caso por los signos de foco neurológicos, y deben ser descartados por imágenes. (1)
2) Qué muestra la resonancia magnética cerebral?
La RMN en T2 muestra hiperintensidades en lóbulo cerebeloso derecho e hiperintensidad pontina izquierda, compatibles con inflamación o infarto. (Figura 2).
Figura 2. La RMN en T2 muestra hiperintensidades en lóbulo cerebeloso derecho (flecha inferior) y una hiperintensidad pontina del lado izquierdo (flecha superior), consistentes con inflamación aguda o infarto.
Las imágenes en T2 de la RMN muestra áreas de alta señal en el lóbulo cerebeloso derecho y en región pontina izquierda, compatibles con infartos múltiples en áreas irrigadas por la circulación posterior. La inflamación aguda es una explicación alternativa para este hallazgo, pero las imágenes de la difusión apoyaron el diagnóstico de isquemia en nuestro paciente.
La TAC con contraste mostró áreas focales de baja densidad en el hemisferio cerebeloso derecho, con una imagen de baja densidad en la protuberancia. Esos hallazgos son sugestivos de múltiples infartos en la circulación posterior. La imagen de la RMN fue llevada a cabo para clarificar la naturaleza de la lesión vista en la TAC, dada que es superior a la TAC para evaluar la fosa craneal posterior.
3) Cuál es el diagnóstico más probable, y cómo lo confirmaría?
La meningitis con romboencefalitis secundaria a infección con L monocytogenes. Esta puede ser confirmada a menudo en el Gram y cultivo del LCR. La presencia de bacilos Gram postivos en el líquido cefalorraquideo es altamente específico para Listeria. Si los cultivos son negativos, entonces la PCR (polymerase chain reaction) 16S, debe usarse para detectar un amplio rango de DNA ribosómico de diferentes bacterias. Debe tomarse hemocultivos, ya que tienen gran valor cuando son positivos.
Dado la constelación de meningitis aguda con signos de tronco cerebral, y cambios en las imágenes de RMN, el diagnóstico considerado más probable fue el de meningoencefalitis (meningitis con romboencefalitis) secundaria a L. monocytogenes, a pesar de la falta de factores de riesgo obvios para contraer Listeria en este paciente.
L. monocytogenes es un bacilo Gram positivo con un tropismo por el tronco cerebral y las meninges. (5) Los factores de riesgo para meningitis por Listeria incluyen la edad, comorbilidades, y estados de inmunocompromiso como el embarazo. El consumo de quesos blandos (no-pasteurizados) pueden causar pequeños brotes epidémicos de listeriosis, (6) aunque el número total de casos es bajo. (7)
El líquido cefalorraquideo fue negativo, así como también fue negativa la PCR para meningo y neumococos. Se llevó a cabo una reacción de PCR 16S. Esta técnica detecta DNA ribosomal bacteriano, y está creciendo mucho su uso, sobre todo cuando los cultivos convencionales son negativos, aunque no se usa actualmente como rutina. (1) Este test está disponible sólo en grandes centros, y los resultados pueden demorar varios días. Por lo tanto se debe comenzar tratamiento empírico para Listeria si se sospecha infección por este agente. Si la PCR 16S es positiva, hay que realizar entonces PCR específica para microorganismos específicos.
Un test de HIV debe ser llevado como regla en todo paciente con infección de sistema nervioso central. (8)
4) Cómo debe tratarse este paciente?
Este paciente fue tratado empíricamente con cefalosporinas de amplio espectro, junto a ampicilina 2 gr cada 4 horas durante 21 días, para cubrir la posibilidad de Listeria monocytogenes.
Sin confirmación microbiológica de un microorganismo responsable, el paciente debe ser tratado empíricamente con cefalosporinas de tercera generación de amplio espectro, de acuerdo a protocolos. (2) El tratamiento empírico puede modificarse más adelante cuando el microorganismo es identificado, si se demuestra que amerita un cambio de tratamiento.
Dexametasona debe ser dada antes de la primer dosis de antibióticos, y continuada por 4 días. Existe poca evidencia disponible para apoyar estas recomendaciones, aunque 6 a 10 mg 4 veces por día son utilizadas generalmente. Una revisión de Cochrane en 2003 (actualizada en 2007) apoyó el uso de dexametasona en este contexto agudo, dado que reduce la tasa de sordera y muerte en adultos, sin causar mayores efectos adversos. (10)
Dado que las cefalosporinas no tratan adecuadamente a Listeria, altas dosis de ampicilina o amoxicilina deben ser aplicadas (2 gr cada 4 horas) y continuadas por 21 días. (1,2,3) El tratamiento de segunda línea es meropenem intravenoso 2 gr cada 8 horas, o cotrimoxazol 3-5 mg/kg cada 6 horas.
Los pacientes con meningitis aguda deben ser tratados por infectólogos y neurólogos. Sin embargo, si dichas especialidades no están disponibles, pueden hacerlo los médicos especialistas en medicina interna. Durante las etapas iniciales, si existe deterioro del nivel de conciencia (medida por la escala de Glasgow), o existe sepsis sistémica no controlada, la internación debe transcurrir en unidades de terapia intensiva. Si el score de la escala de Glasgow cae, hay que repetir rápidamente las imágenes, ya que la profundización del deterioro de conciencia puede ser expresión de una complicación, tal como trombosis de los senos venosos, empiema subdural, o hidrocefalia.
Evolución del paciente.
Este paciente desarrolló una marcada erupción por drogas una vez que la dexametasona fue interrumpida. Se interpretó secundaria a la amoxicilina, la cual se cambió a meropenem sin eventuales efectos adversos. La PCR 16S fue negativa, por lo que no se alcanzó un diagnóstico microbiológico definitivo. Un test de HIV fue negativo, y la serología para enfermedad de Lyme fue negativa, tanto en la fase aguda como en la de convalecencia. Las imágenes de RMN fueron repetidas antes del alta, mostrando que la lesión pontina tenía restricción de la difusión, lo cual favoreció el diagnóstico de infarto. Fue dado de alta después de completar 3 semanas de antibióticos intravenosos, teniendo una recuperación completa.
Traducción de:
“A 56 year old man with headache, fever, and neurological symptoms”
Ruth Dobson, specialty registrar in neurology
Clare Shannon, foundation year 2 trainee
BMJ 2010; 340:b5603 doi: 10.1136/bmj.b5603 (Published 20 January 2010)
Referencias
EPIDEMIOLOGÍA Y PATOGÉNESIS DE LA INFECCIÓN POR LISTERIA MONOCYTOGENES.
Listeria monocytogenes (única especie de Listerias que infecta al humano), es un bacilo Gram positivo aeróbico y anaeróbico facultativo, móvil, beta hemolítico, no formador de esporas. Puede confundirse con neumococo o difteroides (Corynebacterias), o aún con especies de Haemophilus.
PATOGÉNESIS.
Listeria es un parásito intracelular facultativo. Su hábitat es el suelo, la tierra y los materiales vegetales en descomposición. La mayoría de las infecciones por Listeria en el adulto son consideradas resultado de la ingestión oral con penetración de la mucosa intestinal e infección sistémica.
La inmunidad hacia Listeria depende principalmente de la activación de la activación de linfoquinas de células T por parte de los macrófagos, que aclaran la Listeria de la sangre. La Interleukina 18 parece jugar un rol en la protección contra Listeria por aumentar el clearence bacteriano, aún en ausencia de interferon gamma, y por a los macrófagos a secretar TNF y óxido nítrico. Cualquier factor que deteriore la función o sobrevida macrofágica, favorece la susceptibilidad a la infección listeriósica.
Listeria tiene predilección por la placenta y el sistema nervioso central. La Listeria cruza la placenta durante la bacteriemia materna e infecta el feto.
EPIDEMIOLOGÍA CLÍNICA.
Como dijimos, el principal hábitat de Listeria es el suelo, y los vegetales en descomposición. Se ha aislado del polvo, de numerosos productos alimenticios de origen animal, de alimentos para animales, agua, aguas servidas, numerosas especies de animales, y humanos asintomáticos. Aproximadamente 1 a 5% de individuos sanos, son excretores de Listeria por heces.
La incidencia de infección es en general baja, menor de 1/100000 habitantes/año en países desarrollados como EEUU. Es mayor en países en vías de desarrollo, y las tasas reales son desconocidas, ya que muchos casos pasan sin diagnóstico.
En EEUU, Listeria es la segunda más alta tasa de mortalidad entre las infecciones transmitidas por alimentos después de Vibrio vulnificus (18% vs 39%).
Un aumento de la tasa de listeriosis ha sido reportada en varios países Europeos, aparentemente relacionados con la disminución de la concentración de sal en la preparación de los alimentos.
Listeriosis es más a menudo una enfermedad esporádica que la que ocurre en brotes. Las gastroenteritis esporádicas debidas a Listeria monocytogenes parece ser infrecuente, por lo que no se requieren estudios específicos de cultivo para Listeria en muestras de heces en casos de estudios de diarrea. La fuente de infección en casos esporádicos, a menudo es desconocido, pero se considera que la mayoría de los casos es por adquisición a través de alimentos. El contagio por contacto directo con animales es raro, y ocurre sobre todo en veterinarios, trabajadores de mataderos, y trabajadores rurales.
Un estudio mostró que un porcentaje alto de los casos esporádicos fueron adquiridos por ingestión de quesos blandos o alimentos comprados en rotiserías. Casi el 70% de los pacientes tienen algún grado de inmunocompromiso (cáncer, HIV, receptores de transplantes de órganos, embarazo, pacientes añosos, o aquellos que reciben terapia con corticosteroides). El pollo insuficientemente cocido aumenta el riesgo de adquirir listeriosis.
Listeria es la causa más común de meningitis bacteriana en pacientes con cáncer, especialmente linfomas, en receptores de transplantes de órganos, y en aquellos que por alguna razón reciben corticoides.
La embarazada, especialmente en el tercer trimestre, es particularmente susceptible a la infección por Listeria, sobre todo en embarazos múltiples. Puede llevar a muerte fetal, partos prematuros, o recién nacidos infectados.
La terapia crónica con corticosteroides es el mayor factor predisponente en pacientes no embarazadas. Las enfermedades neoplásicas hematológicas o tumores sólidos, y los transplantados (especialmente de riñón), pacientes con SIDA, insuficiencia renal crónica terminal por nefropatía diabética (incluyendo hemodializados o quienes reciben diálisis peritoneal), sobrecarga de hierro (hemocromatosis con cirrosis, o sobrecarga transfisional de hierro en pacientes dializados), o enfermedades colágeno-vasculares, también son factores predisponentes importantes. La sobrecarga de hierro puede actuar por un doble mecanismo: disminuye la fagocitosis de los macrófagos cargados con hierro, y aumenta la virulencia bacteriana.
La profilaxis para Pneumocystis jirovecii con trimetoprima-sulfametoxazol, ha disminuido la incidencia de infección por Listeria en poblaciones con SIDA.
Se ha reportado adquisición intrahospitalaria de listeriosis.
MANIFESTACIONES CLÍNICAS Y DIAGNÓSTICO DE LAS INFECCIONES POR LISTERIA MOMOCYTOGENES.
La Listeria monocytogenes es un importante patógeno bacteriano en neonatos, inmunocomprometidos, ancianos, embarazadas, y ocasionalmente en individuos previamente sanos.
SÍNDROMES CLÍNICOS.
Listeria monocytogenes es considerado como un patógeno que causa enfermedad invasiva, incluyendo meningitis, meningoencefalitis, o bacteriemia en pacientes inmunosuprimidos, en edades extremas de la vida incluyendo neonatos y gerontes, y mujeres embarazadas. Sin embargo, Listeria puede también causar gastroenteritis febril aguda autolimitada en huésped normal si se ingiere un alto número de microrganismos con un alimento.
Es más común en meses de verano. El período de incubación va de 6 horas a 90 días, pero es de generalmente un día en el caso de las gastroenteritis febriles agudas.
GASTROENTERITIS FEBRILES.
Listeria produce menos del 1% de las infecciones bacterianas adquiridas por alimentos. Puede presentarse en brotes epidémicos. Ocurre después de la ingesta de un gran inóculo bacteriano. La tasa de ataque en un brote de gastroenteritis es de 50 a 100%, y la incubación promedio es de 24 horas (con un rango de 6 a 240 horas). Los síntomas son fiebre, diarrea acuosa, náuseas, vómitos, cefalea, y artromialgias generalizadas. Los síntomas suelen durar 2 días y los pacientes se recuperan completamente. La infección invasiva es rara, estando más en riesgo los inmunocomprometidos, embarazadas, o ancianos. Los quesos blandos no-pasteurizados han sido fuente de infección. En un brote de 57 adultos quienes ingirieron queso contaminado 21% tuvieron bacteriemia, 40% meningitis, 39% meningoencefalitis. El 42% tenían enfermedades de base, y más de la mitad tenían más de 65 años de edad. Estos hallazgos sugieren que un número sustancial de personas normales, que tienen exposición a Listeria, tienen infección asintomática o subclínica.
Las gastroenteritis esporádicas por Listeria monocytogenes parecen ser una enfermedad infrecuente (0,5%).
INFECCIÓN EN EL EMBARAZO.
La listeriosis en el embarazo ocurre más comúnmente durante el tercer trimestre.
Fiebre, escalofríos, lumbalgia ocurre como forma de presentación en la embarazada, con un cuadro seudogripal. La infección puede ser leve, resolverse sin terapia y el diagnóstico puede pasarse por alto si no se toman muestras de hemocultivos.
No hay indicadores clínicos específicos de bacteriemia por listeria en la mujer embarazada, y la invasión del sistema nervioso central es poco frecuente. Por lo tanto hay que obtener hemocultivos en toda embarazada febril cuando no existe una explicación evidente (infección urinaria, faringitis).
La infección por Listeria en la embarazada puede ocasionar muerte fetal, parto prematuro, o neonatos infectados. Una característica infección uterina severa, la granulomatosis infantiséptica, puede resultar en transmisión transplacentaria. Los infantes con este trastorno, tienen abscesos diseminados y/o granulomas en múltiples órganos internos (hígado, bazo, pulmones, riñones y cerebro). Pueden desarrollar también lesiones dermatológicas papulares o ulceradas. La mayoría de los neonatos con granulomatosis infantiséptica son mortinatos o mueren inmediatamente después de nacidos.
Los obstetras a veces reciben consultas de pacientes embarazadas que han ingerido alimentos implicados en brotes de listeriosis que han recibido amplia difusión pública en los medios. Es razonable tranquilizar a estas pacientes y recomendar cultivos de materia fecal y de sangre para pacientes con cualquier síntoma, incluyendo diarrea.
SEPSIS DE ORIGEN DESCONOCIDO.
La sepsis por Listeria ocurre en pacientes de todas las edades. Los neonatos probablemente adquieren la infección durante o después del nacimiento. En adultos, la sepsis por Listeria se da generalmente en pacientes con inmunocompromiso o en ancianos. Clásicamente se presenta con escalofríos y fiebre. Puede haber shock séptico, y puede haber metástasis séptica en cerebro y meninges, produciendo meningitis o cerebritis. La bacteriemia sin invasión de sistema nervioso central es la regla en la embarazada con listeriosis, pero el riesgo es mayor, a mayor inmunocompromiso (por ej transplantados renales). El diagnóstico de bacteriemia por Listeria se hace por cultivos de sangre.
INFECCIONES DE SISTEMA NERVIOSO CENTRAL.
La manifestación más común de infección por listeria de SNC es la meningoencefalitis. La cerebritis, que raramente progresa a absceso, y la romboencefalitis (encefalitis del tronco cerebral) son menos comunes.
Meningoencefalitis.
La meningoencefalitis por Listeria ocurre especialmente en neonatos y en inmunocomprometidos.
La presentación clínica de la meningoencefalitis por Listeria varía desde una enfermedad leve con fiebre y cambios en el estado mental del paciente, hasta un curso fulminante que evoluciona rápidamente al coma. La mayoría de los adultos tienen enfermedad subaguda, con o sin irritación meníngea.
Pueden existir signos de foco neurológico, lo que indica un componente encefalítico. Se puede ver entonces alteraciones de los pares craneales, ataxia, temblor, hemiplejia, e hipoacusia con evolución a sordera. Puede haber convulsiones tardíamente en el curso de la enfermedad.
Una presentación subaguda con parálisis de pares craneales, y un líquido cefalorraquideo con aumento de las células a predominio linfocitario, aumento de proteínas, y descenso de la glucosa, puede confundirse con meningitis tuberculosa o meningitis fúngica. En este grupo de pacientes, el cultivo del líquido cefalorraquídeo es positivo para Listeria, pero los hemocultivos positivos raramente ocurren si el cultivo del líquido cefalorrquídeo es negativo.
Cerebritis.
La cerebritis resulta de una invasión hematógena del parénquima cerebral, con escaso o nulo compromiso meníngeo. Sin embargo, pueden ocurrir cerebritis y meningitis en el mismo paciente. La cerebritis se presenta clínicamente con un amplio rango de manifestaciones, desde fiebre y cefalea, hasta hemiplejia, que recuerda un accidente cerebrovascular.
La evolución a absceso cerebral es rara.
Romboencefalitis.
La romboencefalitis (encefalitis de tronco cerebral) es una rara manifestación de infección por listeria, que ocurre típicamente en un paciente sano, que ha adquirido listeriosis vía consumo de alimentos contaminados, a menudo en brotes.
La romboencefalitis sigue frecuentemente un curso bifásico, comenzando con cefalea, fiebre, náuseas, y vómitos, seguido después de varios días de parálisis de pares craneales, ataxia, temblor y otros signos cerebelosos, alteraciones de la conciencia, y a veces convulsiones y hemiparesia. Casi la mitad evoluciona a fallo respiratorio.
El diagnóstico diferencial de la romboencefalitis incluye la encefalitis por herpes simplex, la tuberculosis, la toxoplasmosis, criptococosis, y otras infecciones fúngicas, la sarcoidosis, la enfermedad de Lyme, linfoma y vasculitis.
El análisis del líquido cefalorraquídeo a menudo revela sólo anormalidades leves, lo cual puede hacer que se retrase el diagnóstico. El cultivo del LCR y los hemocultivos son positivos en 40 y 60% de los casos respectivamente. La RMN mejor método que la TAC, para ver las imágenes características de la enfermedad, aunque no suelen observarse en estadios precoces del proceso.
La mortalidad es alrededor de 60%. Los no tratados tienen 100% de mortalidad, mientras que los tratados sobreviven 70%, aunque un porcentaje alto, queda con alguna secuela neurológica.
INFECCIONES LOCALES.
Numerosas manifestaciones focales de listeriosis han sido descriptas, más comúnmente en inmunocomprometidos. Las infecciones de piel u ojos, como resultado de la inoculación directa ocurre en veterinarios, granjeros, y trabajadores de laboratorios.
Otra complicación incluye el síndrome óculoglandular de Parinaud, la linfadenitis, neumonía, empiema, miocarditis, endocarditis (usualmente de presentación subaguda), artritis séptica, osteomielitis, infección de prótesis articulares, fascitis necrotizante, arteritis, e infección de injertos (incluyendo fístulas de diálisis).
Abscesos espinales y cerebrales, y colecistitis son el resultado de la siembra hematógena, y de una hepatitis aguda que simula una hepatitis viral pueden verse en pacientes con infección diseminada por listeria.
Puede haber peritonitis en pacientes tratados con diálisis peritoneal continua ambulatoria, o en pacientes con cirrosis (peritonitis espontánea).
DIAGNÓSTICO.
El diagnóstico de infección por listeria debe ser sospechada clínicamente, aunque no es fácil ya que puede simular la presentación de cualquier otra enfermedad infecciosa, y por lo tanto, el diagnóstico puede ser solamente establecido por el aislamiento del organismo por cultivo del líquido cefalorraquídeo o de hemocultivos. Sin embargo, los cultivos del LCR son positivos en la romboencefalitis por listeria sólo en 40%, y menos aún, en pacientes con abscesos cerebrales. En cambio, la positividad es mayor en los hemocultivos, en pacientes con infecciones del sistema nervioso central (60 a 70%).
El análisis del LCR en pacientes con listeriosis muestra pleocitosis que va desde 100% de polimorfonucleares hasta 100% de células mononucleares. La listeria es la única causa de meningitis bacteriana (no tuberculosa) que presenta aumento sustancial número de linfocitos (más de 25%) en el LCR en ausencia de terapia antibiótica. Las proteínas aumentan en LCR en forma moderada. También es moderado el descenso de la glucorraquia.
La tinción de Gram en la meningitis por Listeria tiene baja sensibilidad (35%). La Listeria puede confundirse con neumococo, o difteroides (Corynebacteria), o puede ser Gram variable y confundirse con especies de Haemophilus.
Por lo tanto, cada vez que se informe “difteroides” en el crecimiento de un cultivo de LCR, debe sospecharse Listeria, y debe tenerse especial cuidado de rotular como “meningitis viral” (aséptica) una meningitis negativa a la tinción de Gram en un paciente con inmunocompromiso o en un geronte.
Entre los pacientes con romboencefalitis, el examen del LCR puede ser normal, o mostrar sólo alteraciones leves.
Cultivos de Materia Fecal.
Los cultivos de heces no están indicados en pacientes con listeriosis sistémica. Sin embargo, en pacientes con sospecha de gastroenteritis por Listeria, o cuando se está investigando un brote de listeriosis, deben utilizarse medios de cultivos especiales, ya que los medios de cultivo comunes no son aptos para el crecimiento de Listeria.
Imágenes.
La resonancia magnética (RMN) es más sensible que la TAC para la detección de lesiones por Listeria en cerebelo, tronco encefálico y corteza. Señales hiperintensas en T2, y lesiones con realce en T1 después de la administración de contraste EV son vistas en el parénquima cerebral.
Se recomienda usar RMN con contraste en todo paciente con meningitis por Listeria, en todo paciente con bacteriemia por Listeria y síntomas o signos de sistema nervioso central, y en pacientes con lesiones intracraneanas. El compromiso aislado del tronco cerebral sugiere fuertemente infección por Listeria (romboencefalitis).
TRATAMIENTO, PRONÓSTICO Y PREVENCIÓN DE LA INFECCIÓN POR LISTERIA MONOCYTOGENES.
Tratamiento.
Ampicilina o penicilina G son las drogas de elección
En adultos la dosis de ampicilina es de 2 gr IV/4 hs. La dosis de penicilina en adultos es de 4 millones UI/4 hs. La ampicilina y la penicilina demuestran una lenta actividad bactericida in vitro a las concentraciones logradas en líquido cefalorraquídeo. Como resultado de ello se utiliza como agente asociado a cualquiera de esas dos drogas, gentamicina en las infecciones de sistema nervioso central, endocarditis, y en las infecciones en neonatos e inmunocomprometidos para lograr sinergia bactericida. La dosis de gentamicina en el adulto es de 3 mg/kg/día IV divididas en tres dosis.
En alergias a penicilina debe desensibilizarse a estos pacientes si es necesario, o tratarlos con trimetoprima-sulfametoxazol 10 a 20 mg/kg IV por día dividido cada 6 a cada 12 hs. TMS es bactericida contra Listeria, y logra adecuados niveles en suero y LCR, y se ha demostrado que la combinación ampicilina/TMS puede ser más efectiva que la combinación ampicilina/gentamicina.
TMS se absorbe bien por vía oral, y se puede rotar a la vía oral rápidamente una vez que la terapia parenteral se ha administrado por unos días tres comprimidos simples cada 6 horas.
Imipenem o meropenem son alternativas excelentes.
Gastroenteritis Febril.
La necesidad de tratamiento de una gastroenteritis listeriósica febril depende de las características del huésped:
En un paciente inmunocompetente, una gastroentritis listeriósica febril se resuelve espontáneamente en la mayoría de los pacientes en el término de 2 días, y por lo tanto no deben tratarse con ATB. Es raro que en un inmunocompetente, la infección se haga invasiva y produzca meningitis, meningoencefalitis, o bacteriemia, aunque esto puede verse en los inmunocomprometidos, y otros grupos como las embarazadas y los ancianos. En estos pacientes hay que dar ampicilina o TMS por varios días.
Embarazo:
La mujer embarazada con bacteriemia listerial puede ser tratada con ampicilina sola 2 gr IV/4 hs. TMS es una alternativa 10 a 20 mg/kg de peso, aunque debe evitarse durante el primer trimestre ya que el metabolismo del ácido fólico puede verse afectado, y durante el último mes por la posibilidad de kernicterus en el feto. Las infecciones de sistema nervioso central por Listeria son raras en la embarazada. La vancomicina es una alternativa entre pacientes embarazadas que se infectan durante un período durante el cual no puede administrarse TMS.
Infecciones Focales.
Numerosas manifestaciones focales de infección por Listeria han sido descriptas, incluyendo el síndrome óculoganglionar de Parinaud, linfadenitis, neumonía, empiema, miocarditis, endocarditis 8usualmente subaguda), artritis séptica, y osteomielitis. El tratamiento de estas localizaciones debe ser adaptado a la condición inmune de cada paciente, estado de embarazo, alergias a drogas, y función renal y hepática.
Duración de la Terapia.
La duración óptima del tratamiento varía según el paciente y el tipo de infección. Entre los pacientes con infecciones de sistema nervioso central, el tratamiento debe continuar hasta que los cultivos del LCR sean negativos, las imágenes cerebrales hayan mejorado significativamente.
En inmunocompetentes es suficiente 2 semanas para una bacteriemia por Listeria, y 2 a 4 semanas para una infección de sistema nervioso central. Esta duración produce recidivas en los inmunocomprometidos, y por lo tanto, son necesarios 3 a 6 semanas son necesarios en estos pacientes con bacteriemias, y 4 a 8 semanas en los que cursan infecciones de sistema nervioso central.
Después de la finalización del tratamiento antibiótico, los pacientes deben ser monitoreados en búsqueda de signos de recidiva clínica. No se aconseja repetir un cultivo de LCR al finalizar el tratamiento, si se ha obtenido un cultivo negativo DURANTE la terapia. En cambio, los pacientes con endocarditis, deben tener repetidos cultivos negativos después de finalizada la terapia, para dar por terminado el tratamiento.
En pacientes tratados con drogas inmunosupresoras (por ejemplo los transplantados renales) es aconsejable disminuir el nivel de inmunosupresión, aunque muchos pacientes han sido tratados exitosamente sin disminuir el nivel de inmunodepresión, lo cual no es siempre posible.
Monitoreo Durante la Terapia.
La respuesta a la terapia dbe ser monitoreada clínicamente (temperatura, signos clínicos, y síntomas) En los pacientes que permanecen febriles, o en aquellos que tienen otros signos o síntomas sugestivos de pobre respuesta después de varios días de tratamiento, hay que repetir los hemocultivos, y en pacientes con infecciones de sistema nervioso central, se repiten los cultivos de LCR, y, si inicialmente fueron anormales, se repiten las imágenes de RMN.
Pronóstico.
El pronóstico de las infecciones por Listeria, es altamente variable, y determinada por el status inmune, el sitio de la infección, y la presencia o ausencia de diagnóstico temprano e iniciación del tratamiento, cuando este esté indicado. Los adultos inmunocompetentes, casi siempre evolucionan bien. Los factores de riesgo de mortalidad son: presencia de neoplasias no hematológicas, alcoholismo, edad mayor de 70 años, uso de corticoides, y enfermedad renal, o receptores de transplantes, sobre todo riñón. Otro factor de riesgo de morbi/mortalidad es la infección del sistema nervioso central. Por ejemplo, los pacientes con meningoencefalitis o romboencefalitis tienen una mortalidad si son tratados, de entre 13 a 43%. Más aún, las secuelas neurológicas son comunes entre los sobrevivientes.
La romboencefalitis típicamente ocurre en individuos jóvenes y sanos que adquieren la Listeria, vía alimentos contaminados, mientras que los abscesos cerebrales ocurren la mayoría en inmunocomprometidos.
Por último, algunas recomendaciones para la prevención de esta infección a través de alimentos contaminados.
Esas recomendaciones incluyen: no consumir leche no pasteurizada, o alimentos que contengan leche no pasteurizada. Lavar minuciosamente los vegetales antes de consumirlos. Mantener la temperatura del refrigerador a 4,4 ºC o menos; el freezer a -17,8ºC o menos. Consumir alimentos pre-cocidos lo antes posible. Mantener la carne, pescado, y aves, separadas de otros alimentos que no serán cocinados, o de aquellos ya cocinados. Lavado de manos, cuchillos o elementos de corte, después de cortar alimentos crudos. Cocinar los alimentos de origen animal, hasta temperaturas seguras en el interior de los mismos (carne vacuna 71 ºC, pollo 77 ºC, pavo 82 ºC, cerdo 71 ºC).
Las siguientes recomendaciones deben hacerse en individuos tales como mujeres embarazadas, y aquellos que están inmunodeprimidos:
No comer hot dogs, fiambres derivados de cerdo, salchichas ahumadas, u otro tipo de carnes de rotisería, a menos que estas sean hervidas antes de consumir; evitar hornos de microondas para recalentar tales carnes, ya que puede producirse una cocción despareja de los alimentos. Evitar que los líquidos de los paquetes de salchichas estén en contacto con otros alimentos, utensilios, y superficies donde se preparan comidas; además, lavarse las manos después de tocar salchichas, fiambres derivados de cerdo, carnes de rotisería, o carne cruda, pollo, pavo, o frutos del mar o sus líquidos. No consumir ensaladas preempaquetadas con jamón, pollo, huevos, atún o frutos del mar. No comer quesos blandos tales como queso en fetas, Camembert, Brie, Roquefort, o quesos estilo Mexicano tales como queso blanco, queso fresco, y Panela, a menos que se tenga la certeza de que la leche en su preparación haya estado pasteurizada. No comer patés refrigerados o. Sin embargo, los productos enlatados o de larga vida son seguros para la embarazada. No comer frutos del mar ahumados refrigerados, a menos que sean cocinados en una cacerola antes de consumirse.
Finalmente, algunas direcciones útiles en relación al manejo y consumo seguro de los alimentos se detallan abajo
www.cdc.gov/ncidod/dbmd/diseaseinfo/listeriosis_g.htm.
http://www.fsis.usda.gov/
Fuente de la actualización en Infecciones por Listeria:
UpToDate 2011