Paciente femenina de 30 años. 
Sin antecedentes médicos personales ni familiares de importancia. Realiza actividad física regular 3 a 4 veces por semana, y presentaba excelente condición física hasta 1 semana antes de su internación.
Dos hijos vivos y sano, el último después de operación cesárea realizada hace 7 meses.
Actualmente en lactancia.

Sin antecedentes médicos personales ni familiares de importancia. Realiza actividad física regular 3 a 4 veces por semana, y presentaba excelente condición física hasta 1 semana antes de su internación.
Dos hijos vivos y sano, el último después de operación cesárea realizada hace 7 meses.
Actualmente en lactancia.
MOTIVO DE INTERNACIÓN:
Día 04/07/2010
Se interna en sala de emergencias el día por dolor abdominal y disnea clase funcional IV.
Su enfermedad actual se remonta a varios días atrás con la aparición de disnea progresiva a los esfuerzos que progresó a clase funcional IV el día del ingreso. No documentó fiebre durante la última semana, pero refiere equivalentes febriles durante ese lapso .
.
En el ingreso, aciente febril 38 ºC, frecuencia cardíaca:110 por minuto. Taquipneica. TA: 140/110 Sat 02:88% con aire ambiente, y con máscara al 50%: 95%. Lúcida, sin foco neurológico.
Ingurgitación yugular 3/3 sin colapso inspiratorio.
Aparato Respiratorio: Hipoventilación con matidez bibasal, escasos rales crepitantes.
Aparato cardiovascular: R1 R2 normofonéticos sin soplos. Galope por tercer ruido.
Abdomen: Hepatomegalia dolorosa. RHA+, abdomen indoloro a la palpación
Miembros: Edemas con edemas, Godet+++. Pulsos presentes. Sensibilidad y motilidad conservada.
Rx de tórax: Redistribución de flujo. Radio-opacidad bibasal, silueta cardiaca impresiona con cardiomegalia.
ECG: FC: 150x´ Eje:+40 ST: leve supradesnivel ST en V2 y V3. Ondas T negativas en DI, AVL, V1, V2 y V3.
Hemocultivos x 2 negativos. Urocultivo y coprocultivo: negativos
Se interpreta el cuadro como insuficiencia cardiaca asociada a un cuadro infeccioso.
Se indica plan a 7 gotas, Furosemida 1 amp/6 hs, nebulizaciones con salbutamol, máscara con O2 al 50% y comienza, con Ciprofloxacina por sedimento urinario patológico, y oseltamivir.
Día 05/04/2010:
Evoluciona hipertensa (170/100). Comienza con Nitroglicerina + Dobutamina por deterioro de función sistólica en el ecocardiograma,
Febril con hipotensión arterial, se retira NTG y Dobutamina. Se indica Dopamina. PVC:16 cm de H2O, Oliguria. PaFI:160.
Ecografía abdominal: Hepatomegalia. Derrame pleural bilateral.
Ecocardiograma: Hipoquinesia global de VI y VD . Derrame antero-posterior leve, válvulas sin masas vegetantes. No está detallada en este primer estudio la fracción de eyección.
Se realiza punción pleural bajo guía ecográfica bilateral: 300 ml izquierdo y 500 ml derecho: Trasudado con 300 y 200 leucocitos por mm3 respectivamente de los cuales 90%linfocitos, 5%monocitos y 3% polimorfonuclea res, con cultivo negativo
res, con cultivo negativo
Día 04/07/2010
Se interna en sala de emergencias el día por dolor abdominal y disnea clase funcional IV.
Su enfermedad actual se remonta a varios días atrás con la aparición de disnea progresiva a los esfuerzos que progresó a clase funcional IV el día del ingreso. No documentó fiebre durante la última semana, pero refiere equivalentes febriles durante ese lapso
En el ingreso, aciente febril 38 ºC, frecuencia cardíaca:110 por minuto. Taquipneica. TA: 140/110 Sat 02:88% con aire ambiente, y con máscara al 50%: 95%. Lúcida, sin foco neurológico.
Ingurgitación yugular 3/3 sin colapso inspiratorio.
Aparato Respiratorio: Hipoventilación con matidez bibasal, escasos rales crepitantes.
Aparato cardiovascular: R1 R2 normofonéticos sin soplos. Galope por tercer ruido.
Abdomen: Hepatomegalia dolorosa. RHA+, abdomen indoloro a la palpación
Miembros: Edemas con edemas, Godet+++. Pulsos presentes. Sensibilidad y motilidad conservada.
Rx de tórax: Redistribución de flujo. Radio-opacidad bibasal, silueta cardiaca impresiona con cardiomegalia.
ECG: FC: 150x´ Eje:+40 ST: leve supradesnivel ST en V2 y V3. Ondas T negativas en DI, AVL, V1, V2 y V3.
Hemocultivos x 2 negativos. Urocultivo y coprocultivo: negativos
Se interpreta el cuadro como insuficiencia cardiaca asociada a un cuadro infeccioso.
Se indica plan a 7 gotas, Furosemida 1 amp/6 hs, nebulizaciones con salbutamol, máscara con O2 al 50% y comienza, con Ciprofloxacina por sedimento urinario patológico, y oseltamivir.
Día 05/04/2010:
Evoluciona hipertensa (170/100). Comienza con Nitroglicerina + Dobutamina por deterioro de función sistólica en el ecocardiograma,
Febril con hipotensión arterial, se retira NTG y Dobutamina. Se indica Dopamina. PVC:16 cm de H2O, Oliguria. PaFI:160.
Ecografía abdominal: Hepatomegalia. Derrame pleural bilateral.
Ecocardiograma: Hipoquinesia global de VI y VD . Derrame antero-posterior leve, válvulas sin masas vegetantes. No está detallada en este primer estudio la fracción de eyección.
Se realiza punción pleural bajo guía ecográfica bilateral: 300 ml izquierdo y 500 ml derecho: Trasudado con 300 y 200 leucocitos por mm3 respectivamente de los cuales 90%linfocitos, 5%monocitos y 3% polimorfonuclea
Pasa a Unidad de Terapia Intensiva
Día 06/04/2010:
Febril. Se rota ATB a ampicilina/sulbactam (cubriendo foco respiratorio). Continúa con Oseltamivir
Continuando con requerimiento de O2. Agrega deterioro del sensorio por lo que se decide ARM bajo sedo-analgesia( SETEO: VCV VT:500 FIO2:0,5 FR12 PEEP5)requiriendo drogas vasoactivas: Dopamina.
Día 07/04/2010:
Continúa bajo sedo-analgesia. Presentó registro febril. 3er dia de ampicilina/sulbactam + Oseltamivir. Glóbulos blancos:14000 con neutrofilia.
Gases arteriales: Acidosis metabólica + alcalosis respiratoria
Cultivos negativos.
Continua con sedo-analgesia, se reduce dosis de Dopamina, Se reduce dosis de Furosemida. PVC: 4 cm de H20. Se plantea destete de ARM. Gases: Alcalosis Mixta.
Ecocardiograma: Aumento del diámetro sistólico del VI con disminución moderada de los índices de función sistólica. FE estimada: 40-45%
Derrame pericárdico antero-posterior leve sin signos de taponamiento cardiaco.
Día 08/04/2010:
Subfebril. Se retira Dopamina
Furosemida se reduce dosis a 1 amp/dia,
Se coloca a la paciente en modo de soporte planeando destete
Día 09/04/2010:
Se retira ARM
Día 12/04/2010:
Pasa a Sala de Clínica Médica
Día 13/04/2010:
Se indica Cabergolina y vendaje compresivo de mamas por 5 dias por galactorrea
Se suspende Furosemida, se indica carvedilol y espironolactona.
Día 14/04/2010:
Sin signos de IC, afebril, normotensa.
Se suspende amoxicilina/clavulánico ( completó 10 días)
El Servicio de Cardiología decide externación indicando:
1-dieta hiposódica
2- Diazepam 5mg cada 12 horas
3- Espironolactona 100mg/día
4- Carvedilol 3,125 mg/día.
Pendientes: Serologia HIV, Chagas y hepatitis B y C.
Se interpretó el cuadro como miocarditis aguda (miocardi opatía periparto?).
opatía periparto?).
Febril. Se rota ATB a ampicilina/sulbactam (cubriendo foco respiratorio). Continúa con Oseltamivir
Continuando con requerimiento de O2. Agrega deterioro del sensorio por lo que se decide ARM bajo sedo-analgesia( SETEO: VCV VT:500 FIO2:0,5 FR12 PEEP5)requiriendo drogas vasoactivas: Dopamina.
Día 07/04/2010:
Continúa bajo sedo-analgesia. Presentó registro febril. 3er dia de ampicilina/sulbactam + Oseltamivir. Glóbulos blancos:14000 con neutrofilia.
Gases arteriales: Acidosis metabólica + alcalosis respiratoria
Cultivos negativos.
Continua con sedo-analgesia, se reduce dosis de Dopamina, Se reduce dosis de Furosemida. PVC: 4 cm de H20. Se plantea destete de ARM. Gases: Alcalosis Mixta.
Ecocardiograma: Aumento del diámetro sistólico del VI con disminución moderada de los índices de función sistólica. FE estimada: 40-45%
Derrame pericárdico antero-posterior leve sin signos de taponamiento cardiaco.
Día 08/04/2010:
Subfebril. Se retira Dopamina
Furosemida se reduce dosis a 1 amp/dia,
Se coloca a la paciente en modo de soporte planeando destete
Día 09/04/2010:
Se retira ARM
Día 12/04/2010:
Pasa a Sala de Clínica Médica
Día 13/04/2010:
Se indica Cabergolina y vendaje compresivo de mamas por 5 dias por galactorrea
Se suspende Furosemida, se indica carvedilol y espironolactona.
Día 14/04/2010:
Sin signos de IC, afebril, normotensa.
Se suspende amoxicilina/clavulánico ( completó 10 días)
El Servicio de Cardiología decide externación indicando:
1-dieta hiposódica
2- Diazepam 5mg cada 12 horas
3- Espironolactona 100mg/día
4- Carvedilol 3,125 mg/día.
Pendientes: Serologia HIV, Chagas y hepatitis B y C.
Se interpretó el cuadro como miocarditis aguda (miocardi
Conclusiones del Caso.
Paciente joven que cursa puerperio de 7 meses, que en un contexto febril presenta un cuadro de insuficiencia cardíaca congestiva (ICC) de rápida instalación y sin antecedentes previos.
Se descartó que la causa de la ICC fuese una valvulopatía. La paciente no tiene factores de riesgo para cardiopatía isquémica, la cual por su edad fue desechada rápidamente. Tampoco existen antecedentes familiares de miocardiopatías.
La aparición 7 meses después del parto por definición excluye la miocardiopatía periparto (hasta 5 meses después del parto). Por ello se interpretó el cuadro como miocarditis aguda. Sin embargo, fue considerada también una hipótesis alternativa, que podría ser que la paciente hubiese presentado una miocardiopatía periparto, que no se expresara clínicamente en forma ostensible, dado la acotada actividad de la paciente los últimos meses, y que la fiebre (objetivada al comienzo de su sintomatología), la hipertensión arterial, y la taquiarritmia, hayan obrado como desencadenantes de la insuficiencia cardíaca, interactuando sobre una miocardiopatía puerperal hasta ese momento oligosintomática. De cualquier manera, las dos hipótesis no son excluyentes, ya que como veremos, entre las hipótesis etiopatogénicas de la miocardiopatía periparto está también la miocarditis aguda.
En cuanto a la interpretación del cuadro febril sin un foco evidente, es compatible con un cuadro viral, probable origen de la miocarditis.
La evolución de la paciente fue sorprendentemente buena en forma rápida como sucede con algunas formas de miocarditis fulminantes, para las cuales esta paciente no reúne los criterios ecocardiográficos de disfunción sistólica más severa que suele verse en dichas formas clínicas.
Al momento del alta no se habían recibido la mayoría de los estudios serológicos solicitados, tendientes a demostrar la etiología del cuadro.
Aprovecharemos el caso para actualizar el tema miocarditis y miocardiopatía periparto, sin que ello signifique que alguno de estos diagnósticos puedan establecerse con claridad en este caso.
ETIOLOGÍA Y PATOGÉNESIS DE LAS MIOCARDITIS.
La miocarditis es una enfermedad inflamatoria del músculo cardíaco. Puede ser agudo, subagudo, y crónico, y puede haber compromiso focal o difuso del miocardio. La presentación en pacientes sintomáticos es frecuentemente como insuficiencia cardíaca (IC), aunque a veces puede presentarse mimetizando un infarto agudo de miocardio o como una taquiarritmia, incluso puede ocurrir muerte súbita, o un bloqueo de alto grado. Si está comprometido el epicardio, el cuadro es el de una miopericarditis, a menudo asociado a dolor pleurítico y derrame pericárdico. La inflamación endomiocárdica aislada y la fibrosis son vistos en la cardiomiopatía de Löffler, en la endomiocarditis tropical, en el síndrome hipereosinofílico, y en algunas reacciones adversas a drogas.
ETIOLOGÍA
La miocarditis puede ser causada por una variedad de enfermedades, infecciosas y no infecciosas.
CAUSAS INFECCIOSAS
Virales:
Coxsackie B virus, echovirus, virus de Epstein-Barr (EBV), citomegalovirus (CMV), adenovirus, HIV, hepatitis B y C, rubéola, sarampión, varicela (VZV), parotiditis urleana, viruela, parvovirus, influenza A y B, herpes virus, poliomielitis, rabia, arbovirus, dengue, fiebre amarilla.
Bacterianas:
Difteria, tuberculosis, salmonella, estafilococo, gonococo, clostridios, brucelosis, psitacosis, tétanos, tularemia, estreptococo, legionella, meningococo, haemophilus, neumococo, cólera, chlamydia, mycoplasma.
Espiroquetósicas:
Sífilis, leptospirosis, fiebre recurrente, enfermedad de Lyme.
Micóticas:
Cándida, histoplasmosis, esporotricosis, coccidioidomicosis, aspergilosis, blastomicosis, criptococosis, actinomicosis, mucormicosis, nocardia, strongiloidiasis.
Rickettsias:
Tifus, fiebre Q, fiebre manchada de las montañas rocosas.
Protozoarios:
Chagas (tripanosomiasis sudamericana), enfermedad del sueño (tripanosomiasis Africana), toxoplasmosis, malaria, leishmaniasis, amebiasis.
Helmintos:
Triquinosis, equinococosis, esquistosomiasis, ascariasis, filariasis, paragonimiasis, estrongiloidiasis.
CAUSAS NO INFECCIOSAS.
Cardiotoxinas:
Catecolaminas, antraciclinas, ciclofosfamida, cocaína, metales pesados (cobre, plomo, hierro), alcohol, arsénico, monóxido de carbono, metisergida,
Cocaina. Metales pesados (cobre, plomo, hierro).
Reacciones de Hipersensibilidad:
Antibióticos (penicilinas, cefalosporinas, sulfonamidas), diuréticos (tiazidas, diuréticos de asa), dobutamina, litio, toxoide tetánico, clozapina, metildopa, picaduras de insectos (abejas, avispas, arañas, escorpiones), picaduras de víboras.
Trastornos Sistémicos:
Enfermedades colágeno-vasculares, sarcoidosis, enfermedad celíaca, enfermedad de Kawasaki, hipereosinofilia, granulomatosis de Wegener, tirotoxicosis, enfermedad inflamatoria intestinal (enfermedad de Crohn, colitis ulcerosa).
Radiación.
Entre las etiologías infecciosas, los virus son los patógenos más frecuentes, pero, las bacterias, hongos, protozoarios y helmintos también pueden producir miocarditis ocasionalmente. En países desarrollados los virus más frecuentemente identificados fueron los enterovirus (incluyendo virus coxsackies) hasta 1990. Hoy en día los virus más frecuentemente encontrados son el parvovirus B19, el Herpes Virus Humano tipo 6, el virus de la hepatitis C (HCV), y los adenovirus, en pacientes con cardiomiopatía crónica, se supone como consecuencia de miocarditis aguda previas. En países subdesarrollados, la carditis reumática, la enfermedad de Chagas y la cardiopatía relacionada a estados avanzados de infección por HIV son causas importantes.
En la búsqueda del agente causal en pacientes con miocarditis, como se verá en “diagnóstico”, se realizan estudios de cultivos de sangre, orina, materia fecal, nasofaringe y de biopsias endomiocárdicas. Estudios serológicos, y estudios de PCR de muestras obtenidas de sangre y tejidos cardíacos para la identificación de ácidos nucleicos virales. Estas metologías diagnósticas empleadas han permitido hacer algunas observaciones:
• La suma de: serología, cultivos y PCR de tejido cardíaco permitieron descubrir la etiología en aproximadamente un tercio de los pacientes con miocarditis. La PCR (en tejido cardíaco) detectó patógenos en 20% de las miocardiopatías dilatadas y solo en 1,4% de los controles. Las muestras de sangre solo fueron positivas para PCR en 1%.
• De 239 pacientes con miocarditis y PCR positiva en tejido cardíaco, 142 fueron positivas para adenovirus, 85 para enterovirus (incluyendo coxsackie), 18 para CMV, 6 para parvovirus, 5 para influenza, A, 5 para herpes simplex virus tipo 1, 3 para EBV y 1 para virus sincitial respiratorio.
Los hallazgos de PCR no deben ser interpretados como diagnóstico definitivo de la causa de la miocarditis, ya que no puede descartarse una infección viral intercurrente o previa, no relacionada con el episodio de miocarditis.
INCIDENCIA Y PREVALENCIA.
La verdadera incidencia de la miocarditis idiopática o “viral” en la población es desconocida. Estudios de hace algunos años sugirieron que el compromiso cardíaco ocurre en 3,5 a 5% de los pacientes durante un brote de infección por virus coxsackie. Sin embargo, hay una dificultad en establecer un diagnóstico de miocarditis, dado que no existe un método establecido no invasivo que sea el “gold standard” diagnóstico. Más aún, la sensibilidad de la biopsia endomiocárdica (que puede revelar un infiltrado linfocitario, a veces con evidencias de daño miocárdico), puede ser tan bajo como 35%.
RELACIÓN ENTRE MIOCARDITIS VIRAL Y MIOCARDIOPATÍA DILATADA.
El rol de la miocarditis viral en la miocardiopatía dilatada (MCD) es un tema de importancia. Hay varios mecanismos por los que una miocarditis viral puede causar MCD aguda o crónica, incluyendo daño viral directo, o como resultado de la respuesta inmune humoral o celular a la persistencia de la infección viral.
PATOGENIA.
Injuria viral directa.
Nuestros conocimientos de la patogénesis de las miocarditis virales proviene de modelos experimentales de infección aguda por virus coxsackie B. El cambio inicial es el daño al miocito en ausencia de respuesta inmune celular. La injuria al miocito puede ser mediada a través de toxicidad viral directa, lisis celular mediada por perforinas, y expresión de citoquinas.
Eventos intracelulares:
La entrada viral en el miocito es mediada por receptores en la superficie de la célula. El receptor coxsackie-adenovirus (CAR) es un receptor común para virus coxsackie B y adenovirus subgrupos A, C, D, E y F. El gen del receptor CAR está localizado en el cromosoma 21q11.2. Con raras excepciones, la expresión de CAR es requerido para la entrada a las células.
El descubrimiento del receptor CAR, eleva la posibilidad de terapia de intervención para bloquear el receptor CAR en casos severos de miocarditis por virus coxsackie B o por adenovirus. Los coreceptores, incluyendo el factor acelerador de caída (decay-accelerating factor) (DAF, CD55), para algunos coxsackie B, e integrinas, ayudan a determinar la eficiencia de la infección. La actividad de las vías de señalización en los miocitos cardíacos también determina susceptibilidad a la miocarditis por coxsackie B, vía efectos en la replicación viral.
Después de la entrada en la célula a través del receptor CAR, el genoma viral del virus coxsackie B es traducido en proteínas estructurales de la cápside y varias proteasas que clivan la poliproteína viral. La proteasa viral 2A puede también clivar ciertas proteínas del huésped, y un mecanismo de injuria del miocito es a través de la interacción de las proteínas virales con el citoesqueleto. En un modelo de ratón transgénico, la expresión restringida de la proteasa 2 A fue suficiente para inducir MCD.
La proteasa 2A cliva la distrofina in vivo, llevando a la disrupción del complejo distrofina-glicoproteína que es esencial para el funcionamiento cardíaco normal. Este mecanismo de disfunción miocárdica está también presente en las cardiomiopatías hereditarias que están relacionadas a la mutación de la distrofina, tal como la distrofia muscular de Duchenne. Hay otra interacción de importancia entre el virus coxsackie B y la distrofina, ya que hay una más eficiente liberación de virus por parte de células deficientes en distrofina. Así, los ratones deficientes en distrofina tienen mayor replicación viral y más severa cardiomiopatía.
Infección Viral Persistente.
La respuesta inmune inicial juega un rol protector contra el desarrollo de miocarditis por coxsackie B. La posible importancia de la replicación viral persistente se demostró en un estudio de miocarditis por coxsackie B de ratones inmunocompetentes. El RNA enteroviral estuvo presente en la miocarditis aguda y persistió durante la fase crónica de la miocardiopatía.
Estudios posteriores mostraron que la infección viral persistente se asoció a disfunción miocárdica. En un modelo de ratón transgénico por ejemplo, la expresión de DNA de coxsackie, y la síntesis de RNA viral sin formación de progenie viral infecciosa resultó en MCD. Los miocitos aislados tuvieron defectos en el acoplamiento excitación-contracción y disminución del acortamiento.
El testeo serológico por PCR y de hibridización con sondas en humanos ha reafirmado la conección entre la persistencia de la infección viral miocárdica y el desarrollo de MCD. Los virus más comúnmente identificados son parvovirus B19 y herpes virus humano tipo 6 (HHV6), pero también han estado implicados otros virus incluyendo HIV, hepatitis C, CMV, y varicela.
Mecanismos Autoinmunes.
Los mecanismos autoinmunes han estado implicados en la patogénesis de las miocarditis. En particular, anticuerpos autorreactivos, pueden jugar un rol en el desarrollo de MCD.
En pacientes con miocarditis viral, la respuesta inmune inicial limita el grado de viremia temprana durante la infección y protege contra la miocarditis. Sin embargo, si la respuesta es insuficiente, el virus puede no ser eliminado, y como consecuencia puede sobrevenir una injuria al miocito. Además de la injuria inducida en forma directa por el virus, la persistencia de fragmentos genómicos virales que pueden no ser capaces de replicarse como virus intactos, pueden producir una respuesta autoinmune.
Autoanticuerpos potencialmente patogénicos contra una variedad de componentes celulares son encontrados en alto porcentaje de pacientes con miocarditis y MCD. Los autoantígenos incluyen miosina cardíaca, el receptor adrenérgico beta-1, el traslocador de adenina nucleótido (ANT), complejo de la deshidrogenasa de alfa-cetoacidos de cadena ramificada (BCKD), una variedad de proteínas sarcolémicas y miolemicas, tejido conectivo, y proteínas de matriz extracelular, incluyendo laminina.
La patogénesis de los anticuerpos anti-corazón comienza probablemente con el daño miocítico inducido por virus, con liberación de proteínas intracelulares. Los antígenos intracelulares pueden ser reconocidos como extraños debido a que previamente no estaban en contacto con el sistema inmune, al estar dentro de la célula, protegidos de la vigilancia inmunológica, o a través de mimetismo molecular entre proteínas enterovirales y cardíacas. Las células T CD4-positivas producen daño miocítico estimulando a las células B, citoquinas citotóxicas, y células T citotóxicas CD8-positivas. La presencia de autoanticuerpos anti-corazón es predictora de desarrollo ulterior de MCD.
La subclase de inmunoglobulinas puede ser importante en MCD mediada por anticuerpos. En un estudio, la subclase IgG3 pero no la IgG 1 ni la IgG2 estuvieron elevadas en pacientes con MCD. En otro estudio, hubo una correlación significativa entre la concentración plasmática de IgG3 y la hemodinamia así como los índices de severidad de insuficiencia cardíaca en el ecocardiograma.
El rol de la IgG3 puede tener implicancias en la terapia. La inmunoadsorción para la remoción de anticuerpos puede ser llevada a cabo, sea con columnas con membranas unidas a proteína A (que se unen y remueven la mayoría de IgG, pero tienen baja afinidad para IgG3), o con columnas anti-IgG (que tienen especificidad para todas las subclases de IgG).
Anticuerpos anti alfa-miosina, anticuerpos anti-receptor-beta-1 han estado presentes en pacientes con miocarditis y sobre todo en la evolución a MCD. Además de promover injuria cardíaca, un subgrupo de esos autoanticuerpos contra el segundo dominio del receptor beta-1, ejerce actividad agonista-like, y puede tener algún rol en el desarrollo de arritmias ventriculares serias.
Las autoinmunidad mediada por células T autoreactivas han mostrado presentar acción patogénica en pacientes con MCD idiopática. La sobreexpresión de células T helper activados y células T citotóxicas estuvo asociada con la presencia de virus coxsackie B, que pueden haber sido el disparador para una respuesta inmune mediada por un superantígeno.
Rol de las Citoquinas:
Finalmente, hay un rol para las citoquinas. En un contexto de estado post viral, las citoquinas regulan la función linfocitaria de una manera positiva y negativa, y ejercen una marcada influencia en las actividades de muchas otras células involucradas en la reparación de tejidos y la restauración de la homeostasis. En modelos animales, la progresión a MCD se caracteriza por cambio en la expresión de citoquinas. Las citoquinas Th1, incluyendo interleukina (IL)-2, interferon gamma, e IL-1-beta, son expresados tempranamente en las lesiones. La transición a fibrosis y a MCD son precedidas por una disminución en las citoquinas Th1 y un aumento en la IL-10, una citoquina Th2. El factor de necrosis tumoral-alfa (TNFa) ha estado implicado en la patogénesis de las miocarditis y las MCD en estudio en animales. La producción de esta citoquina por los miocitos cardíacos fue suficiente para causar severa enfermedad cardíaca, incluyendo miocarditis transmural y finalmente fibrosis biventricular, dilatación de las cámaras y disfunción de VI. Además, hay una fuerte relación linear entre los niveles de TNFa y mortalidad en un modelo de ratón con insuficiencia cardíaca secundaria a miocarditis. En miocarditis humana la biopsia endomiocárdica mostró mayores niveles de precursor de TNFa y de enzima convertidora de TNFa (TACE), que convierte el precursor a su forma madura.
En síntesis:
La injuria viral y la respuesta inmune subsecuente pueden ser simplificadas en un modelo de tres fases para categorizar los estadios de progresión de una infección viral aguda a una miocardiopatía dilatada.
• La primera fase comprende la infección viral con muerte celular del miocito dentro de horas de la entrada viral a la célula. En este estadio agudo, la muerte del miocito resulta de daño viral directo, y conduce a la exposición de las proteínas del huésped al sistema inmune.
• La segunda fase, que sigue rápidamente, es una respuesta inmune innata, que comprende la función regulatoria alterada de las células T, células NK, interferón gamma, y óxido nítrico.
• En la tercera fase, una respuesta inmune específica se caracteriza por la aparición de anticuerpos contra los agentes patógenos y contra las proteínas cardíacas del huésped, y células T autoreactivas. La mayoría de los sujetos se recuperan con pocas consecuencias, pero una minoría mueren por arritmias, o progresan a una fase crónica de fallo cardíaco. El stress hemodinámico y neurohumoral conduce a la dilatación ventricular.
MANIFESTACIONES CLÍNICAS Y DIAGNÓSTICO DE MIOCARDITIS EN ADULTOS.
Aunque la histología sigue siendo el gold standard para establecer el diagnóstico de miocarditis, a los pacientes de bajo riesgo casi siempre se establece el diagnóstico presuntivo de miocarditis, si las imágenes y el cuadro clínico, sugieren miocardiopatía de reciente inicio.
La presentación clínica de las miocarditis es altamente variable. Estas diferencias de manifestaciones clínicas, reflejan la variabilidad en la severidad de la enfermedad. La inflamación miocárdica puede ser focal o difusa, afectando cualquiera o todas las cavidades cardíacas. Las miocarditis severas, difusas pueden evolucionar a MCD. Los hallazgos histológicos de miocarditis crónica son usualmente más sutiles, e incluyen antígenos HLA y expresión de moléculas de adhesión alterados, e infiltrados celulares que son visibles solo con inmunotinciones celulares específicas.
Estudios antiguos sugerían que el compromiso cardíaco ocurría en 3,5 a 5% de los pacientes en un brote de infección por virus coxsackies. Sin embargo, hay una dificultad significativa en establecer el diagnóstico de miocarditis debido a que no hay un “gold standard” no invasivo establecido. La sensibilidad de la biopsia endomiocárdica para miocarditis usando criterios histológicos es bajo, en el orden de 10 a 35% debido a la variabilidad en la interpretación y a errores en la toma de muestras.
Las imágenes de resonancia magnética (RMN) son útiles para diagnosticar inflamación epicárdica o medio parietal y edema en pacientes con bajo rendimiento en biopsias endomiocárdicas de ventrículo derecho.
Otro problema es que muchos casos de compromiso miocárdico pueden ser subclínicos. Por ejemplo, la tasa de aumento de troponina después de la vacunación de viruela es 1:200, pero la tasa de miocarditis clínica es aproximadamente 1:5500. Además, síntomas y signos sutiles pueden ser pasados por alto por las manifestaciones sistémicas de un proceso de enfermedad de base. En los estadios tempranos de miocarditis viral por ejemplo, el paciente puede tener fiebre, mialgias, y dolores musculares. Los síntomas musculares son atribuidos a miositis inducidos por un virus miotrópico tal como virus coxsackie A.
Manifestaciones clínicas:
El espectro de presentación de las miocarditis agudas puede ser amplio. A continuación las formas más frecuentes con las que se presenta un paciente con miocarditis:
• Fatiga excesiva.
• Dolor torácico.
• Taquicardia sinusal inexplicada.
• Pericarditis aguda.
• Tercer o cuarto ruido, o galope de suma.
• Alteraciones en el electrocardiograma.
• Alteraciones en el ecocardiograma.
• Nueva cardiomegalia en la Rx de tórax.
• Arritmia auricular o ventricular.
• Bloqueo cardíaco parcial o completo.
• Insuficiencia cardíaca congestiva de comienzo reciente.
• Infarto de miocardio atípico.
• Shock cardiogénico.
• Muerte súbita inesperada.
Insuficiencia cardíaca:
Muchos casos sintomáticos de miocarditis postviral o linfocitaria se presentan con un síndrome de insuficiencia cardíaca (IC) y MCD. En un estudio de 1230 casos de MCD en los EE UU, 9% fueron considerados debidos miocarditis. En muchos pacientes que desarrollan IC, la fatiga y la capacidad de tolerancia al ejercicio disminuida son las manifestaciones iniciales. Sin embargo, la miocarditis difusa, severa, si es rápida en la evolución, puede resultar en fallo miocárdico agudo y shock cardiogénico. Los signos de fallo ventricular derecho incluyen presión venosa yugular aumentada, hepatomegalia, y edema periférico. La alteración de la función ventricular derecha “protege” al corazón izquierdo de los síntomas de congestión pulmonar. Si en cambio lo que predomina es el compromiso ventricular izquierdo, el paciente puede tener síntomas pulmonares de congestión, como disnea, ortopnea, rales, y en casos severos, edema agudo de pulmón.
Dolor torácico:
El dolor torácico está usualmente asociado a pericarditis concomitante. Sin embargo, la miocarditis puede mimetizar isquemia miocárdica y/o infarto, tanto clínicamente como en el electrocardiograma, particularmente en pacientes más jóvenes. La isquemia asociada a miocarditis puede ser debida a inflamación localizada o espasmo coronario.
Muerte cardíaca súbita:
La miocarditis puede presentarse como muerte súbita inesperada, presumiblemente debido a taquicardia o fibrilación ventricular. En una serie de autopsias de pacientes de menos de 40 años que se presentaron como muerte súbita en ausencia de enfermedad cardíaca conocida, la miocarditis fue responsable de 22% de los casos de menos de 30 años y 11% en los mayores de 30 años.
Arritmias:
Un número de arritmias pueden ser vistas. La taquicardia sinusal es más frecuente que las serias arritmias auriculares y ventriculares, mientras que las palpitaciones secundarias a extrasístoles auriculares, o, más a menudo, extrasístoles ventriculares son comunes.
Las miocarditis pueden ocurrir como una complicación de otras miocardiopatías incluyendo la amiloidosis cardíaca, la cardiomiopatía hipertrófica y la cardiomiopatía arritmogénica de ventrículo derecho. En la amiloidosis y en la cardiomiopatía hipertrófica, la miocarditis puede afectar el pronóstico.
Clasificación Clínicopatologica.
Una clasificación clínicopatológica utilizando tanto elementos histológicos como clínicos pueden proveer información pronóstica acerca de pacientes con IC debida a miocarditis. Un estudio propuso la siguiente clasificación:
• Miocarditis fulminante:
La miocarditis fulminante se presenta con fallo cardíaco agudo hasta 2 semanas después de los pródromos virales. Los pacientes tienen severo compromiso cardiovascular y pueden requerir soporte circulatorio mecánico. Múltiples focos de miocarditis activa son típicos, y la disfunción ventricular a menudo se normaliza si los pacientes sobreviven a la enfermedad aguda.
• Miocarditis aguda:
La miocarditis aguda se presenta con un inicio de la enfermedad menos distintivo. Los pacientes suelen presentarse con disfunción ventricular establecida y puede progresar a MCD.
• Miocarditis crónica activa: La miocarditis crónica activa también se presenta con un inicio menos distintivo de enfermedad. Los pacientes afectados a menudo tienen recidivas clínicas e histológicas, y desarrollan disfunción ventricular asociada con cambios inflamatorios crónicos, y leve a moderada fibrosis en el estudio histológico.
• Miocarditis crónica persistente:
La miocarditis crónica persistente, que también se presenta como una enfermedad menos distintiva, se caracteriza por un infiltrado histológico persistente, a menudo con focos de necrosis miocítica pero sin disfunción ventricular, a pesar de otros síntomas tales como dolor torácico o palpitaciones.
Examen físico.
Además de los signos de sobrecarga de líquidos, el examen físico a menudo revela evidencias directas de disfunción cardíaca en pacientes sintomáticos.
• Galope por R3 y ocasionalmente por R4 son signos importantes de deterioro de la función ventricular, particularmente cuando el compromiso miocárdico agudo biventricular resultan en congestión pulmonar y sistémica.
• Si la dilatación ventricular derecha o izquierda es severa, la auscultación puede revelar soplos de insuficiencia mitral o tricuspídea.
• Un frote pericárdico y un derrame pueden ser evidentes en pacientes con miopericarditis.
Laboratorio.
Los análisis de rutina de sangre y orina son a menudo normales o revelan solo anormalidades inespecíficas.
Enzimas cardíacas:
La elevación de las enzimas cardíacas reflejan la necrosis miocárdica. Ellas son vistas en algunos pero no en todos los pacientes con miocarditis. Los hallazgos experimentales y clínicos, sugieren que la elevación de los niveles de troponina I o T (cTnI o cTnT) pueden ser más comunes que las elevaciones de la CK-MB en pacientes con miocarditis probada por biopsia endomiocárdica. (34 por ciento versus 6%). Las elevaciones de cTnI estuvieron correlacionados con una corta duración (menos de un mes) de síntomas de fallo cardíaco, sugiriendo que la mayor proporción de necrosis cardíaca ocurre al principio de la enfermedad. Las elevaciones persistentes de las enzimas cardíacas son indicativas de necrosis en curso.
Electrocardiograma (ECG):
El ECG puede ser normal o anormal en las miocarditis. Sin embargo, las anormalidades son inespecíficas a menos que haya compromiso pericárdico. Los cambios pueden incluir alteraciones inespecíficas del ST, latidos ectópicos auriculares o ventriculares, arritmias ventriculares complejas (apareadas, o taquicardia ventricular no sostenida), o, raramente, taquicardia auricular o fibrilación auricular. Un bloqueo de alto grado es poco frecuente en las miocarditis linfocitaria, pero común en la sarcoidosis cardíaca y en las miocarditis idiopáticas de células gigantes.
Las miocarditis pueden, en algunos casos, simular exactamente el patrón de las pericarditis agudas o del infarto agudo de miocardio (IAM). Como en el IAM, las miocarditis pueden tener elevaciones regionales del ST y ondas Q. Las miocarditis deben ser sospechadas en pacientes jóvenes que se presentan con posible IAM pero tienen angiografía coronaria normal.
La presencia de onda Q, o bloqueo de rama izquierda se asocia con mayores tasas de transplante o muerte.
Radiografía de tórax:
El tamaño del corazón en la Rx de tórax varía desde el tamaño normal hasta la cardiomegalia con o sin congestión vascular y derrame pleural. Una considerable cardiomegalia biventricular puede asociarse a la ausencia total de congestión pulmonar debido a la presencia de fallo cardíaco derecho y/o moderada a severa regurgitación tricuspídea.
Figura 1. Radiografía de tórax secuencial en miocarditis agu da.
da.
Rx de tórax frente secuencial en un hombre joven con miocarditis aguda (derecha), y tres meses más tarde (izquierda). En la primera radiografía se observa cardiomegalia y congestión pulmonar. Tres meses después, los pulmones se han aclarado pero el paciente tiene miocardiopatía dilatada con cardiomegalia persistente.
Ecocardiografía:
El ecocardiograma se ha transformado en la metodología diagnóstica de mayor valor en detectar la disminución de la función ventricular en las miocarditis agudas, aún cuando son subclínicas. Un ventrículo esferoideo en las miocarditis agudas, tiende a remodelar a una forma elíptica más normal en el curso de algunos meses. La disfunción es generalmente global, pero puede ser regional o segmentario. Una señal de Doppler tisular anormal puede proveer evidencia adicional de miocarditis, aunque no ha sido evaluado en grandes estudios.
Un leve deterioro de la contractilidad miocárdica puede ser evidente solo cuando el estudio es llevado a cabo en reposo más que durante el ejercicio. Sin embargo, pueden verse alteraciones de la motilidad parietal inducidas por ejercicio, que representan generalmente disfunción debido a alteraciones microvasculares.
El ecocardiograma puede también detectar un trombo silente intracardíaco, regurgitación mitral o tricuspídea, y compromiso pericárdico coexistente.
Tanto la miocarditis fulminante como la miocarditis aguda se asocian con disfunción sistólica del VI. Sin embargo, los pacientes con miocarditis fulminante tienden a tener dimensiones diastólicas ventriculares izquierdas normales o casi normales, y un aumento del grosor septal, mientras que aquellos pacientes con miocarditis aguda tienden a tener dimensiones diastólicas ventriculares izquierdas aumentadas, y grosor septal normal. A los seis meses, los pacientes con miocarditis fulminante tienen un mejoramiento dramático en la función sistólica, mientras que no hay cambios en los pacientes con miocarditis aguda.
Ventriculografía isotópica:
Con el uso difundido de la ecocardiografía, la ventriculografía isotópica tiene poco que ofrecer. Sin embargo, puede ser útil cuando las imágenes del ecocardiograma transtorácico son subóptimas, o cuando la ecocardiografía transesofágica no está disponible. Además, hay menos variabilidad en la medición de la fracción de eyección obtenida de la ventriculografía isotópica seriada, debido a que es menos operador dependiente.
Cardio resonancia magnética (CRM):
La cardioresonancia puede detectar edema miocárdico e injuria miocárdica en las miocarditis.
Los hallazgos incluyen aumento en la intensidad de señal focal y global en T2 (usada para calcular relación de edema (RE)), aumento en el realce de contraste miocárdico focal o global en relación al músculo esquelético, y la presencia de realce tardío con gadolinio (RT). El RT parece ser menos sensible que el realce relativo global (gRE), o RE para la detección de miocarditis, de manera que la negatividad del realce tardío con gadolinio no excluye la miocarditis. La mejor performance diagnóstica puede ser obtenida con la positividad de dos de esas tres secuencias, las cuales brindan un 76% de sensibilidad y 96% de especificidad.
La CRM ha demostrado que las miocarditis a menudo comienzan como un proceso focal:
• En un estudio de CRM que usó realce con gadolinio se observó que existía un aumento focal inicial, que se hizo global después de cuatro semanas. (Figura 2).
• En otro estudio, el 88% de los pacientes tuvieron uno o más focos en la CRM con gadolinio con RT, más a menudo en la pared libre del ventrículo izquierdo (VI). La CRM puede así, guiar la biopsia endomiocárdica para mejorar el rendimiento diagnóstico.
• Diferentes patógenos virales producen diferentes patrones de injuria miocárdica. Los pacientes con parvovirus B19 tienen compromiso subepicárdico de la pared libre del VI, en la CRM con gadolinio en RT, mientras que los pacientes con herpes virus humano tipo 6 tienen compromiso septal.
Figura 2
CRM con realce de contraste en un paciente con miocarditis aguda.
Panel A: en el día 2 de comienzo de los síntomas, el realce de contraste revela pequeños focos de aumento de la intensidad de señal en el miocardio posterior y en el septum basal.
Panel B: en el día 14, se ve un aumento más difuso en la intensidad de la señal miocárdica, especialmente en el septum (flecha).
Panel C: en el día 84 no se ve realce de contraste.
El patrón de realce tardío con gadolinio en las miocarditis puede generalmente ser distinguido de la miocardiopatía isquémica. En la miocarditis el RT afecta preferencialmente el epicardio y el miocardio medio con respeto del endocardio. En la miocardiopatía isquémica, el RT refleja la distribución del infarto de miocardio que típicamente afecta el endocardio con extensión variable al miocardio medio y al epicardio.
El RT con gadolinio ha sido descripto en algunos pacientes con miocardiopatía no isquémica donde la etiología es menos clara. Es posible que algunos pacientes con miocardiopatía no isquémica que tienen realce miocárdico en la CRM, en realidad tienen miocarditis, aunque este concepto no ha sido formalmente estudiado.
Diagnóstico.
Hay dos componentes para el diagnóstico de miocarditis: cuándo debe ser sospechado, y, cómo se confirma el diagnóstico
Cuándo sospechar miocarditis:
Las manifestaciones de miocarditis descriptas más arriba, a menudo sugieren el diagnóstico clínicamente. La miocarditis aguda debe ser sospechada siempre que un paciente, especialmente un varón joven, se presente con anormalidades cardíacas de reciente comienzo, que no tengan otra explicación, tales como insuficiencia cardíaca, infarto de miocardio, arritmias cardíacas, o alteraciones de la conducción. Un antecedente de infección reciente del tracto respiratorio superior, o enteritis puede también ser encontrado en la mayoría de los casos de miocarditis viral.
Cuando un paciente se presenta con insuficiencia cardíaca, y una miocardiopatía presuntamente debida a miocarditis, deben excluirse primero enfermedades cardíacas congénitas, valvulares, isquémicas, y cardiopulmonares. El paso siguiente del clínico es considerar enfermedades del músculo cardíaco de naturaleza no inflamatoria, tales como las asociadas a enfermedades autoinmunes, o toxinas tales como etanol o cocaína.
Hay otros contextos en los que el diagnóstico de miocarditis debe ser considerado:
• Cuando manifestaciones sistémicas de infecciones virales, bacterianas, rickettsiales, fúngicas, o parasitarias, se asocien a alteraciones nuevas de la función cardíaca. Dado que muchos virus cardiotrópicos, incluyendo coxsackie A son también miotropos, la presencia de dolores musculares y, particularmente hipersensibilidad a la palpación muscular, debe siempre hacer pensar de que puede haber un compromiso miocárdico simultáneo.
• Cuando una infección viral, especialmente enfermedades exantemáticas de la niñez debidas a parvovirus B19, se acompañan de taquicardia fuera de proporción a la fiebre.
• Cuando una enfermedad infecciosa se presente con evidencias de pericarditis.
• Cuando un paciente, particularmente un joven, se presente con signos y síntomas clínicos de infarto agudo de miocardio, sobre todo si la coronariografía es normal.
• Cuando un paciente desarrolle síntomas de fallo cardíaco asociado con rash y eosinofilia siguiendo a la administración de una droga nueva o una vacuna.
Un diagnóstico presuntivo de miocarditis debe ser realizado en base a la presentación clínica y de laboratorio delineadas antes. En un escenario clínico de reciente enfermedad gripal, vacunación, u otra injuria miocárdica sospechada, todo paciente con aumento por otra parte inexplicado en la troponina, cambios electrocardiográficos sugestivos de injuria miocárdica, o anormalidades de la función cardíaca en el ecocardiograma o en la CRM pueden ser considerados como “posible miocarditis subclínica” si no tienen síntomas cardiovasculares. Si los pacientes reúnen los criterios de posible miocarditis subclínica, pero también tienen un síndrome clínico compatible con miocarditis, entonces deben ser categorizados como “miocarditis posible”. Si las anormalidades en las imágenes del ecocardiograma o de la CRM son de reciente aparición, entonces el nivel de certeza diagnóstica se eleva y se requiere el término de “miocarditis probable”.
Biopsia endomiocárdica.
Cuándo debe ser llevada a cabo una biopsia endomiocárdica (BEM)? El rol de la biopsia endomiocárdica en la evaluación de la enfermedad cardiovascular fue tratada en 2007 en una reunión científica de la AHA/ACCF/ESC.
La BEM debe ser llevada a cabo en escenarios clínicos de miocarditis fulminante o donde se sospeche miocarditis de células gigantes. La BEM debe también ser considerada en otros escenarios clínicos donde el diagnóstico de miocarditis puede modificar el tratamiento o el pronóstico. Si se determina que un paciente debe ser sometido a BEM, este debe ser derivado a un centro de experiencia.
Histología.
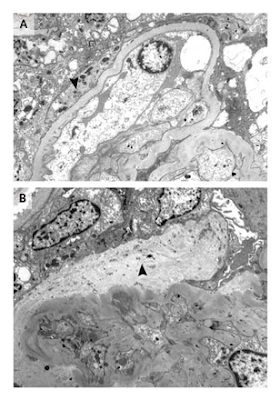
El examen histológico revela infiltrados celulares, que son usualmente histiocitarios y mononucleares, con o sin daño miocítico asociado. Las formas histológicas específicas de miocarditis incluyen la miocarditis eosinofílica, granulomatosa, y la miocarditis de células gigantes. Los infiltrados son de severidad variable y están a menudo asociados a necrosis del miocito y desorganización del citoesqueleto miocárdico (Figura 3 A- y 3B)

Figura 3 A. Miocarditis por viruela.
Autopsia de un paciente con miocarditis aguda asociada a viruela, mostrando necrosis de miofibrillas y prominentes infiltrados mononucleares.
 Figura 3 B. Miocarditis difusa aguda.
Figura 3 B. Miocarditis difusa aguda.
Biopsia endomiocárdica de ventrículo derecho mostrando miocarditis difusa aguda. Hay prominente necrosis de miofibrillas asociada a infiltrado mononuclear de alto grado.
Con las miocarditis subagudas y crónicas, la fibrosis intersticial puede reemplazar los miocitos, y puede ser vista la hipertrofia miofibrilar (Figura 4).
 Figura 4. Fibrosis cicatrizal posterior a miocarditis aguda
Figura 4. Fibrosis cicatrizal posterior a miocarditis aguda
La biopsia endomiocárdica obtenida un año después de una miocarditis aguda probada por biopsia. Hay ahora considerable fibrosis con disrupción de la arquitectura miocárdica normal.
Los criterios para el diagnóstico histológico incluyen los “criterios de Dallas” que se basan en criterios de tinción histológica y el uso de criterios inmunohistológicos.
Criterios de Dallas.
La variablididad en la interpretación de la BEM condujo a un panel de expertos patólogos cardíacos a desarrollar estos criterios, que son ahora usados por la mayoría de los investigadores para definir la enfermedad:
• Miocarditis activa: es definida como “un infiltrado inflamatorio del miocardio con necrosis y/o degeneración de los miocitos adyacentes, no típicos de daño isquémico asociado a enfermedad coronaria” Los infiltrados son usualmente mononucleares pero pueden ser neutrofílicos, u ocasionalmente eosinofílicos.
• Miocarditis borderline: es un término usado cuando los infiltrados inflamatorios son demasiado ralos, o no se puede demostrar injuria del miocito.
Hay sin embargo, una creciente preocupación por la precisión de los criterios de Dallas para el diagnóstico de miocarditis. En un reporte que comparó con datos de autopsia, la sensibilidad y la especificidad fueron de aproximadamente 60% y 80% respectivamente.
La baja sensibilidad de la BEM es en parte debida a la naturaleza focal y transitoria de los infiltrados. Las siguientes observaciones ilustran la importancia de la toma de muestras:
• En un estudio con autopsias en 38 pacientes, la biopsia de VD fue positiva en 63% de los pacientes pero solo en el 17% de las muestras, o sea que hay que tomar muchas muestras; valores similares fueron vistos en biopsias de VI. Cuando diez muestras son tomadas por ventrículo, la tasa de falsos negativos fue de 37% y 45% para el VD y el VI respectivamente.
• En un reporte de CRM con confirmación histológica, el sitio más común de compromiso focal fue la superficie epicárdica de la pared libre del VI, mientras que la mayoría de las biopsias endocárdicas se obtienen del lado ventricular derecho del septum interventricular. Entre los 21 pacientes en quienes se tomaron biopsias endomiocárdicas dirigidas por CRM y obtenidas de áreas de realce de contraste, la evaluación histológica mostró miocarditis activa en 19. Mientras que entre los 11 pacientes que fueron biopsiados en una región no afectada por CRM, se vio miocarditis histológica solo en 1. Aunque esos resultados son importantes, su aplicabilidad clínica es incierta ya que existe preocupación acerca del riesgo de biopsiar la pared libre de VI que es la zona más frecuentemente afectada en CRM.
Otro problema con el diagnóstico histológico es que aún en manos de expertos patólogos, a menudo hay desacuerdo en la interpretación del material de biopsia miocárdica. Por ejemplo en el Myocarditis Treatment Trial (MTT) la interpretación de expertos fue confirmada solo en 67% de los casos.
Un tercer problema es que puede haber genoma viral en el miocardio sin suficientes cambios histológicos para reunir los criterios de Dallas. En un estudio de 34 niños con presentación clínica compatible con miocarditis, 13 de las 26 muestras fueron positivas para virus patógenos sin evidencias de miocarditis en la microscopía de luz.
Los patógenos virales, incluyendo HHV6 y parvovirus B19, que son ahora comúnmente identificados en el miocardio de pacientes con miocardiopatía, usualmente no desencadenan una respuesta inmune celular.
El rol de la BEM en la detección de miocarditis en pacientes con miocardiopatía dilatada (MCD) crónica ha ido evolucionando. En una revisión, la miocarditis estuvo presente solo en 9% de los pacientes con MCD. Se espera el resultado de estudios de gran volumen acerca de la confirmación de resultados observados en estudios menores en paciente con MCD crónicas estables en quienes se comparó el uso de inmunosupresión contra placebo, observándose una mejoría significativa en la fracción de eyección en el grupo tratado. Estos pacientes no tenían genoma viral por PCR en la BEM.
PCR e Inmunohistoquímica.
La detección del genoma viral por PCR (polymerase chain reaction) puede ser usado para identificar patógenos virales específicos, aunque el valor clínico de la detección del genoma viral permanece incierto, especialmente en ausencia de criterios histológicos de miocarditis.
Una serie de casos en 1990 sugirió que genomas enterovirales en el miocardio de pacientes con fallo cardíaco, era un biomarcador de peor pronóstico.
Un estudio no randomizado evaluó 41 pacientes con fallo cardíaco progresivo por 6 meses, que no respondieron a la terapia standard y en quienes se encontró miocarditis activa linfocitaria en la biopsia. Los 41 pacientes fueron tratados con prednisona azatioprina por 6 meses, y 21 tuvieron mejoría de la fracción de eyección al final del tratamiento. De los 20 pacientes que no respondieron a la terapia inmunosupresora, 17 tenían genomas virales detectados por PCR. De los 21 pacientes que respondieron al tratamiento, solo 3 tenían PCR positivos.
Esos hallazgos son consistentes con otro estudio en los que la persistencia del genoma viral por PCR, estuvo asociado a disfunción de VI progresiva, mientras que el clearence del genoma viral, se asoció a mejoramiento de la función ventricular.
Una reciente serie de casos de gran tamaño en la que se demostró que parvovirus B19 se detectó muy frecuentemente, sugirió también que el genoma viral no era predictivo de muerte o de transplante cardíaco a menos que estuviera presente además la miocarditis. Una interpretación de estos datos es que los enterovirus son usualmente patogénicos en la miocardiopatía dilatada aguda y crónica, pero que parvovirus B19 puede a veces no estar relacionado con la patogénesis de la miocardiopatía.
Otros tests. Existen una serie de tests que han sido usados en casos seleccionados pero su utilidad es limitada:
• Scan con galio: Puede ser de valor en algunos casos, mostrando evidencias de infiltración celular miocárdica severa. Ha sido reemplazado por la CRM.
• Scan antimiosina: Que puede ser positivo revelando necrosis. No está comercialmente disponible desde 1997.
• Angiografía coronaria: No da información específica pero es de valor para descartar otras enfermedades cardíacas tales como congénitas, reumáticas, o isquémicas. A veces en las miocarditis puede verse espasmo coronario severo que causa angina.
Determinación de etiologías específicas.
La titulación de anticuerpos en etapa aguda como en fase de convalescencia han sido utilizados para determinar la etiología específica en una MCD. Esos tests parecen ser de poca utilidad, dado que no hay diferencias entre los pacientes y los controles en la comunidad que comparte los mismos contactos. De forma similar, los cultivos virales de las muestras para virus son raramente exitosos.
Por otro lado, un diagnóstico histopatológico de causa específica de miocarditis es ocasionalmente posible en pacientes con toxoplasmosis, enfermedad de Chagas, enfermedad de Lyme, y triquinelosis. El examen en microscopía electrónica es ocasionalmente útil para excluir toxicidad cardíaca por drogas. Los característicos cuerpos de inclusión intranucleares pueden ser vistos en la carditis por citomegalovirus.
Un antecedente de vacunación antivariólica en los últimos 30 días debe alertar ante la posibilidad de miocarditis por hipersensibilidad o miopericarditis. Dado que la viremia es rara después de la vacunación y que los anticuerpos aumentan después de una vacunación exitosa, esas investigaciones no sirven para confirmar el diagnóstico, el cual se basa principalmente en la relación temporal entre ambos eventos.
Recomendaciones finales:
En pacientes que se presentan con insuficiencia cardíaca, o evidencias de miocarditis, es fundamental realizar una minuciosa historia clínica haciendo énfasis en las causas posibles de miocarditis/miocardiopatía. El diagnóstico de MCD es establecido adicionalmente con un detallado examen físico y evaluación de laboratorio que incluya ECG, Rx de tórax, y ecocardiograma.
Una vez que se ha descartado la posibilidad de enfermedad cardíaca isquémica, lesiones valvulares críticas, y miocardiopatías restrictivas o hipertróficas, la necesidad de BEM dependerá del curso y la severidad de la presentación. Información adicional se obtiene por tests de laboratorio, incluyendo tests apropiados para descartar enfermedades autoinmunes, aspirados grasos para amiloidosis, y niveles de ferritina para hemocromatosis también pueden guiar la necesidad de BEM en casos seleccionados.
La mayoría de los pacientes que se presentan con insuficiencia cardíaca subaguda a crónica en quienes se hace diagnóstico de MCD deben ser manejados inicialmente con terapia de insuficiencia cardíaca, con lo cual la mayoría responderá y no requerirán BEM.
En aquellos con rápido deterioro a pesar del manejo terapéutico óptimo, una BEM puede brindar información diagnóstica y afectar las elecciones terapéuticas. Los pacientes con presentaciones crónicas pero que son refractarios al tratamiento médico deben ser también considerados para la BEM, si es que hay fuertes sospechas de procesos potencialmente reversibles como hemocromatosis, amiloidosis, y en quienes los tests no invasivos no son concluyentes.
Historia Natural y Terapia de las Miocarditis en Adultos.
El tratamiento de las miocarditis consiste tanto en la terapia específica de la causa de la miocarditis, como la terapia inespecífica de las manifestaciones clínicas tales como insuficiencia cardíaca y arritmias. Antes de ser tratados ambos tópicos, revisaremos la historia natural de este trastorno.
Una minoría significativa de pacientes con pericarditis, también tienen miocarditis, un trastorno llamado miopericarditis.
Historia Natural.
La historia natural de la miocarditis basada en poblaciones no se conoce con precisión dado que no existen tests diagnósticos no invasivos que confirmen el diagnóstico. Sin embargo, los estudios seroepidemiológicos sugieren que la mayoría de los casos de infección por virus Coxsackie B son subclínicos y tienen un curso benigno.
En poblaciones de hospitales o clínicas, la historia natural de las miocarditis varía con la causa de base y los síntomas de presentación. En la mayoría de los pacientes que desarrollan inflamación, como evidencian los cambios ECG, esta es aparentemente autolimitada sin secuelas. Los cambios ECG más severos tales como bloqueo de rama derecha, alto grado de bloqueo, y onda Q, se asocian con peor pronóstico a largo plazo. Una minoría de los pacientes inicialmente asintomáticos, sin embargo, desarrollan insuficiencia cardíaca, arritmias severas, trastornos de conducción, o aún, colapso circulatorio. Raramente, las miocarditis postvirales pueden ser fatales debido a fallo miocárdico o muerte súbita inesperada.
En contraste, la mayoría de los pacientes con miocarditis linfocitaria postviral sintomáticos se presentan con insuficiencia cardíaca (IC) o MCD. Sin embargo, signos y síntomas sutiles de compromiso cardíaco pueden ser pasados por alto por las manifestaciones sistémicas de la infección viral.
Los pacientes con miocarditis que se presentaron con MCD en el Myocarditis Treatment Trial (MTT) tuvieron remodelado temprano del VI con dilatación de la cámara y desarrollo de una cavidad más esférica. Más del 50% de esos pacientes, demostraron reversibilidad del proceso de remodelado con una reducción del volumen del VI y restauración de la cámara con una forma más elíptica, que estuvo asociada a mejoramiento de la fracción de eyección de VI.
En una minoría de pacientes con miocarditis aguda, la disminución de la reserva cardíaca, arritmias, o disturbios de la conducción pueden persistir por años; esto puede ser debido a tejido cicatrizal residual, miocarditis activa persistente, u, ocasionalmente la persistencia de infección viral. En una revisión de 1230 pacientes con MCD, 9% tuvieron miocarditis.
Rol de los anticuerpos.
Hay evidencia sugestiva de que algunos casos de miocarditis conducen a MCD debido a una reacción autoinmune activa contra proteínas miocárdicas. Como ejemplo, la presencia de autoanticuerpos anti-alfa miosina puede estar asociado a peor pronóstico en miocardiopatías crónicas, como es manifestado por una menor probabilidad de mejoramiento en la función sistólica y diastólica del VI comparado con los pacientes sin esos anticuerpos. Los pacientes con anticuerpos, no tuvieron mejoramiento en la fracción de eyección a los 6 meses, comparados con un 9% de aumento de la misma, en pacientes sin anticuerpos. De manera similar, la presencia de anticuerpos anti-corazón en familiares del paciente con MCD idiopática predice futura dilatación de VI.
En contraste, en pacientes con miocardiopatía aguda, mayores títulos de IgG anti-corazón, se asociaron a mejor función de VI en el MTT. Esta observación sugiere que la respuesta inmune aguda a la infección viral, usualmente sirve para eliminar el patógeno y mejorar la función cardíaca.
PRONÓSTICO.
El pronóstico a largo plazo de la mayoría de los casos de miocarditis leves no son conocidos, ya que la herramienta diagnóstica primaria, la BEM, tiende a ser aplicada solo a pacientes con manifestaciones clínicas mayores tales como insuficiencia cardíaca refractaria, o arritmias que ponen en peligro la vida.
Miocarditis linfocitaria, presumiblemente viral: El pronóstico de las miocarditis depende de la causa y severidad de la enfermedad. La miocarditis linfocitaria por ejemplo, tiene un curso variable:
• Algunos pacientes tienen enfermedad subclínica.
• Algunos tienen enfermedad indolente que progresa a MCD.
• Otros se presentan con enfermedad fulminante, que puede ser fatal, o puede resolverse completamente después del soporte hemodinámico exitoso en esta etapa aguda.
En un reporte de 27 pacientes (promedio de edad 47 años) con biopsia de miocardio que mostraba miocarditis definida o borderline, la sobrevida a los 5 años fue de 56%, similar a una cohorte de pacientes con MCD sin miocarditis aguda.
No se sabe que datos en la presentación pueden predecir el resultado en la miocarditis viral aguda. En una serie de 109 casos con criterios de Dallas positivos ( miocarditis activa o borderline), los hallazgos en la presentación que fueron predictivos de muerte posterior o de transplante fueron: síncope (riesgo relativo 8,5), bloqueo de rama (riesgo relativo 2,9), y fracción de eyección de VI de menos de 40% (riesgo relativo 2,9). Aunque la histología borderline fue protectora, este hallazgo no fue visto en otras series.
Otro factor pronóstico adverso es el desarrollo de hipertensión pulmonar.
Miocarditis fulminante:
Los pacientes que se presentan con miocarditis fulminante, aunque más severamente enfermos, más probablemente, pueden recuperarse completamente en forma más probable que aquellos con miocarditis aguda si sobreviven la fase aguda de la enfermedad.
Persistencia del genoma viral:
Un importante predictor de la evolución en pacientes con miocarditis viral puede ser la presencia o ausencia de la persistencia del genoma viral en el miocardio. En estudios de pacientes con BEM, los pacientes con adecuado clearence del genoma viral tuvieron un aumento en la fracción de eyección de VI de 50 a 58%, mientras que aquellos con persistencia del genoma viral tuvieron una reducción significativa de la misma de 54 a 51%.
Sin embargo, otra serie de casos en la que parvovirus B 19 fue el patógeno más frecuente, no se demostró un efecto del genoma viral en el riesgo de muerte o transplante cardíaco, aumentando la sospecha de que el genoma viral puede a veces reflejar una infección latente y no una infección viral activa.
La persistencia del genoma viral también identifica a los pacientes que improbablemente respondan a la terapia inmunosupresora.
Aunque los datos sugieren que la persistencia del genoma viral puede predecir un deterioro gradual de la función ventricular izquierda en miocardiopatía dilatada crónica, la realización de una BEM en estos pacientes dependerá de mayores evidencias de algún tratamiento efectivo de la miocardiopatía viral.
Rol de los marcadores serológicos:
Aunque los parámetros clínicos son solo parcialmente predictivos de la evolución, los parámetros serológicos, particularmente el Fas ligando soluble (FasL) e interleukina (IL)-10 pueden ser útiles en las miocarditis agudas severas. Fas (CD95), un miembro de la familia de receptores del factor de necrosis tumoral (TNF), es expresado siguiendo a la activación de células-B. La unión de Fas con su ligando natural (FasL, que es expresado en las células T activadas) disparando la muerte celular apoptótica. Como resultado, Fas regula la expansión clonal de las células B autoreactivas.
En una serie, la concentración sérica de Fas soluble y FasL fueron significativamente mayores en pacientes con miocarditis aguda comparada con pacientes normales o pacientes con infartos antiguos. Entre los pacientes con miocarditis, las concentraciones de Fas y FasL estuvieron significativamente más alta en aquellos que murieron durante la hospitalización comparados con los que se dieron de alta después de la recuparación.
Una mayor concentración de IL-10 en la admisión puede ser predictiva de shock cardiogénico y muerte en pacientes con miocarditis fulminante.
Miocarditis de células gigantes:
La miocarditis idiopática de células gigantes (MCG) es rara y frecuentemente fatal tipo de miocarditis. La patogénesis de este trastorno no es conocido. En un modelo animal, un trastorno similar a la MCG fue inducido por inmunización con miosina cardíaca. Sin embargo, los anticuerpos antimiosina son frecuentemente encontrados en pacientes con miocarditis y no están limitados a las MCG.
En una serie de 63 pacientes con MCG, los síntomas de presentación fueron: insuficiencia cardíaca (75%), arritmias ventriculares (14%), y bloqueo cardíaco (5%) Los síntomas iniciales similares al infarto agudo de miocardio se ven en 6%. La tasa de muerte o transplante cardíaco fue de 89% y la sobrevida media desde el inicio de los síntomas fue de 5,5 meses. Esto representa un peor pronóstico comparado con la miocarditis linfocitaria o viral, los cuales 50% de tales pacientes están vivos sin transplante a los 5 años.
Miocardiopatía dilatada de reciente comienzo:
El pronóstico puede ser relativamente bueno en pacientes con reciente inicio de MCD (menos de 6 meses). En un ensayo randomizado de 62 de tales pacientes, algunos de los cuales se probó que tenían miocarditis, la fracción de eyección de VI aumentó de 25% basal hasta 42% en un año, 36% tuvieron una fracción de eyección de VI normal, y la sobrevida libre de transplante al año y a los dos años fue de 92 y 88% respectivamente.
TERAPIA ESPECÍFICA.
Hay un número de causas (primariamente infecciosas) de miocarditis para las que hay terapia específica, tales como Mycoplasma, enfermedad de Lyme (Borrelia burgdorferi) enfermedad de Chagas. Debe tenerse en cuenta sin embargo, que no siempre el tratamiento específico afecta la miocarditis en si misma. Consideraciones similares se aplican a trastornos autinmunes como la miocarditis por lupus.
Miocarditis linfocitaria: La infección viral es la causa más comúnmente identificada de miocarditis linfocitaria. Desde 1950 hasta 1980 los estudios experimentales y seroepidemiológicos asociaban a los enterovirus, particularmente especies de Coxsackie B, con miocarditis. Al final de la década de 1980, las técnicas moleculares tales como la PCR, identificaron genomas virales en el tejido cardíaco de pacientes con miocarditis aguda y MCD. El espectro de los virus asociados a miocarditis se amplió en la medida que se usaron técnicas de PCR para identificar genomas virales en muestras de tejido cardíaco. Actualmente los genomas más comúnmente identificados son parvovirus B19 y herpes virus humano tipo 6 (HHV6). Los enterovirus todavía son causa de miocarditis sobre todo en pequeños brotes regionales.
Terapia antiviral.
La terapia antiviral con ribavirina o interferon alfa reduce la severidad de las lesiones miocárdicas y la mortalidad en miocarditis murina experimental debida a Coxsackie B3. Sin embargo, este efecto beneficioso se observa solo si la terapia es comenzada antes de la inoculación, o rápidamente después. Por lo tanto la aplicabilidad en humanos de estos hallazgos es incierta, ya que los pacientes con miocarditis viral no son vistos en estadios tan tempranos. Sin embargo, la terapia antiviral puede ser considerada en miocarditis fulminantes, en brotes institucionales y en casos adquiridos en laboratorio.
La terapia antiviral con interferon beta, también puede ser beneficiosa para pacientes con MCD crónica y evidencias de genoma viral en la BEM por PCR. En una serie de 22 pacientes con disfunción persistente de VI, insuficiencia cardíaca sintomática, y persistencia enteroviral o adenoviral en el miocardio por PCR, interferon beta dado en forma subcutánea 18.000.000 de UI por semana por 24 semanas, erradicó el genoma viral por PCR en todos los pacientes, y se produjo una significativa disminución de tamaño del VI asociado a un significativo aumento de la función.
Terapia inmunosupresora.
Dado que la inflamación puede persistir en el miocardio después del clearence del patógeno inicial disparado por autoantígenos endógenos, se ha postulado que la terapia inmunosupresora puede ser efectiva en casos seleccionados de miocarditis. Sin embargo, tanto los corticosteroides como la ciclosporina exacerban la miocarditis viral murina. El efecto de la inmunosupresión varía con la variedad de ratones utilizados, los virus y el tiempo de tratamiento. En un estudio, micofenolato mofetil inhibió el desarrollo de miocarditis por virus Coxsackie B.
En un ensayo, 111 pacientes con diagnóstico histopatológico de miocarditis y una fracción de eyección de VI de menos de 45% fueron randomizados a recibir terapia convencional sola o inmunosupresión, con ciclosporina o azatioprina por 28 semanas. En todos los pacientes la fracción de eyección aumentó de 25 a 34% y la mortalidad fue de 20% al año y 56% a los 4,3 años. No hubo diferencias entre ambos grupos.
En contraste con los pacientes con miocarditis aguda, los pacientes con evidencias de inflamación crónica, responden a la terapia inmunomodulatoria.
Hay varias posibles explicaciones para la carencia de efectos en miocardiopatía aguda:
• La mayoría de los pacientes con miocardiopatía aguda mejoran con el tratamiento standard del fallo cardíaco, y como resultado de ello, un efecto aditivo de el tratamiento inmunosupresor no es fácil de detectar, debido a este mejoramiento en el brazo control.
• El uso de los criterios de Dallas para el diagnóstico de miocarditis puede no haber identificado aquellos pacientes que s ebeneficiarían de la inmunosupresión. Los marcadores de activación inmune, más que los infiltrados celulares (criterios de Dallas) parecen identificar a la población de pacientes que pueden beneficiarse de la inmunosupresión.
• Los hallazgos no se aplican a todos los pacientes con miocarditis tales como niños, aquellos con shock cardiogénico, o aquellos que se prsentan con arritmias.
Inmunoglobulina intravenosa.
La inmunoglobulina intravenosa tiene un efecto antiviral e inmunomodulador, sugestivo de que puede jugar un rol en el tratamiento de la miocarditis viral. Sin embargo, estudios en pacientes con miocarditis viral probada no mostraron mejoría en forma significativa que ameriten recomendar de rutina esta terapia en miocarditis aguda. Ha tenido algún efecto la inmunoglobulina en pacientes con miocardiopatía dilatada crónica, no así en la miocardiopatía dilatada de reciente comienzo.
AINES.
Las drogas antiinflamatorias no esteroideas no son efectivas en modelos animales. Por el contrario, ellas pueden aumentar el proceso inflamatorio y aumentar la mortalidad.
MCD aguda idiopática.
Aunque la infección viral es la causa más comúnmente identificada de miocarditis que se presentan como miocardiopatía dilatada, no se puede determinar la etiología en 50% de los casos. La mayoría de esos casos probablemente resulten de infección oculta, de un proceso autoinmune, o de estadios tempranos de enfermedades miocárdicas genéticamente determinadas. El posible rol de la autoinmunidad ha conducido a la evaluación de la efectividad de la inmunoglobulina intravenosa. En estos pacientes, una dosis de 1 gr/kg de peso por día por dos días mejoraron la fracción de eyección al año.
Miocarditis de células gigantes.
En contraste al curso clínico variable de la MCD debida a miocarditis linfocitaria, el curso clínico de la miocarditis de células gigantes es usualmente caracterizado por deterioro agudo y fulminante en la frección de eyección de VI, a pesar del tratamiento standard del fallo cardíaco, arritmias ventriculares frecuentes, y bloqueo cardíaco. En un estudio de 63 pacientes la tasa de muerte o transplante fu de 89%, y la sobrevida media fue de solo 5,5 meses desde el inicio de los síntomas.
La inflamación miocárdica parece mediada por células T y células gigantes, y la terapia dirigida a las células T puede por lo tanto ser beneficiosa. En un caso reportado, dos pacientes respondieron favorablemente a terapia citolítica con muromonab-CD3.
A diferencia de las MCD y de las miocarditis linfocitarias, los pacientes con miocarditis de células gigantes (MCG), tratados con ciertos regímenes inmunosupresores pueden tener un significativo aumento de la sobrevida, comparados con quienes no reciben inmunosupresores. En un ensayo, los pacientes con MCG que recibieron inmunosupresores, el promedio de sobrevida libre de transplante fue de 13 meses comparado con solo 3 meses en el grupo placebo. Los inmunosupresores usados son habitualmente ciclosporina y corticosteroides. También se ha usado el muromomab-CD3.
El transplante es una terapia efectiva para la MCG. La tasa de recurrencia histológica post transplante fue de 25% en la biopsia post transplante.
Miocarditis eosinofílica.
La miocarditis eosinofílica (ME) se caracteriza predominantemente por infiltrado eosinofílico que puede ocurrir en asociación con enfermedades malignas, infección parasitaria, miocarditis por hipersensibilidad (MHS), fibrosis endomiocárdica, y con síndrome hipereosinofílico idiopático:
• La MHS se presenta como muerte súbita o fallo cardíaco rápidamente progresivo, a veces con rash, fiebre y eosinofilia periférica. La miocarditis eosinofílica necrotizante tiene un excepcionalmente mal pronóstico, con la mayoría de los casos diagnosticados en la autopsia.
• En contraste, la miocarditis eosinofílica asociada a síndrome hipereosinofílico, típicamente evoluciona en semanas a meses. La presentación es usualmente biventricular, con fallo cardíaco, aunque las arritmias pueden llevar a la muerte súbita.
El tratamiento consiste en altas dosis de corticosteroides y la remoción de la droga causal (en el caso de la MHS) o el tratamiento del trastorno de base.
Miocarditis sarcoide.
La miocarditis sarcoide puede responder al tratamiento con corticosteroides si este se administra antes del desarrollo de fibrosis extensa del VI. Es menos claro si la terapia con esteroides previene la enfermedad de conducción o las arritmias ventriculares. Algunos recomiendan un cardiodesfibrilador implatable como terapia primaria de la taquicardia ventricular, ya que hay una alta tasa de recurrencias de taquicardia ventricular con la terapia con drogas antiarrítmicas, aún cuando estas sean guiadas con tests electrofisiológicos.
Enfermedad celíaca.
Un reporte sugiere que la enfermedad celíaca, que a menudo no es sospechada clínicamente, es la causa de tanto como el 5% de los pacientes con miocarditis autoinmune. Ese reporte refiere que muchos de esos pacientes no tenían los síntomas gastrointestinales clásicos de la enfermedad celíaca (dolor abdominal recurrente, diarrea y pérdida de peso), pero todos tenían deficiencia de hierro, y refractaria a la administración de hierro. La función cardíaca y las arritmias mejoraron siguiendo una dieta libre de gluten con o sin inmunosupresores.
RESUMEN:
Con excepción de la enfermedad debida a trastornos específicos tales como sarcoidosis y enfermedad celíaca, el tratamiento de las miocarditis sigue siendo de sostén como se describe en la siguiente sección. La terapia inmunosupresora no ha sido efectiva en forma predecible en las miocarditis agudas linfocitarias, quizás debido en parte a la relativamente alta tasa de recuperación con la terapia del fallo cardíaco, y se requieren más datos para medir el efecto de las drogas antivirales, tales como el interferón. Más datos se requieren para determinar si la ausencia de genoma viral en la biopsia endomiocárdica identifica a los pacientes que más probablemente responda a los inmunosupresores.
TERAPIA INÉSPECÍFICA.
Varias medidas inespecíficas son importantes, incluyendo el tratamiento de la insuficiencia cardíaca y las arritmias de acuerdo a las guías actuales, evitar el ejercicio, y en casos seleccionados la anticoagulación.
Tratamiento de la insuficiencia cardíaca:
La insuficiencia cardíaca (IC) debe ser tratada con dieta baja en sodio, inducción de la diuresis de acuerdo a necesidad, e inhibidores de la enzima convertidora de angiotensina (iECA). Los beta bloqueantes pueden ser también útiles. En contraste, la digoxina aumenta la mortalidad en modelos animales.
El soporte circulatorio mecánico con balón de contrapulsación intraaórtico, o asistencia con sostén mecánico de VI (“Cardiopulmonary assist device and short-term left ventricular assist devices") debe ser considerado cuando la IC es intratable o cuando el shock cardiogénico no responde a la terapia médica. Varios reportes sugieren que en algunos pacientes estas medidas pueden ser un puente hasta la recuperación espontánea en las miocarditis fulminantes.
Evitar el ejercicio.
La actividad física debe ser restringida para reducir el trabajo del corazón durante la fase aguda de miocarditis, especialmente cuando hay fiebre, infección sistémica activa o IC.
Monitoreo electrocardiográfico.
El monitoreo electrocardiográfico puede permitir la detección temprana de arritmias asintomáticas pero potencialmente fatales, y/o defectos de conducción. Por esta razón, se recomienda a los pacientes con miocarditis aguda, sobre todo inestables que sean internados.
Arritmias.
Los pacientes con miocarditis aguda pueden desarrollar tanto taqui como bradiarritmias. Dado que estas arritmias se resuelven después de la fase aguda, la terapia es solo de sostén.
En 2006 el American College of Cardiology/American Heart Association/European Society of Cardiology (ACC/AHA/ESC) establecieron guías para el manejo de las arritmias ventriculares, y la prevención de la muerte súbita en pacientes con miocarditis:
• Terapia antiarrítmica no debe ser dada a pacientes con extrasístoles asintomáticas supraventriculares o para arritmias ventriculares no sostenidas asintomáticas.
• Las taquicardias supraventriculares (TSV), pueden inducir o agravar la insuficiencia cardíaca. Para la TSV se recomienda la restauración del ritmo sinusal es recomendado como approach inicial. Para las TVS recurrentes, las opciones de controlar la frecuencia y terapia antiarrítmica.
• Arritmias ventriculares sostenidas deben ser tratadas con cardioversión urgente, y las arritmias recurrentes deben ser tratadas con drogas antiarrítmicas.
• Taquicardia ventricular no sostenida puede ser tratada con drogas antiarrítmicas.
• Cuando la terapia antiarrítmica es necesaria, las opciones incluyen amiodarona, dofetilida (con precauciones por el efecto proarrítmico), y en pacientes que no están en insuficiencia cardíaca clase funcional IV, usar betabloqueantes o bloqueantes cálcicos.
• La colocación de un cardiodesfibrilador implantable puede ser beneficioso en pacientes con arritmias que ponen en peligro la vida, que no están en fase aguda de miocarditis, quienes reciben terapia médica óptima, y que tienen una expectativa de vida razonable, y buen status funcional.
• El bloqueo cardíaco completo y/o la bradicardia sintomática son indicaciones de marcapaseo durante la fase aguda de miocarditis. Estos trastornos de conducción a menudo son transitorios, por lo tanto la primera medida es colocar un marcapaso transitorio.
• Anticoagulación. Las complicaciones tromboembólicas pueden ocurrir cuando la insuficiencia cardíaca es severa o prolongada. El ecocardiograma es especialmente útil para la detacción de trombos intracardíacos, que si están presentes son una indicación de terapia anticoagulante. La anticoagulación puede ser también aconsejable como medida preventiva en otras causas de insuficiencia cardíaca crónica.
Es recomendable la terapia con warfarina en pacientes con fibrilación auricular o con ritmo sinusal que reunen los siguientes criterios:
• Insuficiencia cardíaca sintomática con una fracción de eyección de VI menor de 20%.
• Factores de riesgo para hemorragias mínimos.
• Un perfril hemodinámico sin evidencias de disfunción de la síntesis hepática.
El grado óptimo de anticoagulación es de grado moderado con RIN entre 2.0 y 3.0.
Otras modalidades terapéuticas.
• Administración de oxígeno es aconsejable en pacientes críticamente enfermos, ya que la hipoxia agrava las miocarditis experimentales.
• Restricción del alcohol a no más de una copa por día, ya que la ingesta de alcohol puede empeorar la severidad de las miocarditis.
• Transplante cardíaco en pacientes que se presentan con miocardiopatía intratable y fallo cardíaco persistente.
SEGUIMIENTO.
Como se dijo antes, la mayoría de los pacientes con miocarditis aguda tienen recuperación parcial o completa. En algunos casos, sin embargo, el proceso puede continuar subclínicamente, y a veces evolucionar a la MCD. La probabilidad de esta complicación tardía está aumentada en pacientes que se presentan con función disminuida de VI.
De acuerdo a eso, los pacientes deben ser seguidos inicialmente a intervalos de uno a tres meses. La actividad física, especialmente deportes competitivos, deben ser permitidos solo gradualmente, y la tolerancia monitoreada. El examinador, debe estar alerta a la persistencia o recurrencia de galope por R3 y R4. El ecocardiograma o el spect con radionúclidos deben ser usados para monitorear el tamaño de las cámaras cardíacas y la frección de eyección del VI. Medir la función cardíaca al mes, a los seis meses y después anualmente o cada vez que los síntomas así lo indiquen.
MIOCARDIOPATÍA PERIPARTO.
Introducción:
La miocardiopatía periparto (MCPP), también llamada miocardiopatía asociada al embarazo, es una rara causa de insuficiencia cardíaca que afecta a las mujeres tardíamente en el embarazo o en el puerperio temprano. Aunque fue inicialmente descripta en 1849, no fue reconocida como una entidad clínica hasta 1930.
La MCPP es un trastorno de etiología desconocida que tiene consecuencias potencialmente devastadoras. El tratamiento es similar a otros tipos de insuficiencia cardíaca con disfunción sistólica de VI. Sin embargo, modificaciones a la terapia standard son necesarias a menudo para asegurar la seguridad de la madre y del feto o del lactante.
Definición:
Son necesarios 4 criterios para el diagnóstico de MCPP:
• Desarrollo de insuficiencia cardíaca en los últimos meses del embarazo o dentro de los 5 meses de posparto.
• Ausencia de una causa identificable de insuficiencia cardíaca.
• Ausencia de enfermedad cardíaca reconocible anteriores a los últimos meses de embarazo.
• Disfunción sistólica de VI (por ejemplo fracción de eyección de VI menor de 45% o fracción de acortamiento reducida).
Tiempo de inicio:
Las mujeres que desarrollan miocardiopatía temprana en el embarazo no reúnen los criterios de para la definición de MCPP basados en el primer y el tercer criterios; sin embargo, el proceso de enfermedad probablemente sea el mismo.
Epidemiología:
La incidencia reportada de MCPP varía. En EE UU 1:15000 partos, Sud-África 1:1000, Haití 1:300 y en Zaire y Nigeria 1:100.
El amplio rango de incidencias puede reflejar la sobreestimación en estudios que se basan solamente en criterios clínicos. Se ha sugerido que en algunos estados Africanos, la entidad pueda confundirse con hipertensión e hipervolemia.
Etiología.
A pesar de muchos intentos de descubrir una etiología distintiva para la MCPP, la causa permanece siendo desconocida. No se ha reconocido un estado hormonal diferente en estas pacientes con MCPP, aún aunque los estrógenos, progesterona y prolactina, tienen efectos significativos sobre el sistema cardiovascular. Un número de otros factores pueden contribuir:
Citoquinas inflamatorias.
Las citoquinas inflamatorias pueden jugar un rol en la patogénesis y progresión de la miocardiopatía y la insuficiencia cardíaca. Las citoquinas que están elevadas en la MCPP comparadas con los controles incluyen: factor de necrosis tumoral (TNF)-alfa y la interleucina -6 (IL-6). Además, Fas/Apo-1, un receptor de señal de apoptosis, y la proteína C reactiva (PCR) están asociados con enfermedad más severa.
Miocarditis.
Un número de investigadores han sugerido a la miocarditis como una causa posible de MCPP. Pacientes con MCPP han mostrado evidencias de miocarditis en la BEM, asociado a necrosis y grados variables de hipertrofia y fibrosis. Se han encontrado evidencias de genoma viral en la BEM.
Respuesta inmune anormal.
Se ha sugerido que una respuesta inmunológica materna a un antígeno fetal puede conducir a MCPP. Algunas células fetales pueden pasar a la circulación materna y permanecen sin rechazo debido a una débil inmunogenicidad de parte del haplotipo paterno en las células quiméricas. Si esas células se alojan en el tejido cardíaco, pueden disparar una respuesta inmunológica autoinmune.
Altos títulos de anticuerpos, cuando se los compara con los controles, han sido descriptos contra las proteínas cardíacas humanas (incluyendo miosina), translocador de nucleótidos de adenina, y dehidrogenasa de alfa cetoácidos de cadena ramificada. Además, las inmunoglobulinas en pacientes con MCPP pueden ser significativamente diferentes en frecuencia y reactividad a aquellas de cohortes de MCD y donantes sanos.
Enfermedad familiar.
Se ha encontrado grupos de pacientes con MCPP en las mismas familias. Este hallazgo puede ser explicado por una razón genética o por factores ambientales.
Factores hemodinámicos.
Durante el embarazo, hay un significativo aumento del volumen sanguíneo y en el gasto cardíaco, lo cual resulta en un remodelado e hipertrofia transitorias del VI. Es posible que haya una exagerada disminución en la función sistólica en mujeres que desarrollan MCPP. El stress hemodinámico de la hipertensión gestacional, que es más común en las mujeres con MCPP, puede contribuir al desarrollo de insuficiencia cardíaca.
Factores de Riesgo.
Aunque la etiología de la MCPP permanece siendo inexplicada, un número de factores han estado asociados con aumento de riesgo. Estos factores son:
• Edad mayor de 30 años.
• Multiparidad.
• Descendencia Africana.
• Embarazo con múltiples fetos.
• Un antecedente de preeclampsia, eclampsia, o hipertensión postparto.
• Abuso materno de cocaína.
• Largo tiempo de uso de terapia tocolítica con beta adrenérgicos tal como la terbutalina (más de 4 semanas).
Hay datos conflictivos acerca de si la deficiencia de selenio es o no un factor de riesgo para MCPP.
Manifestaciones Clínicas.
La MCPP es raramente observada antes de las 36 semanas de gestación, y las pacientes afectadas usualmente se presentan durante los primeros cuatro a cinco meses del postparto. Esto contrasta con la mujer embarazada con enfermedad cardíaca de base (isquémica, valvular o miopática), la que tiende a desarrollar síntomas de insuficiencia cardíaca durante el segundo trimestre de la gestación, coincidiendo con la mayor carga hemodinámica impuesta por el estado grávido.
Las pacientes se quejan principalmente de disnea; otros síntomas frecuentes incluyen tos, ortopnea, disnea paroxística nocturna, y hemoptisis. Un estado de fatiga inespecífica, malestar precordial, o dolor abdominal pueden confundir la evaluación inicial debido a la ocurrencia de estos síntomas normalmente durante el embarazo.
Las embolias sistémicas y pulmonares son más comunes en MCPP que en otros tipos de miocardiopatías, probablemente debido a que al riesgo asociado a la miocardiopatía, se agrega el estado hipercoagulable inducido por el embarazo.
Diagnóstico.
Como se dijo antes, el diagnóstico de MCPP se basa en los cuatro criterios mencionados antes:
• Desarrollo de insuficiencia cardíaca en los últimos meses del embarazo o dentro de los 5 meses de posparto.
• Ausencia de una causa identificable de insuficiencia cardíaca.
• Ausencia de enfermedad cardíaca reconocible, anteriores a los últimos meses de embarazo.
• Disfunción sistólica de VI (por ejemplo fracción de eyección de VI menor de 45% o fracción de acortamiento reducida.
El último criterio fue agregado para prevenir la inclusión de pacientes con trastornos que mimetizan la insuficiencia cardíaca. Tales trastornos incluyen: hipertensión acelerada, disfunción diastólica, infección sistémica, embolismo pulmonar, o complicaciones del embarazo en si mismo (por ejemplo preeclampsia, o embolia de líquido amniótico).
Un electrocardiograma (ECG) y un ecocardiograma deben ser llevados a cabo en pacientes sospechadas de padecer MCPP. Otros estudios tales como cateterismo cardíaco, Rx de tórax, biopsia endomiocárdica (BEM), y serologías para virus pueden ser seleccionadas en casos particulares.
Electrocardiograma.
Los hallazgos ECG incluyen: taquicardia sinusal (o raramente fibrilación auricular), anormalidades inespecíficas del ST y de la onda T, y anormalidades del voltaje (bajo voltaje o criterios de hipertrofia ventricular izquierda). Las ondas Q están ocasionalmente presentes en las derivaciones precordiales. Los intervalos PR y QRS pueden estar prolongados.
Ecocardiograma.
El ecocardiograma usualmente revela una reducción global en la contractilidad, y agrandamiento del VI sin hipertrofia (Figura 5). La aplicación de las mediciones con Doppler, hace generalmente innecesaria la cateterización cardíaca innecesaria en la mayoría de las pacientes.

Figura 5. Ecocardiograma en Miocardiopatía Periparto.
Vista de cuatro cámaras de un ecocardiograma bi-dimiensional de una paciente con disfunción ventricular izquierda persistente después del embarazo, que muestra dilatación auricular y ventricular izquierdas. Hay un trombo en el apex ventricular.
El umbral de agrandamiento del VI y la disfunción necesaria para diagnosticar MCPP no han sido definidos con precisión. La siguiente definición, está basada en un workshop de la NHLBI en 1992 para miocardiopatías dilatadas (MCD) idiopáticas, ha sido propuesto:
• Fracción de eyección de VI menor de 45% y/o fracción de acortamiento menor de 30%
MAS
• Dimensiones finales diastólicas de VI mayores de 2,7 cm/m2.
Aunque la mayoría de los cardiólogos considerarían miocardiopatía una reducción de menos de 50% de la fracción de eyección de VI, esto no reuniría los criterios estrictos para MCPP.
Otros posibles hallazgos ecocardiográficos incluyen:
• Heterogeneidades regionales de la pared engrosada en sístole.
• Agrandamiento auricular izquierdo.
• Regurgitación mitral o tricuspídea.
• Pequeño derrame pericárdico.
Radiografía de tórax
La Rx de tórax muestra típicamente agrandamiento de la silueta cardíaca con evidencias de congestión venosa pulmonar, y/o intersticial, y, en ocasiones, derrame pleural. Sin embargo, una Rx de tórax no es necesaria para el diagnóstico de MCPP, y su uso es desaconsejado si la mujer está todavía embarazada. Si a pesar del examen físico, el diagnóstico de edema de pulmón es incierto y es necesaria una Rx de tórax, hay que discutir la opción con la paciente, y en todo caso realizarla con protección del feto.
Cateterización cardíaca.
La cateterización derecha es raramente necesaria debido a que la medida de presiones cardíacas puede hacerse por ecocardiograma con Doppler. Puede ser útil en pacientes críticamente enfermas que necesitan una evaluación más completa o una evaluación constante de su estado hemodinámico.
La cateterización izquierda con angiografía coronaria es sólo necesaria en pacientes con factores de riesgo significativos para enfermedad coronaria, para descartar cardiopatía isquémica como causa de la miocardiopatía. Como con la Rx de tórax, la fluoroscopía debe ser discutida con la paciente, y de realizarla debe hacerse con protección fetal.
Biopsia endomiocárdica.
El rol de la BEM permanece no muy claro. Como se dijo antes, una proporción variable de pacientes tienen evidencias de miocarditis. Otros hallazgos histológicos en la MCPP pueden incluir hipertofia miofibrilar y/o degeneración, fibrsis, y edema intersticial.
No hay hallazgos patognomónicos en la MCPP y hay un riesgo inherente a la realización de una BEM, por lo tanto, es un elemento diagnóstico usado con indicaciones muy precisas.
Estudios virales y bacterianos.
El rol de los cultivos virales y bacterianos, así como el estudio de los títulos virales seleccionados (por ejemplo Coxsackie B) no están claros. Los resultados de esos tests son inespecíficos y tienen valor pronóstico limitado en pacientes con miocarditis.
Tratamiento.
El tratamiento de la MCPP es similar al de otras causas de insuficiencia cardíaca. Elementos terapéuticos adicionales incluyen la anticoagulación y el manejo de las arritmias. La inmunosupresión, y la terapia con inmunoglobulinas han sido evaluados, aunque el rol de esos tratamientos en la MCPP no ha sido establecido.
Las medidas terapéuticas incluyen:
• Optimización hemodinámica.
• Alivio de los síntomas.
• Cuando sea posible, las terapias crónicas que mejoran el resultado a largo plazo.
Las consideraciones terapéuticas que hay que realizar en pacientes con MCPP son:
• Evitar los IECA.
Los inhibidores de la enzima convertidora están contraindicados en cualquier momento del embarazo debido al riesgo de efectos adversos fetales.
• Diuréticos.
Los diuréticos se administran para aliviar la congestión pulmonar y el marcado edema periférico del embarazo Se ha reportado una diátesis hemorrágica e hiponatremia en neonatos de mujeres que tomaban diuréticos tiazídicos durante el embarazo.
• Digoxina.
Aunque no es una terapia de primera línea en la mayoría de los casos, la digoxina es apropiada para casos seleccionados de insuficiencia cardíaca, y puede ser particularmente útil en pacientes con MCPP por dos razones:
1) el uso imposible de terapias convencionales para la insuficiencia cardíaca como IECA, inhibidores del receptor de angiotensina, o beta bloqueantes en el embarazo, y
2) las demandas fisiológicas aumentadas durante el embarazo puede exacerbar los síntomas de insuficiencia cardíaca. La digoxina es segura en el embarazo. Pequeñas cantidades de digoxina se excretan por la leche materna, aunque no han sido reportados efectos adversos.
• Vasodilatadores.
Dado que los IECA y los inhibidores del receptor de angiotensina están contraindicados en el embarazo, la hidralazina es la droga de elección cuando se requiere terapia vasodilatadora oral antes del parto. Se ha usado muchos años en la hipertensión del embarazo y parece ser segura tanto para la madre como para el feto. Cuando se requiere terapia vasodilatadora intravenosa en pacientes con severa insuficiencia cardíaca descompensada, se aconseja el uso de nitroglicerina. También pueden usarse nitroprusiato y nesiritide, aunque debido a sus potenciales efectos tóxicos sólo deben ser usados cuando han fracasado las otras opciones.
• Beta-bloqueantes.
Los beta-bloqueantes son generalmente seguros durante el embarazo, aunque efectos adversos han sido reportados. En general se prefiere los beta 1 selectivos ya que estos agentes menos probablemente interferirán con la relajación uterina mediada por beta 2, y la vasodilatación periférica. Los infantes nacidos de madres tratadas con esas medicaciones deben ser observados por 72 a 96 horas después del parto. Los beta bloqueantes no deben comenzar a administrarse en la fase de insuficiencia cardíaca descompensada, pero son un importante componente en el régimen terapéutico crónico de pacientes con insuficiencia cardíaca debidas a disfunción sistólica.
• Antagonistas de la aldosterona.
Los antagonistas de la aldosterona aldosterona y eplerenona, en la terapia crónica, prolongan la sobrevida en pacientes seleccionados con insuficiencia cardíaca. Sin embargo, no hay datos ni experiencia clínica que apoyen la seguridad de estos agentes durante el embarazo. Por lo tanto no deben ser usados por ahora durante esta etapa.
• Inotrópicos.
Algunas pacientes con insuficiencia cardíaca descompensada e hipotensión se benefician del soporte inotrópico intravenoso. Cada una de las drogas inotrópicas (dobutamina, dopamina, milrinona) tienen propiedades levemente diferentes así como diferentes riesgos relacionados con el embarazo. Se utilizan en insuficiencia cardíaca que no responde a la terapéutica.
• Vasopresores.
Los vasopresores (norepinefrina, fenilefrina), normalmente son evitados en pacientes con insuficiencia cardíaca, dado que estos pacientes, usualmente tienen alta resistencia vascular sistémica, y un mayor aumento de la misma puede deteriorar el gasto cardíaco. En las mujeres embarazadas, los vasopresores conllevan el riesgo adicional de disminuir el flujo sanguíneo uterino. En pacientes críticamente enfermas, hipotensas, sin embargo, la presión sanguínea necesita ser sostenida, y en esas situaciones tendrían indicación estos agentes.
Arritmias ventriculares.
Las arritmias ventriculares deben ser tratadas agresivamente con terapias farmacológicas y no farmacológicas. Este artículo no desarrollará el tipo de drogas usadas en el embarazo, pero digamos que las más utilizadas son la adenosina, beta bloqueantes, digital, bloqueantes cálcicos, quinidina disopiramida, procainamida, lidocaína, mexiletina, flecainida, propafenona, ibutilida, sotalol y amiodarona, esta última con precaución, ya que puede producir hipotiroidismo neonatal. De las terapias no farmacológicas, según estén indicadas, se usan la ablación por radiofrecuencia, la cardioversión eléctrica, y en algunos casos puede estar indicada la colocación de un cardiodesfibrilador implantable.
Anticoagulación.
Las pacientes con MCPP están en alto riesgo de formación de trombos y tromboembolismo debido al estado hipercoagulable del embarazo, asociado a la estasis de la sangre debida a disfunción severa del VI. Así, los clínicos deben considerar el uso de la anticoagulación en esas pacientes, particularmente cuando la disfunción de VI sea severa (por ejemplo fracción de eyección de VI menor a 30%).
La elección de un régimen de anticoagulación en una mujer embarazada es un desafío debido a los potenciales efectos teratogénicos y a la complejidad del uso de los diferentes agentes que no serán tratados aquí.
Agentes inmunosupresores.
Ocasionalmente se han usado en pacientes con MCPP y miocarditis probada por biopsia, pero su eficacia no es clara. La inmunosupresión empírica, en ausencia de evidencias, no es recomendada, ya que la mayoría de los casos reportados tienen hallazgos inespecíficos en la biopsia. Esas drogas, a menudo tienen efectos colaterales significativos, y los estudios en otras formas de miocarditis no han mostrado beneficios claros de la terapia inmunosupresora.
Inmunoglobulina intravenosa.
La inmunoglobulina intravenosa se ha usado en pacientes con miocarditis o miocardiopatía recientemente dilatada y no ha mostrado beneficios claros. En MCPP mostró leve beneficio, aunque no significativo debido al tamaño de las muestras.
Bromocriptina.
Hay reportes de casos que han sugerido posibles beneficios a la terapia con bromocriptina en pacientes con MCPP. Esta estrategia de tratamiento está basada en observaciones experimentales de prevención de MCPP en ratones, vía bloqueo de la prolactina con bromocriptina. Sin embargo, hay datos insuficientes para establecer la seguridad o eficacia de la bromocriptina en MCPP.
Transplante cardíaco.
El transplante cardíaco es a menudo el único tratamiento aceptable para una mujer en quien la terapia convencional no es exitosa. Estudios antiguos encontraron que el transplante fue llevado a cabo en hasta un tercio de las mujeres con MCPP. Sin embargo, en reportes más contemporáneos, el transplante fue requerido en sólo 4 a 7% de las pacientes. La asistencia con dispositivos mecánicos como un puente hasta el transplante ya fue tratado antes.
Pronóstico.
El pronóstico de la MCPP debe tener en cuenta la evolución materna, y las consecuencias obstétricas y neonatales, así como los efectos en embarazos subsecuentes.
Resultados maternos. La serie más grande que evaluó este aspecto es de 123 casos de MCPP, mostró 4% de necesidad de transplante y una tasa de mortalidad de 10% en el seguimiento a 2 años. Resultados similares mostraron las series del Johns Hopkins, con 6% de mortalidad a los 5 años y necesidad de transplante de 7% a 8,6 años.
La muerte por MCPP es usualmente causada por fallo de bomba progresivo, muerte súbita, o eventos tromboembólicos.
Los siguientes factores de pronóstico adverso han sido identificados en diferentes estudios:
• Peor clase funcional de la New York Heart Association.
• Mujeres negras.
• Multiparidad.
Entre las mujeres que no murieron ni requirieron transplante en el estudio de 123 pacientes, el promedio de la fracción de eyección de VI, aumentó de 28% al diagnóstico a 46% en 2 años. La recuperación de la fracción de eyección de VI por encima de 50% ocurrió en 54% de los pacientes, y el grado de recuperación fue mayor en aquellas con una fracción de eyección de VI basal de más de 30%. Un cardiodesfibrilador implantable o un marcapaso permanente fueron requeridos en 3 y 2% de las pacientes respectivamente. En este y en otros estudios, la recuperación de la unción del VI ocurrió a los seis meses después del diagnóstico.
Los factores predictores de disfunción persistentes de de VI son los siguientes:
• Fracción de eyección de VI igual o menor de 30%.
• Acortamiento fraccional de menos de 20% y dimensiones final diastólica de VI de igual o más de 6 cm.
• Troponina T elevada.
No está claro si la mujer con MCPP tiene un pronóstico diferente a la mujer embarazada con otro tipo de miocardiopatía.
Efectos obstétrico y neonatales.
En estos puntos los datos son más limitados. En el reporte de 123 pacientes, el parto por cesárea fue llevado a cabo en 40% de las pacientes, mayormente por indicaciones obstétricas. La prematurez (menos de 37 semanas) ocurrió en 25%, el promedio de peso al nacimiento fue de 3,1 kg (rango de 1,4 a 5,0 kg), y 5,9% de los infantes eran pequeños para la edad. Hubo dos fetos muertos, una muerte neonatal, y cuatro recién nacidos con defectos congénitos.
Embarazos subsecuentes.
El riesgo asociado a embarazos subsecuentes en mujeres con historia de MCPP no está claro. Los datos disponibles de varias series de casos sugieren que el riesgo de complicaciones es alto, particularmente en aquellas mujeres que no tuvieron una recuperación completa de la función del VI.
Recuperación de la función del VI.
Entre las mujeres en quienes la función del VI volvió a lo normal, el riesgo de embarazos subsecuentes parece menor que el de aquellas con disfunción persistente de la función del VI, pero elevada respecto a la población general.
Algunas mujeres que recuperan la función de VI después de un episodio inicial de MCPP, tienen una declinación progresiva de la función del VI en embarazos subsecuentes. Esas mujeres deben ser aconsejadas acerca de los potenciales riesgos antes de embarazarse, y si se embarazan, realizar un monitoreo de los signos de disfunción VI.
Disfunción persistente de VI.
Los riesgos potenciales de embarazos subsecuentes en mujeres que tienen disfunción persistente de VI parece ser sustancial.
Así, aunque algunas mujeres puedan tolerar embarazos subsecuentes, aquellas que presentan disfunción de VI persistente deben ser aconsejadas a evitar embarazos debido al riesgo de progresión de la insuficiencia cardíaca y muerte.
Hay reportes anecdóticos de embarazos exitosos post transplante cardíaco por MCPP. Además de los problemas relacionados con el embarazo después de un transplante cardíaco por cualquier razón, las mujeres que han sido transplantadas por MCPP están en riesgo de fallo del injerto debido a recurrencia de la enfermedad, por lo que deben ser fuertemente aconsejadas a evitar futuros embarazos hasta que se reciban mayores datos.
Fuente:
UpToDate.
Emedicine.com
The New England Journal of Medicine.

Presentó la Dra. Florencia Gonzalez.
Residente de Clínica Médica.
Hospital Municipal de Azul.
Paciente joven que cursa puerperio de 7 meses, que en un contexto febril presenta un cuadro de insuficiencia cardíaca congestiva (ICC) de rápida instalación y sin antecedentes previos.
Se descartó que la causa de la ICC fuese una valvulopatía. La paciente no tiene factores de riesgo para cardiopatía isquémica, la cual por su edad fue desechada rápidamente. Tampoco existen antecedentes familiares de miocardiopatías.
La aparición 7 meses después del parto por definición excluye la miocardiopatía periparto (hasta 5 meses después del parto). Por ello se interpretó el cuadro como miocarditis aguda. Sin embargo, fue considerada también una hipótesis alternativa, que podría ser que la paciente hubiese presentado una miocardiopatía periparto, que no se expresara clínicamente en forma ostensible, dado la acotada actividad de la paciente los últimos meses, y que la fiebre (objetivada al comienzo de su sintomatología), la hipertensión arterial, y la taquiarritmia, hayan obrado como desencadenantes de la insuficiencia cardíaca, interactuando sobre una miocardiopatía puerperal hasta ese momento oligosintomática. De cualquier manera, las dos hipótesis no son excluyentes, ya que como veremos, entre las hipótesis etiopatogénicas de la miocardiopatía periparto está también la miocarditis aguda.
En cuanto a la interpretación del cuadro febril sin un foco evidente, es compatible con un cuadro viral, probable origen de la miocarditis.
La evolución de la paciente fue sorprendentemente buena en forma rápida como sucede con algunas formas de miocarditis fulminantes, para las cuales esta paciente no reúne los criterios ecocardiográficos de disfunción sistólica más severa que suele verse en dichas formas clínicas.
Al momento del alta no se habían recibido la mayoría de los estudios serológicos solicitados, tendientes a demostrar la etiología del cuadro.
Aprovecharemos el caso para actualizar el tema miocarditis y miocardiopatía periparto, sin que ello signifique que alguno de estos diagnósticos puedan establecerse con claridad en este caso.
ETIOLOGÍA Y PATOGÉNESIS DE LAS MIOCARDITIS.
La miocarditis es una enfermedad inflamatoria del músculo cardíaco. Puede ser agudo, subagudo, y crónico, y puede haber compromiso focal o difuso del miocardio. La presentación en pacientes sintomáticos es frecuentemente como insuficiencia cardíaca (IC), aunque a veces puede presentarse mimetizando un infarto agudo de miocardio o como una taquiarritmia, incluso puede ocurrir muerte súbita, o un bloqueo de alto grado. Si está comprometido el epicardio, el cuadro es el de una miopericarditis, a menudo asociado a dolor pleurítico y derrame pericárdico. La inflamación endomiocárdica aislada y la fibrosis son vistos en la cardiomiopatía de Löffler, en la endomiocarditis tropical, en el síndrome hipereosinofílico, y en algunas reacciones adversas a drogas.
ETIOLOGÍA
La miocarditis puede ser causada por una variedad de enfermedades, infecciosas y no infecciosas.
CAUSAS INFECCIOSAS
Virales:
Coxsackie B virus, echovirus, virus de Epstein-Barr (EBV), citomegalovirus (CMV), adenovirus, HIV, hepatitis B y C, rubéola, sarampión, varicela (VZV), parotiditis urleana, viruela, parvovirus, influenza A y B, herpes virus, poliomielitis, rabia, arbovirus, dengue, fiebre amarilla.
Bacterianas:
Difteria, tuberculosis, salmonella, estafilococo, gonococo, clostridios, brucelosis, psitacosis, tétanos, tularemia, estreptococo, legionella, meningococo, haemophilus, neumococo, cólera, chlamydia, mycoplasma.
Espiroquetósicas:
Sífilis, leptospirosis, fiebre recurrente, enfermedad de Lyme.
Micóticas:
Cándida, histoplasmosis, esporotricosis, coccidioidomicosis, aspergilosis, blastomicosis, criptococosis, actinomicosis, mucormicosis, nocardia, strongiloidiasis.
Rickettsias:
Tifus, fiebre Q, fiebre manchada de las montañas rocosas.
Protozoarios:
Chagas (tripanosomiasis sudamericana), enfermedad del sueño (tripanosomiasis Africana), toxoplasmosis, malaria, leishmaniasis, amebiasis.
Helmintos:
Triquinosis, equinococosis, esquistosomiasis, ascariasis, filariasis, paragonimiasis, estrongiloidiasis.
CAUSAS NO INFECCIOSAS.
Cardiotoxinas:
Catecolaminas, antraciclinas, ciclofosfamida, cocaína, metales pesados (cobre, plomo, hierro), alcohol, arsénico, monóxido de carbono, metisergida,
Cocaina. Metales pesados (cobre, plomo, hierro).
Reacciones de Hipersensibilidad:
Antibióticos (penicilinas, cefalosporinas, sulfonamidas), diuréticos (tiazidas, diuréticos de asa), dobutamina, litio, toxoide tetánico, clozapina, metildopa, picaduras de insectos (abejas, avispas, arañas, escorpiones), picaduras de víboras.
Trastornos Sistémicos:
Enfermedades colágeno-vasculares, sarcoidosis, enfermedad celíaca, enfermedad de Kawasaki, hipereosinofilia, granulomatosis de Wegener, tirotoxicosis, enfermedad inflamatoria intestinal (enfermedad de Crohn, colitis ulcerosa).
Radiación.
Entre las etiologías infecciosas, los virus son los patógenos más frecuentes, pero, las bacterias, hongos, protozoarios y helmintos también pueden producir miocarditis ocasionalmente. En países desarrollados los virus más frecuentemente identificados fueron los enterovirus (incluyendo virus coxsackies) hasta 1990. Hoy en día los virus más frecuentemente encontrados son el parvovirus B19, el Herpes Virus Humano tipo 6, el virus de la hepatitis C (HCV), y los adenovirus, en pacientes con cardiomiopatía crónica, se supone como consecuencia de miocarditis aguda previas. En países subdesarrollados, la carditis reumática, la enfermedad de Chagas y la cardiopatía relacionada a estados avanzados de infección por HIV son causas importantes.
En la búsqueda del agente causal en pacientes con miocarditis, como se verá en “diagnóstico”, se realizan estudios de cultivos de sangre, orina, materia fecal, nasofaringe y de biopsias endomiocárdicas. Estudios serológicos, y estudios de PCR de muestras obtenidas de sangre y tejidos cardíacos para la identificación de ácidos nucleicos virales. Estas metologías diagnósticas empleadas han permitido hacer algunas observaciones:
• La suma de: serología, cultivos y PCR de tejido cardíaco permitieron descubrir la etiología en aproximadamente un tercio de los pacientes con miocarditis. La PCR (en tejido cardíaco) detectó patógenos en 20% de las miocardiopatías dilatadas y solo en 1,4% de los controles. Las muestras de sangre solo fueron positivas para PCR en 1%.
• De 239 pacientes con miocarditis y PCR positiva en tejido cardíaco, 142 fueron positivas para adenovirus, 85 para enterovirus (incluyendo coxsackie), 18 para CMV, 6 para parvovirus, 5 para influenza, A, 5 para herpes simplex virus tipo 1, 3 para EBV y 1 para virus sincitial respiratorio.
Los hallazgos de PCR no deben ser interpretados como diagnóstico definitivo de la causa de la miocarditis, ya que no puede descartarse una infección viral intercurrente o previa, no relacionada con el episodio de miocarditis.
INCIDENCIA Y PREVALENCIA.
La verdadera incidencia de la miocarditis idiopática o “viral” en la población es desconocida. Estudios de hace algunos años sugirieron que el compromiso cardíaco ocurre en 3,5 a 5% de los pacientes durante un brote de infección por virus coxsackie. Sin embargo, hay una dificultad en establecer un diagnóstico de miocarditis, dado que no existe un método establecido no invasivo que sea el “gold standard” diagnóstico. Más aún, la sensibilidad de la biopsia endomiocárdica (que puede revelar un infiltrado linfocitario, a veces con evidencias de daño miocárdico), puede ser tan bajo como 35%.
RELACIÓN ENTRE MIOCARDITIS VIRAL Y MIOCARDIOPATÍA DILATADA.
El rol de la miocarditis viral en la miocardiopatía dilatada (MCD) es un tema de importancia. Hay varios mecanismos por los que una miocarditis viral puede causar MCD aguda o crónica, incluyendo daño viral directo, o como resultado de la respuesta inmune humoral o celular a la persistencia de la infección viral.
PATOGENIA.
Injuria viral directa.
Nuestros conocimientos de la patogénesis de las miocarditis virales proviene de modelos experimentales de infección aguda por virus coxsackie B. El cambio inicial es el daño al miocito en ausencia de respuesta inmune celular. La injuria al miocito puede ser mediada a través de toxicidad viral directa, lisis celular mediada por perforinas, y expresión de citoquinas.
Eventos intracelulares:
La entrada viral en el miocito es mediada por receptores en la superficie de la célula. El receptor coxsackie-adenovirus (CAR) es un receptor común para virus coxsackie B y adenovirus subgrupos A, C, D, E y F. El gen del receptor CAR está localizado en el cromosoma 21q11.2. Con raras excepciones, la expresión de CAR es requerido para la entrada a las células.
El descubrimiento del receptor CAR, eleva la posibilidad de terapia de intervención para bloquear el receptor CAR en casos severos de miocarditis por virus coxsackie B o por adenovirus. Los coreceptores, incluyendo el factor acelerador de caída (decay-accelerating factor) (DAF, CD55), para algunos coxsackie B, e integrinas, ayudan a determinar la eficiencia de la infección. La actividad de las vías de señalización en los miocitos cardíacos también determina susceptibilidad a la miocarditis por coxsackie B, vía efectos en la replicación viral.
Después de la entrada en la célula a través del receptor CAR, el genoma viral del virus coxsackie B es traducido en proteínas estructurales de la cápside y varias proteasas que clivan la poliproteína viral. La proteasa viral 2A puede también clivar ciertas proteínas del huésped, y un mecanismo de injuria del miocito es a través de la interacción de las proteínas virales con el citoesqueleto. En un modelo de ratón transgénico, la expresión restringida de la proteasa 2 A fue suficiente para inducir MCD.
La proteasa 2A cliva la distrofina in vivo, llevando a la disrupción del complejo distrofina-glicoproteína que es esencial para el funcionamiento cardíaco normal. Este mecanismo de disfunción miocárdica está también presente en las cardiomiopatías hereditarias que están relacionadas a la mutación de la distrofina, tal como la distrofia muscular de Duchenne. Hay otra interacción de importancia entre el virus coxsackie B y la distrofina, ya que hay una más eficiente liberación de virus por parte de células deficientes en distrofina. Así, los ratones deficientes en distrofina tienen mayor replicación viral y más severa cardiomiopatía.
Infección Viral Persistente.
La respuesta inmune inicial juega un rol protector contra el desarrollo de miocarditis por coxsackie B. La posible importancia de la replicación viral persistente se demostró en un estudio de miocarditis por coxsackie B de ratones inmunocompetentes. El RNA enteroviral estuvo presente en la miocarditis aguda y persistió durante la fase crónica de la miocardiopatía.
Estudios posteriores mostraron que la infección viral persistente se asoció a disfunción miocárdica. En un modelo de ratón transgénico por ejemplo, la expresión de DNA de coxsackie, y la síntesis de RNA viral sin formación de progenie viral infecciosa resultó en MCD. Los miocitos aislados tuvieron defectos en el acoplamiento excitación-contracción y disminución del acortamiento.
El testeo serológico por PCR y de hibridización con sondas en humanos ha reafirmado la conección entre la persistencia de la infección viral miocárdica y el desarrollo de MCD. Los virus más comúnmente identificados son parvovirus B19 y herpes virus humano tipo 6 (HHV6), pero también han estado implicados otros virus incluyendo HIV, hepatitis C, CMV, y varicela.
Mecanismos Autoinmunes.
Los mecanismos autoinmunes han estado implicados en la patogénesis de las miocarditis. En particular, anticuerpos autorreactivos, pueden jugar un rol en el desarrollo de MCD.
En pacientes con miocarditis viral, la respuesta inmune inicial limita el grado de viremia temprana durante la infección y protege contra la miocarditis. Sin embargo, si la respuesta es insuficiente, el virus puede no ser eliminado, y como consecuencia puede sobrevenir una injuria al miocito. Además de la injuria inducida en forma directa por el virus, la persistencia de fragmentos genómicos virales que pueden no ser capaces de replicarse como virus intactos, pueden producir una respuesta autoinmune.
Autoanticuerpos potencialmente patogénicos contra una variedad de componentes celulares son encontrados en alto porcentaje de pacientes con miocarditis y MCD. Los autoantígenos incluyen miosina cardíaca, el receptor adrenérgico beta-1, el traslocador de adenina nucleótido (ANT), complejo de la deshidrogenasa de alfa-cetoacidos de cadena ramificada (BCKD), una variedad de proteínas sarcolémicas y miolemicas, tejido conectivo, y proteínas de matriz extracelular, incluyendo laminina.
La patogénesis de los anticuerpos anti-corazón comienza probablemente con el daño miocítico inducido por virus, con liberación de proteínas intracelulares. Los antígenos intracelulares pueden ser reconocidos como extraños debido a que previamente no estaban en contacto con el sistema inmune, al estar dentro de la célula, protegidos de la vigilancia inmunológica, o a través de mimetismo molecular entre proteínas enterovirales y cardíacas. Las células T CD4-positivas producen daño miocítico estimulando a las células B, citoquinas citotóxicas, y células T citotóxicas CD8-positivas. La presencia de autoanticuerpos anti-corazón es predictora de desarrollo ulterior de MCD.
La subclase de inmunoglobulinas puede ser importante en MCD mediada por anticuerpos. En un estudio, la subclase IgG3 pero no la IgG 1 ni la IgG2 estuvieron elevadas en pacientes con MCD. En otro estudio, hubo una correlación significativa entre la concentración plasmática de IgG3 y la hemodinamia así como los índices de severidad de insuficiencia cardíaca en el ecocardiograma.
El rol de la IgG3 puede tener implicancias en la terapia. La inmunoadsorción para la remoción de anticuerpos puede ser llevada a cabo, sea con columnas con membranas unidas a proteína A (que se unen y remueven la mayoría de IgG, pero tienen baja afinidad para IgG3), o con columnas anti-IgG (que tienen especificidad para todas las subclases de IgG).
Anticuerpos anti alfa-miosina, anticuerpos anti-receptor-beta-1 han estado presentes en pacientes con miocarditis y sobre todo en la evolución a MCD. Además de promover injuria cardíaca, un subgrupo de esos autoanticuerpos contra el segundo dominio del receptor beta-1, ejerce actividad agonista-like, y puede tener algún rol en el desarrollo de arritmias ventriculares serias.
Las autoinmunidad mediada por células T autoreactivas han mostrado presentar acción patogénica en pacientes con MCD idiopática. La sobreexpresión de células T helper activados y células T citotóxicas estuvo asociada con la presencia de virus coxsackie B, que pueden haber sido el disparador para una respuesta inmune mediada por un superantígeno.
Rol de las Citoquinas:
Finalmente, hay un rol para las citoquinas. En un contexto de estado post viral, las citoquinas regulan la función linfocitaria de una manera positiva y negativa, y ejercen una marcada influencia en las actividades de muchas otras células involucradas en la reparación de tejidos y la restauración de la homeostasis. En modelos animales, la progresión a MCD se caracteriza por cambio en la expresión de citoquinas. Las citoquinas Th1, incluyendo interleukina (IL)-2, interferon gamma, e IL-1-beta, son expresados tempranamente en las lesiones. La transición a fibrosis y a MCD son precedidas por una disminución en las citoquinas Th1 y un aumento en la IL-10, una citoquina Th2. El factor de necrosis tumoral-alfa (TNFa) ha estado implicado en la patogénesis de las miocarditis y las MCD en estudio en animales. La producción de esta citoquina por los miocitos cardíacos fue suficiente para causar severa enfermedad cardíaca, incluyendo miocarditis transmural y finalmente fibrosis biventricular, dilatación de las cámaras y disfunción de VI. Además, hay una fuerte relación linear entre los niveles de TNFa y mortalidad en un modelo de ratón con insuficiencia cardíaca secundaria a miocarditis. En miocarditis humana la biopsia endomiocárdica mostró mayores niveles de precursor de TNFa y de enzima convertidora de TNFa (TACE), que convierte el precursor a su forma madura.
En síntesis:
La injuria viral y la respuesta inmune subsecuente pueden ser simplificadas en un modelo de tres fases para categorizar los estadios de progresión de una infección viral aguda a una miocardiopatía dilatada.
• La primera fase comprende la infección viral con muerte celular del miocito dentro de horas de la entrada viral a la célula. En este estadio agudo, la muerte del miocito resulta de daño viral directo, y conduce a la exposición de las proteínas del huésped al sistema inmune.
• La segunda fase, que sigue rápidamente, es una respuesta inmune innata, que comprende la función regulatoria alterada de las células T, células NK, interferón gamma, y óxido nítrico.
• En la tercera fase, una respuesta inmune específica se caracteriza por la aparición de anticuerpos contra los agentes patógenos y contra las proteínas cardíacas del huésped, y células T autoreactivas. La mayoría de los sujetos se recuperan con pocas consecuencias, pero una minoría mueren por arritmias, o progresan a una fase crónica de fallo cardíaco. El stress hemodinámico y neurohumoral conduce a la dilatación ventricular.
MANIFESTACIONES CLÍNICAS Y DIAGNÓSTICO DE MIOCARDITIS EN ADULTOS.
Aunque la histología sigue siendo el gold standard para establecer el diagnóstico de miocarditis, a los pacientes de bajo riesgo casi siempre se establece el diagnóstico presuntivo de miocarditis, si las imágenes y el cuadro clínico, sugieren miocardiopatía de reciente inicio.
La presentación clínica de las miocarditis es altamente variable. Estas diferencias de manifestaciones clínicas, reflejan la variabilidad en la severidad de la enfermedad. La inflamación miocárdica puede ser focal o difusa, afectando cualquiera o todas las cavidades cardíacas. Las miocarditis severas, difusas pueden evolucionar a MCD. Los hallazgos histológicos de miocarditis crónica son usualmente más sutiles, e incluyen antígenos HLA y expresión de moléculas de adhesión alterados, e infiltrados celulares que son visibles solo con inmunotinciones celulares específicas.
Estudios antiguos sugerían que el compromiso cardíaco ocurría en 3,5 a 5% de los pacientes en un brote de infección por virus coxsackies. Sin embargo, hay una dificultad significativa en establecer el diagnóstico de miocarditis debido a que no hay un “gold standard” no invasivo establecido. La sensibilidad de la biopsia endomiocárdica para miocarditis usando criterios histológicos es bajo, en el orden de 10 a 35% debido a la variabilidad en la interpretación y a errores en la toma de muestras.
Las imágenes de resonancia magnética (RMN) son útiles para diagnosticar inflamación epicárdica o medio parietal y edema en pacientes con bajo rendimiento en biopsias endomiocárdicas de ventrículo derecho.
Otro problema es que muchos casos de compromiso miocárdico pueden ser subclínicos. Por ejemplo, la tasa de aumento de troponina después de la vacunación de viruela es 1:200, pero la tasa de miocarditis clínica es aproximadamente 1:5500. Además, síntomas y signos sutiles pueden ser pasados por alto por las manifestaciones sistémicas de un proceso de enfermedad de base. En los estadios tempranos de miocarditis viral por ejemplo, el paciente puede tener fiebre, mialgias, y dolores musculares. Los síntomas musculares son atribuidos a miositis inducidos por un virus miotrópico tal como virus coxsackie A.
Manifestaciones clínicas:
El espectro de presentación de las miocarditis agudas puede ser amplio. A continuación las formas más frecuentes con las que se presenta un paciente con miocarditis:
• Fatiga excesiva.
• Dolor torácico.
• Taquicardia sinusal inexplicada.
• Pericarditis aguda.
• Tercer o cuarto ruido, o galope de suma.
• Alteraciones en el electrocardiograma.
• Alteraciones en el ecocardiograma.
• Nueva cardiomegalia en la Rx de tórax.
• Arritmia auricular o ventricular.
• Bloqueo cardíaco parcial o completo.
• Insuficiencia cardíaca congestiva de comienzo reciente.
• Infarto de miocardio atípico.
• Shock cardiogénico.
• Muerte súbita inesperada.
Insuficiencia cardíaca:
Muchos casos sintomáticos de miocarditis postviral o linfocitaria se presentan con un síndrome de insuficiencia cardíaca (IC) y MCD. En un estudio de 1230 casos de MCD en los EE UU, 9% fueron considerados debidos miocarditis. En muchos pacientes que desarrollan IC, la fatiga y la capacidad de tolerancia al ejercicio disminuida son las manifestaciones iniciales. Sin embargo, la miocarditis difusa, severa, si es rápida en la evolución, puede resultar en fallo miocárdico agudo y shock cardiogénico. Los signos de fallo ventricular derecho incluyen presión venosa yugular aumentada, hepatomegalia, y edema periférico. La alteración de la función ventricular derecha “protege” al corazón izquierdo de los síntomas de congestión pulmonar. Si en cambio lo que predomina es el compromiso ventricular izquierdo, el paciente puede tener síntomas pulmonares de congestión, como disnea, ortopnea, rales, y en casos severos, edema agudo de pulmón.
Dolor torácico:
El dolor torácico está usualmente asociado a pericarditis concomitante. Sin embargo, la miocarditis puede mimetizar isquemia miocárdica y/o infarto, tanto clínicamente como en el electrocardiograma, particularmente en pacientes más jóvenes. La isquemia asociada a miocarditis puede ser debida a inflamación localizada o espasmo coronario.
Muerte cardíaca súbita:
La miocarditis puede presentarse como muerte súbita inesperada, presumiblemente debido a taquicardia o fibrilación ventricular. En una serie de autopsias de pacientes de menos de 40 años que se presentaron como muerte súbita en ausencia de enfermedad cardíaca conocida, la miocarditis fue responsable de 22% de los casos de menos de 30 años y 11% en los mayores de 30 años.
Arritmias:
Un número de arritmias pueden ser vistas. La taquicardia sinusal es más frecuente que las serias arritmias auriculares y ventriculares, mientras que las palpitaciones secundarias a extrasístoles auriculares, o, más a menudo, extrasístoles ventriculares son comunes.
Las miocarditis pueden ocurrir como una complicación de otras miocardiopatías incluyendo la amiloidosis cardíaca, la cardiomiopatía hipertrófica y la cardiomiopatía arritmogénica de ventrículo derecho. En la amiloidosis y en la cardiomiopatía hipertrófica, la miocarditis puede afectar el pronóstico.
Clasificación Clínicopatologica.
Una clasificación clínicopatológica utilizando tanto elementos histológicos como clínicos pueden proveer información pronóstica acerca de pacientes con IC debida a miocarditis. Un estudio propuso la siguiente clasificación:
• Miocarditis fulminante:
La miocarditis fulminante se presenta con fallo cardíaco agudo hasta 2 semanas después de los pródromos virales. Los pacientes tienen severo compromiso cardiovascular y pueden requerir soporte circulatorio mecánico. Múltiples focos de miocarditis activa son típicos, y la disfunción ventricular a menudo se normaliza si los pacientes sobreviven a la enfermedad aguda.
• Miocarditis aguda:
La miocarditis aguda se presenta con un inicio de la enfermedad menos distintivo. Los pacientes suelen presentarse con disfunción ventricular establecida y puede progresar a MCD.
• Miocarditis crónica activa: La miocarditis crónica activa también se presenta con un inicio menos distintivo de enfermedad. Los pacientes afectados a menudo tienen recidivas clínicas e histológicas, y desarrollan disfunción ventricular asociada con cambios inflamatorios crónicos, y leve a moderada fibrosis en el estudio histológico.
• Miocarditis crónica persistente:
La miocarditis crónica persistente, que también se presenta como una enfermedad menos distintiva, se caracteriza por un infiltrado histológico persistente, a menudo con focos de necrosis miocítica pero sin disfunción ventricular, a pesar de otros síntomas tales como dolor torácico o palpitaciones.
Examen físico.
Además de los signos de sobrecarga de líquidos, el examen físico a menudo revela evidencias directas de disfunción cardíaca en pacientes sintomáticos.
• Galope por R3 y ocasionalmente por R4 son signos importantes de deterioro de la función ventricular, particularmente cuando el compromiso miocárdico agudo biventricular resultan en congestión pulmonar y sistémica.
• Si la dilatación ventricular derecha o izquierda es severa, la auscultación puede revelar soplos de insuficiencia mitral o tricuspídea.
• Un frote pericárdico y un derrame pueden ser evidentes en pacientes con miopericarditis.
Laboratorio.
Los análisis de rutina de sangre y orina son a menudo normales o revelan solo anormalidades inespecíficas.
Enzimas cardíacas:
La elevación de las enzimas cardíacas reflejan la necrosis miocárdica. Ellas son vistas en algunos pero no en todos los pacientes con miocarditis. Los hallazgos experimentales y clínicos, sugieren que la elevación de los niveles de troponina I o T (cTnI o cTnT) pueden ser más comunes que las elevaciones de la CK-MB en pacientes con miocarditis probada por biopsia endomiocárdica. (34 por ciento versus 6%). Las elevaciones de cTnI estuvieron correlacionados con una corta duración (menos de un mes) de síntomas de fallo cardíaco, sugiriendo que la mayor proporción de necrosis cardíaca ocurre al principio de la enfermedad. Las elevaciones persistentes de las enzimas cardíacas son indicativas de necrosis en curso.
Electrocardiograma (ECG):
El ECG puede ser normal o anormal en las miocarditis. Sin embargo, las anormalidades son inespecíficas a menos que haya compromiso pericárdico. Los cambios pueden incluir alteraciones inespecíficas del ST, latidos ectópicos auriculares o ventriculares, arritmias ventriculares complejas (apareadas, o taquicardia ventricular no sostenida), o, raramente, taquicardia auricular o fibrilación auricular. Un bloqueo de alto grado es poco frecuente en las miocarditis linfocitaria, pero común en la sarcoidosis cardíaca y en las miocarditis idiopáticas de células gigantes.
Las miocarditis pueden, en algunos casos, simular exactamente el patrón de las pericarditis agudas o del infarto agudo de miocardio (IAM). Como en el IAM, las miocarditis pueden tener elevaciones regionales del ST y ondas Q. Las miocarditis deben ser sospechadas en pacientes jóvenes que se presentan con posible IAM pero tienen angiografía coronaria normal.
La presencia de onda Q, o bloqueo de rama izquierda se asocia con mayores tasas de transplante o muerte.
Radiografía de tórax:
El tamaño del corazón en la Rx de tórax varía desde el tamaño normal hasta la cardiomegalia con o sin congestión vascular y derrame pleural. Una considerable cardiomegalia biventricular puede asociarse a la ausencia total de congestión pulmonar debido a la presencia de fallo cardíaco derecho y/o moderada a severa regurgitación tricuspídea.
Figura 1. Radiografía de tórax secuencial en miocarditis agu
Rx de tórax frente secuencial en un hombre joven con miocarditis aguda (derecha), y tres meses más tarde (izquierda). En la primera radiografía se observa cardiomegalia y congestión pulmonar. Tres meses después, los pulmones se han aclarado pero el paciente tiene miocardiopatía dilatada con cardiomegalia persistente.
Ecocardiografía:
El ecocardiograma se ha transformado en la metodología diagnóstica de mayor valor en detectar la disminución de la función ventricular en las miocarditis agudas, aún cuando son subclínicas. Un ventrículo esferoideo en las miocarditis agudas, tiende a remodelar a una forma elíptica más normal en el curso de algunos meses. La disfunción es generalmente global, pero puede ser regional o segmentario. Una señal de Doppler tisular anormal puede proveer evidencia adicional de miocarditis, aunque no ha sido evaluado en grandes estudios.
Un leve deterioro de la contractilidad miocárdica puede ser evidente solo cuando el estudio es llevado a cabo en reposo más que durante el ejercicio. Sin embargo, pueden verse alteraciones de la motilidad parietal inducidas por ejercicio, que representan generalmente disfunción debido a alteraciones microvasculares.
El ecocardiograma puede también detectar un trombo silente intracardíaco, regurgitación mitral o tricuspídea, y compromiso pericárdico coexistente.
Tanto la miocarditis fulminante como la miocarditis aguda se asocian con disfunción sistólica del VI. Sin embargo, los pacientes con miocarditis fulminante tienden a tener dimensiones diastólicas ventriculares izquierdas normales o casi normales, y un aumento del grosor septal, mientras que aquellos pacientes con miocarditis aguda tienden a tener dimensiones diastólicas ventriculares izquierdas aumentadas, y grosor septal normal. A los seis meses, los pacientes con miocarditis fulminante tienen un mejoramiento dramático en la función sistólica, mientras que no hay cambios en los pacientes con miocarditis aguda.
Ventriculografía isotópica:
Con el uso difundido de la ecocardiografía, la ventriculografía isotópica tiene poco que ofrecer. Sin embargo, puede ser útil cuando las imágenes del ecocardiograma transtorácico son subóptimas, o cuando la ecocardiografía transesofágica no está disponible. Además, hay menos variabilidad en la medición de la fracción de eyección obtenida de la ventriculografía isotópica seriada, debido a que es menos operador dependiente.
Cardio resonancia magnética (CRM):
La cardioresonancia puede detectar edema miocárdico e injuria miocárdica en las miocarditis.
Los hallazgos incluyen aumento en la intensidad de señal focal y global en T2 (usada para calcular relación de edema (RE)), aumento en el realce de contraste miocárdico focal o global en relación al músculo esquelético, y la presencia de realce tardío con gadolinio (RT). El RT parece ser menos sensible que el realce relativo global (gRE), o RE para la detección de miocarditis, de manera que la negatividad del realce tardío con gadolinio no excluye la miocarditis. La mejor performance diagnóstica puede ser obtenida con la positividad de dos de esas tres secuencias, las cuales brindan un 76% de sensibilidad y 96% de especificidad.
La CRM ha demostrado que las miocarditis a menudo comienzan como un proceso focal:
• En un estudio de CRM que usó realce con gadolinio se observó que existía un aumento focal inicial, que se hizo global después de cuatro semanas. (Figura 2).
• En otro estudio, el 88% de los pacientes tuvieron uno o más focos en la CRM con gadolinio con RT, más a menudo en la pared libre del ventrículo izquierdo (VI). La CRM puede así, guiar la biopsia endomiocárdica para mejorar el rendimiento diagnóstico.
• Diferentes patógenos virales producen diferentes patrones de injuria miocárdica. Los pacientes con parvovirus B19 tienen compromiso subepicárdico de la pared libre del VI, en la CRM con gadolinio en RT, mientras que los pacientes con herpes virus humano tipo 6 tienen compromiso septal.
Figura 2
CRM con realce de contraste en un paciente con miocarditis aguda.
Panel A: en el día 2 de comienzo de los síntomas, el realce de contraste revela pequeños focos de aumento de la intensidad de señal en el miocardio posterior y en el septum basal.
Panel B: en el día 14, se ve un aumento más difuso en la intensidad de la señal miocárdica, especialmente en el septum (flecha).
Panel C: en el día 84 no se ve realce de contraste.
El patrón de realce tardío con gadolinio en las miocarditis puede generalmente ser distinguido de la miocardiopatía isquémica. En la miocarditis el RT afecta preferencialmente el epicardio y el miocardio medio con respeto del endocardio. En la miocardiopatía isquémica, el RT refleja la distribución del infarto de miocardio que típicamente afecta el endocardio con extensión variable al miocardio medio y al epicardio.
El RT con gadolinio ha sido descripto en algunos pacientes con miocardiopatía no isquémica donde la etiología es menos clara. Es posible que algunos pacientes con miocardiopatía no isquémica que tienen realce miocárdico en la CRM, en realidad tienen miocarditis, aunque este concepto no ha sido formalmente estudiado.
Diagnóstico.
Hay dos componentes para el diagnóstico de miocarditis: cuándo debe ser sospechado, y, cómo se confirma el diagnóstico
Cuándo sospechar miocarditis:
Las manifestaciones de miocarditis descriptas más arriba, a menudo sugieren el diagnóstico clínicamente. La miocarditis aguda debe ser sospechada siempre que un paciente, especialmente un varón joven, se presente con anormalidades cardíacas de reciente comienzo, que no tengan otra explicación, tales como insuficiencia cardíaca, infarto de miocardio, arritmias cardíacas, o alteraciones de la conducción. Un antecedente de infección reciente del tracto respiratorio superior, o enteritis puede también ser encontrado en la mayoría de los casos de miocarditis viral.
Cuando un paciente se presenta con insuficiencia cardíaca, y una miocardiopatía presuntamente debida a miocarditis, deben excluirse primero enfermedades cardíacas congénitas, valvulares, isquémicas, y cardiopulmonares. El paso siguiente del clínico es considerar enfermedades del músculo cardíaco de naturaleza no inflamatoria, tales como las asociadas a enfermedades autoinmunes, o toxinas tales como etanol o cocaína.
Hay otros contextos en los que el diagnóstico de miocarditis debe ser considerado:
• Cuando manifestaciones sistémicas de infecciones virales, bacterianas, rickettsiales, fúngicas, o parasitarias, se asocien a alteraciones nuevas de la función cardíaca. Dado que muchos virus cardiotrópicos, incluyendo coxsackie A son también miotropos, la presencia de dolores musculares y, particularmente hipersensibilidad a la palpación muscular, debe siempre hacer pensar de que puede haber un compromiso miocárdico simultáneo.
• Cuando una infección viral, especialmente enfermedades exantemáticas de la niñez debidas a parvovirus B19, se acompañan de taquicardia fuera de proporción a la fiebre.
• Cuando una enfermedad infecciosa se presente con evidencias de pericarditis.
• Cuando un paciente, particularmente un joven, se presente con signos y síntomas clínicos de infarto agudo de miocardio, sobre todo si la coronariografía es normal.
• Cuando un paciente desarrolle síntomas de fallo cardíaco asociado con rash y eosinofilia siguiendo a la administración de una droga nueva o una vacuna.
Un diagnóstico presuntivo de miocarditis debe ser realizado en base a la presentación clínica y de laboratorio delineadas antes. En un escenario clínico de reciente enfermedad gripal, vacunación, u otra injuria miocárdica sospechada, todo paciente con aumento por otra parte inexplicado en la troponina, cambios electrocardiográficos sugestivos de injuria miocárdica, o anormalidades de la función cardíaca en el ecocardiograma o en la CRM pueden ser considerados como “posible miocarditis subclínica” si no tienen síntomas cardiovasculares. Si los pacientes reúnen los criterios de posible miocarditis subclínica, pero también tienen un síndrome clínico compatible con miocarditis, entonces deben ser categorizados como “miocarditis posible”. Si las anormalidades en las imágenes del ecocardiograma o de la CRM son de reciente aparición, entonces el nivel de certeza diagnóstica se eleva y se requiere el término de “miocarditis probable”.
Biopsia endomiocárdica.
Cuándo debe ser llevada a cabo una biopsia endomiocárdica (BEM)? El rol de la biopsia endomiocárdica en la evaluación de la enfermedad cardiovascular fue tratada en 2007 en una reunión científica de la AHA/ACCF/ESC.
La BEM debe ser llevada a cabo en escenarios clínicos de miocarditis fulminante o donde se sospeche miocarditis de células gigantes. La BEM debe también ser considerada en otros escenarios clínicos donde el diagnóstico de miocarditis puede modificar el tratamiento o el pronóstico. Si se determina que un paciente debe ser sometido a BEM, este debe ser derivado a un centro de experiencia.
Histología.
El examen histológico revela infiltrados celulares, que son usualmente histiocitarios y mononucleares, con o sin daño miocítico asociado. Las formas histológicas específicas de miocarditis incluyen la miocarditis eosinofílica, granulomatosa, y la miocarditis de células gigantes. Los infiltrados son de severidad variable y están a menudo asociados a necrosis del miocito y desorganización del citoesqueleto miocárdico (Figura 3 A- y 3B)
Figura 3 A. Miocarditis por viruela.
Autopsia de un paciente con miocarditis aguda asociada a viruela, mostrando necrosis de miofibrillas y prominentes infiltrados mononucleares.
Biopsia endomiocárdica de ventrículo derecho mostrando miocarditis difusa aguda. Hay prominente necrosis de miofibrillas asociada a infiltrado mononuclear de alto grado.
Con las miocarditis subagudas y crónicas, la fibrosis intersticial puede reemplazar los miocitos, y puede ser vista la hipertrofia miofibrilar (Figura 4).
La biopsia endomiocárdica obtenida un año después de una miocarditis aguda probada por biopsia. Hay ahora considerable fibrosis con disrupción de la arquitectura miocárdica normal.
Los criterios para el diagnóstico histológico incluyen los “criterios de Dallas” que se basan en criterios de tinción histológica y el uso de criterios inmunohistológicos.
Criterios de Dallas.
La variablididad en la interpretación de la BEM condujo a un panel de expertos patólogos cardíacos a desarrollar estos criterios, que son ahora usados por la mayoría de los investigadores para definir la enfermedad:
• Miocarditis activa: es definida como “un infiltrado inflamatorio del miocardio con necrosis y/o degeneración de los miocitos adyacentes, no típicos de daño isquémico asociado a enfermedad coronaria” Los infiltrados son usualmente mononucleares pero pueden ser neutrofílicos, u ocasionalmente eosinofílicos.
• Miocarditis borderline: es un término usado cuando los infiltrados inflamatorios son demasiado ralos, o no se puede demostrar injuria del miocito.
Hay sin embargo, una creciente preocupación por la precisión de los criterios de Dallas para el diagnóstico de miocarditis. En un reporte que comparó con datos de autopsia, la sensibilidad y la especificidad fueron de aproximadamente 60% y 80% respectivamente.
La baja sensibilidad de la BEM es en parte debida a la naturaleza focal y transitoria de los infiltrados. Las siguientes observaciones ilustran la importancia de la toma de muestras:
• En un estudio con autopsias en 38 pacientes, la biopsia de VD fue positiva en 63% de los pacientes pero solo en el 17% de las muestras, o sea que hay que tomar muchas muestras; valores similares fueron vistos en biopsias de VI. Cuando diez muestras son tomadas por ventrículo, la tasa de falsos negativos fue de 37% y 45% para el VD y el VI respectivamente.
• En un reporte de CRM con confirmación histológica, el sitio más común de compromiso focal fue la superficie epicárdica de la pared libre del VI, mientras que la mayoría de las biopsias endocárdicas se obtienen del lado ventricular derecho del septum interventricular. Entre los 21 pacientes en quienes se tomaron biopsias endomiocárdicas dirigidas por CRM y obtenidas de áreas de realce de contraste, la evaluación histológica mostró miocarditis activa en 19. Mientras que entre los 11 pacientes que fueron biopsiados en una región no afectada por CRM, se vio miocarditis histológica solo en 1. Aunque esos resultados son importantes, su aplicabilidad clínica es incierta ya que existe preocupación acerca del riesgo de biopsiar la pared libre de VI que es la zona más frecuentemente afectada en CRM.
Otro problema con el diagnóstico histológico es que aún en manos de expertos patólogos, a menudo hay desacuerdo en la interpretación del material de biopsia miocárdica. Por ejemplo en el Myocarditis Treatment Trial (MTT) la interpretación de expertos fue confirmada solo en 67% de los casos.
Un tercer problema es que puede haber genoma viral en el miocardio sin suficientes cambios histológicos para reunir los criterios de Dallas. En un estudio de 34 niños con presentación clínica compatible con miocarditis, 13 de las 26 muestras fueron positivas para virus patógenos sin evidencias de miocarditis en la microscopía de luz.
Los patógenos virales, incluyendo HHV6 y parvovirus B19, que son ahora comúnmente identificados en el miocardio de pacientes con miocardiopatía, usualmente no desencadenan una respuesta inmune celular.
El rol de la BEM en la detección de miocarditis en pacientes con miocardiopatía dilatada (MCD) crónica ha ido evolucionando. En una revisión, la miocarditis estuvo presente solo en 9% de los pacientes con MCD. Se espera el resultado de estudios de gran volumen acerca de la confirmación de resultados observados en estudios menores en paciente con MCD crónicas estables en quienes se comparó el uso de inmunosupresión contra placebo, observándose una mejoría significativa en la fracción de eyección en el grupo tratado. Estos pacientes no tenían genoma viral por PCR en la BEM.
PCR e Inmunohistoquímica.
La detección del genoma viral por PCR (polymerase chain reaction) puede ser usado para identificar patógenos virales específicos, aunque el valor clínico de la detección del genoma viral permanece incierto, especialmente en ausencia de criterios histológicos de miocarditis.
Una serie de casos en 1990 sugirió que genomas enterovirales en el miocardio de pacientes con fallo cardíaco, era un biomarcador de peor pronóstico.
Un estudio no randomizado evaluó 41 pacientes con fallo cardíaco progresivo por 6 meses, que no respondieron a la terapia standard y en quienes se encontró miocarditis activa linfocitaria en la biopsia. Los 41 pacientes fueron tratados con prednisona azatioprina por 6 meses, y 21 tuvieron mejoría de la fracción de eyección al final del tratamiento. De los 20 pacientes que no respondieron a la terapia inmunosupresora, 17 tenían genomas virales detectados por PCR. De los 21 pacientes que respondieron al tratamiento, solo 3 tenían PCR positivos.
Esos hallazgos son consistentes con otro estudio en los que la persistencia del genoma viral por PCR, estuvo asociado a disfunción de VI progresiva, mientras que el clearence del genoma viral, se asoció a mejoramiento de la función ventricular.
Una reciente serie de casos de gran tamaño en la que se demostró que parvovirus B19 se detectó muy frecuentemente, sugirió también que el genoma viral no era predictivo de muerte o de transplante cardíaco a menos que estuviera presente además la miocarditis. Una interpretación de estos datos es que los enterovirus son usualmente patogénicos en la miocardiopatía dilatada aguda y crónica, pero que parvovirus B19 puede a veces no estar relacionado con la patogénesis de la miocardiopatía.
Otros tests. Existen una serie de tests que han sido usados en casos seleccionados pero su utilidad es limitada:
• Scan con galio: Puede ser de valor en algunos casos, mostrando evidencias de infiltración celular miocárdica severa. Ha sido reemplazado por la CRM.
• Scan antimiosina: Que puede ser positivo revelando necrosis. No está comercialmente disponible desde 1997.
• Angiografía coronaria: No da información específica pero es de valor para descartar otras enfermedades cardíacas tales como congénitas, reumáticas, o isquémicas. A veces en las miocarditis puede verse espasmo coronario severo que causa angina.
Determinación de etiologías específicas.
La titulación de anticuerpos en etapa aguda como en fase de convalescencia han sido utilizados para determinar la etiología específica en una MCD. Esos tests parecen ser de poca utilidad, dado que no hay diferencias entre los pacientes y los controles en la comunidad que comparte los mismos contactos. De forma similar, los cultivos virales de las muestras para virus son raramente exitosos.
Por otro lado, un diagnóstico histopatológico de causa específica de miocarditis es ocasionalmente posible en pacientes con toxoplasmosis, enfermedad de Chagas, enfermedad de Lyme, y triquinelosis. El examen en microscopía electrónica es ocasionalmente útil para excluir toxicidad cardíaca por drogas. Los característicos cuerpos de inclusión intranucleares pueden ser vistos en la carditis por citomegalovirus.
Un antecedente de vacunación antivariólica en los últimos 30 días debe alertar ante la posibilidad de miocarditis por hipersensibilidad o miopericarditis. Dado que la viremia es rara después de la vacunación y que los anticuerpos aumentan después de una vacunación exitosa, esas investigaciones no sirven para confirmar el diagnóstico, el cual se basa principalmente en la relación temporal entre ambos eventos.
Recomendaciones finales:
En pacientes que se presentan con insuficiencia cardíaca, o evidencias de miocarditis, es fundamental realizar una minuciosa historia clínica haciendo énfasis en las causas posibles de miocarditis/miocardiopatía. El diagnóstico de MCD es establecido adicionalmente con un detallado examen físico y evaluación de laboratorio que incluya ECG, Rx de tórax, y ecocardiograma.
Una vez que se ha descartado la posibilidad de enfermedad cardíaca isquémica, lesiones valvulares críticas, y miocardiopatías restrictivas o hipertróficas, la necesidad de BEM dependerá del curso y la severidad de la presentación. Información adicional se obtiene por tests de laboratorio, incluyendo tests apropiados para descartar enfermedades autoinmunes, aspirados grasos para amiloidosis, y niveles de ferritina para hemocromatosis también pueden guiar la necesidad de BEM en casos seleccionados.
La mayoría de los pacientes que se presentan con insuficiencia cardíaca subaguda a crónica en quienes se hace diagnóstico de MCD deben ser manejados inicialmente con terapia de insuficiencia cardíaca, con lo cual la mayoría responderá y no requerirán BEM.
En aquellos con rápido deterioro a pesar del manejo terapéutico óptimo, una BEM puede brindar información diagnóstica y afectar las elecciones terapéuticas. Los pacientes con presentaciones crónicas pero que son refractarios al tratamiento médico deben ser también considerados para la BEM, si es que hay fuertes sospechas de procesos potencialmente reversibles como hemocromatosis, amiloidosis, y en quienes los tests no invasivos no son concluyentes.
Historia Natural y Terapia de las Miocarditis en Adultos.
El tratamiento de las miocarditis consiste tanto en la terapia específica de la causa de la miocarditis, como la terapia inespecífica de las manifestaciones clínicas tales como insuficiencia cardíaca y arritmias. Antes de ser tratados ambos tópicos, revisaremos la historia natural de este trastorno.
Una minoría significativa de pacientes con pericarditis, también tienen miocarditis, un trastorno llamado miopericarditis.
Historia Natural.
La historia natural de la miocarditis basada en poblaciones no se conoce con precisión dado que no existen tests diagnósticos no invasivos que confirmen el diagnóstico. Sin embargo, los estudios seroepidemiológicos sugieren que la mayoría de los casos de infección por virus Coxsackie B son subclínicos y tienen un curso benigno.
En poblaciones de hospitales o clínicas, la historia natural de las miocarditis varía con la causa de base y los síntomas de presentación. En la mayoría de los pacientes que desarrollan inflamación, como evidencian los cambios ECG, esta es aparentemente autolimitada sin secuelas. Los cambios ECG más severos tales como bloqueo de rama derecha, alto grado de bloqueo, y onda Q, se asocian con peor pronóstico a largo plazo. Una minoría de los pacientes inicialmente asintomáticos, sin embargo, desarrollan insuficiencia cardíaca, arritmias severas, trastornos de conducción, o aún, colapso circulatorio. Raramente, las miocarditis postvirales pueden ser fatales debido a fallo miocárdico o muerte súbita inesperada.
En contraste, la mayoría de los pacientes con miocarditis linfocitaria postviral sintomáticos se presentan con insuficiencia cardíaca (IC) o MCD. Sin embargo, signos y síntomas sutiles de compromiso cardíaco pueden ser pasados por alto por las manifestaciones sistémicas de la infección viral.
Los pacientes con miocarditis que se presentaron con MCD en el Myocarditis Treatment Trial (MTT) tuvieron remodelado temprano del VI con dilatación de la cámara y desarrollo de una cavidad más esférica. Más del 50% de esos pacientes, demostraron reversibilidad del proceso de remodelado con una reducción del volumen del VI y restauración de la cámara con una forma más elíptica, que estuvo asociada a mejoramiento de la fracción de eyección de VI.
En una minoría de pacientes con miocarditis aguda, la disminución de la reserva cardíaca, arritmias, o disturbios de la conducción pueden persistir por años; esto puede ser debido a tejido cicatrizal residual, miocarditis activa persistente, u, ocasionalmente la persistencia de infección viral. En una revisión de 1230 pacientes con MCD, 9% tuvieron miocarditis.
Rol de los anticuerpos.
Hay evidencia sugestiva de que algunos casos de miocarditis conducen a MCD debido a una reacción autoinmune activa contra proteínas miocárdicas. Como ejemplo, la presencia de autoanticuerpos anti-alfa miosina puede estar asociado a peor pronóstico en miocardiopatías crónicas, como es manifestado por una menor probabilidad de mejoramiento en la función sistólica y diastólica del VI comparado con los pacientes sin esos anticuerpos. Los pacientes con anticuerpos, no tuvieron mejoramiento en la fracción de eyección a los 6 meses, comparados con un 9% de aumento de la misma, en pacientes sin anticuerpos. De manera similar, la presencia de anticuerpos anti-corazón en familiares del paciente con MCD idiopática predice futura dilatación de VI.
En contraste, en pacientes con miocardiopatía aguda, mayores títulos de IgG anti-corazón, se asociaron a mejor función de VI en el MTT. Esta observación sugiere que la respuesta inmune aguda a la infección viral, usualmente sirve para eliminar el patógeno y mejorar la función cardíaca.
PRONÓSTICO.
El pronóstico a largo plazo de la mayoría de los casos de miocarditis leves no son conocidos, ya que la herramienta diagnóstica primaria, la BEM, tiende a ser aplicada solo a pacientes con manifestaciones clínicas mayores tales como insuficiencia cardíaca refractaria, o arritmias que ponen en peligro la vida.
Miocarditis linfocitaria, presumiblemente viral: El pronóstico de las miocarditis depende de la causa y severidad de la enfermedad. La miocarditis linfocitaria por ejemplo, tiene un curso variable:
• Algunos pacientes tienen enfermedad subclínica.
• Algunos tienen enfermedad indolente que progresa a MCD.
• Otros se presentan con enfermedad fulminante, que puede ser fatal, o puede resolverse completamente después del soporte hemodinámico exitoso en esta etapa aguda.
En un reporte de 27 pacientes (promedio de edad 47 años) con biopsia de miocardio que mostraba miocarditis definida o borderline, la sobrevida a los 5 años fue de 56%, similar a una cohorte de pacientes con MCD sin miocarditis aguda.
No se sabe que datos en la presentación pueden predecir el resultado en la miocarditis viral aguda. En una serie de 109 casos con criterios de Dallas positivos ( miocarditis activa o borderline), los hallazgos en la presentación que fueron predictivos de muerte posterior o de transplante fueron: síncope (riesgo relativo 8,5), bloqueo de rama (riesgo relativo 2,9), y fracción de eyección de VI de menos de 40% (riesgo relativo 2,9). Aunque la histología borderline fue protectora, este hallazgo no fue visto en otras series.
Otro factor pronóstico adverso es el desarrollo de hipertensión pulmonar.
Miocarditis fulminante:
Los pacientes que se presentan con miocarditis fulminante, aunque más severamente enfermos, más probablemente, pueden recuperarse completamente en forma más probable que aquellos con miocarditis aguda si sobreviven la fase aguda de la enfermedad.
Persistencia del genoma viral:
Un importante predictor de la evolución en pacientes con miocarditis viral puede ser la presencia o ausencia de la persistencia del genoma viral en el miocardio. En estudios de pacientes con BEM, los pacientes con adecuado clearence del genoma viral tuvieron un aumento en la fracción de eyección de VI de 50 a 58%, mientras que aquellos con persistencia del genoma viral tuvieron una reducción significativa de la misma de 54 a 51%.
Sin embargo, otra serie de casos en la que parvovirus B 19 fue el patógeno más frecuente, no se demostró un efecto del genoma viral en el riesgo de muerte o transplante cardíaco, aumentando la sospecha de que el genoma viral puede a veces reflejar una infección latente y no una infección viral activa.
La persistencia del genoma viral también identifica a los pacientes que improbablemente respondan a la terapia inmunosupresora.
Aunque los datos sugieren que la persistencia del genoma viral puede predecir un deterioro gradual de la función ventricular izquierda en miocardiopatía dilatada crónica, la realización de una BEM en estos pacientes dependerá de mayores evidencias de algún tratamiento efectivo de la miocardiopatía viral.
Rol de los marcadores serológicos:
Aunque los parámetros clínicos son solo parcialmente predictivos de la evolución, los parámetros serológicos, particularmente el Fas ligando soluble (FasL) e interleukina (IL)-10 pueden ser útiles en las miocarditis agudas severas. Fas (CD95), un miembro de la familia de receptores del factor de necrosis tumoral (TNF), es expresado siguiendo a la activación de células-B. La unión de Fas con su ligando natural (FasL, que es expresado en las células T activadas) disparando la muerte celular apoptótica. Como resultado, Fas regula la expansión clonal de las células B autoreactivas.
En una serie, la concentración sérica de Fas soluble y FasL fueron significativamente mayores en pacientes con miocarditis aguda comparada con pacientes normales o pacientes con infartos antiguos. Entre los pacientes con miocarditis, las concentraciones de Fas y FasL estuvieron significativamente más alta en aquellos que murieron durante la hospitalización comparados con los que se dieron de alta después de la recuparación.
Una mayor concentración de IL-10 en la admisión puede ser predictiva de shock cardiogénico y muerte en pacientes con miocarditis fulminante.
Miocarditis de células gigantes:
La miocarditis idiopática de células gigantes (MCG) es rara y frecuentemente fatal tipo de miocarditis. La patogénesis de este trastorno no es conocido. En un modelo animal, un trastorno similar a la MCG fue inducido por inmunización con miosina cardíaca. Sin embargo, los anticuerpos antimiosina son frecuentemente encontrados en pacientes con miocarditis y no están limitados a las MCG.
En una serie de 63 pacientes con MCG, los síntomas de presentación fueron: insuficiencia cardíaca (75%), arritmias ventriculares (14%), y bloqueo cardíaco (5%) Los síntomas iniciales similares al infarto agudo de miocardio se ven en 6%. La tasa de muerte o transplante cardíaco fue de 89% y la sobrevida media desde el inicio de los síntomas fue de 5,5 meses. Esto representa un peor pronóstico comparado con la miocarditis linfocitaria o viral, los cuales 50% de tales pacientes están vivos sin transplante a los 5 años.
Miocardiopatía dilatada de reciente comienzo:
El pronóstico puede ser relativamente bueno en pacientes con reciente inicio de MCD (menos de 6 meses). En un ensayo randomizado de 62 de tales pacientes, algunos de los cuales se probó que tenían miocarditis, la fracción de eyección de VI aumentó de 25% basal hasta 42% en un año, 36% tuvieron una fracción de eyección de VI normal, y la sobrevida libre de transplante al año y a los dos años fue de 92 y 88% respectivamente.
TERAPIA ESPECÍFICA.
Hay un número de causas (primariamente infecciosas) de miocarditis para las que hay terapia específica, tales como Mycoplasma, enfermedad de Lyme (Borrelia burgdorferi) enfermedad de Chagas. Debe tenerse en cuenta sin embargo, que no siempre el tratamiento específico afecta la miocarditis en si misma. Consideraciones similares se aplican a trastornos autinmunes como la miocarditis por lupus.
Miocarditis linfocitaria: La infección viral es la causa más comúnmente identificada de miocarditis linfocitaria. Desde 1950 hasta 1980 los estudios experimentales y seroepidemiológicos asociaban a los enterovirus, particularmente especies de Coxsackie B, con miocarditis. Al final de la década de 1980, las técnicas moleculares tales como la PCR, identificaron genomas virales en el tejido cardíaco de pacientes con miocarditis aguda y MCD. El espectro de los virus asociados a miocarditis se amplió en la medida que se usaron técnicas de PCR para identificar genomas virales en muestras de tejido cardíaco. Actualmente los genomas más comúnmente identificados son parvovirus B19 y herpes virus humano tipo 6 (HHV6). Los enterovirus todavía son causa de miocarditis sobre todo en pequeños brotes regionales.
Terapia antiviral.
La terapia antiviral con ribavirina o interferon alfa reduce la severidad de las lesiones miocárdicas y la mortalidad en miocarditis murina experimental debida a Coxsackie B3. Sin embargo, este efecto beneficioso se observa solo si la terapia es comenzada antes de la inoculación, o rápidamente después. Por lo tanto la aplicabilidad en humanos de estos hallazgos es incierta, ya que los pacientes con miocarditis viral no son vistos en estadios tan tempranos. Sin embargo, la terapia antiviral puede ser considerada en miocarditis fulminantes, en brotes institucionales y en casos adquiridos en laboratorio.
La terapia antiviral con interferon beta, también puede ser beneficiosa para pacientes con MCD crónica y evidencias de genoma viral en la BEM por PCR. En una serie de 22 pacientes con disfunción persistente de VI, insuficiencia cardíaca sintomática, y persistencia enteroviral o adenoviral en el miocardio por PCR, interferon beta dado en forma subcutánea 18.000.000 de UI por semana por 24 semanas, erradicó el genoma viral por PCR en todos los pacientes, y se produjo una significativa disminución de tamaño del VI asociado a un significativo aumento de la función.
Terapia inmunosupresora.
Dado que la inflamación puede persistir en el miocardio después del clearence del patógeno inicial disparado por autoantígenos endógenos, se ha postulado que la terapia inmunosupresora puede ser efectiva en casos seleccionados de miocarditis. Sin embargo, tanto los corticosteroides como la ciclosporina exacerban la miocarditis viral murina. El efecto de la inmunosupresión varía con la variedad de ratones utilizados, los virus y el tiempo de tratamiento. En un estudio, micofenolato mofetil inhibió el desarrollo de miocarditis por virus Coxsackie B.
En un ensayo, 111 pacientes con diagnóstico histopatológico de miocarditis y una fracción de eyección de VI de menos de 45% fueron randomizados a recibir terapia convencional sola o inmunosupresión, con ciclosporina o azatioprina por 28 semanas. En todos los pacientes la fracción de eyección aumentó de 25 a 34% y la mortalidad fue de 20% al año y 56% a los 4,3 años. No hubo diferencias entre ambos grupos.
En contraste con los pacientes con miocarditis aguda, los pacientes con evidencias de inflamación crónica, responden a la terapia inmunomodulatoria.
Hay varias posibles explicaciones para la carencia de efectos en miocardiopatía aguda:
• La mayoría de los pacientes con miocardiopatía aguda mejoran con el tratamiento standard del fallo cardíaco, y como resultado de ello, un efecto aditivo de el tratamiento inmunosupresor no es fácil de detectar, debido a este mejoramiento en el brazo control.
• El uso de los criterios de Dallas para el diagnóstico de miocarditis puede no haber identificado aquellos pacientes que s ebeneficiarían de la inmunosupresión. Los marcadores de activación inmune, más que los infiltrados celulares (criterios de Dallas) parecen identificar a la población de pacientes que pueden beneficiarse de la inmunosupresión.
• Los hallazgos no se aplican a todos los pacientes con miocarditis tales como niños, aquellos con shock cardiogénico, o aquellos que se prsentan con arritmias.
Inmunoglobulina intravenosa.
La inmunoglobulina intravenosa tiene un efecto antiviral e inmunomodulador, sugestivo de que puede jugar un rol en el tratamiento de la miocarditis viral. Sin embargo, estudios en pacientes con miocarditis viral probada no mostraron mejoría en forma significativa que ameriten recomendar de rutina esta terapia en miocarditis aguda. Ha tenido algún efecto la inmunoglobulina en pacientes con miocardiopatía dilatada crónica, no así en la miocardiopatía dilatada de reciente comienzo.
AINES.
Las drogas antiinflamatorias no esteroideas no son efectivas en modelos animales. Por el contrario, ellas pueden aumentar el proceso inflamatorio y aumentar la mortalidad.
MCD aguda idiopática.
Aunque la infección viral es la causa más comúnmente identificada de miocarditis que se presentan como miocardiopatía dilatada, no se puede determinar la etiología en 50% de los casos. La mayoría de esos casos probablemente resulten de infección oculta, de un proceso autoinmune, o de estadios tempranos de enfermedades miocárdicas genéticamente determinadas. El posible rol de la autoinmunidad ha conducido a la evaluación de la efectividad de la inmunoglobulina intravenosa. En estos pacientes, una dosis de 1 gr/kg de peso por día por dos días mejoraron la fracción de eyección al año.
Miocarditis de células gigantes.
En contraste al curso clínico variable de la MCD debida a miocarditis linfocitaria, el curso clínico de la miocarditis de células gigantes es usualmente caracterizado por deterioro agudo y fulminante en la frección de eyección de VI, a pesar del tratamiento standard del fallo cardíaco, arritmias ventriculares frecuentes, y bloqueo cardíaco. En un estudio de 63 pacientes la tasa de muerte o transplante fu de 89%, y la sobrevida media fue de solo 5,5 meses desde el inicio de los síntomas.
La inflamación miocárdica parece mediada por células T y células gigantes, y la terapia dirigida a las células T puede por lo tanto ser beneficiosa. En un caso reportado, dos pacientes respondieron favorablemente a terapia citolítica con muromonab-CD3.
A diferencia de las MCD y de las miocarditis linfocitarias, los pacientes con miocarditis de células gigantes (MCG), tratados con ciertos regímenes inmunosupresores pueden tener un significativo aumento de la sobrevida, comparados con quienes no reciben inmunosupresores. En un ensayo, los pacientes con MCG que recibieron inmunosupresores, el promedio de sobrevida libre de transplante fue de 13 meses comparado con solo 3 meses en el grupo placebo. Los inmunosupresores usados son habitualmente ciclosporina y corticosteroides. También se ha usado el muromomab-CD3.
El transplante es una terapia efectiva para la MCG. La tasa de recurrencia histológica post transplante fue de 25% en la biopsia post transplante.
Miocarditis eosinofílica.
La miocarditis eosinofílica (ME) se caracteriza predominantemente por infiltrado eosinofílico que puede ocurrir en asociación con enfermedades malignas, infección parasitaria, miocarditis por hipersensibilidad (MHS), fibrosis endomiocárdica, y con síndrome hipereosinofílico idiopático:
• La MHS se presenta como muerte súbita o fallo cardíaco rápidamente progresivo, a veces con rash, fiebre y eosinofilia periférica. La miocarditis eosinofílica necrotizante tiene un excepcionalmente mal pronóstico, con la mayoría de los casos diagnosticados en la autopsia.
• En contraste, la miocarditis eosinofílica asociada a síndrome hipereosinofílico, típicamente evoluciona en semanas a meses. La presentación es usualmente biventricular, con fallo cardíaco, aunque las arritmias pueden llevar a la muerte súbita.
El tratamiento consiste en altas dosis de corticosteroides y la remoción de la droga causal (en el caso de la MHS) o el tratamiento del trastorno de base.
Miocarditis sarcoide.
La miocarditis sarcoide puede responder al tratamiento con corticosteroides si este se administra antes del desarrollo de fibrosis extensa del VI. Es menos claro si la terapia con esteroides previene la enfermedad de conducción o las arritmias ventriculares. Algunos recomiendan un cardiodesfibrilador implatable como terapia primaria de la taquicardia ventricular, ya que hay una alta tasa de recurrencias de taquicardia ventricular con la terapia con drogas antiarrítmicas, aún cuando estas sean guiadas con tests electrofisiológicos.
Enfermedad celíaca.
Un reporte sugiere que la enfermedad celíaca, que a menudo no es sospechada clínicamente, es la causa de tanto como el 5% de los pacientes con miocarditis autoinmune. Ese reporte refiere que muchos de esos pacientes no tenían los síntomas gastrointestinales clásicos de la enfermedad celíaca (dolor abdominal recurrente, diarrea y pérdida de peso), pero todos tenían deficiencia de hierro, y refractaria a la administración de hierro. La función cardíaca y las arritmias mejoraron siguiendo una dieta libre de gluten con o sin inmunosupresores.
RESUMEN:
Con excepción de la enfermedad debida a trastornos específicos tales como sarcoidosis y enfermedad celíaca, el tratamiento de las miocarditis sigue siendo de sostén como se describe en la siguiente sección. La terapia inmunosupresora no ha sido efectiva en forma predecible en las miocarditis agudas linfocitarias, quizás debido en parte a la relativamente alta tasa de recuperación con la terapia del fallo cardíaco, y se requieren más datos para medir el efecto de las drogas antivirales, tales como el interferón. Más datos se requieren para determinar si la ausencia de genoma viral en la biopsia endomiocárdica identifica a los pacientes que más probablemente responda a los inmunosupresores.
TERAPIA INÉSPECÍFICA.
Varias medidas inespecíficas son importantes, incluyendo el tratamiento de la insuficiencia cardíaca y las arritmias de acuerdo a las guías actuales, evitar el ejercicio, y en casos seleccionados la anticoagulación.
Tratamiento de la insuficiencia cardíaca:
La insuficiencia cardíaca (IC) debe ser tratada con dieta baja en sodio, inducción de la diuresis de acuerdo a necesidad, e inhibidores de la enzima convertidora de angiotensina (iECA). Los beta bloqueantes pueden ser también útiles. En contraste, la digoxina aumenta la mortalidad en modelos animales.
El soporte circulatorio mecánico con balón de contrapulsación intraaórtico, o asistencia con sostén mecánico de VI (“Cardiopulmonary assist device and short-term left ventricular assist devices") debe ser considerado cuando la IC es intratable o cuando el shock cardiogénico no responde a la terapia médica. Varios reportes sugieren que en algunos pacientes estas medidas pueden ser un puente hasta la recuperación espontánea en las miocarditis fulminantes.
Evitar el ejercicio.
La actividad física debe ser restringida para reducir el trabajo del corazón durante la fase aguda de miocarditis, especialmente cuando hay fiebre, infección sistémica activa o IC.
Monitoreo electrocardiográfico.
El monitoreo electrocardiográfico puede permitir la detección temprana de arritmias asintomáticas pero potencialmente fatales, y/o defectos de conducción. Por esta razón, se recomienda a los pacientes con miocarditis aguda, sobre todo inestables que sean internados.
Arritmias.
Los pacientes con miocarditis aguda pueden desarrollar tanto taqui como bradiarritmias. Dado que estas arritmias se resuelven después de la fase aguda, la terapia es solo de sostén.
En 2006 el American College of Cardiology/American Heart Association/European Society of Cardiology (ACC/AHA/ESC) establecieron guías para el manejo de las arritmias ventriculares, y la prevención de la muerte súbita en pacientes con miocarditis:
• Terapia antiarrítmica no debe ser dada a pacientes con extrasístoles asintomáticas supraventriculares o para arritmias ventriculares no sostenidas asintomáticas.
• Las taquicardias supraventriculares (TSV), pueden inducir o agravar la insuficiencia cardíaca. Para la TSV se recomienda la restauración del ritmo sinusal es recomendado como approach inicial. Para las TVS recurrentes, las opciones de controlar la frecuencia y terapia antiarrítmica.
• Arritmias ventriculares sostenidas deben ser tratadas con cardioversión urgente, y las arritmias recurrentes deben ser tratadas con drogas antiarrítmicas.
• Taquicardia ventricular no sostenida puede ser tratada con drogas antiarrítmicas.
• Cuando la terapia antiarrítmica es necesaria, las opciones incluyen amiodarona, dofetilida (con precauciones por el efecto proarrítmico), y en pacientes que no están en insuficiencia cardíaca clase funcional IV, usar betabloqueantes o bloqueantes cálcicos.
• La colocación de un cardiodesfibrilador implantable puede ser beneficioso en pacientes con arritmias que ponen en peligro la vida, que no están en fase aguda de miocarditis, quienes reciben terapia médica óptima, y que tienen una expectativa de vida razonable, y buen status funcional.
• El bloqueo cardíaco completo y/o la bradicardia sintomática son indicaciones de marcapaseo durante la fase aguda de miocarditis. Estos trastornos de conducción a menudo son transitorios, por lo tanto la primera medida es colocar un marcapaso transitorio.
• Anticoagulación. Las complicaciones tromboembólicas pueden ocurrir cuando la insuficiencia cardíaca es severa o prolongada. El ecocardiograma es especialmente útil para la detacción de trombos intracardíacos, que si están presentes son una indicación de terapia anticoagulante. La anticoagulación puede ser también aconsejable como medida preventiva en otras causas de insuficiencia cardíaca crónica.
Es recomendable la terapia con warfarina en pacientes con fibrilación auricular o con ritmo sinusal que reunen los siguientes criterios:
• Insuficiencia cardíaca sintomática con una fracción de eyección de VI menor de 20%.
• Factores de riesgo para hemorragias mínimos.
• Un perfril hemodinámico sin evidencias de disfunción de la síntesis hepática.
El grado óptimo de anticoagulación es de grado moderado con RIN entre 2.0 y 3.0.
Otras modalidades terapéuticas.
• Administración de oxígeno es aconsejable en pacientes críticamente enfermos, ya que la hipoxia agrava las miocarditis experimentales.
• Restricción del alcohol a no más de una copa por día, ya que la ingesta de alcohol puede empeorar la severidad de las miocarditis.
• Transplante cardíaco en pacientes que se presentan con miocardiopatía intratable y fallo cardíaco persistente.
SEGUIMIENTO.
Como se dijo antes, la mayoría de los pacientes con miocarditis aguda tienen recuperación parcial o completa. En algunos casos, sin embargo, el proceso puede continuar subclínicamente, y a veces evolucionar a la MCD. La probabilidad de esta complicación tardía está aumentada en pacientes que se presentan con función disminuida de VI.
De acuerdo a eso, los pacientes deben ser seguidos inicialmente a intervalos de uno a tres meses. La actividad física, especialmente deportes competitivos, deben ser permitidos solo gradualmente, y la tolerancia monitoreada. El examinador, debe estar alerta a la persistencia o recurrencia de galope por R3 y R4. El ecocardiograma o el spect con radionúclidos deben ser usados para monitorear el tamaño de las cámaras cardíacas y la frección de eyección del VI. Medir la función cardíaca al mes, a los seis meses y después anualmente o cada vez que los síntomas así lo indiquen.
MIOCARDIOPATÍA PERIPARTO.
Introducción:
La miocardiopatía periparto (MCPP), también llamada miocardiopatía asociada al embarazo, es una rara causa de insuficiencia cardíaca que afecta a las mujeres tardíamente en el embarazo o en el puerperio temprano. Aunque fue inicialmente descripta en 1849, no fue reconocida como una entidad clínica hasta 1930.
La MCPP es un trastorno de etiología desconocida que tiene consecuencias potencialmente devastadoras. El tratamiento es similar a otros tipos de insuficiencia cardíaca con disfunción sistólica de VI. Sin embargo, modificaciones a la terapia standard son necesarias a menudo para asegurar la seguridad de la madre y del feto o del lactante.
Definición:
Son necesarios 4 criterios para el diagnóstico de MCPP:
• Desarrollo de insuficiencia cardíaca en los últimos meses del embarazo o dentro de los 5 meses de posparto.
• Ausencia de una causa identificable de insuficiencia cardíaca.
• Ausencia de enfermedad cardíaca reconocible anteriores a los últimos meses de embarazo.
• Disfunción sistólica de VI (por ejemplo fracción de eyección de VI menor de 45% o fracción de acortamiento reducida).
Tiempo de inicio:
Las mujeres que desarrollan miocardiopatía temprana en el embarazo no reúnen los criterios de para la definición de MCPP basados en el primer y el tercer criterios; sin embargo, el proceso de enfermedad probablemente sea el mismo.
Epidemiología:
La incidencia reportada de MCPP varía. En EE UU 1:15000 partos, Sud-África 1:1000, Haití 1:300 y en Zaire y Nigeria 1:100.
El amplio rango de incidencias puede reflejar la sobreestimación en estudios que se basan solamente en criterios clínicos. Se ha sugerido que en algunos estados Africanos, la entidad pueda confundirse con hipertensión e hipervolemia.
Etiología.
A pesar de muchos intentos de descubrir una etiología distintiva para la MCPP, la causa permanece siendo desconocida. No se ha reconocido un estado hormonal diferente en estas pacientes con MCPP, aún aunque los estrógenos, progesterona y prolactina, tienen efectos significativos sobre el sistema cardiovascular. Un número de otros factores pueden contribuir:
Citoquinas inflamatorias.
Las citoquinas inflamatorias pueden jugar un rol en la patogénesis y progresión de la miocardiopatía y la insuficiencia cardíaca. Las citoquinas que están elevadas en la MCPP comparadas con los controles incluyen: factor de necrosis tumoral (TNF)-alfa y la interleucina -6 (IL-6). Además, Fas/Apo-1, un receptor de señal de apoptosis, y la proteína C reactiva (PCR) están asociados con enfermedad más severa.
Miocarditis.
Un número de investigadores han sugerido a la miocarditis como una causa posible de MCPP. Pacientes con MCPP han mostrado evidencias de miocarditis en la BEM, asociado a necrosis y grados variables de hipertrofia y fibrosis. Se han encontrado evidencias de genoma viral en la BEM.
Respuesta inmune anormal.
Se ha sugerido que una respuesta inmunológica materna a un antígeno fetal puede conducir a MCPP. Algunas células fetales pueden pasar a la circulación materna y permanecen sin rechazo debido a una débil inmunogenicidad de parte del haplotipo paterno en las células quiméricas. Si esas células se alojan en el tejido cardíaco, pueden disparar una respuesta inmunológica autoinmune.
Altos títulos de anticuerpos, cuando se los compara con los controles, han sido descriptos contra las proteínas cardíacas humanas (incluyendo miosina), translocador de nucleótidos de adenina, y dehidrogenasa de alfa cetoácidos de cadena ramificada. Además, las inmunoglobulinas en pacientes con MCPP pueden ser significativamente diferentes en frecuencia y reactividad a aquellas de cohortes de MCD y donantes sanos.
Enfermedad familiar.
Se ha encontrado grupos de pacientes con MCPP en las mismas familias. Este hallazgo puede ser explicado por una razón genética o por factores ambientales.
Factores hemodinámicos.
Durante el embarazo, hay un significativo aumento del volumen sanguíneo y en el gasto cardíaco, lo cual resulta en un remodelado e hipertrofia transitorias del VI. Es posible que haya una exagerada disminución en la función sistólica en mujeres que desarrollan MCPP. El stress hemodinámico de la hipertensión gestacional, que es más común en las mujeres con MCPP, puede contribuir al desarrollo de insuficiencia cardíaca.
Factores de Riesgo.
Aunque la etiología de la MCPP permanece siendo inexplicada, un número de factores han estado asociados con aumento de riesgo. Estos factores son:
• Edad mayor de 30 años.
• Multiparidad.
• Descendencia Africana.
• Embarazo con múltiples fetos.
• Un antecedente de preeclampsia, eclampsia, o hipertensión postparto.
• Abuso materno de cocaína.
• Largo tiempo de uso de terapia tocolítica con beta adrenérgicos tal como la terbutalina (más de 4 semanas).
Hay datos conflictivos acerca de si la deficiencia de selenio es o no un factor de riesgo para MCPP.
Manifestaciones Clínicas.
La MCPP es raramente observada antes de las 36 semanas de gestación, y las pacientes afectadas usualmente se presentan durante los primeros cuatro a cinco meses del postparto. Esto contrasta con la mujer embarazada con enfermedad cardíaca de base (isquémica, valvular o miopática), la que tiende a desarrollar síntomas de insuficiencia cardíaca durante el segundo trimestre de la gestación, coincidiendo con la mayor carga hemodinámica impuesta por el estado grávido.
Las pacientes se quejan principalmente de disnea; otros síntomas frecuentes incluyen tos, ortopnea, disnea paroxística nocturna, y hemoptisis. Un estado de fatiga inespecífica, malestar precordial, o dolor abdominal pueden confundir la evaluación inicial debido a la ocurrencia de estos síntomas normalmente durante el embarazo.
Las embolias sistémicas y pulmonares son más comunes en MCPP que en otros tipos de miocardiopatías, probablemente debido a que al riesgo asociado a la miocardiopatía, se agrega el estado hipercoagulable inducido por el embarazo.
Diagnóstico.
Como se dijo antes, el diagnóstico de MCPP se basa en los cuatro criterios mencionados antes:
• Desarrollo de insuficiencia cardíaca en los últimos meses del embarazo o dentro de los 5 meses de posparto.
• Ausencia de una causa identificable de insuficiencia cardíaca.
• Ausencia de enfermedad cardíaca reconocible, anteriores a los últimos meses de embarazo.
• Disfunción sistólica de VI (por ejemplo fracción de eyección de VI menor de 45% o fracción de acortamiento reducida.
El último criterio fue agregado para prevenir la inclusión de pacientes con trastornos que mimetizan la insuficiencia cardíaca. Tales trastornos incluyen: hipertensión acelerada, disfunción diastólica, infección sistémica, embolismo pulmonar, o complicaciones del embarazo en si mismo (por ejemplo preeclampsia, o embolia de líquido amniótico).
Un electrocardiograma (ECG) y un ecocardiograma deben ser llevados a cabo en pacientes sospechadas de padecer MCPP. Otros estudios tales como cateterismo cardíaco, Rx de tórax, biopsia endomiocárdica (BEM), y serologías para virus pueden ser seleccionadas en casos particulares.
Electrocardiograma.
Los hallazgos ECG incluyen: taquicardia sinusal (o raramente fibrilación auricular), anormalidades inespecíficas del ST y de la onda T, y anormalidades del voltaje (bajo voltaje o criterios de hipertrofia ventricular izquierda). Las ondas Q están ocasionalmente presentes en las derivaciones precordiales. Los intervalos PR y QRS pueden estar prolongados.
Ecocardiograma.
El ecocardiograma usualmente revela una reducción global en la contractilidad, y agrandamiento del VI sin hipertrofia (Figura 5). La aplicación de las mediciones con Doppler, hace generalmente innecesaria la cateterización cardíaca innecesaria en la mayoría de las pacientes.
Figura 5. Ecocardiograma en Miocardiopatía Periparto.
Vista de cuatro cámaras de un ecocardiograma bi-dimiensional de una paciente con disfunción ventricular izquierda persistente después del embarazo, que muestra dilatación auricular y ventricular izquierdas. Hay un trombo en el apex ventricular.
El umbral de agrandamiento del VI y la disfunción necesaria para diagnosticar MCPP no han sido definidos con precisión. La siguiente definición, está basada en un workshop de la NHLBI en 1992 para miocardiopatías dilatadas (MCD) idiopáticas, ha sido propuesto:
• Fracción de eyección de VI menor de 45% y/o fracción de acortamiento menor de 30%
MAS
• Dimensiones finales diastólicas de VI mayores de 2,7 cm/m2.
Aunque la mayoría de los cardiólogos considerarían miocardiopatía una reducción de menos de 50% de la fracción de eyección de VI, esto no reuniría los criterios estrictos para MCPP.
Otros posibles hallazgos ecocardiográficos incluyen:
• Heterogeneidades regionales de la pared engrosada en sístole.
• Agrandamiento auricular izquierdo.
• Regurgitación mitral o tricuspídea.
• Pequeño derrame pericárdico.
Radiografía de tórax
La Rx de tórax muestra típicamente agrandamiento de la silueta cardíaca con evidencias de congestión venosa pulmonar, y/o intersticial, y, en ocasiones, derrame pleural. Sin embargo, una Rx de tórax no es necesaria para el diagnóstico de MCPP, y su uso es desaconsejado si la mujer está todavía embarazada. Si a pesar del examen físico, el diagnóstico de edema de pulmón es incierto y es necesaria una Rx de tórax, hay que discutir la opción con la paciente, y en todo caso realizarla con protección del feto.
Cateterización cardíaca.
La cateterización derecha es raramente necesaria debido a que la medida de presiones cardíacas puede hacerse por ecocardiograma con Doppler. Puede ser útil en pacientes críticamente enfermas que necesitan una evaluación más completa o una evaluación constante de su estado hemodinámico.
La cateterización izquierda con angiografía coronaria es sólo necesaria en pacientes con factores de riesgo significativos para enfermedad coronaria, para descartar cardiopatía isquémica como causa de la miocardiopatía. Como con la Rx de tórax, la fluoroscopía debe ser discutida con la paciente, y de realizarla debe hacerse con protección fetal.
Biopsia endomiocárdica.
El rol de la BEM permanece no muy claro. Como se dijo antes, una proporción variable de pacientes tienen evidencias de miocarditis. Otros hallazgos histológicos en la MCPP pueden incluir hipertofia miofibrilar y/o degeneración, fibrsis, y edema intersticial.
No hay hallazgos patognomónicos en la MCPP y hay un riesgo inherente a la realización de una BEM, por lo tanto, es un elemento diagnóstico usado con indicaciones muy precisas.
Estudios virales y bacterianos.
El rol de los cultivos virales y bacterianos, así como el estudio de los títulos virales seleccionados (por ejemplo Coxsackie B) no están claros. Los resultados de esos tests son inespecíficos y tienen valor pronóstico limitado en pacientes con miocarditis.
Tratamiento.
El tratamiento de la MCPP es similar al de otras causas de insuficiencia cardíaca. Elementos terapéuticos adicionales incluyen la anticoagulación y el manejo de las arritmias. La inmunosupresión, y la terapia con inmunoglobulinas han sido evaluados, aunque el rol de esos tratamientos en la MCPP no ha sido establecido.
Las medidas terapéuticas incluyen:
• Optimización hemodinámica.
• Alivio de los síntomas.
• Cuando sea posible, las terapias crónicas que mejoran el resultado a largo plazo.
Las consideraciones terapéuticas que hay que realizar en pacientes con MCPP son:
• Evitar los IECA.
Los inhibidores de la enzima convertidora están contraindicados en cualquier momento del embarazo debido al riesgo de efectos adversos fetales.
• Diuréticos.
Los diuréticos se administran para aliviar la congestión pulmonar y el marcado edema periférico del embarazo Se ha reportado una diátesis hemorrágica e hiponatremia en neonatos de mujeres que tomaban diuréticos tiazídicos durante el embarazo.
• Digoxina.
Aunque no es una terapia de primera línea en la mayoría de los casos, la digoxina es apropiada para casos seleccionados de insuficiencia cardíaca, y puede ser particularmente útil en pacientes con MCPP por dos razones:
1) el uso imposible de terapias convencionales para la insuficiencia cardíaca como IECA, inhibidores del receptor de angiotensina, o beta bloqueantes en el embarazo, y
2) las demandas fisiológicas aumentadas durante el embarazo puede exacerbar los síntomas de insuficiencia cardíaca. La digoxina es segura en el embarazo. Pequeñas cantidades de digoxina se excretan por la leche materna, aunque no han sido reportados efectos adversos.
• Vasodilatadores.
Dado que los IECA y los inhibidores del receptor de angiotensina están contraindicados en el embarazo, la hidralazina es la droga de elección cuando se requiere terapia vasodilatadora oral antes del parto. Se ha usado muchos años en la hipertensión del embarazo y parece ser segura tanto para la madre como para el feto. Cuando se requiere terapia vasodilatadora intravenosa en pacientes con severa insuficiencia cardíaca descompensada, se aconseja el uso de nitroglicerina. También pueden usarse nitroprusiato y nesiritide, aunque debido a sus potenciales efectos tóxicos sólo deben ser usados cuando han fracasado las otras opciones.
• Beta-bloqueantes.
Los beta-bloqueantes son generalmente seguros durante el embarazo, aunque efectos adversos han sido reportados. En general se prefiere los beta 1 selectivos ya que estos agentes menos probablemente interferirán con la relajación uterina mediada por beta 2, y la vasodilatación periférica. Los infantes nacidos de madres tratadas con esas medicaciones deben ser observados por 72 a 96 horas después del parto. Los beta bloqueantes no deben comenzar a administrarse en la fase de insuficiencia cardíaca descompensada, pero son un importante componente en el régimen terapéutico crónico de pacientes con insuficiencia cardíaca debidas a disfunción sistólica.
• Antagonistas de la aldosterona.
Los antagonistas de la aldosterona aldosterona y eplerenona, en la terapia crónica, prolongan la sobrevida en pacientes seleccionados con insuficiencia cardíaca. Sin embargo, no hay datos ni experiencia clínica que apoyen la seguridad de estos agentes durante el embarazo. Por lo tanto no deben ser usados por ahora durante esta etapa.
• Inotrópicos.
Algunas pacientes con insuficiencia cardíaca descompensada e hipotensión se benefician del soporte inotrópico intravenoso. Cada una de las drogas inotrópicas (dobutamina, dopamina, milrinona) tienen propiedades levemente diferentes así como diferentes riesgos relacionados con el embarazo. Se utilizan en insuficiencia cardíaca que no responde a la terapéutica.
• Vasopresores.
Los vasopresores (norepinefrina, fenilefrina), normalmente son evitados en pacientes con insuficiencia cardíaca, dado que estos pacientes, usualmente tienen alta resistencia vascular sistémica, y un mayor aumento de la misma puede deteriorar el gasto cardíaco. En las mujeres embarazadas, los vasopresores conllevan el riesgo adicional de disminuir el flujo sanguíneo uterino. En pacientes críticamente enfermas, hipotensas, sin embargo, la presión sanguínea necesita ser sostenida, y en esas situaciones tendrían indicación estos agentes.
Arritmias ventriculares.
Las arritmias ventriculares deben ser tratadas agresivamente con terapias farmacológicas y no farmacológicas. Este artículo no desarrollará el tipo de drogas usadas en el embarazo, pero digamos que las más utilizadas son la adenosina, beta bloqueantes, digital, bloqueantes cálcicos, quinidina disopiramida, procainamida, lidocaína, mexiletina, flecainida, propafenona, ibutilida, sotalol y amiodarona, esta última con precaución, ya que puede producir hipotiroidismo neonatal. De las terapias no farmacológicas, según estén indicadas, se usan la ablación por radiofrecuencia, la cardioversión eléctrica, y en algunos casos puede estar indicada la colocación de un cardiodesfibrilador implantable.
Anticoagulación.
Las pacientes con MCPP están en alto riesgo de formación de trombos y tromboembolismo debido al estado hipercoagulable del embarazo, asociado a la estasis de la sangre debida a disfunción severa del VI. Así, los clínicos deben considerar el uso de la anticoagulación en esas pacientes, particularmente cuando la disfunción de VI sea severa (por ejemplo fracción de eyección de VI menor a 30%).
La elección de un régimen de anticoagulación en una mujer embarazada es un desafío debido a los potenciales efectos teratogénicos y a la complejidad del uso de los diferentes agentes que no serán tratados aquí.
Agentes inmunosupresores.
Ocasionalmente se han usado en pacientes con MCPP y miocarditis probada por biopsia, pero su eficacia no es clara. La inmunosupresión empírica, en ausencia de evidencias, no es recomendada, ya que la mayoría de los casos reportados tienen hallazgos inespecíficos en la biopsia. Esas drogas, a menudo tienen efectos colaterales significativos, y los estudios en otras formas de miocarditis no han mostrado beneficios claros de la terapia inmunosupresora.
Inmunoglobulina intravenosa.
La inmunoglobulina intravenosa se ha usado en pacientes con miocarditis o miocardiopatía recientemente dilatada y no ha mostrado beneficios claros. En MCPP mostró leve beneficio, aunque no significativo debido al tamaño de las muestras.
Bromocriptina.
Hay reportes de casos que han sugerido posibles beneficios a la terapia con bromocriptina en pacientes con MCPP. Esta estrategia de tratamiento está basada en observaciones experimentales de prevención de MCPP en ratones, vía bloqueo de la prolactina con bromocriptina. Sin embargo, hay datos insuficientes para establecer la seguridad o eficacia de la bromocriptina en MCPP.
Transplante cardíaco.
El transplante cardíaco es a menudo el único tratamiento aceptable para una mujer en quien la terapia convencional no es exitosa. Estudios antiguos encontraron que el transplante fue llevado a cabo en hasta un tercio de las mujeres con MCPP. Sin embargo, en reportes más contemporáneos, el transplante fue requerido en sólo 4 a 7% de las pacientes. La asistencia con dispositivos mecánicos como un puente hasta el transplante ya fue tratado antes.
Pronóstico.
El pronóstico de la MCPP debe tener en cuenta la evolución materna, y las consecuencias obstétricas y neonatales, así como los efectos en embarazos subsecuentes.
Resultados maternos. La serie más grande que evaluó este aspecto es de 123 casos de MCPP, mostró 4% de necesidad de transplante y una tasa de mortalidad de 10% en el seguimiento a 2 años. Resultados similares mostraron las series del Johns Hopkins, con 6% de mortalidad a los 5 años y necesidad de transplante de 7% a 8,6 años.
La muerte por MCPP es usualmente causada por fallo de bomba progresivo, muerte súbita, o eventos tromboembólicos.
Los siguientes factores de pronóstico adverso han sido identificados en diferentes estudios:
• Peor clase funcional de la New York Heart Association.
• Mujeres negras.
• Multiparidad.
Entre las mujeres que no murieron ni requirieron transplante en el estudio de 123 pacientes, el promedio de la fracción de eyección de VI, aumentó de 28% al diagnóstico a 46% en 2 años. La recuperación de la fracción de eyección de VI por encima de 50% ocurrió en 54% de los pacientes, y el grado de recuperación fue mayor en aquellas con una fracción de eyección de VI basal de más de 30%. Un cardiodesfibrilador implantable o un marcapaso permanente fueron requeridos en 3 y 2% de las pacientes respectivamente. En este y en otros estudios, la recuperación de la unción del VI ocurrió a los seis meses después del diagnóstico.
Los factores predictores de disfunción persistentes de de VI son los siguientes:
• Fracción de eyección de VI igual o menor de 30%.
• Acortamiento fraccional de menos de 20% y dimensiones final diastólica de VI de igual o más de 6 cm.
• Troponina T elevada.
No está claro si la mujer con MCPP tiene un pronóstico diferente a la mujer embarazada con otro tipo de miocardiopatía.
Efectos obstétrico y neonatales.
En estos puntos los datos son más limitados. En el reporte de 123 pacientes, el parto por cesárea fue llevado a cabo en 40% de las pacientes, mayormente por indicaciones obstétricas. La prematurez (menos de 37 semanas) ocurrió en 25%, el promedio de peso al nacimiento fue de 3,1 kg (rango de 1,4 a 5,0 kg), y 5,9% de los infantes eran pequeños para la edad. Hubo dos fetos muertos, una muerte neonatal, y cuatro recién nacidos con defectos congénitos.
Embarazos subsecuentes.
El riesgo asociado a embarazos subsecuentes en mujeres con historia de MCPP no está claro. Los datos disponibles de varias series de casos sugieren que el riesgo de complicaciones es alto, particularmente en aquellas mujeres que no tuvieron una recuperación completa de la función del VI.
Recuperación de la función del VI.
Entre las mujeres en quienes la función del VI volvió a lo normal, el riesgo de embarazos subsecuentes parece menor que el de aquellas con disfunción persistente de la función del VI, pero elevada respecto a la población general.
Algunas mujeres que recuperan la función de VI después de un episodio inicial de MCPP, tienen una declinación progresiva de la función del VI en embarazos subsecuentes. Esas mujeres deben ser aconsejadas acerca de los potenciales riesgos antes de embarazarse, y si se embarazan, realizar un monitoreo de los signos de disfunción VI.
Disfunción persistente de VI.
Los riesgos potenciales de embarazos subsecuentes en mujeres que tienen disfunción persistente de VI parece ser sustancial.
Así, aunque algunas mujeres puedan tolerar embarazos subsecuentes, aquellas que presentan disfunción de VI persistente deben ser aconsejadas a evitar embarazos debido al riesgo de progresión de la insuficiencia cardíaca y muerte.
Hay reportes anecdóticos de embarazos exitosos post transplante cardíaco por MCPP. Además de los problemas relacionados con el embarazo después de un transplante cardíaco por cualquier razón, las mujeres que han sido transplantadas por MCPP están en riesgo de fallo del injerto debido a recurrencia de la enfermedad, por lo que deben ser fuertemente aconsejadas a evitar futuros embarazos hasta que se reciban mayores datos.
Fuente:
UpToDate.
Emedicine.com
The New England Journal of Medicine.
Presentó la Dra. Florencia Gonzalez.
Residente de Clínica Médica.
Hospital Municipal de Azul.