|
| Hospital Dr. Angel Pintos de Azul. |
Paciente varón de 61 años.
MOTIVO DE INTERNACIÓN:Se interna el 23/07/2010 por lumbalgia y fiebre.
ENFERMEDAD ACTUAL:Treinta días antes de la actual internación presentó un episodio de infección urinaria alta, que cursó con lumbalgia y fiebre de 39º C, con rescate de S. aureus meticilino sensible, tratado con norfloxacina + trimetoprima/sulfametoxazol. A pesar del tratamiento antibiótico, el paciente, persistió con fiebre y dolor lumbar durante 2 semanas, por lo que es derivado desde una localidad vecina al Hospital Municipal de Azul con diagnóstico presuntivo de espondilodiscitis, para confirmación diagnóstica, realización de estudios de imágenes y tratamiento.
ANTECEDENTES PERSONALES Y FAMILIARES:Hace 8 años presentó fractura traumática de tibia y peroné derechos que debió ser intervenida quirúrgicamente, con colocación de clavos medulares. Posteriormente presentó complicación infecciosa de la fractura por lo que debieron ser extraídos los clavos, y debió recibir tratamiento antibiótico prolongado. No presentó secuelas de dicha fractura, ni presenta dolor actual a ese nivel.
Resto de los antecedentes sin importancia.
EXAMEN FÍSICO:Paciente febril (cursa día 14º de fiebre), con lumbalgia de moderada a severa, con irradiación ciatálgica izquierda. El dolor no calma con el reposo, y es dolorosa la movilización aún en la cama.
No hay alteraciones en la sensibilidad ni de la fuerza en miembros inferiores, con reflejos osteotendinosos normales. Es dolorosa la percusión de la columna a nivel de L3, L4, L5 y sacro, así como la región de la articulación sacroilíaca izquierda, con maniobras para sacroilíaca izquierda positivas.
La región de la antigua fractura de tibia y peroné no presenta eritema, calor, flogosis, no duele la palpación de esa zona, y no impresiona como probable foco infeccioso primario.
Piel y Tejido Celular Subcutáneo:No hay edemas ni hay focos sugestivos de infección primaria dermatológica, piodermitis, forúnculos etc.
Aparato Cardiovascular: TA 140/80, frecuencia cardíaca 90 por minuto. No hay soplos.
Aparato Respiratorio: s/p.
Abdomen: Blando depresible indoloro, no hay adenomegalias, puntos ureterales negativos.
Aparato Genitourinario: s/p.
LABORATORIO:Gr: 4360000. Gb: 11700. 75% NS. VSG (eritrosedimentación globular): 100 mm/hora.
Función renal y hepática normales. Electrolitos normales.
Hemocultivos: 1 de 2 positivo para S. aureus meticilino sensible del mismo perfil de sensiblidad que el que presentaba en la vía urinaria.
Proteinograma electroforético: hipergamaglobulinemia policlonal. Calcemia normal.
Rx de columna: signos de espondiloartrosis inespecíficos.
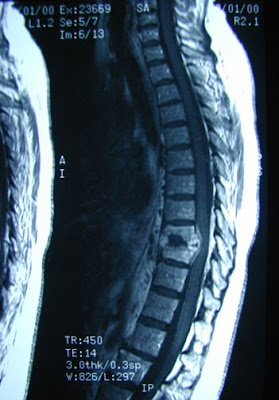
RMN: “Cambio de señal en cuerpos vertebrales L4 y L5 con despegamiento del espacio epidural en la región anterior del canal raquídeo con compresión del saco y reducción neuroforaminal bilateral (proceso inflamatorio?)”(Figuras).
MOTIVO DE INTERNACIÓN:Se interna el 23/07/2010 por lumbalgia y fiebre.
ENFERMEDAD ACTUAL:Treinta días antes de la actual internación presentó un episodio de infección urinaria alta, que cursó con lumbalgia y fiebre de 39º C, con rescate de S. aureus meticilino sensible, tratado con norfloxacina + trimetoprima/sulfametoxazol. A pesar del tratamiento antibiótico, el paciente, persistió con fiebre y dolor lumbar durante 2 semanas, por lo que es derivado desde una localidad vecina al Hospital Municipal de Azul con diagnóstico presuntivo de espondilodiscitis, para confirmación diagnóstica, realización de estudios de imágenes y tratamiento.
ANTECEDENTES PERSONALES Y FAMILIARES:Hace 8 años presentó fractura traumática de tibia y peroné derechos que debió ser intervenida quirúrgicamente, con colocación de clavos medulares. Posteriormente presentó complicación infecciosa de la fractura por lo que debieron ser extraídos los clavos, y debió recibir tratamiento antibiótico prolongado. No presentó secuelas de dicha fractura, ni presenta dolor actual a ese nivel.
Resto de los antecedentes sin importancia.
EXAMEN FÍSICO:Paciente febril (cursa día 14º de fiebre), con lumbalgia de moderada a severa, con irradiación ciatálgica izquierda. El dolor no calma con el reposo, y es dolorosa la movilización aún en la cama.
No hay alteraciones en la sensibilidad ni de la fuerza en miembros inferiores, con reflejos osteotendinosos normales. Es dolorosa la percusión de la columna a nivel de L3, L4, L5 y sacro, así como la región de la articulación sacroilíaca izquierda, con maniobras para sacroilíaca izquierda positivas.
La región de la antigua fractura de tibia y peroné no presenta eritema, calor, flogosis, no duele la palpación de esa zona, y no impresiona como probable foco infeccioso primario.
Piel y Tejido Celular Subcutáneo:No hay edemas ni hay focos sugestivos de infección primaria dermatológica, piodermitis, forúnculos etc.
Aparato Cardiovascular: TA 140/80, frecuencia cardíaca 90 por minuto. No hay soplos.
Aparato Respiratorio: s/p.
Abdomen: Blando depresible indoloro, no hay adenomegalias, puntos ureterales negativos.
Aparato Genitourinario: s/p.
LABORATORIO:Gr: 4360000. Gb: 11700. 75% NS. VSG (eritrosedimentación globular): 100 mm/hora.
Función renal y hepática normales. Electrolitos normales.
Hemocultivos: 1 de 2 positivo para S. aureus meticilino sensible del mismo perfil de sensiblidad que el que presentaba en la vía urinaria.
Proteinograma electroforético: hipergamaglobulinemia policlonal. Calcemia normal.
Rx de columna: signos de espondiloartrosis inespecíficos.
RMN: “Cambio de señal en cuerpos vertebrales L4 y L5 con despegamiento del espacio epidural en la región anterior del canal raquídeo con compresión del saco y reducción neuroforaminal bilateral (proceso inflamatorio?)”(Figuras).
RMN. Se observa cambio de intensidad de señal en discos de L4 y L5. No se observa un compromiso discal franco.
RMN. Se observa un esbozo de protrusión del espacio epidural por hernia discal o absceso epidural incipiente.
Figura 2.
RMN con realce de contraste en T1 en una mujer de 55 años que muestra discitis torácica con absceso epidural asociado y compresión de médula espinal. Debido a la compresión medular, esta paciente debió ser sometida a descompresión quirúrgica.
DIAGNÓSTICO.El diagnóstico de osteomielitis vertebral es dificultoso en algunos pacientes, y relativamente fácil en otros. No es infrecuente que el dolor sea atribuido a traumatismos menores u otras causas, particularmente en pacientes sin factores de riesgo para osteomielitis, tales como uso de drogas intravenosas, endocarditis, cirugía espinal previa, diabetes, terapia con corticosteroides, u otros estados de inmunocompromiso.
La osteomielitis vertebral es usualmente sospechada en base a la sintomatología clínica y los hallazgos anormales en las imágenes radiológicas, de RMN o de scan con radionúclidos; es usualmente confirmada por aspiración del espacio del disco intervertebral infectado (discitis) o del hueso vertebral.
HEMOCULTIVOS.Los hemocultivos son positivos en hasta el 50 a70% de los pacientes con osteomielitis vertebral. Ellos deben ser obtenidos en todos los pacientes con sospecha de osteomielitis vertebral, dado que los hemocultivos positivos pueden obviar la necesidad de tests diagnósticos invasivos.
IMÁGENES.
RADIOGRAFÍAS:La radiografía simple es a menudo normal cuando es obtenida en las fases tempranas de la infección. Los hallazgos típicos en la osteomielitis consiste en cambios destructivos de dos cuerpos vertebrales contiguos con colapso del espacio del intervertebral. Sin embargo, la destrucción ósea puede no ser aparente por dos o tres semanas, y a veces más, después del inicio de los síntomas. Raramente las infecciones están confinadas a una vértebra y produce colapso del cuerpo vertebral, que mimetiza una fractura vertebral por compresión. Figura 3.
Figura 3.
TAC en un paciente con discitis que muestra la destrucción extensiva a los platillos vertebrales. Nótese la preservación de los elementos posteriores, incluyendo las facetas articulares, la lámina, y la apófisis espinosa. Esto es el hallazgo común en una discitis piogénica y menos común en tuberculosis (enfermedad de Pott).
Figura 4. Punción Aspiración y Biopsia del Disco Intervertebral Guiado por Radioscopía
Procedimiento de punción aspiración del disco con aguja guiado por radioscopía. Esta imagen muestra los sutiles cambios de la espondilodiscitis en la radiografía. Aunque la pérdida temprana de altura del espacio discal puede estar presente, no se ve erosión definida del platillo vertebral. Los hallazgos de RMN en este caso mostraron evidencias de infección, y el cultivo del aspirado fue positivo para Staphylococcus aureus.

Figura 5. Punción Aspiración y Biopsia del Disco Guiada por TAC.
Trayectoria de la aguja en la biopsia de un disco intervertebral infectado guiada por TAC. Debe haber especial cuidado de evitar el saco tecal y las raíces nerviosas.
TÉCNICAS BASADAS EN AMPLIFICACIÓN DE DNA.
Las técnicas basadas en el análisis del DNA del material aspirado del disco se correlacionan bien con los métodos de cultivos tradicionales. Sin embargo, estas técnicas deben ser reservadas para una minoría de pacientes en quienes la reaspiración y los cultivos microbiológicos de rutina no han podido detectar el agente causal. La contaminación con flora de piel, es un problema para las técnicas basadas en amplificación de DNA.
SÍNTESIS DEL ABORDAJE DIAGNÓSTICO SUGERIDO.
La evaluación inicial de la mayoría de los pacientes con sospecha de osteomielitis vertebral incluye: examen físico, VSG, hemocultivos, y radiografías de las zonas dolorosas de la columna. Los pacientes deben ser cuidadosamente interrogados acerca de posibles factores predisponentes o elementos como enfermedades de base, internaciones previas, procedimientos invasivos, uso de inyecciones intravenosas, y viajes.
Si hay dolor localizado en columna y/o VSG acelerada, y si las radiografías son negativas, usualmente se obtiene una RMN para evaluar la posibilidad de osteomielitis. Un scan con radionúclidos se realiza sólo en pacientes seleccionados con esos elementos clínicos y en quienes no se puede realizar RMN. Si cualquiera de estos métodos de imagen muestra cambios típicos sugestivos de osteomielitis vertebral, se debe proceder a punción aspiración biopsia con aguja guiada por TAC del hueso afectado. La muestra obtenida se envía para examen histológico y para cultivos para bacterias aeróbicas, anaeróbicas, hongos y micobacterias.
En pacientes con hallazgos clínicos y radiográficos típicos de osteomielitis vertebral y con hemocultivos positivos para patógenos probables como S. aureus, bacilos Gram-negativos, o P. aeruginosa, la biopsia aspiración con aguja puede no ser necesaria.
Si los hemocultivos y los resultados microbiológicos del material aspirado con aguja son negativos, y la sospecha clínica e imagenológica de osteomielitis vertebral sigue siendo alta, se puede llevar a cabo una segunda biopsia. Si esta segunda muestra es también negativa, se debe iniciar la terapia empírica dirigida a Gram-positivos (especialmente S. aureus), y Gram-negativos. Si esta terapia empírica no resulta en una mejoría clínica objetiva en tres a cuatro semanas, una tercera biopsia con aguja o una cirugía abierta debe ser llevada a cabo. Hay otras autoridades que indican cirugía abierta ante el primer set de cultivos negativos.
EVALUACIÓN PARA ENDOCARDITIS:
En pacientes seleccionados es necesario un abordaje diagnóstico para descartar endocarditis infecciosa. Un estudio de 91 casos de osteomielitis vertebral (excluyendo tuberculosis, brucelosis, pacientes con hemocultivos negativos, y casos posquirúrgicos) identificó 28 pacientes (31 %) con endocarditis infecciosa (EI) . Cuando los pacientes con y sin EI fueron comparados, los siguientes factores de riesgo estuvieron asociados significativamente en aquellos que tenían EI:
• Condiciones cardíacas predisponentes.
• Fallo cardíaco.
• Hemocultivos positivos.
• Infección debida a organismos Gram-positivos.
La osteomielitis vertebral sin EI fue más común en pacientes con infecciones del tracto urinario, o con infección por gérmenes Gram-negativos.
Aunque la duración de la terapia de la osteomielitis vertebral es no menos de 6 semanas, también sería adecuado para tratar una EI, la importancia de identificar una EI coexistente es que el paciente con EI requiere ulterior seguimiento para evaluar posible daño valvular y antibióticoterapia profiláctica frente a procedimientos que puedan producir bacteriemia.
Esos hallazgos sugieren que los pacientes con osteomielitis vertebral que presentan algún factor predisponente de EI de los mencionados arriba, deben ser evaluados con ecocardiografía.
DIFICULTADES Y ERRORES EN EL MANEJO:
Las siguientes advertencias son aplicables al diagnóstico y manejo de las osteomielitis vertebrales:
• El dolor vertebral (dorsalgia o lumbalgia) de la osteomielitis vertebral puede responder inicialmente al reposo en cama y a medidas conservadoras, llevando a la interpretación errónea de que se trata de una lumbalgia aguda de esfuerzo u otra causa no infecciosa.
• Un antecedente de enfermedad degenerativa de columna o un trauma reciente pueden oscurecer o hacer que se retrase el diagnóstico.
• Estudios radiográficos incluyendo RMN y TAC pueden dar resultados falsos negativos, particularmente si son llevados a cabo tempranamente en el curso de la enfermedad.
• Las radiografías simples, la TAC, y la RMN pueden ir empeorando sus hallazgos, aún varias semanas después de la iniciación de la terapia que será finalmente exitosa.
• La osteomielitis vertebral raramente ocurre sin compromiso característico del disco intervertebral. En casos donde el disco está respetado, puede erróneamente diagnosticarse cáncer o fractura compresiva.
TRATAMIENTO.
El tratamiento con antibióticos y raramente también con cirugía conducen en la mayoría de los casos a la curación de los pacientes con osteomielitis vertebral. El diagnóstico precoz y un cuidadoso seguimiento en la búsqueda de signos de extensión a partes blandas, abscesos paraespinales, y compresión medular son de gran importancia. La respuesta a la terapéutica es mejor evaluada con los síntomas y la medida seriada de la VSG y de la PCR, más que con seguimiento con imágenes.
TRATAMIENTO ANTIMICROBIANO.
La mayoría de los casos de osteomielitis vertebral responden al tratamiento antimicrobiano. Sin embargo, algunos pacientes requieren además, cirugía.
No hay ensayos randomizados controlados que hayan evaluado regímenes para osteomielitis vertebral. Los regímenes se basan en los resultados de los hemocultivos y de la biopsia del espacio discal. La decisión de comenzar o esperar para comenzar una terapia empírica antes de los cultivos, se basa en cada caso particular. Debido a que la terapia de esta infección es prolongada y debido a que puede haber necesidad de repetir la biopsia si esta es negativa (por ejemplo debido a un error de toma de muestra), se aconseja generalmente esperar hasta el resultado de los cultivos mientras los pacientes están estables.
Si los cultivos de sangre y la punción biopsia repetida son negativos, y la sospecha clínica de osteomielitis vertebral sigue siendo alta en base a la clínica y a los hallazgos de imágenes, se debiera comenzar con antibióticoterapia empírica dirigida contra los organismos que más probablemente causen infección en este contexto (por ejemplo estafilococos, estreptococos, y bacilos Gram-negativos).
Rutinariamente se administran antibióticos por vía parenteral, con excepción de infecciones documentadas debidas a bacilos Gram-negativos sensibles a fluorquinolonas. La terapia con fluoroquinolonas orales puede ser usada en osteomielitis por bacilos Gram-negativos tempranas, si el microorganismo tiene alta sensibilidad en los tests de susceptibilidad, y si la compliance a la tolerancia y la adherencia a la terapia oral puede ser monitoreada.
TRATAMIENTOS ESPECÍFICOS DE ACUERDO A RESCATES:
Estafilococos s/p.
Si se trata de un estafilococo sensible a meticilina, se recomienda nafcilina, oxacilina (1,5 gr IV cada 4 horas); si es meticilino resistente se recomienda vancomicina (30 mg/kg/24 hs en dos dosis iguales, no excediendo de 2 gr/día a menos que las concentraciones en suero sean inapropiadamente bajas.
Estreptococos s/p.
Si el estreptococo es muy sensible a penicilina (CIM de menos de 0,12 mcg/mL) se recomienda tratamiento con ceftriaxona (1 a 2 g IV cada 24 hs) o penicilina G (12 a 18 millones U/día por infusión continua o en seis dosis divididas.
Si el estreptococo tiene una sensibilidad intermedia o es totalmente resistente a penicilina, generalmente se lo trata con ceftriaxona o mayores dosis de penicilina (24 millones de U/día por infusión continua o en seis dosis divididas.
Bacilos Gram-negativos.
La elección de un agente específico para terapia empírica, debe basarse en el conocimiento de los patógenos prevalentes (y patrones de sensibilidad) dentro de un contexto hospitalario. El tratamiento inicial con uno de los siguientes es apropiado:
• Cefalosporinas de tercera generación (ceftriaxona 1 a 2 g IV diarios o ceftazidima r g IV cada 8 horas, o cefotaxima 2 g IV cada seis horas).
• Cefalosporinas de cuarta generación (cefepime 2 g IV cada 12 horas).
• Fluoroquinolonas (ciprofloxacina 400 mg cada 12 horas o 500 a 750 mg por vía oral cada 12 horas).
TERAPIA PARA OSTEOMIELITIS CULTIVOS NEGATIVAS.
Un régimen apropiado es vancomicina (30 mg/kg cada 24 hs a menos que las concentraciones séricas sean inapropiadamente bajas), más una de los siguientes: cefotaxime (2 gr cada seis horas), ceftazidime ( 1 a 2 g IV cada 12 horas), ceftriaxona (1 a 2 g IV diarios), cefepime (2 g IV cada 12 horas), o ciprofloxacina (400 mg IV cada 12 horas, o 500 a 750 mg por vía oral cada 12 horas).
Los anaerobios son raros patógenos en pacientes con osteomielitis vertebral, y no se debe agregar cobertura para anaerobios en la terapia empírica inicial. Tal cobertura que puede ser brindada por ticarcilina-clavulánico (3,1 g IV cada seis horas) o agragando metronidazol 500 mg IV cada 6 horas) a una terapia combinada, deben darse en dos situaciones:
1) si los hallazgos clínicos son sugestivos de infección por anaerobios (por ejemplo pacientes con abscesos intraabdominales), o
2) si el Gram es positivo y no existe desarrollo en los cultivos.
Si la terapia empírica no resulta en un mejoramiento clínico objetivo en tres a cuatro semanas, una tercer biopsia con aguja percutánea o cirugía abierta deben ser llevadas a cabo.
ROTACIÓN A MEDICACIÓN ORAL.
Si hay buena respuesta clínica a la terapia parenteral, después de varias semanas de terapia intravenosa, se debe considerar el cambio a la vía oral. Esto debe hacerse si existe una droga de probada susceptibilidad para el germen en cuestión, y si la terapia oral puede ser vigilada y monitoreada de cerca.
DURACIÓN DEL TRATAMIENTO.
El mínimo es seis semanas. Terapias más largas (doce semanas) pueden ser necesarias en pacientes con enfermedad avanzada, manifestada por la destrucción ósea importante y/o infección paravertebral.
MEDIDAS ADICIONALES.
El reposo en cama, y los opioides son generalmente útiles en manejar el dolor del paciente. Un corset ballenado puede brindar alivio.
El reposo en cama puede ser particularmente importante, especialmente en osteomielitis lumbar. El reposo debe durar por lo menos los primeros 10 días de tratamiento.
ROL DE LA CIRUGÍA.
La cirugía es necesaria en una minoría de pacientes con osteomielitis vertebral. Hay tres principales indicaciones:
• Progresión de la enfermedad a pesar de una terapia antimicrobiana adecuada específica o empírica.
• Compresión medular, o amenaza de que ello ocurra debido a colapso vertebral y/o inestabilidad de la columna.
• Drenaje de un absceso epidural o paravertebral.
Las técnicas quirúrgicas mínimamente invasivas incluyen toracoscopía, laparoscopía, debridamiento transpedicular percutáneo, y discectomía, así como procedimientos video asistidos usando incisiones abiertas limitadas son usadas en una minoría de casos.
Si el absceso paravertebral o epidural está presente, el drenaje con catéter guiado por TAC es usualmente suficiente. Sin embargo, el drenaje quirúrgico abierto, el debridamiento óseo quirúrgico, y la fusión de cuerpos vertebrales (con o sin injerto e instrumentación posterior) son ocasionalmente requeridos.
ROL DE LAS IMÁGENES.
La utilidad de obtener imágenes cuatro a ocho semansa después de completar el tratamiento de la osteomielitis vertebral se indica solamente en aquellos pacientes que tuvieron una evolución errática o empeoramiento del status clínico al final de la terapia.
PRONÓSTICO.
La complicación más seria de la osteomielitis vertebral es el compromiso neurológico secundario ya sea a la formación de un absceso epidural, o al aplastamiento vertebral. La mayoría pero no todos los pacientes tienen mejoramiento gradual del dolor lumbar después del comienzo de la terapia, y el dolor desaparece del todo cuando se produce la fusión ósea definitiva. Sin embargo, puede a veces persistir. La mejor forma de reducir la morbi-mortalidad asociada a osteomielitis vertebral es limitar el tiempo entre el inicio de los síntomas y la iniciación de la terapia apropiada.
Los factores de riesgo independientes de muerte o síntomas residuales incluyen:
• Compromiso neurológico en el momento del diagnóstico (por ejemplo debilidad motora, inestabilidad espinal, parálisis).
• Infección adquirida nosocomialmente.
• Retraso en el diagnóstico.
MORTALIDAD.
En la era antibiótica, la mortalidad por osteomielitis vertebral es de 5%, y la tasa de déficits neurológicos residuales es de menos de 7%.
Fuentes consultadas.
UpToDate 2010.
Emedicine. com
The New England Journal of Medicine.
Presentó:
Dra. Florencia González.
Residente de Clínica Médica.
Hospital Municipal de Azul.
Ecocardiograma transtorácico: normal. Está pendiente la realización de ecocardiograma transesofágico.
Es evaluado por Servicios de Clínica Médica, Traumatología, Neurocirugía, y Urología, y se interpreta como espondilodiscitis séptica por S. aureus y se comienza tratamiento con cefalotina + rifampicina.
El paciente evoluciona afebril a la 72 horas de comenzado el nuevo esquema antibiótico, y con franca mejoría de la lumbalgia.
El día 05/08/2019 se solicita derivación a su ciudad de origen para completar tratamiento.
Conclusiones del Caso.Paciente de 61 años que presentó una infección urinaria alta 30 días antes, rescatándose SAMS, que a pesar del tratamiento antibiótico persistió febril, agregándose un cambio de modalidad de la lumbalgia, que al ingreso a este hospital impresiona como de origen osteoarticular. Fue derivado con sospecha diagnóstica de espondilodiscitis séptica, que se confirmó durante la internación.
La confirmación diagnóstica se estableció en base a la clínica del paciente, a los hallazgos imagenológicos, y al aislamiento de un germen como S. aureus, que es un patógeno habitual de osteomielitis vertebral. Este último hallazgo motivó que no se considerara necesaria la biopsia de la región del disco para confirmación bacteriológica.
No quedó claro el foco de origen de la espondilodiscitis, ya que el aparato urinario, si bien puede ser la causa de diseminación bacteriana con colonizaciones vertebrales, generalmente eso se da con gérmenes Gram-negativos. SAMS no es un germen habitual de infección urinaria ascendente, pero si de infección hematógena, como creemos que fue este caso. Por lo tanto, la infección urinaria fue considerada también una localización secundaria de una bacteriemia, así como lo fue la espondilodiscitis de un foco desconocido. Se descartó endocarditis bacteriana, ya que el paciente presentó un ecocardiograma bidimensional normal, que si bien tiene baja sensibilidad de detección de endocarditis (menor de 70%), el mismo no mostró ninguna alteración valvular, no soplos en la exploración con Doppler, y pudo realizarse con buena ventana. De todas formas se realizará un ecocardiograma transesofágico.
Tampoco impresionó el foco traumatológico antiguo como la fuente de diseminación bacteriana primaria. No se puede descartar un foco dermatológico que haya evolucionado a la curación con el primer esquema antibiótico.
De todas maneras, como veremos, hay un porcentaje de pacientes con espondilodiscitis séptica en los que nunca se descubre el foco infeccioso inicial.
La RMN realizada, no exploró la articulación sacroilíaca por lo que no puede descartarse que el paciente presente también una localización infecciosa a ese nivel que esté evolucionando bien con el tratamiento antibiótico.
OSTEOMIELITIS VERTEBRAL Y DISCITIS.INTRODUCCIÓN.
La osteomielitis vertebral fue reconocida como una entidad clínica distintiva por Hipócrates y por Galeno. Antes del descubrimiento de los antibióticos, la osteomielitis vertebral era fatal en aproximadamente 25% de los casos. Hoy día la mortalidad es rara, pero la morbilidad es común; además, el retraso diagnóstico puede producir complicaciones discapacitantes.
Los términos osteomielitis y discitis son a menudo usados en forma indistinta por los clínicos. Dado que el espacio discal no tiene irrigación sanguínea directa en los adultos, este espacio es afectado secundariamente, cuando existe diseminación hematógena al hueso, y subsecuentemente se produce una diseminación al espacio discal intervertebral adyacente. Sin embargo, la infección puede también diseminarse desde el espacio discal al hueso adyacente, cuando la infección se produce después de una cirugía, o después de inyecciones aplicadas en el espacio discal.
En este artículo, los términos osteomielitis y discitis serán usados en forma indistinta, dado que el diagnóstico y el tratamiento de ambas entidades es similar.
EPIDEMIOLOGÍA.
La osteomielitis vertebral es primariamente una enfermedad de adultos, con la mayoría de pacientes mayores de 50 años. Como regla general, la incidencia ajustada por edad, aumenta progresivamente con cada décad de la vida. Los hombres son afectados aproximadamente el doble que las mujeres, sin que se sepa exactamente el por qué de esta diferencia.
Es difícil obtener información confiable sobre la incidencia anual real de la osteomielitis vertebral, pero se estima en 1:250.000; este valor ha aumentado en forma firme en los últimos años. La razón de este aumento de la incidencia se debe a tres razones:
• Aumento de las tasas nosocomiales de bacteriemia, debido al aumento de la utilización de catéteres y dispositivos de instrumentación intravascular.
• Aumento de la edad poblacional.
• Aumento de la drogadicción intravenosa.
PATOGÉNESIS.
Los agentes patógenos pueden alcanzar las vértebras por tres rutas básicamente:
• Diseminación hematógena desde un foco infeccioso distante.
• Inoculación directa por un trauma espinal o cirugía de columna.
• Diseminación contigua desde un foco infeccioso vecino.
Aunque antes se creía que la diseminación de la infección ocurría vía los plexos venosos de Batson, esta teoría no es la que prevalece hoy día.
Los potenciales orígenes o focos infecciosos, fuente de la diseminación hematógena o contigua de la infección, incluyen focos génitourinarios, piel y partes blandas (que a su vez incluye uso de drogas intravenosas), tracto respiratorio, infección de los sitios de catéteres intravasculares, infección post operatorias de heridas, endocarditis, e infecciones dentarias. En muchos pacientes, el foco infeccioso primario nunca es encontrado. Causas menos comunes incluyen infecciones valvulares protésicas o nativas, diseminación directa desde una perforación de esófago, abscesos renales o peridiverticulares, y lesiones aórticas infectadas. La osteomielitis vertebral raramente ocurre como complicación de una punción lumbar, mielografía, aortografía translumbar, quimionucleolisis, discografía, inyección de corticosteroides en las articulaciones interfacetarias, colocación de catéteres epidurales, o inyección de corticosteroides por vía epidural.
Diseminación Hematógena.
La diseminación hematógena es, lejos, la causa más común de osteomielitis vertebral. El mecanismo por el cual las bacterias en la sangre causan osteomielitis vertebral es complejo. A diferencia de los huesos largos cuyas cavidades medulares metafisarias están compuestas por tejido adiposo avascular, los huesos vertebrales de los adultos tienen una médula abundante y ricamente vascular con un flujo lento pero abundante, vía vasos nutrientes de la arteria espinal posterior. Además, esos vasos progresivamente desarrollan una anatomía en “sacacorchos” a medida que envejecen lo cual los predispone a la siembra bacteriana hematógena.
Los microorganismos sembrados por vía hematógena, pueden filtrar a la cavidad medular de la vértebra y producir una infección local supurada. La iniciación de la infección puede ser facilitada por un trauma reciente con distorsión de la arquitectura.
Las arterias segmentarias que proveen irrigación a las vértebras, usualmente se bifurcan para suministrar irrigación a las dos carillas de los dos cuerpos vertebrales adyacentes. Así, la osteomielitis hematógena vertebral, generalmente causa destrucción ósea en dos cuerpos vertebrales adyacentes y su correspondiente disco intervertebral. Los cuerpos vertebrales lumbares son los más frecuentemente afectados, seguidos en frecuencia por los dorsales, y mucho más raramente por los cuerpos vertebrales cervicales.
La infección vertebral por diseminación contigua puede ocurrir desde tejidos como la aorta, el esófago, o el intestino, vecinos a la columna. La extensión de la infección en tales casos, es facilitado por la ausencia de un cartílago circunferencial del platillo vertebral o de una capa de hueso compacto limitante. La extensión posterior puede llevar a un absceso epidural y subdural, o aún meningitis, mientras la extensión anterior puede producir abscesos paravertebrales, retrofaríngeos, mediastinales, subfrénicos, retroperitoneales, o abscesos del psoas. La infección vertebral a nivel torácico puede extenderse al espacio pleural y ser causa de empiema.
La infección ocasionalmente asienta en componentes de las vértebras que no son el cuerpo vertebral. Esos componentes incluyen las apófisis espinosas, las láminas, las articulaciones interfacetarias y raramente la apófisis odontoides.
MICROBIOLOGÍA.
El organismo más importante causante de osteomielitis vertebral es Staphylococcus aureus, dando cuenta de más de 50% de los casos en la mayoría de las series en los países desarrollados. Dado que la proporción de S.aureus meticilino resistentes (SAMR) ha aumentado durante la última década, la importancia relativa de SAMR como causa de osteomielitis vertebral ha aumentado simultáneamente. Sin embargo, el rango de patógenos reportados es grande; patógenos menos comunes incluyen:
• Bacilos entéricos gram-negativos, particularmente después de instrumentación del tracto urinario.
• Pseudomona aeruginosa y Cándida spp, están frecuentemente asociados con sepsis de accesos vasculares o inyección de drogas intravenosas.
• Estreptococos hemolíticos de grupo B y G, especialmente en pacientes con diabetes mellitus.
• Tuberculosis.
La geografía también influencia en los microorganismos encontrados como causa de osteomielitis vertebral. La Brucella melitensis es un importante patógeno en Medio Este y en países del Mediterráneo; la Burkholderia pseudomallei (melioidosis) debe sospecharse siempre en osteomielitis de regiones periecuatoriales; y Salmonella y Entamoeba histolítica son causas ocasionales en Sudamérica y África. Además, la presencia de inmunosupresión tiene efecto en los probables patógenos de osteomielitis vertebral en un paciente individual.
MANIFESTACIONES CLÍNICAS.
La manifestación más importante de la osteomielitis vertebral es el dolor dorsal, lumbar o cervical, a veces confundido con dolores de enfermedad vertebral degenerativa. Dado que lumbalgia es un síntoma de consulta común a un consultorio de clínica médica, es esencial considerar siempre a la osteomielitis vertebral, en la lista de diagnósticos diferenciales.
SÍNTOMAS Y SIGNOS.
No hay características diagnósticas específicas del dolor en la osteomielitis vertebral. El dolor comienza en forma insidiosa y empeora progresivamente en el término de semanas y a veces varios meses. En una serie de 64 pacientes con osteomielitis hematógena vertebral, por ejemplo, la duración promedio de los síntomas, fue de 48 +/- 40 días. El dolor, a menudo empeora durante la noche, aunque, al menos inicialmente, puede ser aliviado con el reposo. Lamentablemente hay pacientes que debutan con paraplejía sin haber presentado dolor previamente.
Los pacientes cuyas infecciones se extienden posteriormente en el espacio epidural, pueden presentarse con síntomas de absceso epidural. Esto a menudo consiste en una secuencia típica de dorsalgia o lumbalgia, que es a menudo focal y severa, y después aparece dolor radicular, debilidad motora, cambios en la sensibilidad, y eventualmente parálisis.
La fiebre es un hallazgo inconstante.

Figura 1.
RMN Sagital en T1 de columna lumbar en un hombre de 74 años que muestra discitis del espacio L4,L5. Nótese la destrucción extensiva a las carillas de los cuerpos vertebrales adyacentes. No hay compresión del saco dural, que es una importante consideración al momento de evaluar la intervención quirúrgica.
EXAMEN FÍSICO.
El dolor local a la percusión de la columna es el signo clínico más confiable; este es frecuentemente acompañado por reducción de la movilidad y/o espasmo muscular secundario de músculos vecinos. Raramente se ve una masa, o aún, una deformidad espinal.
El examen físico debe incluir la palpación en busca de una retención urinaria aguda, y la exploración de los signos y maniobras del psoas (por ejemplo dolor y limitación a la movilización de la cadera), y un cuidadoso examen neurológico de los miembros inferiores.
LABORATORIO:
El recuento de leucocitos puede estar elevado o normal, pero más de 80% de los pacientes tienen elevaciones de la VSG, que puede exceder los 100 mm/h, y los reactantes de fase aguda, como la proteína C rectiva (PCR) están elevados.
La VSG, si está elevada, puede ser de utilidad en el seguimiento de la eficacia de la terapia. Sin embargo, un rápido descenso no es común, y puede tardar 2 semanas en comenzar a bajar. Dado que la PCR se normaliza más rápido que la VSG con tratamiento exitoso de las infecciones espinales, y después de la cirugía de fusión vertebral, algunos expertos prefieren el seguimiento con niveles de PCR más que con VSG durante y después del tratamiento de la osteomielitis vertebral.
DIAGNÓSTICO DIFERENCIAL.
El diagnóstico diferencial en pacientes que presentan lumbalgia acompañada de fiebre y/o bacteriemia, incluyen las infecciones en otras localizaciones, fracturas compresivas, metástasis vertebrales, hernias discales, o enfermedad espinal degenerativa.
Es evaluado por Servicios de Clínica Médica, Traumatología, Neurocirugía, y Urología, y se interpreta como espondilodiscitis séptica por S. aureus y se comienza tratamiento con cefalotina + rifampicina.
El paciente evoluciona afebril a la 72 horas de comenzado el nuevo esquema antibiótico, y con franca mejoría de la lumbalgia.
El día 05/08/2019 se solicita derivación a su ciudad de origen para completar tratamiento.
Conclusiones del Caso.Paciente de 61 años que presentó una infección urinaria alta 30 días antes, rescatándose SAMS, que a pesar del tratamiento antibiótico persistió febril, agregándose un cambio de modalidad de la lumbalgia, que al ingreso a este hospital impresiona como de origen osteoarticular. Fue derivado con sospecha diagnóstica de espondilodiscitis séptica, que se confirmó durante la internación.
La confirmación diagnóstica se estableció en base a la clínica del paciente, a los hallazgos imagenológicos, y al aislamiento de un germen como S. aureus, que es un patógeno habitual de osteomielitis vertebral. Este último hallazgo motivó que no se considerara necesaria la biopsia de la región del disco para confirmación bacteriológica.
No quedó claro el foco de origen de la espondilodiscitis, ya que el aparato urinario, si bien puede ser la causa de diseminación bacteriana con colonizaciones vertebrales, generalmente eso se da con gérmenes Gram-negativos. SAMS no es un germen habitual de infección urinaria ascendente, pero si de infección hematógena, como creemos que fue este caso. Por lo tanto, la infección urinaria fue considerada también una localización secundaria de una bacteriemia, así como lo fue la espondilodiscitis de un foco desconocido. Se descartó endocarditis bacteriana, ya que el paciente presentó un ecocardiograma bidimensional normal, que si bien tiene baja sensibilidad de detección de endocarditis (menor de 70%), el mismo no mostró ninguna alteración valvular, no soplos en la exploración con Doppler, y pudo realizarse con buena ventana. De todas formas se realizará un ecocardiograma transesofágico.
Tampoco impresionó el foco traumatológico antiguo como la fuente de diseminación bacteriana primaria. No se puede descartar un foco dermatológico que haya evolucionado a la curación con el primer esquema antibiótico.
De todas maneras, como veremos, hay un porcentaje de pacientes con espondilodiscitis séptica en los que nunca se descubre el foco infeccioso inicial.
La RMN realizada, no exploró la articulación sacroilíaca por lo que no puede descartarse que el paciente presente también una localización infecciosa a ese nivel que esté evolucionando bien con el tratamiento antibiótico.
OSTEOMIELITIS VERTEBRAL Y DISCITIS.INTRODUCCIÓN.
La osteomielitis vertebral fue reconocida como una entidad clínica distintiva por Hipócrates y por Galeno. Antes del descubrimiento de los antibióticos, la osteomielitis vertebral era fatal en aproximadamente 25% de los casos. Hoy día la mortalidad es rara, pero la morbilidad es común; además, el retraso diagnóstico puede producir complicaciones discapacitantes.
Los términos osteomielitis y discitis son a menudo usados en forma indistinta por los clínicos. Dado que el espacio discal no tiene irrigación sanguínea directa en los adultos, este espacio es afectado secundariamente, cuando existe diseminación hematógena al hueso, y subsecuentemente se produce una diseminación al espacio discal intervertebral adyacente. Sin embargo, la infección puede también diseminarse desde el espacio discal al hueso adyacente, cuando la infección se produce después de una cirugía, o después de inyecciones aplicadas en el espacio discal.
En este artículo, los términos osteomielitis y discitis serán usados en forma indistinta, dado que el diagnóstico y el tratamiento de ambas entidades es similar.
EPIDEMIOLOGÍA.
La osteomielitis vertebral es primariamente una enfermedad de adultos, con la mayoría de pacientes mayores de 50 años. Como regla general, la incidencia ajustada por edad, aumenta progresivamente con cada décad de la vida. Los hombres son afectados aproximadamente el doble que las mujeres, sin que se sepa exactamente el por qué de esta diferencia.
Es difícil obtener información confiable sobre la incidencia anual real de la osteomielitis vertebral, pero se estima en 1:250.000; este valor ha aumentado en forma firme en los últimos años. La razón de este aumento de la incidencia se debe a tres razones:
• Aumento de las tasas nosocomiales de bacteriemia, debido al aumento de la utilización de catéteres y dispositivos de instrumentación intravascular.
• Aumento de la edad poblacional.
• Aumento de la drogadicción intravenosa.
PATOGÉNESIS.
Los agentes patógenos pueden alcanzar las vértebras por tres rutas básicamente:
• Diseminación hematógena desde un foco infeccioso distante.
• Inoculación directa por un trauma espinal o cirugía de columna.
• Diseminación contigua desde un foco infeccioso vecino.
Aunque antes se creía que la diseminación de la infección ocurría vía los plexos venosos de Batson, esta teoría no es la que prevalece hoy día.
Los potenciales orígenes o focos infecciosos, fuente de la diseminación hematógena o contigua de la infección, incluyen focos génitourinarios, piel y partes blandas (que a su vez incluye uso de drogas intravenosas), tracto respiratorio, infección de los sitios de catéteres intravasculares, infección post operatorias de heridas, endocarditis, e infecciones dentarias. En muchos pacientes, el foco infeccioso primario nunca es encontrado. Causas menos comunes incluyen infecciones valvulares protésicas o nativas, diseminación directa desde una perforación de esófago, abscesos renales o peridiverticulares, y lesiones aórticas infectadas. La osteomielitis vertebral raramente ocurre como complicación de una punción lumbar, mielografía, aortografía translumbar, quimionucleolisis, discografía, inyección de corticosteroides en las articulaciones interfacetarias, colocación de catéteres epidurales, o inyección de corticosteroides por vía epidural.
Diseminación Hematógena.
La diseminación hematógena es, lejos, la causa más común de osteomielitis vertebral. El mecanismo por el cual las bacterias en la sangre causan osteomielitis vertebral es complejo. A diferencia de los huesos largos cuyas cavidades medulares metafisarias están compuestas por tejido adiposo avascular, los huesos vertebrales de los adultos tienen una médula abundante y ricamente vascular con un flujo lento pero abundante, vía vasos nutrientes de la arteria espinal posterior. Además, esos vasos progresivamente desarrollan una anatomía en “sacacorchos” a medida que envejecen lo cual los predispone a la siembra bacteriana hematógena.
Los microorganismos sembrados por vía hematógena, pueden filtrar a la cavidad medular de la vértebra y producir una infección local supurada. La iniciación de la infección puede ser facilitada por un trauma reciente con distorsión de la arquitectura.
Las arterias segmentarias que proveen irrigación a las vértebras, usualmente se bifurcan para suministrar irrigación a las dos carillas de los dos cuerpos vertebrales adyacentes. Así, la osteomielitis hematógena vertebral, generalmente causa destrucción ósea en dos cuerpos vertebrales adyacentes y su correspondiente disco intervertebral. Los cuerpos vertebrales lumbares son los más frecuentemente afectados, seguidos en frecuencia por los dorsales, y mucho más raramente por los cuerpos vertebrales cervicales.
La infección vertebral por diseminación contigua puede ocurrir desde tejidos como la aorta, el esófago, o el intestino, vecinos a la columna. La extensión de la infección en tales casos, es facilitado por la ausencia de un cartílago circunferencial del platillo vertebral o de una capa de hueso compacto limitante. La extensión posterior puede llevar a un absceso epidural y subdural, o aún meningitis, mientras la extensión anterior puede producir abscesos paravertebrales, retrofaríngeos, mediastinales, subfrénicos, retroperitoneales, o abscesos del psoas. La infección vertebral a nivel torácico puede extenderse al espacio pleural y ser causa de empiema.
La infección ocasionalmente asienta en componentes de las vértebras que no son el cuerpo vertebral. Esos componentes incluyen las apófisis espinosas, las láminas, las articulaciones interfacetarias y raramente la apófisis odontoides.
MICROBIOLOGÍA.
El organismo más importante causante de osteomielitis vertebral es Staphylococcus aureus, dando cuenta de más de 50% de los casos en la mayoría de las series en los países desarrollados. Dado que la proporción de S.aureus meticilino resistentes (SAMR) ha aumentado durante la última década, la importancia relativa de SAMR como causa de osteomielitis vertebral ha aumentado simultáneamente. Sin embargo, el rango de patógenos reportados es grande; patógenos menos comunes incluyen:
• Bacilos entéricos gram-negativos, particularmente después de instrumentación del tracto urinario.
• Pseudomona aeruginosa y Cándida spp, están frecuentemente asociados con sepsis de accesos vasculares o inyección de drogas intravenosas.
• Estreptococos hemolíticos de grupo B y G, especialmente en pacientes con diabetes mellitus.
• Tuberculosis.
La geografía también influencia en los microorganismos encontrados como causa de osteomielitis vertebral. La Brucella melitensis es un importante patógeno en Medio Este y en países del Mediterráneo; la Burkholderia pseudomallei (melioidosis) debe sospecharse siempre en osteomielitis de regiones periecuatoriales; y Salmonella y Entamoeba histolítica son causas ocasionales en Sudamérica y África. Además, la presencia de inmunosupresión tiene efecto en los probables patógenos de osteomielitis vertebral en un paciente individual.
MANIFESTACIONES CLÍNICAS.
La manifestación más importante de la osteomielitis vertebral es el dolor dorsal, lumbar o cervical, a veces confundido con dolores de enfermedad vertebral degenerativa. Dado que lumbalgia es un síntoma de consulta común a un consultorio de clínica médica, es esencial considerar siempre a la osteomielitis vertebral, en la lista de diagnósticos diferenciales.
SÍNTOMAS Y SIGNOS.
No hay características diagnósticas específicas del dolor en la osteomielitis vertebral. El dolor comienza en forma insidiosa y empeora progresivamente en el término de semanas y a veces varios meses. En una serie de 64 pacientes con osteomielitis hematógena vertebral, por ejemplo, la duración promedio de los síntomas, fue de 48 +/- 40 días. El dolor, a menudo empeora durante la noche, aunque, al menos inicialmente, puede ser aliviado con el reposo. Lamentablemente hay pacientes que debutan con paraplejía sin haber presentado dolor previamente.
Los pacientes cuyas infecciones se extienden posteriormente en el espacio epidural, pueden presentarse con síntomas de absceso epidural. Esto a menudo consiste en una secuencia típica de dorsalgia o lumbalgia, que es a menudo focal y severa, y después aparece dolor radicular, debilidad motora, cambios en la sensibilidad, y eventualmente parálisis.
La fiebre es un hallazgo inconstante.

Figura 1.
RMN Sagital en T1 de columna lumbar en un hombre de 74 años que muestra discitis del espacio L4,L5. Nótese la destrucción extensiva a las carillas de los cuerpos vertebrales adyacentes. No hay compresión del saco dural, que es una importante consideración al momento de evaluar la intervención quirúrgica.
EXAMEN FÍSICO.
El dolor local a la percusión de la columna es el signo clínico más confiable; este es frecuentemente acompañado por reducción de la movilidad y/o espasmo muscular secundario de músculos vecinos. Raramente se ve una masa, o aún, una deformidad espinal.
El examen físico debe incluir la palpación en busca de una retención urinaria aguda, y la exploración de los signos y maniobras del psoas (por ejemplo dolor y limitación a la movilización de la cadera), y un cuidadoso examen neurológico de los miembros inferiores.
LABORATORIO:
El recuento de leucocitos puede estar elevado o normal, pero más de 80% de los pacientes tienen elevaciones de la VSG, que puede exceder los 100 mm/h, y los reactantes de fase aguda, como la proteína C rectiva (PCR) están elevados.
La VSG, si está elevada, puede ser de utilidad en el seguimiento de la eficacia de la terapia. Sin embargo, un rápido descenso no es común, y puede tardar 2 semanas en comenzar a bajar. Dado que la PCR se normaliza más rápido que la VSG con tratamiento exitoso de las infecciones espinales, y después de la cirugía de fusión vertebral, algunos expertos prefieren el seguimiento con niveles de PCR más que con VSG durante y después del tratamiento de la osteomielitis vertebral.
DIAGNÓSTICO DIFERENCIAL.
El diagnóstico diferencial en pacientes que presentan lumbalgia acompañada de fiebre y/o bacteriemia, incluyen las infecciones en otras localizaciones, fracturas compresivas, metástasis vertebrales, hernias discales, o enfermedad espinal degenerativa.
Figura 2.
RMN con realce de contraste en T1 en una mujer de 55 años que muestra discitis torácica con absceso epidural asociado y compresión de médula espinal. Debido a la compresión medular, esta paciente debió ser sometida a descompresión quirúrgica.
DIAGNÓSTICO.El diagnóstico de osteomielitis vertebral es dificultoso en algunos pacientes, y relativamente fácil en otros. No es infrecuente que el dolor sea atribuido a traumatismos menores u otras causas, particularmente en pacientes sin factores de riesgo para osteomielitis, tales como uso de drogas intravenosas, endocarditis, cirugía espinal previa, diabetes, terapia con corticosteroides, u otros estados de inmunocompromiso.
La osteomielitis vertebral es usualmente sospechada en base a la sintomatología clínica y los hallazgos anormales en las imágenes radiológicas, de RMN o de scan con radionúclidos; es usualmente confirmada por aspiración del espacio del disco intervertebral infectado (discitis) o del hueso vertebral.
HEMOCULTIVOS.Los hemocultivos son positivos en hasta el 50 a70% de los pacientes con osteomielitis vertebral. Ellos deben ser obtenidos en todos los pacientes con sospecha de osteomielitis vertebral, dado que los hemocultivos positivos pueden obviar la necesidad de tests diagnósticos invasivos.
IMÁGENES.
RADIOGRAFÍAS:La radiografía simple es a menudo normal cuando es obtenida en las fases tempranas de la infección. Los hallazgos típicos en la osteomielitis consiste en cambios destructivos de dos cuerpos vertebrales contiguos con colapso del espacio del intervertebral. Sin embargo, la destrucción ósea puede no ser aparente por dos o tres semanas, y a veces más, después del inicio de los síntomas. Raramente las infecciones están confinadas a una vértebra y produce colapso del cuerpo vertebral, que mimetiza una fractura vertebral por compresión.
 Figura 3.
Figura 3.TAC en un paciente con discitis que muestra la destrucción extensiva a los platillos vertebrales. Nótese la preservación de los elementos posteriores, incluyendo las facetas articulares, la lámina, y la apófisis espinosa. Esto es el hallazgo común en una discitis piogénica y menos común en tuberculosis (enfermedad de Pott).
TOMOGRAFÍA COMPUTADA:
La TAC muestra cambios típicos o sugestivos de osteomielitis vertebral, antes de que estos sean evidentes en la radiografías. La TAC también es útil para detectar la presencia de secuestros óseos, o los abscesos de partes blandas adyacentes, así como para localizar el sitio óptimo para realizar una punción biopsia de la zona.
Sin embargo, las anormalidades sutiles detectadas por TAC, tales como las irregularidades del borde inferior o superior de los cuerpos vertebrales de las vértebras adyacentes, no son muy específicos de osteomielitis, y las alteraciones destructivas tempranas pueden ser pasadas por alto por este método. La TAC también puede dar falsos negativos en el absceso epidural.
RESONANCIA MAGNÉTICA NUCLEAR:
La RMN es la técnica radiológica más sensible para detectar osteomielitis vertebral. La RMN es también superior a la TAC para detectar abscesos epidurales, pero no puede ser utilizada en pacientes con ciertos implantes metálicos.
Los hallazgos de la osteomielitis vertebral en la RMN incluyen:
• En la imágenes en T1, hay disminución de la intensidad de señal en los cuerpos vertebrales y disco intervertebral, y pérdida de definición del platillo vertebral.
• En las imágenes en T2, aumento de la señal del disco, y menos a menudo del cuerpo vertebral
• Realce de contraste del disco y del cuerpo vertebral. Además, el anillo de realce de las regiones paraespinales y epidurales se correlaciona con formación de abscesos, mientras que un realce homogéneo se correlaciona con la formación de un flemón.
Los falsos negativos de la RMN han sido reportados en pacientes con osteomielitis vertebral y abscesos epidurales, especialmente en aquellos con meningitis concurrente, o con largos abscesos sin un margen claro. Por otro lado, los falsos positivos se ven en fracturas o en infartos óseos.
SCAN CON RADIONÚCLIDOS:
Los estudios radioisotópicos pueden ser útiles como estudios adicionales cuando los cambios radiológicos en las radiografías simples o en la TAC, están ausentes o son equívocos, y hay alta sospecha clínica de osteomielitis. Estos estudios con radioisótopos son relativamente sensibles pero la especificidad para infección es baja.
• Scan con leucocitos marcados son raramente útiles para el diagnóstico de osteomielitis vertebral dado que las anomalías típicamente se manifiestan como defectos fotopénicos inespecíficos, con capatación reducida del radioisótopo.
• La centelleografía de tres fases usando tecnecio marcado es un test relativamente sensible y específico, pero puede producir resultados falsos positivos en pacientes con trastornos no infecciosos tales como fracturas. Los resultados falsos negativos también pueden ocurrir en la infección temprana o en casos en los que el infarto óseo se acompaña de infección ósea.
• La imágenes con galio son las técnicas con radionúclidos más sensibles y específicas en la osteomielitis vertebral. Un test positivo típico revela intensa captación en dos vértebras adyacentes con pérdida del espacio de disco comprometido.
BIOPSIA CON AGUJA:
La biopsia con aguja guiada por TAC es generalmente necesaria para confirmar la sospecha clínica y radiográfica de osteomielitis vertebral. La biopsia con aguja puede ser llevada a cabo con aguja fina o agujas de biopsia. Las muestras deben ser enviadas para cultivos para gérmenes aeróbicos, anaeróbicos, micobacterias, y hongos. La sensibilidad (medida en términos de resultados de cultivos positivos o tinción con Gram del material aspirado) ha variado en varios estudios desde tan bajo como 50% a tan alto como 73 a 100%.
La TAC muestra cambios típicos o sugestivos de osteomielitis vertebral, antes de que estos sean evidentes en la radiografías. La TAC también es útil para detectar la presencia de secuestros óseos, o los abscesos de partes blandas adyacentes, así como para localizar el sitio óptimo para realizar una punción biopsia de la zona.
Sin embargo, las anormalidades sutiles detectadas por TAC, tales como las irregularidades del borde inferior o superior de los cuerpos vertebrales de las vértebras adyacentes, no son muy específicos de osteomielitis, y las alteraciones destructivas tempranas pueden ser pasadas por alto por este método. La TAC también puede dar falsos negativos en el absceso epidural.
RESONANCIA MAGNÉTICA NUCLEAR:
La RMN es la técnica radiológica más sensible para detectar osteomielitis vertebral. La RMN es también superior a la TAC para detectar abscesos epidurales, pero no puede ser utilizada en pacientes con ciertos implantes metálicos.
Los hallazgos de la osteomielitis vertebral en la RMN incluyen:
• En la imágenes en T1, hay disminución de la intensidad de señal en los cuerpos vertebrales y disco intervertebral, y pérdida de definición del platillo vertebral.
• En las imágenes en T2, aumento de la señal del disco, y menos a menudo del cuerpo vertebral
• Realce de contraste del disco y del cuerpo vertebral. Además, el anillo de realce de las regiones paraespinales y epidurales se correlaciona con formación de abscesos, mientras que un realce homogéneo se correlaciona con la formación de un flemón.
Los falsos negativos de la RMN han sido reportados en pacientes con osteomielitis vertebral y abscesos epidurales, especialmente en aquellos con meningitis concurrente, o con largos abscesos sin un margen claro. Por otro lado, los falsos positivos se ven en fracturas o en infartos óseos.
SCAN CON RADIONÚCLIDOS:
Los estudios radioisotópicos pueden ser útiles como estudios adicionales cuando los cambios radiológicos en las radiografías simples o en la TAC, están ausentes o son equívocos, y hay alta sospecha clínica de osteomielitis. Estos estudios con radioisótopos son relativamente sensibles pero la especificidad para infección es baja.
• Scan con leucocitos marcados son raramente útiles para el diagnóstico de osteomielitis vertebral dado que las anomalías típicamente se manifiestan como defectos fotopénicos inespecíficos, con capatación reducida del radioisótopo.
• La centelleografía de tres fases usando tecnecio marcado es un test relativamente sensible y específico, pero puede producir resultados falsos positivos en pacientes con trastornos no infecciosos tales como fracturas. Los resultados falsos negativos también pueden ocurrir en la infección temprana o en casos en los que el infarto óseo se acompaña de infección ósea.
• La imágenes con galio son las técnicas con radionúclidos más sensibles y específicas en la osteomielitis vertebral. Un test positivo típico revela intensa captación en dos vértebras adyacentes con pérdida del espacio de disco comprometido.
BIOPSIA CON AGUJA:
La biopsia con aguja guiada por TAC es generalmente necesaria para confirmar la sospecha clínica y radiográfica de osteomielitis vertebral. La biopsia con aguja puede ser llevada a cabo con aguja fina o agujas de biopsia. Las muestras deben ser enviadas para cultivos para gérmenes aeróbicos, anaeróbicos, micobacterias, y hongos. La sensibilidad (medida en términos de resultados de cultivos positivos o tinción con Gram del material aspirado) ha variado en varios estudios desde tan bajo como 50% a tan alto como 73 a 100%.
Procedimiento de punción aspiración del disco con aguja guiado por radioscopía. Esta imagen muestra los sutiles cambios de la espondilodiscitis en la radiografía. Aunque la pérdida temprana de altura del espacio discal puede estar presente, no se ve erosión definida del platillo vertebral. Los hallazgos de RMN en este caso mostraron evidencias de infección, y el cultivo del aspirado fue positivo para Staphylococcus aureus.

Figura 5. Punción Aspiración y Biopsia del Disco Guiada por TAC.
Trayectoria de la aguja en la biopsia de un disco intervertebral infectado guiada por TAC. Debe haber especial cuidado de evitar el saco tecal y las raíces nerviosas.
TÉCNICAS BASADAS EN AMPLIFICACIÓN DE DNA.
Las técnicas basadas en el análisis del DNA del material aspirado del disco se correlacionan bien con los métodos de cultivos tradicionales. Sin embargo, estas técnicas deben ser reservadas para una minoría de pacientes en quienes la reaspiración y los cultivos microbiológicos de rutina no han podido detectar el agente causal. La contaminación con flora de piel, es un problema para las técnicas basadas en amplificación de DNA.
SÍNTESIS DEL ABORDAJE DIAGNÓSTICO SUGERIDO.
La evaluación inicial de la mayoría de los pacientes con sospecha de osteomielitis vertebral incluye: examen físico, VSG, hemocultivos, y radiografías de las zonas dolorosas de la columna. Los pacientes deben ser cuidadosamente interrogados acerca de posibles factores predisponentes o elementos como enfermedades de base, internaciones previas, procedimientos invasivos, uso de inyecciones intravenosas, y viajes.
Si hay dolor localizado en columna y/o VSG acelerada, y si las radiografías son negativas, usualmente se obtiene una RMN para evaluar la posibilidad de osteomielitis. Un scan con radionúclidos se realiza sólo en pacientes seleccionados con esos elementos clínicos y en quienes no se puede realizar RMN. Si cualquiera de estos métodos de imagen muestra cambios típicos sugestivos de osteomielitis vertebral, se debe proceder a punción aspiración biopsia con aguja guiada por TAC del hueso afectado. La muestra obtenida se envía para examen histológico y para cultivos para bacterias aeróbicas, anaeróbicas, hongos y micobacterias.
En pacientes con hallazgos clínicos y radiográficos típicos de osteomielitis vertebral y con hemocultivos positivos para patógenos probables como S. aureus, bacilos Gram-negativos, o P. aeruginosa, la biopsia aspiración con aguja puede no ser necesaria.
Si los hemocultivos y los resultados microbiológicos del material aspirado con aguja son negativos, y la sospecha clínica e imagenológica de osteomielitis vertebral sigue siendo alta, se puede llevar a cabo una segunda biopsia. Si esta segunda muestra es también negativa, se debe iniciar la terapia empírica dirigida a Gram-positivos (especialmente S. aureus), y Gram-negativos. Si esta terapia empírica no resulta en una mejoría clínica objetiva en tres a cuatro semanas, una tercera biopsia con aguja o una cirugía abierta debe ser llevada a cabo. Hay otras autoridades que indican cirugía abierta ante el primer set de cultivos negativos.
EVALUACIÓN PARA ENDOCARDITIS:
En pacientes seleccionados es necesario un abordaje diagnóstico para descartar endocarditis infecciosa. Un estudio de 91 casos de osteomielitis vertebral (excluyendo tuberculosis, brucelosis, pacientes con hemocultivos negativos, y casos posquirúrgicos) identificó 28 pacientes (31 %) con endocarditis infecciosa (EI) . Cuando los pacientes con y sin EI fueron comparados, los siguientes factores de riesgo estuvieron asociados significativamente en aquellos que tenían EI:
• Condiciones cardíacas predisponentes.
• Fallo cardíaco.
• Hemocultivos positivos.
• Infección debida a organismos Gram-positivos.
La osteomielitis vertebral sin EI fue más común en pacientes con infecciones del tracto urinario, o con infección por gérmenes Gram-negativos.
Aunque la duración de la terapia de la osteomielitis vertebral es no menos de 6 semanas, también sería adecuado para tratar una EI, la importancia de identificar una EI coexistente es que el paciente con EI requiere ulterior seguimiento para evaluar posible daño valvular y antibióticoterapia profiláctica frente a procedimientos que puedan producir bacteriemia.
Esos hallazgos sugieren que los pacientes con osteomielitis vertebral que presentan algún factor predisponente de EI de los mencionados arriba, deben ser evaluados con ecocardiografía.
DIFICULTADES Y ERRORES EN EL MANEJO:
Las siguientes advertencias son aplicables al diagnóstico y manejo de las osteomielitis vertebrales:
• El dolor vertebral (dorsalgia o lumbalgia) de la osteomielitis vertebral puede responder inicialmente al reposo en cama y a medidas conservadoras, llevando a la interpretación errónea de que se trata de una lumbalgia aguda de esfuerzo u otra causa no infecciosa.
• Un antecedente de enfermedad degenerativa de columna o un trauma reciente pueden oscurecer o hacer que se retrase el diagnóstico.
• Estudios radiográficos incluyendo RMN y TAC pueden dar resultados falsos negativos, particularmente si son llevados a cabo tempranamente en el curso de la enfermedad.
• Las radiografías simples, la TAC, y la RMN pueden ir empeorando sus hallazgos, aún varias semanas después de la iniciación de la terapia que será finalmente exitosa.
• La osteomielitis vertebral raramente ocurre sin compromiso característico del disco intervertebral. En casos donde el disco está respetado, puede erróneamente diagnosticarse cáncer o fractura compresiva.
TRATAMIENTO.
El tratamiento con antibióticos y raramente también con cirugía conducen en la mayoría de los casos a la curación de los pacientes con osteomielitis vertebral. El diagnóstico precoz y un cuidadoso seguimiento en la búsqueda de signos de extensión a partes blandas, abscesos paraespinales, y compresión medular son de gran importancia. La respuesta a la terapéutica es mejor evaluada con los síntomas y la medida seriada de la VSG y de la PCR, más que con seguimiento con imágenes.
TRATAMIENTO ANTIMICROBIANO.
La mayoría de los casos de osteomielitis vertebral responden al tratamiento antimicrobiano. Sin embargo, algunos pacientes requieren además, cirugía.
No hay ensayos randomizados controlados que hayan evaluado regímenes para osteomielitis vertebral. Los regímenes se basan en los resultados de los hemocultivos y de la biopsia del espacio discal. La decisión de comenzar o esperar para comenzar una terapia empírica antes de los cultivos, se basa en cada caso particular. Debido a que la terapia de esta infección es prolongada y debido a que puede haber necesidad de repetir la biopsia si esta es negativa (por ejemplo debido a un error de toma de muestra), se aconseja generalmente esperar hasta el resultado de los cultivos mientras los pacientes están estables.
Si los cultivos de sangre y la punción biopsia repetida son negativos, y la sospecha clínica de osteomielitis vertebral sigue siendo alta en base a la clínica y a los hallazgos de imágenes, se debiera comenzar con antibióticoterapia empírica dirigida contra los organismos que más probablemente causen infección en este contexto (por ejemplo estafilococos, estreptococos, y bacilos Gram-negativos).
Rutinariamente se administran antibióticos por vía parenteral, con excepción de infecciones documentadas debidas a bacilos Gram-negativos sensibles a fluorquinolonas. La terapia con fluoroquinolonas orales puede ser usada en osteomielitis por bacilos Gram-negativos tempranas, si el microorganismo tiene alta sensibilidad en los tests de susceptibilidad, y si la compliance a la tolerancia y la adherencia a la terapia oral puede ser monitoreada.
TRATAMIENTOS ESPECÍFICOS DE ACUERDO A RESCATES:
Estafilococos s/p.
Si se trata de un estafilococo sensible a meticilina, se recomienda nafcilina, oxacilina (1,5 gr IV cada 4 horas); si es meticilino resistente se recomienda vancomicina (30 mg/kg/24 hs en dos dosis iguales, no excediendo de 2 gr/día a menos que las concentraciones en suero sean inapropiadamente bajas.
Estreptococos s/p.
Si el estreptococo es muy sensible a penicilina (CIM de menos de 0,12 mcg/mL) se recomienda tratamiento con ceftriaxona (1 a 2 g IV cada 24 hs) o penicilina G (12 a 18 millones U/día por infusión continua o en seis dosis divididas.
Si el estreptococo tiene una sensibilidad intermedia o es totalmente resistente a penicilina, generalmente se lo trata con ceftriaxona o mayores dosis de penicilina (24 millones de U/día por infusión continua o en seis dosis divididas.
Bacilos Gram-negativos.
La elección de un agente específico para terapia empírica, debe basarse en el conocimiento de los patógenos prevalentes (y patrones de sensibilidad) dentro de un contexto hospitalario. El tratamiento inicial con uno de los siguientes es apropiado:
• Cefalosporinas de tercera generación (ceftriaxona 1 a 2 g IV diarios o ceftazidima r g IV cada 8 horas, o cefotaxima 2 g IV cada seis horas).
• Cefalosporinas de cuarta generación (cefepime 2 g IV cada 12 horas).
• Fluoroquinolonas (ciprofloxacina 400 mg cada 12 horas o 500 a 750 mg por vía oral cada 12 horas).
TERAPIA PARA OSTEOMIELITIS CULTIVOS NEGATIVAS.
Un régimen apropiado es vancomicina (30 mg/kg cada 24 hs a menos que las concentraciones séricas sean inapropiadamente bajas), más una de los siguientes: cefotaxime (2 gr cada seis horas), ceftazidime ( 1 a 2 g IV cada 12 horas), ceftriaxona (1 a 2 g IV diarios), cefepime (2 g IV cada 12 horas), o ciprofloxacina (400 mg IV cada 12 horas, o 500 a 750 mg por vía oral cada 12 horas).
Los anaerobios son raros patógenos en pacientes con osteomielitis vertebral, y no se debe agregar cobertura para anaerobios en la terapia empírica inicial. Tal cobertura que puede ser brindada por ticarcilina-clavulánico (3,1 g IV cada seis horas) o agragando metronidazol 500 mg IV cada 6 horas) a una terapia combinada, deben darse en dos situaciones:
1) si los hallazgos clínicos son sugestivos de infección por anaerobios (por ejemplo pacientes con abscesos intraabdominales), o
2) si el Gram es positivo y no existe desarrollo en los cultivos.
Si la terapia empírica no resulta en un mejoramiento clínico objetivo en tres a cuatro semanas, una tercer biopsia con aguja percutánea o cirugía abierta deben ser llevadas a cabo.
ROTACIÓN A MEDICACIÓN ORAL.
Si hay buena respuesta clínica a la terapia parenteral, después de varias semanas de terapia intravenosa, se debe considerar el cambio a la vía oral. Esto debe hacerse si existe una droga de probada susceptibilidad para el germen en cuestión, y si la terapia oral puede ser vigilada y monitoreada de cerca.
DURACIÓN DEL TRATAMIENTO.
El mínimo es seis semanas. Terapias más largas (doce semanas) pueden ser necesarias en pacientes con enfermedad avanzada, manifestada por la destrucción ósea importante y/o infección paravertebral.
MEDIDAS ADICIONALES.
El reposo en cama, y los opioides son generalmente útiles en manejar el dolor del paciente. Un corset ballenado puede brindar alivio.
El reposo en cama puede ser particularmente importante, especialmente en osteomielitis lumbar. El reposo debe durar por lo menos los primeros 10 días de tratamiento.
ROL DE LA CIRUGÍA.
La cirugía es necesaria en una minoría de pacientes con osteomielitis vertebral. Hay tres principales indicaciones:
• Progresión de la enfermedad a pesar de una terapia antimicrobiana adecuada específica o empírica.
• Compresión medular, o amenaza de que ello ocurra debido a colapso vertebral y/o inestabilidad de la columna.
• Drenaje de un absceso epidural o paravertebral.
Las técnicas quirúrgicas mínimamente invasivas incluyen toracoscopía, laparoscopía, debridamiento transpedicular percutáneo, y discectomía, así como procedimientos video asistidos usando incisiones abiertas limitadas son usadas en una minoría de casos.
Si el absceso paravertebral o epidural está presente, el drenaje con catéter guiado por TAC es usualmente suficiente. Sin embargo, el drenaje quirúrgico abierto, el debridamiento óseo quirúrgico, y la fusión de cuerpos vertebrales (con o sin injerto e instrumentación posterior) son ocasionalmente requeridos.
ROL DE LAS IMÁGENES.
La utilidad de obtener imágenes cuatro a ocho semansa después de completar el tratamiento de la osteomielitis vertebral se indica solamente en aquellos pacientes que tuvieron una evolución errática o empeoramiento del status clínico al final de la terapia.
PRONÓSTICO.
La complicación más seria de la osteomielitis vertebral es el compromiso neurológico secundario ya sea a la formación de un absceso epidural, o al aplastamiento vertebral. La mayoría pero no todos los pacientes tienen mejoramiento gradual del dolor lumbar después del comienzo de la terapia, y el dolor desaparece del todo cuando se produce la fusión ósea definitiva. Sin embargo, puede a veces persistir. La mejor forma de reducir la morbi-mortalidad asociada a osteomielitis vertebral es limitar el tiempo entre el inicio de los síntomas y la iniciación de la terapia apropiada.
Los factores de riesgo independientes de muerte o síntomas residuales incluyen:
• Compromiso neurológico en el momento del diagnóstico (por ejemplo debilidad motora, inestabilidad espinal, parálisis).
• Infección adquirida nosocomialmente.
• Retraso en el diagnóstico.
MORTALIDAD.
En la era antibiótica, la mortalidad por osteomielitis vertebral es de 5%, y la tasa de déficits neurológicos residuales es de menos de 7%.
Fuentes consultadas.
UpToDate 2010.
Emedicine. com
The New England Journal of Medicine.
Presentó:
Dra. Florencia González.
Residente de Clínica Médica.
Hospital Municipal de Azul.