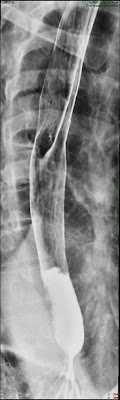
Radiografía de cuello de un hombre de 46 años que se presentó al departamento de emergencias por fiebre de 3 días de evolución, disfagia, odinofagia, babeo y disfonía.
Cuál es el diagnóstico?
La Rx muestra el clásico signo del pulgar (classic "thumbprint sign") (Fig 1 flecha) característico de la epiglotitis. El paciente tuvo un distress respiratorio progresivo, y requirió una intubación de urgencia. En la laringoscopía directa se observó una epiglotis inflamada. La vía aérea estaba casi completamente obstruída y permitió solo el pasaje de un tubo endotraqueal de pequeño calibre.
Se comenzó la terapia con amoxicilina-clavulánico y corticosteroides. El paciente se recuperó bien, y el tubo endotraqueal fue retirado al 5º día.
Se comenzó la terapia con amoxicilina-clavulánico y corticosteroides. El paciente se recuperó bien, y el tubo endotraqueal fue retirado al 5º día.
Figura:
Clásico signo del pulgar ("thumbprint sign") (flechas) característicos de la epiglotitis.
Antes del uso difundido de la vacuna contra Haemophilus influenzae tipo B, la epiglotitis ocurría principalmente en niños. Recientemente, la incidencia ha disminuido entre los niños y ha aumentado entre los adultos. (1) La epiglotitis del adulto es diferente de su contrapartida pediátrica, en el sentido de que la identificación del germen es menos común (2) y la mortalidad mayor. De 15% a 21% de los pacientes requieren ya sea intubación endotraqueal o traqueostomía de emergencia. (1,3) Los casos restantes pueden ser tratados solamente con antibióticos. En ciertos casos los corticoides intravenosos pueden ser beneficiosos.
El síntoma más común es el dolor de garganta, odinofagia y disfonía. (3) La Rx lateral de cuello tiene una sensibilidad de 88%, mientras que la laringoscopía es el procedimiento de mayor precisión diagnóstica. (2) El reconocimiento temprano de esta condición y la preservación de la permeabilidad de la vía aérea es crucial para evitar una posible evolución fatal.
Traducción de:
Adult epiglottitis
Che-Kim Tan, Khee-Siang Chan and Kuo-Chen Cheng
Department of Intensive Care Medicine, Chi-Mei Medical Center, Yungkang, Tainan, Taiwan
CMAJ. 2007 February 27; 176(5): 620, 624.
Conclusiones del Caso.
El síntoma más común es el dolor de garganta, odinofagia y disfonía. (3) La Rx lateral de cuello tiene una sensibilidad de 88%, mientras que la laringoscopía es el procedimiento de mayor precisión diagnóstica. (2) El reconocimiento temprano de esta condición y la preservación de la permeabilidad de la vía aérea es crucial para evitar una posible evolución fatal.
Traducción de:
Adult epiglottitis
Che-Kim Tan, Khee-Siang Chan and Kuo-Chen Cheng
Department of Intensive Care Medicine, Chi-Mei Medical Center, Yungkang, Tainan, Taiwan
CMAJ. 2007 February 27; 176(5): 620, 624.
Conclusiones del Caso.
Recuerdo anatómico.
la epiglotis forma la pared posterior del espacio valecular debajo de la base de la lengua (Figura 2). Está conectada al cartílago tiroides y al hueso hioides por ligamentos. La epiglotis es un fino cartílago que está cubierto anteriormente por una capa de epitelio escamoso estratificado. Esta capa escamosa también cubre el tercio superior de la superficie posterior, donde se une al epitelio respiratorio que se extiende a la laringe. La capa epitelial escamosa es redundante sobre el cartílago, creando un gran espacio potencial o virtual.
Patogénesis.
La obstrucción de la vía aérea, que puede resultar en paro cardiorespiratorio, es rápidamente progresivo. Los signos de obstrucción de la vía aérea (estridor, ronquido inspiratorio, retracción intercostal y supraesternal, taquipnea, y cianosis) pueden estar ausentes hasta muy tardíamente en el curso de la enfermedad, cuando la obstrucción de la vía aérea es casi completa.
Etiología.
En los niños el Haemophilus influenzae tipo b (Hib) es el agente infeccioso más común, aunque bajó después de la vacunación masiva. Otros H. influenzae (tipos A, F), estreptococos y estafilocoscos.
En adultos una variedad de bacterias, virus y hongos pueden ser causa: Haemophilus influenzae type b (Hib) H. influenzae types A y F, Haemophilus parinfluenzae, Streptococcus pneumoniae, Staphylococcus aureus, Beta-hemolytic streptococci: Grupos A, B, C, F, G, Pasteurella multocida, Moraxella catarrhalis, Klebsiella pneumoniae, Neisseria spp, Escherichia coli, Enterobacter cloacae, Pseudomonas aeruginosa(inmunocomprometidos).
Causas virales: Herpes simplex virus tipo 1, Varicella zoster virus, Parainfluenza virus tipo 3, Influenza B virus, Epstein-Barr virus.
Fúngicas: Cándida (inmunocomprometidos).
Causas no infecciosas:Causas traumáticas: incluyen injuria térmica, cuerpos extraños, e ingestión cáustica. La epiglotitis también puede raramente ocurrir como complicación de transplante de órgano sólido o médula ósea (por ejemplo como manifestación de enfermedad linfoproliferativa o enfermedad de injerto vs huésped).
Los factores de riesgo en niños incluyen la vacunación incompleta, mientras que en los adultos, las comorbilidades como la hipertensión arterial, la diabetes mellitus, el abuso de sustancias, y las deficiencias inmunes.
Manifestaciones Clínicas.
Presentación
El objetivo primario en el manejo de pacientes con epiglotitis es hacer un diagnóstico definitivo e iniciar tratamiento antes del comienzo de la obstrucción de la vía aérea. El foco del tratamiento es el mantenimiento de la vía aérea. En pacientes con total o casi total obstrucción de la vía aérea, el control de la vía aérea necesariamente precede a la evaluación diagnóstica.Los hallazgos clínicos de obstrucción de la vía aérea difieren con la edad, la severidad, y la etiología. Los niños pequeños, clásicamente se presentan con dificultad respratoria, ansiedad, y la característica postura en “trípode” o de “olfateo” (“tripod” u “sniffing”) (Figuras 3 y 4)
Figura 3.
La posición en “trípode” (el tronco inclinado hacia adelante, el cuello hiperextendido, y el mentón apuntando hacia adelante) es indicativo de epiglotitis. Nótese la apariencia tóxica del niño.
La posición en “trípode” (el tronco inclinado hacia adelante, el cuello hiperextendido, y el mentón apuntando hacia adelante) es indicativo de epiglotitis. Nótese la apariencia tóxica del niño.
Figura 4.
Esta niña de 4 años tiene epiglotitis causado por Haemophilus influenzae tipo b. A) Ella prefiere estar sentada y parece ansiosa. B) La niña asume la característica posición de olfateo o de aspirar, posición que maximiza la permeabilidad de la vía aérea.
Sin embargo, la presentación puede ser sutil (Figura 5). Los niños mayores, y adolescentes pueden presentarse con dolor de garganta severo pero con examen orofaríngeo relativamente normal.

Figura 5
Este niño de un año parece levemente ansioso pero mucho menos tóxico que los pacientes con la presentación clásica.
Figura 5
Este niño de un año parece levemente ansioso pero mucho menos tóxico que los pacientes con la presentación clásica.
Niños.
Síntomas en niños:
• Dificultad respiratoria(80%).
• Estridor (80).
• Voz apagada o ronquera (79%.
• Faringitis (73%).
• Fiebre (57%).
• Dolor de garganta (50%).
• Dolor en región anterior del cuello (38%).
• Tos (30%).
• Dificultad deglutoria (26%).
• Cambios en tono de voz (20%).
Adultos.Los síntomas de presentación de la epiglotitis en adultos incluyen:
• Dolor de garganta u odinofagia (90 a 100%).
• Fiebre de más de 37,5 ºC (26 a 90%).
• Voz apagada (50 a 80%).
• Babeo (15 a 65%).
• Estridor o compromiso respiratorio (33%.
• Ronquera (20 a 40%).
La progresión de los síntomas en adultos es más lenta que en niños. En una serie de 106 pacientes, 65 por ciento se presentaron dos días después del inicio de los síntomas de inicio, pero 9% se presentaron más de una semana después.
Examen.
• Dificultad respiratoria moderada a severa: En niños con moderada a severa dificultad respiratoria y elementos clínicos de epiglotitis (por ejemplo ansiedad, “sniffing”(Fig 4), y signos d ecompromiso de vía aérea superior, particularmente estridor, babeo, o postura en “trípode” (Fig 3)), debe sospecharse epiglotitis sin realizar un examen intraoral. Debe mantenerse al niño lo más calmado posible, y acompañárselo a la sala de operaciones con un experimentado anestesista o cirujano. En la sala de operaciones, la epiglotis y la vía aérea deben ser visualizadas vía laringoscopía directa o broncoscopía, y en algunas circunstancias controladas, debe establecerse una vía aérea artificial.
• Dificultad respiratoria leve: en niños en quien la epiglotitis sea una posibilidad, pero en quien, otros diagnósticos sean considerados más probables, el niño debe ser colocado con delicadeza en posición sentado, preferentemente en las rodillas de uno de sus padres, y examinado con cuidadosa dedicación con un bajalenguas o laringoscopía indirecta (por ejemplo un examen con espejo o nasofaringoscopio flexible). Este examen también debe realizarse en un ámbito donde pueda asegurarse la permeabilidad de la vía aérea si esto fuera necesario, en el departamento de emergencias, sala de operaciones o unidad de cuidaos intensivos dependiendo del grado de dificultad respiratoria. Como alternativa, para niños en quienes un examen oral aumenta mucho la ansiedad, una Rx lateral de cuello puede ser obtenida.
Hallazgos del examen: El examen de la cavidad oral y la orofaringe en pacientes con epiglotitis es normal en la mayoría de los pacientes. Puede verse aumento de secreciones. El complejo laringotraqueal puede ser doloroso a la palpación, particularmente en la región del hueso hioides.
Los hallazgos en la epiglotitis incluyen: inflamación y edema de las estructuras supraglóticas (epiglotis, pliegue aritenoepiglótico, y cartílago aritenoides) (Figura 6). Las cuerdas vocales falsas pueden estar comprometidas.
Una epiglotis hinchada, de aspecto de cereza, y un tubo endotraqueal pasando por su región posterior.
Laboratorio:
Los estudios de laboratorio no deben ser llevados a cabo en pacientes con sospecha de epiglotitis hasta que la vía aérea sea asegurada. El laboratorio debe incluir examen completo de sangre con recuento diferncial, cultivos de sangre, y cultivo epiglótico en los pacientes intubados. La mayoría de los pacientes tienen recuento elevado de glóbulos blancos, pero este es un dato inespecífico.
Hallazgos radiográficos.
Hallazgos radiográficos.
Los hallazgos radiográficos incluyen:
• Una epiglotis agrandada protruyendo en la pared anterior de la hipofaringe (el “signo del pulgar” "thumb sign") (Fig 7). En adultos con epiglotitis, el ancho de la epiglotis es usualmente de más de 8 mm.
Figura 7.
A) Epiglotis normal en la Rx lateral de cuello, con un dibujo de dicha región en cuadro B. En los cuadros C yD un paciente con epiglotitis.
A) Epiglotis normal en la Rx lateral de cuello, con un dibujo de dicha región en cuadro B. En los cuadros C yD un paciente con epiglotitis.
• Pérdida del espacio aéreo vallecular, un hallazgo que puede ser pasado por alto.
• Engrosamiento de los pliegues aritenoepiglóticos (Figura 8). En adultos con epiglotitis, el ancho de los pliegues aritenoepiglóticos son usualmente de más de 7 mm.
• Engrosamiento de los pliegues aritenoepiglóticos (Figura 8). En adultos con epiglotitis, el ancho de los pliegues aritenoepiglóticos son usualmente de más de 7 mm.
Figura 8.
Radiografía lateral de cuello que demuestra una epiglotis hinchada (flecha) y pliegues aritenoepiglóticos en un niño con epiglotitis debida a Haemophilus influenzae tipo b. La epiglotis hinchada es a menudo llamada “signo del pulgar”
• Hipofaringe distendida (inespecífica)
• Rectificación de la lordosis cervical fisiológica (inespecífico).
• Rectificación de la lordosis cervical fisiológica (inespecífico).
Complicaciones:
• Absceso epiglótico. Puede resultar de una infección coalescente o una infección secundaria de un mucocele epigótico. El absceso epiglótico ocurre predominantemente en adultos y puede complicar al 30% de los pacientes. Estos pacientes tienen más riesgo de compromiso de la vía aérea. Puede verse por laringoscopía o por TAC, que debe realizarse solo en pacientes estables. Requiere drenaje además de antibióticos.
• Infección secundaria (neumonía, adenitis cervical, celulitis, artritis séptica, y meningitis) que ocurren como consecuencia de bacteriemia o extensión directa.
• Epiglotitis necrotizante, que es un complicación rara de la epiglotitis en pacientes con inmunodeficiencias (HIV, linfohistiocitosis hemofagocítica).
• Muerte, en niños menos de 1% y adultos menos de 3,3%. La mayoría de las muertes son por obstrucción de la vía aérea y ocurren camino del hospital o rápidamente después del arribo al mismo.
Diagnóstico:
Figura 9.
Epiglotis normal y epiglotitis.
A) Epiglotis normal. B) Edema y eritema característicos de la epiglotitis aguda.
Microbiología.El diagnóstico etiológico debe hacerse por cultivo del organismo patógeno de la sangre o de la superficie de la epiglotis. El hisopado de la epiglotis es dificultoso, puede ser peligroso, está contraindicado en pacientes no intubados, y son positivos en 33 a 75% de los pacientes con epiglotitis. Los hemocultivos son positivos en 70% de los casos en niños y entre 0 y 17% en adultos.
Diagnóstico diferencial.
El diagnóstico diferencial de la epiglotitis incluye otras causas de obstrucción de la vía aérea incluyendo:
• Laringotraqueítis (crup) o crup espasmódico (respuesta angioedema-like con menos inflamación visible por laringoscopía).
• Uvulitis.
• Traqueítis bacteriana.
• Abbsceso peritonsilar o retrofaríngeo.
• Cuerpo extraño alojado en la laringe o en la valécula.
• Angioedema (anafilaxia o angioedema hereditario)
• Anormalidades congénitas de la vía aérea.
• Difteria.
Tratamiento y Prevención.Principios generales.
• Mantenimiento de la vía aérea.
• Administración de agentes antimicrobianos apropiados. Los antimicrobianos pueden no ser necesarios en los raros casos en quienes la causa del edema epiglótico es claramente conocido, como los causados por injuria térmica, inhalacional, química o térmica.
Los pacientes con sospecha de epiglotitis deben ser monitoreados cautelosamente por clínicos capaces de llevar a cabo una rápida resucitación, en un ámbito con equipamiento necesario para la estabilización de la vía aérea y ventilación (por ejemplo en departamento de emergencias, sala de operaciones o unidad de cuidados intensivos).
Se debe administrar oxígeno humidificado si está indicado.
El manejo de la vía aérea es crítico en estos pacientes, y si es necesario deben ser intubados por personal altamente entrenado. En ocasiones puede estar indicada la cricotirotomía. En los niños, dado el pequeño diámetro de la vía respiratoria y el riesgo de la progresión rápida a obstrucción completa, muchas veces se requieren la colocación de una vía aérea artificial, aún en aquellos que no presenten una dificultad respiratoria muy importante. Con la intubación precoz, se logró disminuir la mortalidad en una serie de 749 casos de epiglotitis de 6% a menos de 1%. Esta tendencia a la intubación precoz es mayor en niños de menos de 6 años de edad, y en algunas situaciones como la de aquellos pequeños para la edad, obesos, o la presencia de enfermedades caríacas, pulmonares, o metabólicas.
En adultos el manejo de la vía aérea es controversial. Algunos autores sugieren que se debe colocar una vía aérea artificial en adultos con epiglotitis, mientras que otros sugieren un approach m´ñas selectivo, basados en los hallazgos de la laringoscopía.
En general, los adultos con epiglotitis y severa dificultad respiratoria (por ejemplo con estridor, babeo, posición sentada erecta, cianosis), o 50% de obstrucción de la luz en la laringoscopía, deben someterse a la colocación de una vía aérea artificial. Los que tienen menos de 50% de compromiso de la luz laríngea deben ser cuidadosamente monitoreados en una unidad de cuidados intensivos sin colocación de una vía aérea artificial.
La administración de oxígeno humidificado suplementario puede ser administrado.
Para resumir, las indicaciones de la colocación de una vía aérea artificial en pacientes con epiglotitis son:
• Edad menor de 4 a 6 años, especialmente con comorbilidades.
• Severa dificultad respiratoria (“sniffing”, o posición en “trípode”), estridor, babeo, cianosis.
• Absceso epiglótico.
• Rápido inicio y progresión de los síntomas.
• Más de 50% de obstrucción de la luz laríngea.
• Comorbilidades como diabetes o inmunodeficiencias (especialmente en adultos)
La elección del tipo de vía aérea se establece de acuerdo a la situación médica en particular, y a la experiencia del médico que lleva a cabo el procedimiento.
• Intubación endotraqueal. Si puede ser exitosamente llevada a cabo, la intubación endotraqueal (nasotraqueal u orotraqueal) es preferida a la traqueostomía. La intubación endotraqueal se asocia a duración más corta de la intubación y menor tiempo de internación. La intubación nasotraqueal es preferida a la orotraqueal debido a que es más fácil de mantener el tubo endotraqueal en su lugar. Las complicaciones a largo plazo de la intubación nasotraqueal son raras.
• Traqueostomía. La traqueostomía se reserva para pacientes en quienes la intubación endotrqueal no es posible.
• Cricotiroidotomía. La cricotiroidotomía quirúrgica (cricotirotomía) puede ser necesaria si ni la intubación endotraqueal ni la traqueostomía pueden ser llevadas a cabo.
Criterios de extubación.La intubación por 2 a 3 días es usualmente necesaria, antes de que la extubación pueda ser llevada a cabo con seguridad. Los criterios de extubación incluyen la resolución de la hinchazón epiglótica/supraglótica, indicada por laringoscopía y/o escape de aire de la vía aérea peritubo, resolución de la fiebre,y capacidad de tragar confortablemente.
Glucocorticoides.El rol de los glucocorticoides en el manejo de la vía aérea de los pacientes con epiglotitis es controversial. El uso racional inicial de glucocorticoides reduce la inflamación y mejora el pasaje de aire por la vía aérea.
Sin embargo se sugiere que no sean usados rutinariamente en el tratamiento inicial de los pacientes con epiglotitis, y se los reserva para aquellos pacientes que no se han podido extubar después de varios días de terapia antimicrobiana apropiada.
Terapia antimicrobiana empírica.La epiglotitis es una entidad infecciosa que pone en riesgo la vida, por lo tanto, la terapéutica dee ser iniciada antes del resultado de los cultivos. El régimen antibiótico debe tener cobertura para los siguientes patógenos:
• Haemophilus influenzae tipo b.
• Neumococo resistente a penicilina.
• Estreptococo beta hemolítico.
• Estafilococo aureus, incluyendo los meticilino resistentes de la comunidad.
La elección del agente depende del patrón de resistencia de los patógenos y del estado del paciente. Se sugiere una combinación de una cefalosporina de tercera generación (ceftriaxona o cefotaxima) y un agente antiestafilocóccico meticilino resistente (clindamicina, vancomicina). Se usa vancomicina cuando hay sepsis severa, aquellos que tienen meningitis concomitante, y en lugares donde hay aumento de la prevalencia de estafilococo aureus meticilino resistente, y resistentes a clindamicina.
Si hay alergia a betalactámicos se puede usar vancomicina más una quinolona.
Con el arribo de los cultivos, la terapia debe ajustarse a la sensibilidad del antibiograma.
La duración del tratamiento es de 7 a 10 días dependiendo de la respuesta clínica. Si hay bacteriemia documentada se requiere más tiempo, lo mismo que en meningitis o inmunodeficiencia.
Después de unos días de control del cuadro se puede rotar a la vía oral.
Prevención.
La prevención de la infección por HiB a través de la inmunización y/o quimioproflaxis de los contactos pueden ser necesaria.
Fuente:
UpToDte.
Emedicine.com
The New England Journal of Medicine.
Canadian Medical Association Journal