cias con malestar general, mialgias generalizadas y rash que se diseminó a toda la superficie corporal. Su, novio que la acompañó a la guardia dijo que los síntomas habían comenzado el día anterior y que mejoraron con ibuprofen. Dijo además que ella había tenido vómitos y que presentó un episodio de confusión durante la noche. Luego había comenzado una cefalea de moderada intensidad difusa que se irradiaba a cuello y empeoraba con los movimientos. No tenía fotofobia, mareos ni convulsiones.
cias con malestar general, mialgias generalizadas y rash que se diseminó a toda la superficie corporal. Su, novio que la acompañó a la guardia dijo que los síntomas habían comenzado el día anterior y que mejoraron con ibuprofen. Dijo además que ella había tenido vómitos y que presentó un episodio de confusión durante la noche. Luego había comenzado una cefalea de moderada intensidad difusa que se irradiaba a cuello y empeoraba con los movimientos. No tenía fotofobia, mareos ni convulsiones.En el examen físico estaba somnolienta y con un malestar general. La temperatura oral era de 38,3 ºC. Estaba taquicárdica e hipotensa, con una frecuencia cardíaca de 120 por minuto y una TA de 80/60 mmHg. La saturación de oxígeno era normal. Hacía gestos de dolor ante la movilización de sus articulaciones particularmente con los movimientos del cuello. Las pupilas medían 3 mm y eran iguales y reactivas. Su examen neurológico era normal excepto por su estado de conciencia somnoliento. Había un rash purp
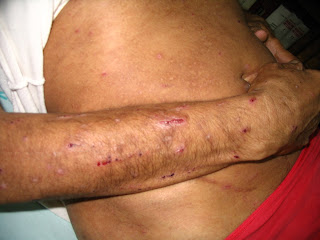
 úrico no doloroso en miembros, tronco y cara (figuras 1 y 2). Resto de examen físico normal
úrico no doloroso en miembros, tronco y cara (figuras 1 y 2). Resto de examen físico normalLaboratorio: Glóbulos blancos 17,600/mm3 Hb 13,6 g/dl y plaquetas 54000/mm3. Creatinina 3,3 mg/dl y urea 57 mg/dl. Los electrolitos eran normales. La mioglobina y la CPK estaban elevadas a 332 ug/L y 149 U/L respectivamente. El RIN era de 2,14. El dímero D estaba marcadamente elevado a >10 ug/ml (10 mg/L). Test de embarazo negativo. Se enviaron cultivos al laboratorio.
Cual es el diagnóstico?
N meningitidis se disemina a través de la inhalación de secreciones respiratorias transmitidas por un portador. El inicio de los síntomas ocurre aproximadamente 3 a 4 días después de la inoculación. El paciente típicamente comienza a tener síntomas de enfermedad respiratoria, seguida de fiebre, cefalea y vómitos; esto rápidamente progresa a cambios en el estado mental (tal como le
 targia y confusión).
targia y confusión).La infección meníngea probablemente resulte de diseminación hematógena, ya que N meningitidis puede ser aislada de hemocultivos en 75% de los pacientes. La sepsis meningocóccica con compromiso multisistémico, sin embargo, ocurre en solo 1/5 de los casos de meningitis causada por N meningitidis. La tasa de mortalidad de la sepsis meningocóccica es muy alta; mayorque la de la meningitis aislada. El síndrome de Waterhouse-Friderichsen es una de las más severas complicaciones de la infección meningocóccica. Aunque se caracteriza por la disfunción multiorgánica en presencia de infección meningocóccica, el síndrome es más típicamente definido por hemorragia en glándulas suprarrenales. (2,3,4)
Un rash purpúrico típico puede ser visto como resultado de septicemia. Esto usualmente aparece primero en tronco y extremidades y subsecuentemente se disemina por toda la superficie corporal. El desarrollo de púrpura fulminans (PF), una condición hemorragípara que pone en riesgo la vida, caracterizada por coagulación intravascular diseminada (CID), y púrpura, indican mal pronóstico. Aunque la presencia de PF es clásica de la infección meningocóccica, otras múltiples causas pueden ser responsables del cuadro y deben ser consideradas. Tres categorías de PF son reconocidas: PF infecciosa aguda, PF idiopática, y PF por anormalidades en el sistema de coagulación. Ocasionalmente, la infección meningocóccica causa solo enfermedad focal, tal como conjuntivitis, artritis séptica, uretritis, pericarditis purulenta, o infección del tracto respiratorio (por ej neumonía, epiglotitis y otitis media). (2)
El diagnóstico de síndrome de Waterhouse-Friderichsen (o de sepsis meningocóccica en general) debe ser hecho tempranemente y debe estar basado en los hallazgos clínicos de fiebre, rash purpúrico, alteración del estado mental, signos meníngeos, hipotensión y shock séptico. Los tests específicos deben ser usados para confirmar el diagnóstico y para guiar el tratamiento subsecuente, pero no deben retrasar la iniciación de la terapia. Un esfuerzo debe hacerse para obtener cultivos antes de comenzar a administrar antibióticos al paciente. Los resultados típicamente no están disponibles hasta después de 12 a 24 horas; sin embargo, pueden guiar la terapia cuando son recibidos. Una punción lumbar con análisis del líquido cefalorraquídeo (LCR) debe incluir recuento celular diferencial, cultivos, tinción de Gram y concentración de proteínas y glucosa. La presencia de meningitis es identificada por leucocitosis con predominio polimorfonuclear, una concentra
 ción elevada de proteínas y una baja concentración de glucosa. La tinción de Gram es a menudo negativa en las meningitis. Los cultivos pueden ser obtenidos del líquido sinovial, pleural o pericárdico si existieran. Hay otros métodos además de los hemocultivos para identificar al meningococo, tales como la detección de antígenos meningocóccicos de líquidos biológicos. Este método es rápido y puede proveer una identificación exacta del serogrupo, pero comúnmente produce resultados falsos negativos. Una reacción en cadena de polimerasa (PCR) puede también identificar serogrupos específicos y no requiere la presencia de organismos vivos. (4)
ción elevada de proteínas y una baja concentración de glucosa. La tinción de Gram es a menudo negativa en las meningitis. Los cultivos pueden ser obtenidos del líquido sinovial, pleural o pericárdico si existieran. Hay otros métodos además de los hemocultivos para identificar al meningococo, tales como la detección de antígenos meningocóccicos de líquidos biológicos. Este método es rápido y puede proveer una identificación exacta del serogrupo, pero comúnmente produce resultados falsos negativos. Una reacción en cadena de polimerasa (PCR) puede también identificar serogrupos específicos y no requiere la presencia de organismos vivos. (4)Sin tratamiento rápido, la tasa de mortalidad del síndrome de Waterhouse-Friderichsen es casi 100%. Aún con un rápido y óptimo tratamiento, aproximadamente 40% de los pacientes con sepsis meningocóccica no sobreviven. Cuando la CID está presente, la mortalidad es tan alta como 90%. La mortalidad global de la enfermedad menincocóccica es 10 a 20, los sobrevivientes tienen el mismo porcentaje de secuelas neurológicas (discapacidad neurológica, pérdidads de un miembro y trastornos de la audición). (4,5)
Lo más importante desde el punto de vista terapéutico es la administración temprane de antibióticos. Los antibióticos deben ser administrados empíricamente cada vez que haya aún una mínima sospecha de infección meningocóccica, debido a que la dilación en comenzar la terapia, expone al paciente al riesgo de enfermedad severa, discapacidad permanente, o muerte. Los agentes antimicrobianos comunes son activos contra especies de Neisseria. La penicilina G es usualmente la terapia antibiótica de primera línea, y tiene una baja tasa de prevalencia de resistencia. En áreas donde la resistencia es común, como en el Reino Unido, o España, las cefalosporinas de 3º generación, pueden ser utilizadas en reemplazo de la penicilina. El tratamiento inicial de un régimen de amplio espectro es recomendado es recomendado en cualquier paciente séptico, y después de recibir el resultado de los cultivos el espectro puede ajustarse a los resultados de los mismos. La terapia inicial debe también estar dirigida a el manejo agresivo de fluidos para mantener una adecuada tensión arterial. La administración de corticosteroides es controversial, pero está típicamente recomendado en casos con sepsis y meningitis. El debridamiento de la piel y el tejido subcutáneo, con subsecuente injerto y o amputación de miembros puede ser necesaria si la septicemia resulta en ua hipoperfusión periférica con necrosis de piel y necrosis ósea. En casos de meningococcemia fulminante, los pacientes deben ser inmediatamente transferidos a una unidad de cuidados intensivos, para una terapia más agresiva, sostén hemodinámica con vasopresores, y monitoreo hemodinámica. La proteína C activada puede ser útil en un número muy limitado de pacientes. El tratamiento de la CID incluye la administración de plasma fresco congelado. Tratamientos adicionales actualmente bajo investigación incluyen anticuerpos monoclonales dirigidos a los mediadores inflamatorios, tales como endotoxinas, factor de necrosis tumoral (TNF), interleukinas y gama-interferón. (4,5)
Todas las personas que han estado en contacto cercano con el paciente con infección meningocóccica están en riesgo elevado de contraer la enfermedad. La diseminación del meningococo ocurre vía secreciones respiratorias, y es fácilmente transmitidos a los contactos cercanos. Por esta razón, todos los miembros de la familia convivientes, compañeros de clse, staff médico, o cualquier otra persona recientemente en contacto cercano con el paciente debe ser considerado en riesgo de contraer la enfermedad. La probabilidad de transmisión varía con la duración y la cercanía de la exposición; es mayor durante los primeros días siguiendo al inicio de la enfermedad. El riesgo de transmisión es mayor con acciones que resultan en una exposición directa a las secreciones de las mucosas, incluyendo besar, respiración boca a boca, compartir alimentos, lentes, beber del pico de la misma botella, o compartir cigarrillos. Las personas que han compartido más de 8 horas en proximidad del paciente infectado, o quienes han tenido contacto con las secreciones del paciente dentro de la semana anterior de los síntomas de comienzo deben recibir tratamiento profiláctico. La quimioprofilaxis debe ser administrada tan pronto como sea posible, ya que la eficacia de la profilaxis es muy baja si los antibióticos no se comienzan dentro de 10 a 14 días después de la exposición. Los cultivos de los tejidos orofaríngeos o nasofaríngeos no son útiles para determinar si los antibióticos son necesarios, y esperar los resultados de esos exámenes pueden causar una inapropiada dilación. En la administración del trat
 amiento profiláctico. Rifampicina, ciprofloxacina, o ceftriaxona son todas elecciones efectivas. La duración de la quimioprofilaxis debe ser de 1 a 2 díuas, dependiendo del antibiótico usado. Ciprofloxacina y ceftriaxona requieren una única dosis de tratamiento, y la rifampicina puede ser dada dos veces por día durante 48 horas, es decir cuatro dosis. (1,3,5)
amiento profiláctico. Rifampicina, ciprofloxacina, o ceftriaxona son todas elecciones efectivas. La duración de la quimioprofilaxis debe ser de 1 a 2 díuas, dependiendo del antibiótico usado. Ciprofloxacina y ceftriaxona requieren una única dosis de tratamiento, y la rifampicina puede ser dada dos veces por día durante 48 horas, es decir cuatro dosis. (1,3,5)Una vacuna está disponible para controlar los brotes de N meningitides. La vacuna polisacárida cuadrivalente es protectora contra todos los serogrupos, excepto el B, y su administración es recomendada en presencia de al menos 3 casos durante 3 meses o menos, o cuando 10 casos ocurren por 100.000 personas en una gran comunidad. La vacunación de rutinano es recomendada y no es costo-efectiva. (3,5)
La paciente del caso fue admitida a UTI después de la administración temprana de ceftriaxona intravenosa.
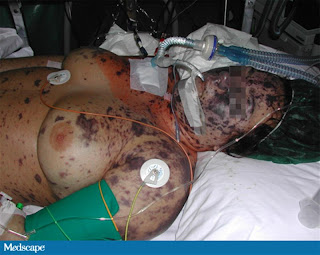
Los hemocultivos desarrollaron serogrupo C de N meningitidis. Pocas horas después de la admisión, las lesiones petequiales se hicieron progresivamente más grandes y rápidamente se hicieron hemorrágicas (Figuras 3 y 4)Terapia agresiva con líquidos, sostén vasopresor, plasma fresco y congelado y proteína C activada fueron administrados.
La paciente requirió ventilación mecánica después de desarrollar fallo insuficiencia respiratoria aguda. El fallo renal rápidamente fue seguido de diálisis. Sus manos y pies rápidamente se pusieron cianóticos (figura 5). A pesar de la terapia agresiva, la disfunción multiorgánica y CID desarrollaron; la paciente falleció 4 días después de la admisión. El examen post mortem confirmó sepsis meningocóccica y reveló meningitis aguda purulenta, apoplejía adrenal, microangiopatía trombótica confluente, y epidermolisis bullosa; esos hallazgos son consistentes con el diagnóstico de síndrome de Waterhouse-Friderichsen.
Referencias bibliográficas
1)Stephens DS, Greenwood B, Brandtzaeg P. Epidemic meningitis, meningococcaemia, and Neisseria meningitidis. Lancet. 2007;369:2196-210.
2)Rosenstein NE, Perkins BA, Stephens DS, Popovic T, Hughes JM. Meningococcal disease. N Engl J Med. 2001;344:1378-88.
3)Gardner P. Clinical practice. Prevention of meningococcal disease. N Engl J Med. 2006;355:1466-73.
4)Shah A, Lettieri CJ. Fulminant meningococcal sepsis in a woman with previously unknown hyposplenism. Medscape J Med. 2008;10:36.
5)Prevention and control of meningococcal disease. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2000;49:1-10.
Moreno Agostini, MD, Director, Intensive Care Unit (Anestesia e Rianimazione), Presidio Ospedaliero di Montebelluna, Azienda U.LSS. n.8 di Asolo, Montebelluna (TV), Italy
En: www.medscape.com
Recordar:
"no other infection so quickly slays" (The adage of W.W. Herrick regarding meningococcemia) ("ninguna otra infección mata tan rápido")
"When meningococcemia is recognized in its early stages, the skin lesions are usually small, pink macules or papules that can appear on any part of the body; treatment at this or the next stage, which is characterized by petechial lesions, will prevent death in almost all cases. However, when the disease progresses and a purpuric rash appears, as in this patient, mortality is greater than 50 percent even with the most aggressive therapyGiven the extraordinarily high benefit-to-risk ratio of penicillin in these circumstances, the threshold for its administration should be very low. British physicians' simple expedient of carrying penicillin G in their emergency bags and administering it promptly whenever meningococcal disease is suspected has reduced the case fatality rate for the disease by 40 percent. Even when the probability of meningococcemia is relatively remote, administration of antibiotics is a better choice than not treating the patient.The physician should not wait for confirmation of the diagnosis or for the appearance of purpura before administering antibiotics"