El paciente tenía antecedentes de artritis reumatoidea pero había estado por otro lado bien hasta 1 mes antes, cuando desarrolló gradualmente un cuadro de linfadenopatías en su cuello, axilas, e ingles, asociado a odinofagia y pérdida del apetito pero sin pérdida de peso.
Aproximadamente 1 semana antes de la evaluación comenzó con fatiga, náuseas, distensión abdominal, diarrea, y tos productiva de esputo blanquecino. En el examen, su médico de cabecera, 5 días antes de su evaluación actual, encontró con una TA de 118/70 mmHg, pulso de 108 latidos por minuto, temperatura de 37,3 ºC, y la saturación de oxígeno era de 98% mientras respiraba aire ambiente. Había lesiones blancas en la lengua lateralmente, y había ganglios linfáticos de hasta 2 cm de diámetro en las regiones submaxilar derecha, cervicales anteriores bilateralmente, cervicales posteriores izquierdas, y ambas regiones axilares. El resto del examen era normal. Los resultados de laboratorio s
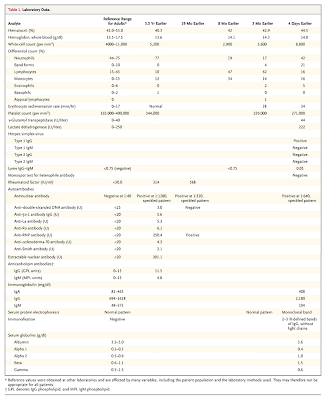 e muestran en la Tabla 1.
e muestran en la Tabla 1.Tabla 1. Datos de laboratorio.
Se le prescribió nistatina oral. El paciente volvió al día siguiente con sibilancias y rinorrea purulenta; en el examen físico había dolor a la palpación de los senos maxilares y un exudado seroso detrás de las membranas timpánicas. Las linfadenopatías habían disminuido de tamaño levemente. El tórax estaba claro a la auscultación. Una Rx de tórax reveló prominencia de los hilios y mediastino superior, sugestivo de linfadenopatía, y engrosamiento pleural biapical y cicatrices parenquimatosas bibasales que eran iguales a una Rx de 16 meses antes. Se comenzó tratamiento con levofloxacina.
Al día siguiente, una TAC de tórax, abdomen y pelvis después de la administración de contraste mostró ganglios linfáticos aumentados de tamaño desde 5 mm hasta 2,5 cm de diámetro en las regiones supraclaviculares bilaterales, axilares, hiliares, ilíacos externos e internos, regiones inguinales, mediastino y retroperitoneo. Algunos de los ganglios axilares contenían centros radiolúcidos, sugestivos de necrosis. Había fibrosis pulmonar biapical y basal, y dos nódulos pulmonares subpleurales del lado derecho, cada uno de 9 mm de diámetro. Una densidad redondeada de 2,5 cm de diámetro, estba presente en la región posterior al estómago, y la pared colónica estaba engrosada. El paciente fue derivado al onco-hematólogo.
El paciente no refirió tener dificultad respiratoria ni dolor torácico. La artritis reumatoidea había sido diagnosticada 3 ½ años antes, y se había manifestado como rigidez matinal, dolor articular, e inflamación principalmente en manos y pies, disminución el rango del movimiento en caderas y columna lumbar, además de los tests serológicos positivos. (Tabla 1) A los 18 años el paciente había tenido dolor e inflamación en codo derecho y ambos tobillos; se diagnosticó artritis reumatoidea juvenil. Los síntomas se resolvieron espontaneamente alrededor de los 20 años. Se le mencionó un diagnóstico de espondilitis anquilopoyética en algún momento, pero el paciente no refirió haber tenido dolor lumbar, iritis, úlceras aftosas, disuria o rash. A los 32 años, se le detectó un agrandamiento del bazo (19 cm medido por ecografía) incidentalmente en un examen durante la evaluación de colecistitis aguda; se llevó a cabo colecistectomía y esplenectomía. En el examen patológico, el bazo pesaba 400 grs, con cambios fibrocongestivos e hiperplasia linfoide reactiva. El examen patológico de la biopsia de médula ósea no mostró anormalidades.
Los síntomas de artritis reumatoidea fueron controlados con prednisona, metotrexato, ácido fólico, AINES, y leflunomida. Diecinueve meses antes de esta evaluación, desarrolló lesiones cutáneas en áreas expuestas al sol; el examen de la biopsia de piel mostró cambios consistentes con lupus eritematoso cutáneo subagudo. Se discontinuó el metotrexato, y se agregó hidroxicloroquina; las lesiones de piel se resolvieron. Un año antes de esta evaluación se discontinuaron los corticoides debido a candidiasis oral recurrente.
El monitoreo de laboratorio de rutina reveló recuentos intermitentemente bajos de leucocitos (Tabla 1) Tres meses antes de esta evaluación, el paciente fue referido al onco-hematólogo para evaluación de su neutropenia. EL examen de un frotis de sangre periférica reveló cuerpos de Howell-Jolly; Los tests de anticuerpos para HIV y virus de hepatitis A, B y C fueron negativos; los niveles séricos de calcio, fósforo, proteínas, y albúmina, y los tests de función hepática y renal fueron normales. Un centelleograma hepatoesplénico no mostró evidencias de bazo accesorio.
La neutropenia fue considerada en relación a la medicación del paciente, y se le aconsejó discutir algunos cambios en la medicación con su reumatólogo.
El paciente tuvo ocasionalmente reflujo gastroesofágico que era aliviado por pantoprazol. En la niñez había sido llevada a cabo una amigdalectomía. No tenía alergia a drogas. Había recibido la vacuna antineumocóccica después de la esplenectomía. Estaba casado por más de una década, y siempre había sido monógamo. No fumaba ni tomaba alcohol. Trabajaba como pintor y no había viajado recientemente. No había antecedentes familiares de enfermedades autoinmunes o cáncer hematológico. Los medicamentos incluian hidroxicloroquina, leflunomida, meloxicam, pantoprazol, ácido fólico, y levofloxacina; nunca había recibido antagonistas de factor de necrosis tumoral.
En el examen, la presión arterial era de 120/60 mmHg, y su peso de 68,2 kg. Había ganglios linfáticos agrandados, móviles, indoloros en las regiones cervical, supraclavicular, axilar e inguinal que eran más grandes del lado izquierdo que del derecho: un ganglio axilar del lado izquierdo medía 4 cm de diámetro. El resto del examen era normal. El KPTT y los tests de anticoagulante lúpico fueron normales.
Una semana más tarde, un procedimiento diagnóstico fue llevado a cabo.
Diagnóstico diferencial:
Dr. Nikhil C. Munshi: Puedo ver los estudios de imágenes?
Dr. Subba Digumarthy: La TAC de tórax, abdomen y pelvis, llevada a cabo después de la administración de material de contraste endovenoso mostró ganglios linfáticos agrandados en la fosa supraclavicular, axila, mediastino, así como en las regiones para-aórticas, ilíacas externas, y regiones inguinales (Figura 1A).

Figura 1.
El panel A muestra ganglios linfáticos agrandados (flecha) en ambas axilas. El panel B muestra realce en un nódulo de partes blandas en el lecho de la esplenectomía, consistente con bazo accesorio. El panel C muestra opacidades en vidrio esmerilado en pulmones (flechas) con distorsión arquitectural, hallazgos consistentes con fibrosis pulmonar
Pequeñas áreas del realce de contraste en el centro de algunos ganglios sugestivos de necrosis. El bazo está ausente. En el lecho esplénico hay clips quirúrgicos y una imagen de partes blandas nodular que realza con contraste; esta imagen es compatible con bazo accesorio (Figura 1B).
Hay múltiples opacidades reticulares en los vértices pulmonares, asociados a distorsión y pequeñas bronquiectasias, y opacidades en vidrio esmerilado y reticulares en las bases pulmonares, con distorsión arquitectural, y áreas limitadas de panalización (Figura 1C). Estos hallazgos son consistentes con fibrosis pulmonar, probablemente relacionada a artritis reumatoidea. Hay también algunos nódulos pulmonares dispersos, que pueden ser granulomas, ganglios linfáticos intraparenquimatosos, o tumores. Estos no pueden ser más precisamente estudiodos con otros estudios.
Dr. Munshi: El elemento clínico mayor de este caso es el rápido desarrollo de linfadenopatías generalizadas sistémicas, sin síntomas sistémicos tales como fiebre, sudoración nocturna, o pérdida de peso; un antecedente de reflujo gastroesofágico; enfermedad autoinmune activa tratada con corticoides y metotrexato; y un antecedente de esplenectomía. Un importante elemento de laboratorio es la presencia de una inmunoglobulina sérica monoclonal.
El diagnóstico diferencial consiste en complicaciones de la enfermedad autoinmune de este paciente, incluyendo causas infecciosas y trastornos linfoproliferativos, así como condiciones que mimetizan o están asociadas a trastornos autoinmunes. Es útil considerar el diagnóstico diferencial en ausencia de información provista por la electroforesis de proteínas séricas y la inmunofijación , y así, estrechar la lista de diagnósticos posibles con esos resultados en mente.
Linfomas indolentes:
La presencia de linfadenopatías generalizadas sin síntomas sistémicos prominentes, un hemograma y un recuento de blancos relativamente normal, y una LDH sérica relativamente baja sugieren un linfoma indolente. El más común de estos trastornos es el linfoma folicular. Sin embargo, el relativamente rápido crecimiento de los ganglios de este paciente no es típico del linfoma folicular, y además, es demasiado joven para esta enfermedad, que empieza generalmente en la sexta década.
Este paciente tiene historia de reflujo gastroesofágico, y refirió pérdida del apetito asociado al comienzo de las linfadenopatías. Los linfomas extranodales de la zona marginal del tejido linfoide asociado alas mucosas (linfoma MALT) típicamente afecta el estómago, donde se asocia a infección por Helicobacter pylori; sin embargo, la infección por H pylori no está asociada típicamente asociada a síntomas de enfermedad por reflujo gastroesofágico, y los linfomas que asientan en el contexto de una infección por H pylori, están típicamente localizados en el estómago, y raramente causan adenopatías generalizadas. El linfoma MALT de sitios no-gástricos están frecuentemente asociados a enfermedades autoinmunes, tal como síndrome de Sjögren, y enfermedad de Hashimoto; sin embargo, no están característicamente asociados a artritis reumatoidea, y afectan sitios extranodales tales como las glándulas salivales o la tiroides. La presentación con linfadenopatías de rápido crecimiento sería no común.
El linfoma linfoplasmocítico, típicamente asociado a macroglobulinemia de Waldenström, puede presentarse con linfadenopatías generalizadas, en pacientes que están por otro lado bien, y a menudo tienen una banda monoclonal en la corrida electroforética del suero. Este paciente es joven para tener macroglobulinemia de Waldenström, ya que la edad promedio de comienzo es en la séptima década de la vida, y este trastorno está caracterizado por la presencia de IgM más que IgG monoclonal.
Linfomas agresivos:
La presentación relativamente aguda y el crecimiento rápido de las linfadenopatías aumenta la sospecha de linfoma agresivo, tal como el linfoma difuso B de células grandes, o el clásico linfoma de Hodgkin. Estas enfermedades son más probables que los linfomas indolentes, ya que ocurren en personas relativamente jóvenes, como el paciente en discusión. La apariencia de un área de necrosis central dentro de algunos ganglios linfáticos en la TAC serían más típicos de un linfoma agresivo que de un linfoma indolente.
Los pacientes con una enfermedad autoinmune, tal como este paciente, quien tiene artritis reumatoidea y lupus eritematoso sistémico, tienen riesgo aumentado de presentar linfomas no-Hodgkin agresivos.
Además del riesgo asociado por presentar enfermedades autoinmunes, este paciente puede estar en un estado de inmunodepresión debido a las drogas tales como el metotrexato o antagonistas del factor de necrosis tumoral para tratar sus trastornos autoinmunes. Los pacientes con inmunodeficiencias iatrogénicas, están en riesgo de dearrollar linfomas agresivos, incluyendo tanto linfomas de Hodgkin, como linfomas difusos B de células grandes, que están usualmente asociados al virus de Epstein-Barr. Los linfomas agresivos más a menudo se presentan con linfadenopatías localizadas, más que generalizadas, y cuando la enfermedad está generalizada, el nivel de LDH está generalmente elevado, y los síntomas sistémicos son típicamente más severos que los que tiene este paciente, que a menudo incluyen fiebre, sudoración nocturna, y pérdida de peso. Este paciente ha recibido metotrexato pero no ha recibido antagonistas del factor de necrosis tumoral, y tanto metotrexato como prednisona han sido discontinuados mucho tiempo antes del comienzo de los síntomas del paciente; por lo tanto, un linfoma relacionado con la inmunosupresión parece improbable.
Infecciones:
La inmunodeficiencia debida al uso de metotrexato y corticosteroides puede predisponer a los pacientes a infecciones oportunistas. La tuberculosis, las infecciones virales, y las infecciones fúngicas son posibles en este paciente con linfadenopatías generalizadas y antecedentes de infección, incluyendo candidiasis oral. Sin embargo, la ausencia de fiebre y leucocitosis argumenta contra la presencia de infección sistémica. Aunque los pacientes que toman altas dosis de medicación inmunosupresora tales como corticosteroides pueden no tener fiebre a pesar de infecciones severas, este paciente había discontinuado el uso de prednisona. No hay evidencia serológica de enfermedad viral aguda.
Enfermedad de Castleman:
La enfermedad de Castleman multicéntrica, a menudo resulta de infección con herpes virus humano tipo 8, puede manifestarse como linfadenopatía generalizada, y puede estar asociada a infección por HIV; puede también estar asociado a paraproteína IgG. (1) Anemia, trombocitosis, una eritrosedimentación elevada, hipoalbuminemia, e hipergammaglobulinemia policlonal son comúnmente vistas; aunque la eritrosedimentación de este paciente está levemente elevada, no tiene ninguno de los otros hallazgos descriptos.
Gamapatía monoclonal:
Los resultados de la electroforesis sérica ordenados por el médico de cabecera justo antes de la consulta con el onco-hematólogo mostró una espiga en la región gama, compatible con la presencia de una inmunoglobulina monoclonal. Muchas condiciones (Tabla 2) están asociadas con la presencia en sangre de proteínas monoclonales compuestas de moléculas de inmunoglobulinas intactas, o, menos comúnmente con, tanto cadenas pesadas como cadenas livianas.

Tabla 2
Causas de proteínas monoclonales en suero
Las cadenas livianas libres pueden ser vistas en la sangre junto a moléculas intactas de inmunoglobulinas, o menos comúnmente, solas, particularmente en pacientes con mieloma múltiple. En este caso, la inmunofijación fue reportada como que mostró la presencia de cadenas pesadas gamma, sin las correspondientes cadenas livianas. La presencia de cadenas pesadas libres en sangre, sin cadenas livianas, es diagnóstica de enfermedad de cadenas pesadas. (2,3)
Una molécula de inmunoglobulina está compuesta de dos cadenas pesadas y dos cadenas livianas que están unidas por un puente disulfuro (Figura 2).

Figura 2
Estructura de la molécula de inmunoglobulina en la enfermedad de la cadena pesada.
Una molécula de inmunoglobulina está compuesta por dos cadenas pesadas (H), y dos cadenas livianas (L), unidas por puentes disulfuro (S-S). La región constante de la cadena pesada normal, tiene tres dominios constantes: CH1 es responsable de la unión a la cadena liviana, CH2 es responsable de la unión al complemento, y la CH3 es resposable de la unión al receptor Fc. En ausencia de una cadena liviana asociada, el dominio CH1, se une a las proteínas del shock térmico 78 y se somete a degradación proteosómica; así, las cadenas pesadas libres, no son secretadas normalmente. En la enfermedad de cadenas pesadas, la deleción no-contigua en el dominio CH1 previene tanto la unión de la cadena pesada a la cadena liviana, como la degradación en el proteosoma, y de esa manera se secretan cadenas pesadas libres.
Las deleciones de tamaño variado en las diversas zonas de la cadena pesada (DH), la región de unión de la cadena pesada (JH), y la región variable de la cadena pesada (VH). CDR es la región determinante de la complementariedad, CL es la región constante de la cadena liviana, COOH es carboxilo terminal, JL es la región de unión de la cadena liviana, NH2 es el amino terminal, y VL es la región variable de la cadena liviana.
La región constante de la cadena pesada normal tiene tres dominios (CH1-CH3); de ellos, CH1 es responsable de la unión a la cadena liviana. En ausencia de una cadena liviana asociada, el dominio CH1 se une a la proteína del shock-térmico 78 (hsp 78), y se somete a degradación proteosómica; así, no es secretada. (4)
Las cadenas pesadas normales que no están asociadas con cadenas livianas nunca son detectadas en suero. En la enfermedad de cadenas pesadas, la deleción no contigua en switch de la región CH1 previene la unión a hsp 78 y la degradación en ausencia de cadenas livianas. (Figura 2). (2)
La enfermedad de cadenas pesadas (Tabla 3) es una rara variante de los linfomas de células B que producen una de tres clases de inmunoglobulina de cadenas pesadas: alfa, mu o gamma. (5,6)

Tabla 3
Enfermedad de cadenas pesadas.
La enfermedad de cadenas pesadas alfa, también conocida como enfermedad de intestino delgado inmunoproliferativo, es una forma de linfoma MALT que desarrolla en intestino delgado en adultos jóvenes que viven en pobres condiciones sanitarias (7,8); puede responder en estadios tempranos al tratamiento con antibióticos, y la infección por Campylobacter jejuni ha estado implicado en su patogénesis. (9)
La enfermedad de cadena pesada mu es un trastorno extremadamente raro con hallazgos clínicos que recuerdan a la leucemia linfática crónica, pero con linfocitos vacuolados en la médula ósea. (10) La enfermedad de cadenas pesadas gamma, que tiene una frecuencia intermedia entre la enfermedad de cadenas pesadas alfa y mu, está típiccamente asociada a linfoma. (11)
Enfermedad de cadenas pesadas gamma:
En este paciente, la presencia de cadenas pesadas gamma sin cadenas livianas sugiere fuertemente el diagnóstico de enfermedad de cadenas pesadas gamma. Desde que fue reportada por primera vez en 1964 por Franklin (también conocida como enfermedad de Franklin), solo alrededor de 130 casos han sido reportados en la literatura. Los pacientes, típicamente se presentan con linfadenopatías generalizadas, esplenomegalia, anemia, y, ocasionalmente con inflamación del paladar y la úvula. Casi un tercio de los pacientes tienen antecedentes de enfermedad autoinmune. La más común es la artritis reumatoidea; otras incluyen anemia hemolítica autoinmune, púrpura trombocitopénica idiopática, vasculitis, lupus eritematoso sistémico, síndrome de Sjögren y miastenia gravis. (11,13) Las manifestaciones autoinmunes a menudo preceden al diagnóstico de linfoma, en algunos casos por varios años. El curso clínico puede ser indolente, recordando la gammapatía monoclonal de significado desconocido (MGUS), o agresivo, comprometiendo médula ósea y otros tejidos.
Mi diagnóstico es enfermedad de cadenas pesadas gamma, asociada a artritis reumatoidea. El procedimiento diagnóstico fue probablemente una biopsia de un ganglio o de médula ósea, donde sospecho se encontró una variante de linfoma linfoplasmocítico, con células plasmáticas productoras de cadenas pesadas sin cadenas livianas.
Dr. Nancy Lee Harris (Patología): Hay alguna pregunta para el Dr Munshi?
Dr. Ronald S. Weinger (Onco-Hematología): Que piensa de la descripción del radiólogo del bazo accesorio?
Dr. Munshi: El compromiso esplénico es visto en la mayoría de los pacientes con enfermedad de cadenas pesadas gamma. Si el bazo accesorio se hubiera agrandado recientemente podría ser parte del proceso.
Un clínico: Usted cree que su antecedente de bazo aumentado de tamaño estuvo relacionado con este diagnóstico?
Dr. Munshi: Aunque es teóricamente posible que el bazo aumentado de tamaño esté relacionado con su enfermedad actual, el tiempo desde la esplenectomía hasta el diagnóstico (14 años) argumenta contra esta posibilidad.
Dr. Hasan Bazari (Medicine): Hay alguna asociación entre hepatitis C, virus de Epstein-Barr, o herpes virus humano tipo 8 y la enfermedad de cadenas pesadas gamma?
Dr. Munshi: No que yo sepa. La mayoría de los reportes de enfermedad de cadenas pesadas fueron antes de 1980, cuando el rol del virus de la hepatitis C en los trastornos linfoproliferativos no se sabía, y el virus del herpes humano tipo 8, todavía no había sido descubierto. En los reportes desde entonces, no tengo conocimiento que se hayan testeado para estos virus.
Dr. Harris: Dr. Weinger, podría resumir, que pensó cuando vió a este paciente?
Dr. Weinger: Yo creí que su persistente neutropenia podía ser debida a neutropenia autoinmune, asociada con su artritis reumatoidea, a pesar de que el bazo había sido removido. Cuando el paciente volvió con su cuadro de linfadenopatías generalizadas, yo creí que tenía un linfoma. Cuando lo vi en mi consultorio , todavía no tenía los resultados de la electroforesis sérica ni de la inmunofijación. Yo solicité una biopsia escisional de un ganglio aumentado de tamaño. Cuando tuve el resultado de la electroforesis, por supuesto que el diagnóstico fue enfermedad de cadenas pesadas gamma.
Diagnóstico clínico:
Enfermedad de cadenas pesadas gamma.
Diagnóstico del Dr Nikhil C Munshi:
Enfermedad de cadenas pesadas gamma.
Discusión patológica:
Dr. Aliyah Rahemtullah: El procedimiento diagnóstico fue una biopsia de un ganglio agrandado de 2 cm de la región cervical derecha. La arquitectura del ganglio estaba borrada por una proliferación polimorfa de células linfoides de pequeño y de mediano tamaño, algunos con diferenciación en células plasmáticas, células plasmáticas, y algunos inmunoblastos grandes (Figura 3A).
Figura 3.
 Biopsia de un ganglio cervical derecho y de médula ósea
Biopsia de un ganglio cervical derecho y de médula óseaLa arquitectura del ganglio está reemplaza por una población linfoide polimorfa, con un patrón de crecimiento difuso (Panel A hematoxilina-eosina). Los linfocitos incluyen formas pequeñas, de apariencia madura, linfocitos plasmocitoides con citoplasma moderadamente abundante, y núcleos excéntricos, y células de tamaño mediano con cromatina dispersa y leves irregularidades nucleares (Panel A inserto). Numerosas células plasmáticas (flechas en el inserto) y grandes inmunoblastos dispersos. La inmunohistoquímica muestra la mayoría del infiltrado linfoide compuesto por células B CD20-positivas, incluyendo inmunoblastos. (Pnel B flecha) con escasas células T CD3-positivas (Panel B insert). Las numerosas células plasmáticas dispersas en todo el ganglio están realzadas por el marcador de células plasmáticas CD138 (Panel C). La tinción inmunohistoquímica para cadenas pesadas muestra que la mayoría de las células plasmáticas son IgG-positivas (Panel D), mientras que la hibridización in-situ para cadenas livianas (inserto derecho) muestra células plasmáticas politípicas dispersas. El número total de células tiñen para cadenas kappa y lambda, menores que el número de células plasmáticas IgG-positivas. La muestra de médula ósea tiene una celularidad de 50% adecuada para la edad con las tres líneas hematopoyéticas maduras (Panel E tinción de Giemsa). Pequeños agregados de células plasmáticas y linfocitos han desplazado los elementos hematopoyéticos normales (flecha), dando cuenta de del 5% de la celularidad total de la médula ósea. Algunas células plasmáticas son maduras, mientras que otras son atípicas con cromatina abierta (Panel E inserto). La tinción inmunohistoquímica de la muestra de la médula ósea muestra agregados de células plasmáticas atípicas positivas para la marcación con CD138 e IgG (Panel F). Sólo células plasmáticas IgM positivas aisladas están presentes. La hibridización in situ para cadenas livianas kappa y lambda mostró células plsmáticas politípicas aisladas, pero las células plasmáticas IgG-positivas dentro de los pequeños agregados fueron negativos tanto para cadenas livianas kappa y lambda.
La tinción inmunohistoquímica demostró una mezcla de células B CD20-positivas y células T CD3-positivas (Figura 3B); muchas células eran negativas para CD20 pero expresaban los antígenos asociados a las células plasmáticas CD138 y oncogen 1 de mieloma múltiple (MUM1) (Figura 3C). La tinción para inmunoglobulinas de cadenas pesadas mostraron que la vasta mayoría de las células plasmáticas contenían IgG citoplasmática, mientras que la hibridación in vitro para cadenas livianas de inmunoglobulinas mostró solo algunas células plasmáticas politípicas. (Figura 3D). Ki-67, un marcador de proliferación, fue positivo en aproximadamente 40% de los núcleos (algo mayor de lo que se hubiera esperado para un linfoma B de células grandes).
Una biopsia de médula ósea, llevada a cabo aproximadamente 1 mes después de la biopsia ganglionar, reveló celularidad casi normal, con algunos pocos agregados linfoplasmocitarios pequeños (Figura 3E). En áreas fuera de los agregados, había pequeños grupos de células plasmáticas que eran positivas para IgG pero negativas tanto para cadenas livianas kappa como lambda (Figura 3F).
Cuatro días antes de que el paciente viera al Dr Weinger (Onco-Hematólogo), la electroforesis proteica, reveló una banda en la región de las inmunoglobulinas, que en la inmunofijación era IgG sin la correspondiente cadena liviana (Figura 4A).

Figura 4
Resultados de la electroforesis sérica y la inmunofijación llevadas a cabo 4 días antes de la evaluación, y la electroforesis de proteínas urinarias e inmunofijación llevadas a cabo en el momento de la biopsia de médula ósea.
La electroforesis de proteínas se basa en la separación de las proteínas de acuerdo a las propiedades de la carga y el tamaño a un pH de 8,6 cuando una muestra es aplicada en el origen de un gel de agarosa. La mayroría de las proteínas están cargadas negativamente a este pH y migran hacia el electrodo cargado positivamente (ánodo). La banda en la posición más anodal es la albúmina.
Las inmunoglobulinas no tienen principalmente carga en este pH y permanecenalrededor del punto de origen, o migran hacia el electrodo cargado negativamente (cátodo). En un paciente que no tiene un componente monoclonal (componente M), el patrón de inmunoglobulina policlonal esperado sería débil sin una banda distintiva. Sin embargo, en este paciente, una banda distinta fue identificada por electroforesis sérica en la región de las inmunoglobulinas en una posición anodal respecto al punto de origen. (Panel A, flecha). Los componentes M son caracterizados por ulterior inmunofijación para identificar las cadenas pesadas y las cadenas livianas que construyen la paraproteína. En este paciente, el componente Mfue caracterizado como IgG (denotada por la banda vista en el carril de la IgG enel Panel A), pero sin una correspondiente cadena liviana (sólo débiles patrones policlonales pueden ser vistos en los carriles kappa y lambda en el Panel A). La electroforesis urinaria (UPE) llevada a cabo aproximadamente 1 mes más tarde revló resultados similares (Panel B), con una amplia banda monoclonal correspondiente a IgG, sin la correspondiente cadena liviana. La cantidad de IgG urinaria total fue calculada en aproximadamente 225 mg/dl.
La electroforesis urinariallevada a cabo en el momento de la biopsia de médula ósea, reveló una densa banda monoclonal, que también fue caracterizada como IgG sin cadena liviana asociada (Figura 4B). Las cadenas pesadas gamma son demasiado pesadas para pasar el espacio urinario, aún en pacientes con elevados niveles séricos; estos hallazgos sugieren ya sea que hay un deterioro de la función renal o una alteración de la estructura de la cadena pesada, tal como que esté truncada su forma que no le permita pasar al espacio urinario.
El linfoma asociado con enfermedad de cadenas pesadas gamma, típicamente compromete los tejidos hemopoyéticos, incluyendo la médula ósea, el bazo, y los ganglios linfáticos, como en este caso, (5) pero puede estar localizado y afectar órganos extrahemopoyéticos, incluyendo aquellos a menudo afectados en el linfoma MALT, tales como piel, tiroides, glándulas salivales, y tracto gastrointestinal. (6) El compromiso esquelético es raro, y los depósitos amiloides no se encuentran, debido a la ausencia de producción de cadenas livianas; la enfermedad de cadenas pesadas, por lo tanto, casi nunca se mimetiza o confunde clínicamente con el mieloma múltiple. (6)
El examen patológico, más comúnmente demuestra una proliferación mixta de linfocitos, plasmocitos linfocitoides, células plasmáticas, y algunos inmunoblastos dispersos, como se vieron en este caso. (6) Estos hallazgos recuerdan al linfoma linfoplasmocítico; sin embargo, el infiltrado es a menudo más polimorfo, con más numerosos inmunoblastos y células de tamaño mediano. Ocasionalmente, predominan las células plasmáticas maduras, o los pacientes se presentan con linfocitosis periférica. (6,14) Hallazgos inusuales, tales como la presencia de células que recuerdan a las células de Red-Stenberg, aumento de eosinófilos e histiocitos, y proliferación vascular pueden plantear el diagnóstico diferencial con el linfoma de Hodgkin, o ciertas formas de linfomas de células T. (6) A diferencia de la enfermedad de cadenas pesadas alfa, la enfermedad de cadenas pesadas gamma, raramente evoluciona a linfoma de células B difuso. (5,6,14) Debido a la asociación de enfermedad de cadenas pesadas gamma con artritis reumatoidea, (6,14,15) el diagnóstico diferencial puede incluir la entidad más común de linfadenopatía reactiva asociada a artritis reumatoidea, que puede ser generalizada, o localizada cerca del sitio de una articulación inflamada, y está caracterizada por hiperplasia folicular. (16)
Después de confirmado el diagnóstico, nosotros revisamos la muestra de la esplenectomía realizada años antes que reveló una hiperplasia folicular reactiva, sin evidencias morfológicas de linfoma; no había tejido disponible para medir inmunoglobulinas y expresión de cadenas pesadas y livianas. Una muestra de una biopsia de médula ósea en ese momento, mostró hemopoyesis normal sin evidencias morfológicas de linfoma. La muestra de piel, obtenida 19 meses antes reveló dermatitis con hallazgos compatibles con lupus eritematoso cutáneo subagudo; sin embargo, eran indistinguibles de una reacción por hipersensibilidad a drogas.
En suma, varios hallazgos confirmaron el diagnóstico de enfermedad de cadenas pesadas gamma sin cadenas livianas.
Dr. Harris: Dr. Munshi, que tratamiento recomendaría)
Dr. Munshi: En algunos pacientes, la enfermedad es indolente, y el paciente puede ser seguido sin intervención específica. En un paciente como este, con linfoma declarado, la intervención terapéutica puede incluir ciclofosfamida, vincristina y prednisona, con o sin doxorrubicina, que han sido usados con algún éxito. (10,13) Si las células del linfoma expresan CD20, el anticuerpo monoclonal anti CD20, rituximab, puede ser útil; en un caso, pareció ser efectivo. (14) El pronóstico es altamente variable; en una revisión, la sobrevida fue desde 1 mes a más de 21 años, con un promedio de 7,4 años. (14)
Dr. Harris: Dr. Weinger, podría decirnos como trató a este paciente?
Dr. Weinger: Yo lo traté con 4 semanas de rituximab; dentro de las 2 semanas, las linfadenopatías habían desaparecido, y el pacente se sentía mejor; retrospectivamente admitió que se había sentido mucho más enfermo en la presentación. Le di 4 dosis adicionales de rituximab, terminando 1 año después del diagnóstico. Diez meses después de la última dosis de rituximab, tanto el linfoma como la artritis reumatoidea entraron en remisión. La electroforesis sérica mostró una pequeña banda monoclonal de cadenas pesadas gamma libres. Los tests para hepatitis C y herpes virus humano tipo 8 fueron negativos.
Dr. Mandakolathur R. Murali (Medicina, Alergia): El factor reumatoideo en este paciente pudo ser una IgM policlonal dirigida a las cadenas pesadas monoclonales. Hubiera sido interesante buscar anticuerpos contra el péptido cíclico citrulinado, que es el marcador de la artritis reumatoidea. Si ese test fuera negativo, el paciente de hecho tiene una forma de vasculitis artritis reumatoidea-like.
Dr. Weinger: El test para anticuerpo contra el péptido cíclico citrulinado fue positivo (a 34 U/L; normal de 0 a 19) 6 meses después de la última dosis de rituximab.
Diagnóstico anatómico:
Enfermedad de cadenas pesadas gamma y artritis reumatoidea.
Traducción de:
CASE RECORDS OF THE MASSACHUSETTS GENERAL HOSPITAL
Case 13-2008 — A 46-Year-Old Man with Rheumatoid Arthritis and Lymphadenopathy
Nikhil C. Munshi, M.D., Subba Digumarthy, M.D., and Aliyah Rahemtullah, M.D
The New England of Medicine
Source Information
From the Boston Veterans Affairs Healthcare System and the Jerome Lipper Center for Multiple Myeloma, Dana–Farber Cancer Institute (N.C.M.); the Departments of Radiology (S.D.) and Pathology (A.R.), Massachusetts General Hospital; and the Departments of Medicine (N.C.M.), Radiology (S.D.), and Pathology (A.R.), Harvard Medical School — all in Boston.
References
1) Waterston A, Bower M. Fifty years of multicentric Castleman's disease. Acta Oncol 2004;43:698-704. [CrossRef][ISI][Medline]
2) Alexander A, Anicito I, Buxbaum J. Gamma heavy chain disease in man: genomic sequence reveals two noncontiguous deletions in a single gene. J Clin Invest 1988;82:1244-1252. [ISI][Medline]
3) Alexander A, Steinmetz M, Barritault D, et al. Gamma heavy chain disease in man: cDNA sequence supports partial gene deletion model. Proc Natl Acad Sci U S A 1982;79:3260-3264. [Free Full Text]
4) Haas IG, Wabl M. Immunoglobulin heavy chain binding protein. Nature 1983;306:387-389. [CrossRef][Medline]
5) Grogan TM, Van Camp B, Kyle RA, Muller-Hermelink HK, Harris NL. Plasma cell neoplasms. In: Jaffe ES, Harris NL, Stein H, Vardiman JW, eds. Tumours of the hematopoietic and lymphoid tissues. Vol. 3 of World Health Organization classification of tumours. Lyon, France: IARC Press, 2001:154-6.
6) Fermand JP, Brouet JC, Danon F, Seligmann M. Gamma heavy chain "disease": heterogeneity of the clinicopathologic features: report of 16 cases and review of the literature. Medicine (Baltimore) 1989;68:321-335. [Medline]
7) Rambaud JC, Galian A, Danon FG, et al. Alpha-chain disease without qualitative serum IgA abnormality: report of two cases, including a "nonsecretory" form. Cancer 1983;51:686-693. [Medline]
8) Al-Saleem T, Al-Mondhiry H. Immunoproliferative small intestinal disease (IPSID): a model for mature B-cell neoplasms. Blood 2005;105:2274-2280. [Free Full Text]
9) Lecuit M, Abachin E, Martin A, et al. Immunoproliferative small intestinal disease associated with Campylobacter jejuni. N Engl J Med 2004;350:239-248. [Free Full Text]
10) Wahner-Roedler DL, Kyle RA. Mu-heavy chain disease: presentation as a benign monoclonal gammopathy. Am J Hematol 1992;40:56-60. [CrossRef][ISI][Medline]
11) Fermand JP, Brouet JC. Heavy-chain diseases. Hematol Oncol Clin North Am 1999;13:1281-1294. [CrossRef][ISI][Medline]
12) Franklin EC. Structural studies of human 7s gamma-globulin (G immunoglobulin): further observations of a naturally occurring protein related to the crystallizable (fast) fragment. J Exp Med 1964;120:691-709. [Free Full Text]
13) Wahner-Roedler DL, Kyle RA. Heavy chain diseases. Best Pract Res Clin Haematol 2005;18:729-746. [Medline]
14) Wahner-Roedler DL, Witzig TE, Loehrer LL, Kyle RA. Gamma-heavy chain disease: review of 23 cases. Medicine (Baltimore) 2003;82:236-250. [CrossRef][Medline]
15) Dickson JR, Harth M, Bell DA, Komar R, Chodirker WB. Gamma heavy chain disease and rheumatoid arthritis. Semin Arthritis Rheum 1989;18:247-251. [CrossRef][ISI][Medline]
16) Ferry JA, Harris NL. Atlas of lymphoid hyperplasia and lymphoma. Philadelphia: W.B. Saunders, 1997:36-8.
No hay comentarios:
Publicar un comentario